- muhammad zainul arifin
advertisement

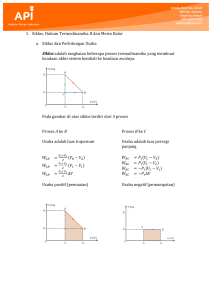
REVERSIBLE, IRREVERSIBLE Sebelum membahas apa itu siklus carnot, pertama-tama kita harus memahami yang disebut dengan proses terbalikkan (reversible) dan tak terbalikkan (Irreversible). Proses reversible adalah proses dimana tidak ada energi yang terbuang dari sistem tersebut, contoh dari proses reversible ini, misalkan kita mempunyai bola yang kita pegang di atas gedung yang tingginya 10 meter, yang artinya bola itu memiliki energi potensial tertentu, kemudian bola itu kita lepaskan dari ketinggian tersebut dan jatuh ke lantai, karena saat tiba di lantai semua energi potensial telah menjadi energi kinetik (dalam wujud kecepatan) yang sejumlah dengan energi potensial ketika masih di ketinggian 10 meter, maka setelah membentur, energi kinetik tersebut akan dirubah kembali menjadi energi potensial yang besarnya sebesar energi kinetik sebelumnya, yang mana sebesar energi potensial ketika bola tersebut sebelum di lepaskan. Karena energi potensial setelah memantul = energi potensial sebelum dijatuhkan, maka dapat kita katakan tidak ada energi yang hilang dari proses tersebut, atau reversible. 1. sebelum jatuh, 2. sampai di lantai, 3. ketinggian puncak Namun, pada kenyataanya, tidak ada proses yang benar-benar reversible, energi tersebut pasti akan hilang karena adanya gesekan, perpindahan panas, ekspansi mendadak ataupun hal lainya, maka bola yang kita jatuhkan dari gedung 10 meter tadi tidak mungkin memantul lagi pada ketinggian yang sama persis 10 meter, karena adanya gesekan dari udara ketika jatuh, gesekan dengan lantai ketika sampai di tanah, terjadinya aliran kalor antara bola dengan udara dan lantai atau timbulnya suara ketika menabrak lantai yang juga mengakibatkan hilangnya energi, maka proses ini kita katakan irreversible, karena ada energi terbuang yang tidak dapat kita manfaatkan lagi. Dalam teori termodinamika, suatu proses kebanyakan diasumsikan sebagai proses yang reversible, karena akan sangat mempermudah perhitungan, walaupun tidak sama persis dengan apa yang terjadi di dunia nyata, namun hasil perhitunganya masih dapat di manfaatkan. Ukuran ketidak-terbalikkan ini terkenal dengan istilah Entropi. Proses melingkar adalah suatu proses pada suatu system setelah mengalami beberapa perubahan keadaan, akhirnya kembali pada keadaan semula. Gb. 2 Gb. 1 Pada proses melingkar, system berubah kemudian kembali ke keadaan semula. Energy dalam proses melingkar tidak berubah. Sebuah proses reversible adalah sebuah proses yang berlangsung sedemikian sehingga pada akhir proses, system dan keliling local ( local surroundings) dapat dikembalikan ke keadaan mula-mula, tanpa meninggalkan suatu perubahan pada sisa universum (rest of universe). Universum disini digunakan dalam arti teknis, yaitu sempit sekali tanpa suatu pengertian kosmos. Universum disini artinya tidak lain adalah bagian yang berhingga dari dunia yang terdiri dari system dan kelilingnya yang dapat mengadakan interaksi dengan system itu. Sebuah proses yang tidak memenuhi syarat-syarat diatas disebut irreversible. Sebagai konsekuensi hukum kedua Termodinamika yang memperlihatkan arah perubahan alami distribusi energy dan memperkenalkan prinsip peningkatan entropi, maka semua proses alam adalah irreversible. Pengubahan usaha menjadi energy dalam sebuah system kalor berlangsung dengan disertai gejala-gejala seperti gesekan viskositas, inelastisitas, tahanan listrikndan listeresisi magnetic. Efek-efek ini disebut efek-efek disipatif dan usaha itu dikatakan terdissipasi. Proses-proses yang disertai dissipasi usaha menjadi energy dalam dikatakan menunjukkan irreversible mekanik luar. Irreversibilitas lainnya ialah irreversibilitas mekanik dalam, irreversibilitas termik, irreversibilitas kimia. Kalau berbagai macam proses alam diselidiki dengan teliti maka ternyata bahwa semuanya disertai salah satu dari dua sifat berikut. 1. Tidak dipenuhinya syarat-syarat untuk kesetimbangan termodinamika, yaitu tidak adanya kesetimbangan mekanik, termik dan kimia 2. Adanya efek disipatif, seperti geseran, viskositas, anelastisitas, tahanan listrik dan listeresis magnetic. Maka dapat ditarik kesimpulan, bahwa sebuah proses akan reversible kalau 1. Proses itu berlangsung quasi-statik 2. Proses itu tidak disertai efek-efek desipatif. Karena tidak mungkin bentuk memenuhi kedua syarat itu dengan sempurna maka jelaslah bahwa sebuah proses reversible adalah sesuatu yang hayal atau ideal. Proses reversible sangat berguna dalam perhitungan teori dalam hal ini, pengandaian proses reversible dalam termodinamika serupa dengan pengandaian yang seringkali dijumpai dalam mekanika, misalnya pengandaian kawat yang tidak bermassa, katrol tanpa geseran dan titik massa. ADIABATIK, ISOTERMAL, DLL 1. Isokhorik adalah proses perubahan keadaan yang terjadi pada volume tetap. Jika gas melakukan proses termodinamika dalam volume yang konstan, gas dikatakan melakukan proses isokhorik. Karena gas berada dalam volume konstan (∆V = 0), gas tidak melakukan usaha (W = 0) dan kalor yang diberikan sama dengan perubahan energi dalamnya. Kalor di sini dapat dinyatakan sebagai kalor gas pada volume konstan QV. QV = ∆U 2. Isobarik adalah proses perubahan keadaan yang terjadi pada volume konstan. Jika gas melakukan proses termodinamika dengan menjaga tekanan tetap konstan, gas dikatakan melakukan proses isobarik. Karena gas berada dalam tekanan konstan, gas melakukan usaha (W = p∆V). Kalor di sini dapat dinyatakan sebagai kalor gas pada tekanan konstanQp. Berdasarkan hukum I termodinamika, pada proses isobarik berlaku Proses sebelumnya telah dituliskan bahwa perubahan energi dalam sama dengan kalor yang diserap gas pada volume konstan QV =∆U Dari sini usaha gas dapat dinyatakan sebagai W = Qp − QV Jadi, usaha yang dilakukan oleh gas (W) dapat dinyatakan sebagai selisih energi (kalor) yang diserap gas pada tekanan konstan (Qp) dengan energi (kalor) yang diserap gas pada volume konstan (QV). 3. Isotermal adalah perubahan sistem, di mana suhu tetap konstan: ΔT = 0. Ini biasanya terjadi ketika suatu sistem berada dalam kontak dengan reservior panas luar (mandi panas), dan perubahan terjadi perlahan cukup untuk memungkinkan sistem untuk terus-menerus menyesuaikan diri dengan suhu reservoir melalui pertukaran panas. Dalam proses isotermal, nilai ΔT0 = tapi Q≠0. 4. Adiabatik adalah tidak ada kalor yang ditambahkan pada sistem atau meninggalkan sistem (Q = 0). Proses adiabatik bisa terjadi pada sistem tertutup yang terisolasi dengan baik. Untuk sistem tertutup yang terisolasi dengan baik, biasanya tidak ada kalor yang dengan seenaknya mengalir ke dalam sistem atau meninggalkan sistem. Proses adiabatik juga bisa terjadi pada sistem tertutup yang tidak terisolasi. Untuk kasus ini, proses harus dilakukan dengan sangat cepat sehingga kalor tidak sempat mengalir menuju sistem atau meninggalkan sistem CARA KERJA SIKLUS CARNOT, DIHUBUNGKAN DENGAN HUKUM I TERMODINAMIKA DAN HUKUM II TERMODINAMIKA Hukum I Termodinamika mengungkapkan bahwa energi dapat diubah dari satu bentuk energi ke bentuk energi yang lain. Hukum ini tidak membatasi tentang arah aliran energi. Dalam kehidupan sehari-hari kita hanya melihat bahwa kalor dapat mengalir dengan sendirinya dari suatu benda (atau bagian benda) yang mempunyai temperatur tinggi ke benda lain (atau bagian lain dari benda yang sama) yang mempunyai temperatur rendah, dan kita tidak melihat proses sebaliknya. Kita juga dapat melihat bahwa kerja dapat diubah secara keseluruhan menjadi kalor, tetapi kita tidak dapat mengubah kalor secara keseluruhan menjadi kerja. Oleh karena itu, masih diperlukan hukum yang mengatur arah proses yang mungkin terjadi. Hukum ini kita kenal sebagai hukum II Termodinamika (Mundilarto, 1992). Menurut Disiki Hadi (1993), bila hukum pertama dan kedua digabungkan atau digunakan bersama, ternyata dapat diperoleh beberapa hubungan termodinamik yang penting. Perumusan hukum pertama termodinamika secara analitik dalam bentuk diferensial untuk sebarang proses adalah: d’Q = dU + d’W (1) Hukum kedua menyatakan bahwa untuk suatu proses reversibel antara dua keadaan seimbang. d’Q = T dS (2) Usaha dalam proses reversibel untuk sistem pVT adalahh d’W = p dV (3) Oleh karena itu pada proses reversibel untuk sistem pVT T dS = dU + p dV (4) Persamaan (4) adalah satu perumusan dari gabungan hukum pertama dan kedua untuk sistem pVT. Untuk sistem lain bentuk persamaan ini tetap berlaku, tetapi tentu saja besaran-besaran tersebut harus diganti dengan besaran-besaran yang sesuai. Persamaan (2) dan (3) hanya berlaku untuk proses reversibel, tetapi persamaan (4) tidak hanya terbatas pada suatu proses, oleh karena persamaan ini hanya menyatakan suatu hubungan antara sifat-sifat sistem dan perbedaan antara nilai sifat-sifat ini, dalam dua keadaan seimbang yang berdekatan. Jadi meskipun telah digunakan proses reversibel untuk menjabarkan hubungan antara dS, dU, dan dV, maka setelah hubungan itu ditentukan hubungan itu tetap berlaku untuk sebarang pasangan keadaan seimbang yang berdekatan. Misalkan suatu sistem mengalami proses ireversibel antara dua keadaan seimbang, maka baik persamaan (1) maupun (4) keduanya berlaku, karena yang pertama benar untuk sebarang proses (reversibel ataupun tidak) dan yang kedua benar untuk sebarang dua keadaan seimbang. Namun T dS ≠ d’Q dan p dV ≠ d’W, sebagai contoh, misalnya proses ireversibel yang berkaitan dengan usaha d’W yang dilakukan untuk mengaduk secara adiabatik zat di dalam sistem pada volume tetap. Entropi sistem akan bertambah, jadi T dS = 0 karena proses itu adalah adiabatik. Demikian pula p dV = 0 karena volumenya tetap, tetapi d’W ≠ 10. Yang pertama kali berhasil memecahkan persoalan tentang efisiensi mesin adalah Sadi Carnot seorang insinyur berkebangsaan Prancis. Sebelum Carnot pada 1824, perbaikan-perbaikan pada mesin uap hanya dari segi kontruksi mekaniknya saja dan tidak berpedoman pengetahuan tentang asas-asas pokoknya. Sumbangan Carnot ini bersifat teoritik, tetapi pengaruhnya atas perkembangan dunia industri dalam abad 19 sangat besar. Secara singkat, Carnot mengesampingkan soal bagaimana bekerjanya mesin kalor dan memusatkan perhatiannya pada sifat-sifat yang penting. Pertama, mesin diberi energi kalor pada temperatur yang relatif tinggi. Kedua, mesin melakukan usaha mekanik. Ketiga, mesin membuang energi kalor pada temperatur rendah. Carnot membayangkan bahwa aliran kalor lewat mesin dari temperatur tinggi ke temperatur rendah seperti halnya aliran air lewat kincir atau turbin dari tempat yang tinggi ke tempat yang rendah dalam selang waktu tertentu jumlah air yang masuk ke dalam turbin sama dengan jumlah air yang keluar dan dari proses ini dihasilkan energi mekanik. Carnot berpendapat bahwa dalam mesin kalor terjadi proses yang sama, yakni energi mekanik dihasilkan dari aliran kalor dari temperatur tinggi ke temperatur rendah melewati mesin. Tetapi jumlah kalor yang dilepaskan oleh mesin adalah lebih kecil dari pada jumlah kalor yang dimasukkan oleh mesin. Selisih antara keduanya sama dengan jumlah kalor yang telah diubah oleh energi mekanik. Walaupun konsep tentang kalor ini salah, Carnot sebenarnya telah berhasil memperoleh ungkapan yang tepat mengenai efisiensi maksimum dari mesin kalor yang bekerja diantara dua temperatur tertentu. Harga efisiensi termal maksimum tercapai jika kerja mesin kalor itu berlangsung secara bolak-balik (reversible). Mesin kalor yang mempunyai karakteristik semacam itu pertama kali dikemukakan oleh Sadi Carnot pada 1824, yang kemudian dikenal sebagai mesin Carnot. Sejumlah gas ideal berada di dalam silinder dengan dasar konduktor panas, dinding isolator gesekan, seperti yang ditunjukkan dalam gambar 1.1. Sebagai bagian dari lingkungan, dalam sistem ini terdapat reservoir panas dengan temperatur TP dan reservoir dingin dengan temperatur TD. Gambar 1.1. Bagan Mesin Carnot Dalam mesin Carnot terdapat satu siklus ideal yang disebut siklus Carnot. Siklus ini terdiri dari dua proses isotermal yang reversibel dan dua proses adiabatik yang reversibel juga, seperti ditunjukkan oleh gambar 1.2. Menurut Mundilarto (1992) di dalam siklus Carnot terdapat empat langkah penting sebagai berikut: Gambar 1.2. Siklus Carnot 1. Mula-mula gas berada dalam keadaan kesitimbangan awal dengan tekanan P 1 dan volume V1. Bejana silinder ditempatkan pada reservoir panas dengan temperatur TP. Gas mengembang secara perlahan-lahan, sehingga mencapai P2, V2 dan TP. Proses tersebut berlangsung secara isotermik pada temperatur TP. Selama proses ini sistem gas menyerap kalor sebesar QP dan melakukan kerja dengan mendorong pengisap ke atas. 2. Bejana silinder ditempatkan pada landasan bukan penghantar, yang memungkinkan gas mengembang lebih lanjut secara perlahan-lahan sehingga mencapai keadaan P3, V3 dan TD. Proses ini berlangsung secara adiabatik, karena tidak ada kalor yang masuk maupun keluar sistem gas. Gas melakukan usaha dengan mendorong pengisap ke atas dan temperaturnya turun menjadi TD. 3. Bejana silinder diletakkan pada reservoir dingin dengan temperatur TD, sehingga gas mengalami pemampatan secara perlahan-lahan sampai mencapai keadaan P4, V4 dan TD. Selama proses ini gas melepasakan kalor sebesar QD ke reservoir dingin melalui dasar bejana. Proses pemampatan ini berlangsung secara isotermik pada temperatur TD. Pengisap melakukan usaha terhadap sistem gas. Silinder diletakkan pada landasan bukan penghantar dan gas dimampatkan secara perlahan-lahan sampai mencapai keadaan P1, V1 dan TP. Kompresi ini berlangsung secara adiabatik karena tidak ada kalor yang masuk maupun keluar sistem gas. Kerja dilakukan pada sistem gas sehingga temperatur menjadi TP. Selama proses ini berlangsung, tidak ada kalor yang keluar atau masuk ke dalam sistem, tekanan sistem meningkat, dan volumenya berkurang. Menurut kurva hubungan p–V dari siklus Carnot, usaha yang dilakukan oleh gas adalah luas daerah di dalam kurva p–V siklus tersebut. Oleh karena siklus selalu kembali ke keadaannya semula, ΔU siklus = 0 sehingga persamaan usaha siklus (Wsiklus) dapat dituliskan menjadi Wsiklus = ΔQsiklus = (Q1 – Q2) dengan: Q1 =kalor yang diserap sistem, dan Q2 = kalor yang dilepaskan sistem. Ketika mesin mengubah energi kalor menjadi energi mekanik (usaha). Perbandingan antara besar usaha yang dilakukan sistem (W) terhadap energi kalor yang diserapnya (Q1) disebut sebagai efisiensi mesin. Persamaan matematis efisiensi mesin ini dituliskan dengan persamaan dengan η = efisiensi mesin. Oleh karena usaha dalam suatu siklus termodinamika dinyatakan dengan W = Q1 – Q2 maka dapat dituliskan menjadi Pada mesin Carnot, besarnya kalor yang diserap oleh sistem (Q1) sama dengan temperatur reservoir suhu tingginya (T1). Demikian juga, besarnya kalor yang dilepaskan sistem (Q2) sama dengan temperatur reservoir suhu rendah mesin Carnot tersebut. Oleh karena itu, Persamaan dapat dituliskan menjadi Keterangan: η : efisiensi mesin Carnot T1 : suhu reservoir bersuhu tinggi (K) T2 : suhu reservoir bersuhu rendah (K) Dari Persamaan diatas tersebut, dapat disimpulkan bahwa efisiensi mesin Carnot dapat ditingkatkan dengan cara menaikkan temperatur reservoir suhu tinggi atau menurunkan temperatur reservoir suhu rendah. LEMBAR KONTRIBUSI 1. Novita Purnamasari H (1503646), Mumammad Zainul Arifin (1504013), Putri Audia AK (1504063) Mengerjakan cara kerja siklus Carnot dihubungkan dengan termodinamika 1 dan 2; adiabatik, isotermal, dll; reversibel, irreversibel, gambar dan grafik (P vs S); efisiensi siklus carnot. 2. Jagad Tahari (1504108), Saskiya Khairani (1504067), Rini Suprianni (1501899) Mengerjakan jawaban soal; membuat cover; mengedit dan menyusun materi; mengeprint; menjilid. DAFTAR PUSTAKA Anomius. 1978. Hand Book Of Comparative Material Standart. Tokyo: Engineering. Bett, Rowluism dan Saville. Thermodynamics for Chemical Engineers. London : The Artlone Press. Daubert. Chemical Engineering Thermodynamics. Singapore : Mc.Graw Hill. Hadi, Dimsiki. 1993. Termodinamika. Yogyakarta: Departemen Pendidikan dan Kebudayaan Haryadi, Bambang. Fisika SMA XI IPA. Jakarta: BSE 2009 Mundilarto, dkk. 1992. Fisika Dasar II. Jakarta: Universitas Terbuka Palupi, Satya Palupy dkk. Fisika untuk SMA/MA Kelas XI. Jakarta: BSE 2009 Smith dan Ness, Van. Introduction to Chemical Engineering Thermodynamics. Singapore : Mc. Graw Hill.