fisika paru dan bernafas denyut jantung dan tekanan darah
advertisement

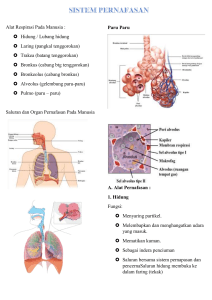
FISIKA PARU DAN BERNAFAS DENYUT JANTUNG DAN TEKANAN DARAH TUBUH Oleh Arif Yachya Apakah bernafas itu ? Tujuan Alat pernafasan : Paru-paru Tujuan Perkuliahan Setelah mengikuti perkuliahan diharapkan mahasiswa mampu : • Menjelaskan tujuan bernafas • Menyebutkan bagian paru-paru dan fungsinya • Menjelaskan proses bernafas bila ditinjau secara fisika • Menyebutkan hukum-hukum fisika yang berku dalam pernafasan Alat ukur volume paru-paru Hukum-hukum yang berlaku dalam pernafasan How do your lungwork video Bernafas • proses pertukaran gas antara makhluk hidup (organisme) dengan lingkungannya • proses pengambilan oksigen dari udara bebas serta melepaskan karbon dioksida dan uap air. Tujuan bernafas memasok O2 segar ke darah di paru dan membuang CO2 dari darah ke luar tubuh Komposisi udara saat inspirasi O2 20 % N2 80% CO2 0,04% Komposisi udara saat ekspirasi O2 16 % N2 80% CO2 4% Dalam 1 hari manusia menghirup 1kg O2 dan yang terserap sebanyak 0,5 kg 1 2 Jelaskan besarnya tekanan udara di dalam paru-paru saat inspirasi dan ekspirasi Mengapa udara yang kita hembuskan saat ekspirasi masih dapat digunakan untuk memberikan nafas bantuan pada orang pingsan ? Anatomi Paru-paru Paru-paru di bungkus oleh suatu jaringan pleura a) Pleura parietalis : berdekatan dengan otot rusuk b) Pleura viseralis : menyatu dengan paruparu Diantara keduanya terdapat ruang intrapleura yg berisi cairan • Bronkhiolus • Alveolus • Alveoli Alveolus mempunyai diameter 0,2 mm & tebal 0,4 um. Dikelilingi darah difusi gas 3 Apa perbedaan alveolus dengan alveoli Hukum-hukumyang berlaku dalam pernafasan 1. Dalton tekanan parsial 2. Boyle PV=konstan 3. Laplace Dalton tekanan parsial Tekanan total suatu campuran gas merupakan akumulasi dari tekanan tiap-tiap gas, seakan-akan gas itu berdiri sendiri. Misal tekanan udara atmosfer = 1 atm (760 mm Hg), maka tekanan gas oksigen = 20% x 760 mm Hg =…….. tekanan gas nitrogen = 80% x 760 mm Hg =…….. Hukum Boyle (Gas ideal) P : tekanan gas (atm) n : mol gas V : volume gas (L) T : suhu mutlak (K) R : konstanta gas 0,08 L.atm/mol K P. V = n.R.T Hukum Boyle-Gay Lussac "Jika volume gas diperkecil maka tekanan gas tersebut membesar asalkan suhunya tetap, atau Jika volume gas diperbesar maka tekanan mengecil". P1.V1 T1 = P2.V2 T2 Hukum Laplace Tekanan pada gelembung alveoli berbanding terbalik dengan radius dan berbanding lurus dengan tegangan permukaan Klep dibuka 4 Mengapa pilot yang terbang di atas 20000 kaki dapat mengalami pingsan Jelaskan hubungan ketinggian dengan tekanan (kandungan) oksigen di udara 5 Menurut anda apakah tekanan darah di leher dengan di kaki sama atau berbeda ? Jelaskan alasannya Spirometer Mini peak flow meter