1. Model Atom dan Struktur Molekul
advertisement

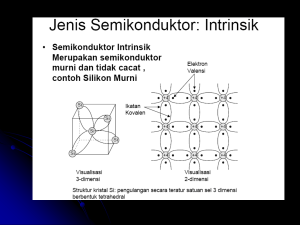
MIKROELEKTRONIKA MODEL ATOM & STRUKTUR MOLEKUL D3 – Teknik Komputer Universitas Gunadarma PENDAHULUAN Definisi • Atom adalah partikel terkecil dari suatu elemen. • Setiap elemen memiliki struktur atom yang unik. • Menurut model atom Bohr, atom terdiri dari inti atom (nucleus) yang dikelilingi oleh elektron. • Nucleus terdiri dari proton (positif) dan neutron (netral). • Elektron yang mengelilingi inti atom berupa negatif. Nomor Atom • Semua elemen diurutkan dalam tabel periodik sesuai dengan nomor atomnya. Contoh : Hidrogen memiliki nomor atom 1 Helium memiliki nomor atom 2 Struktur Atom Model Atom Bohr TEORI ATOM Teori Atom Carl H. Synder • Ambil segenggam paper clip dengan ukuran & warna yang sama : 1.Bagi kedalam tumpukan yang sama. 2.Bagi kembali tumpukan yang lebih kecil kedalam 2 tumpukan yang sama. 3.Ulangi langkah 1 & 2 sampai ke suatu tumpukan yang hanya terdiri dari sebuah paper clip. Paper clip tersebut masih memiliki fungsi sebagai penjepit kertas yaitu menjepit kertas agar tidak berantakan. 4.Sekarang ambil gunting potong sebuh paper clip tersebut menjadi dua bagian. Pertanyaan : Dapatkah setengah paper clip tersebut memiliki fungsi yang sama dengan sebuah paper clip? • Jika kita lakukan hal yang sama dengan elemen apa saja, maka kita akan mencapai suatu kondisi dimana bagian suatu benda tidak dapat dibagi lagi tetapi masih memiliki sifat yang sama seperti sebuah paper clip tadi. Bagian yang tidak dapat dibagi lagi inilah yang disebut Atom. Teori Atom John Dalton • Setiap Elemen terbentuk dari Atom-atom – Tumpukan paper clip. • Semua atom-atom dari suatu elemen memilki sifat yang sama – Semua paper clip dalam tumpukan memiliki ukuran dan warna yang sama. • Atoms dari elemen yang berbeda adalah berbeda(ukuran dan ciri-ciri) – seperti perbedaan ukuran dan warna paper clip. • Atoms dari elemen yang berbeda dapat dikombinasikan untuk membentuk campuran – Kita dapat menghubungkan ukuran dan warna yang berbeda dari paper clip untuk membentuk struktur baru. • Dalam reaksi kimia, atom tidak dapat dibuat, di musnahkan, atau dirubah – tidak ada paper clip baru yang muncul, tidak ada paper clip yang hilang dan tidak ada paper clip yang berubah dari satu ukuran/warna ke ukuran/warna lainnya. • Dalam berbagai campuran, nomor dan jenis dari atom tetap sama – Jumlah total dan type paper clip pada saat mulai dan akhir adalah sama. PARTIKEL BERMUATAN • Muatan negatif elektron yaitu 1.6 x 10-19 Coulomb • Massa elektron yaitu 9.11 x 10-31 kg • Muatan ion positif : suatu kelipatan dari muatan elektron dengan tanda muatan yang berlawanan. • Partikel yang diionisasikan tunggal, besar muatannya sama dengan muatan elektron. • Partikel yang diionisasikan rangkap, muatan ion menjadi dua kali muatan elektron. • Massa suatu atom sama dengan berat atom dikalikan dengan 1.66 x 10-27 kg. • Jari – jari elektron kira-kira 10-15 m , jari – jari atom 10-10 m SIFAT DASAR ELEKTRON • Elektron bergerak mengelilingi inti atom. • Elektron bermuatan negatif. • Elektron bergerak dengan arah yang sama dan menghasilkan arus listrik. • Elektron direpresentasikan dengan e-. • Elektron yang letaknya jauh dari nucleus memiliki energi yang lebih besar dibandingkan elektron yang berada dekat dengan nucleus. IKATAN ELEKTRO VALENSI • Ikatan kovalen terjadi apabila dua elektron dimiliki bersama oleh sepasang ion yang berdekatan atau bertetangga. • Dalam ikatan ini, sebuah elektron berpeluang hilang dari struktur ini dalam keadaan tertentu yang akan meninggalkan sebuah lubang. • Kekosongan dalam ikatan kovalen dapat pindah dari ion ke ion dalam kristal dan menghasilkan suatu arus yang setara dengan arus yang dihasilkan oleh gerakan muatan positif yang bebas. TINGKAT ENERGI ATOM • Diketahui persamaan tingkat energi setiap keadaan dalam Joule : mq4 Wn = - 1 8h202 n2 • Untuk setiap bilangan bulat n, dalam persamaan tersebut ditarik satu garis horizontal. Garis – garis ini disusun secara vertikal menurut harga numerik terhitung dari persamaan tersebut. Penyajian dengan gambar tersebut dinamakan diagram tingkat energi. • Bilangan di sebelah kiri merupakan energi dari tiap tingkatan dalam elektron volt. • Bilangan di sebelah kanan merupakan harga n. • Keadaan energi yang paling rendah disebut dengan tingkatan normal atau tingkatan dasar. • Keadaan stasioner lainnya dari atom disebut keadaan tereksitasi, kritis atau resonan. • Semakin banyak energi yang diberikan kepada elektron, elektron tersebut bergerak ke keadaan stasioner, di mana elektron tersebut menjauhi inti. • Apabila energi yang diberikan cukup besar untuk mengeluarkan elektron tersebut dari medan ion, elektron tersebut akan terlepas dari ion tersebut. Energi yang diperlukan untuk proses ini adalah potensial ionisasi. • Sebagai contoh hidrogen besarnya 13.60 eV. Orbit • Lintasan yang mengelilingi inti atom dimana memiliki elektron dimana disebut juga level energi. Elektron Valensi • Elektron yang berada di lapisan paling luar dari inti atom. Ionisasi • Proses hilangnya elektron valensi. Elektron Bebas • Elektron yang keluar dari lintasan. Jumlah Elektron dalam Lintasan • Jumlah maksimum elektron yang mungkin dalam satu lintasan diberikan dengan rumus : Ne = 2n2 dimana n adalah jumlah lintasan. PITA ENERGI Hukum dasar yang menjelaskan hubungan antara elektron dengan kulit orbit : • elektron bergerak dalam kulit orbit. Elektron tidak dapat mengelilingi inti atom dalam ruangan yang ada antara dua buah kulit orbit. • setiap kulit orbit berhubungan dengan sebuah range energi khusus,elektron-elektron yang bergerak dalam suatu kulit orbit akan memilki sejumlah energi yang sama. Catatan : level energi dalam kulit akan meningkat ketika makin jauh dari inti atom. Hal ini dapat disimpulkan maka elektron valensi selalu memilki level energi yang tertinggi dalam setiap atom. • elektron untuk berpindah dari suatu kulit ke kulit yang lain menyerap energi untuk menyesuaikan level energi antara level energi kulit awal dengan level energi kulit yang dituju. • Jika suatu atom menyerap cukup energi untuk berpindah dari suatu kulit yang satu kekulit yang lain, sebenarnya elektron ini kembali melepaskan energi yang diserapnya dan mengembalikannya ke kulit energi yang rendah • Pita energi : tingkat energi yang sangat berdekatan, tapi besar sekali cacahnya. • Pita valensi : pita yang diduduki oleh elektron. • Pita konduksi : pita kosong yang berada di atas pita terlarang • Pita terlarang : pita yang tidak memiliki energi di dalamnya. KONDUKTOR, ISOLATOR & SEMIKONDUKTOR • Konduktor merupakan penghantar listrik yang paling mudah. Contoh : Perak, tembaga, Emas, Alumunium. – Konduktor dicirikan dengan adanya satu elektron valensi bebas dimana elektron valensi ini dapat melepaskan diri dari atom dan menjadi atom bebas. – Banyaknya atom bebas dapat menyebabkan arus listrik. • Isolator bukan merupakan penghantar listrik yang baik – Elektron valensinya mengikat kuat pada atom dan memiliki sedikit elektron bebas serta dicirikan dengan memiliki 8 elektron valensi. Contoh : Intan • Semikonduktor merupakan penghantar listrik yang berada di antara konduktor dan isolator. – Jumlah elektron valensi pada semikonduktor biasanya terdiri dari 4 elektron valensi. Contoh : Silikon, Germanium, Karbon. Apakah perbedaan atom semikonduktor dengan atom konduktor ??? Mengapa Silikon banyak digunakan pada material semikonduktor dibandingkan dengan germanium ??? Energy Energy Energy Conduction Band Conduction Band Energy Gap Energy Gap Conduction Band Valence Band Insulator Valence Band Semikonduktor Diagram Level Energi Valence Band Konduktor Overlap ISOLATOR • Pada isolator, pita terlarang yang lebar memisahkan daerah valensi yang penuh dari pita konduksi yang kosong. • Energi yang dapat diberikan kepada elektron terlalu kecil untuk memindahkan elektron dari pita yang penuh ke pita yang kosong • Karena elektron tidak dapat memperoleh energi yang mencukupi, maka penghantaran tidak mungkin berlangsung. SEMIKONDUKTOR • Suatu bahan dengan lebar pita terlarang yang relatif kecil. • Pita valensi tetap penuh dan pita konduksi kosong sehingga bersifat isolator yang dinamakan semikonduktor intrinsik (murni). • Bila sebagian elektron valensi memperoleh panas termal yang lebih besar, maka elektron akan memasuki pita konduksi.Elektron bebas ini akan mudah bergerak walaupun dipengaruhi oleh medan yang kecil. Isolator ini dinamakan semikonduktor karena mulai dapat menghantarkan arus. • Lubang dalam semikonduktor menunjuk pada tingkatan energi yang kosong yang biasanya penuh dalam pita valensi. • Lubang ini berperan sebagai pembawa listrik yang sama efektifnya dengan elektron yang bebas. • Bila kristal diberi atom takmurni, takmurnian ini akan mempunyai tingkat energi yang berada dalam pita terlarang. Tingkatan takmurnian ini juga akan mempengaruhi penghantaran. • Suatu semikonduktor dimana pita konduksi sangat dikuasai oleh adanya takmurnian maka disebut semikonduktor ektrinsik (takmurnian). KONDUKTOR • Pita konduksi dan pita valensi saling tumpang tindih dan memiliki elektron bebas yang banyak. • Dibawah pengaruh medan listrik yang dikenakan, elektron dapat memperoleh energi tambahan dan memasuki tingkat energi yang lebih tinggi. • Karena elektron yang dapat berpindah tempat ini membentuk arus, maka pita energi yang terisi sebagian merupakan pita konduksi. ELEKTRON KONDUKSI DAN HOLE • Elektron konduksi dinamakan juga elektron bebas. • Ketika elektron berpindah ke pita konduksi, elektron tersebut meninggalkan hole pada pita valensi. • Setiap elektron yang pindah ke pita konduksi dan meninggalkan hole dinamakan pasangan elektron-hole. • Proses rekombinasi terjadi bila elektron pada pita konduksi kehilangan energinya dan jatuh kembali ke hole yang ada di pita valensi.