Uploaded by
abellya040101
Pengaruh Katalis Ammonium Molibdat dalam Reaksi Kalium Iodida dan Hidrogen Peroksida
advertisement

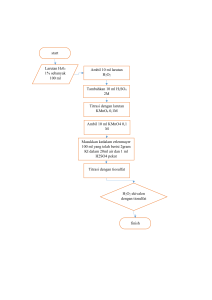
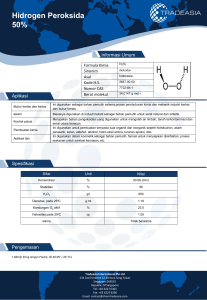
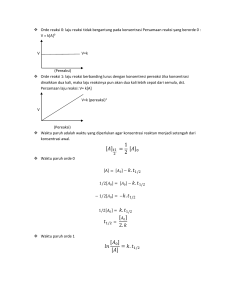
I. Judul Percobaan Pengaruh Katalis Ammonium Molibdat dalam Reaksi Kalium Iodida dan Hidrogen Peroksida II. Hari, Tanggal/ Jam Mulai Percobaan Kamis, 29 Februari 2024/ 10.00 WIB III. Hari, Tanggal/ Jam Selesai Percobaan Kamis, 29 Februari 2024/ 12.00 WIB IV. Tujuan Percobaan Untuk Mengetahui Pengaruh Katalis Ammonium Molibdat dalam Reaksi Kalium Iodida dan Hidrogen Peroksida V. Tinjauan Pustaka a. Laju Reaksi Laju reaksi adalah laju perubahan konsentrasi reaktan dan produk dalam satuan waktu. Laju reaksi menyatakan penurunan konsentrasi reaktan atau peningkatan konsentrasi produk reaksi per satuan waktu (detik). Atau laju reaksi dapat dinyatakan dalam mol zat per liter dalam satu satuan waktu (detik). Laju reaksi dapat dipengaruhi oleh beberapa faktor, yaitu konsentrasi reaktan, luas permukaan sentuhan, suhu, dan katalis (Chang, 2005). Tujuan dari mempelajari laju reaksi adalah dapat memprediksi reaksi laju sesuatu. Materi dapat dilakukan dengan menghitung secara matematis melalui hukum tingkat. Hukum Laju Reaksi atau Persamaan Laju Reaksi: a A + bB → cC + dD Hukum laju reaksi (The Rate Law) menunjukkan korelasi antara laju reaksi (V) dengan konsentrasi laju reaksi (k) dan konsentrasi reaktan yang dinaikkan pangkat bilangan tertentu (reaksi orde). Reaksi laju hukum dapat dinyatakan sebagai berikut: a A + bB → cC + dD Hukum laju reaksi (The Rate Law) menunjukkan korelasi antara laju reaksi (V) dengan konsentrasi laju reaksi (k) dan konsentrasi reaktan yang dinaikkan ke pangkat bilangan tertentu (reaksi orde). Reaksi laju hukum dapat dinyatakan sebagai berikut: a A + bB → cC + dD Keterangan: - A dan B adalah reaktor - C dan D adalah produk - a b C D adalah reaksi pemerataan koefisien Sehingga kecepatan hukum dapat ditulis sebagai berikut: v = k [A]m[B]n Keterangan: - v = laju reaksi (m / detik) - k = konstanta laju reaksi (L / mol.detik) - [A] = konsentrasi zat A (mol / L) - [B] = konsentrasi zat B (mol / L) - m = urutan reaksi sehubungan dengan A - n = urutan reaksi sehubungan dengan B Pangkat m dan n dalam hukum laju reaksi adalah pangkat bilangan (reaksi orde), yang hanya dapat ditentukan melalui percobaan nilai m atau n tidak sama dengan koefisien reaksi a dan b. Angka pangkat m dan n menunjukkan pengaruh konsentrasi reaktan A dan B terhadap laju reaksi. Urutan total (urutan keseluruhan) atau laju reaksi adalah urutan total reaktan. Nilai koefisien k disebut konstanta laju, yang tidak tergantung pada konsentrasi (tetapi tergantung pada suhu) (Atkins, 1996). b. Faktor-faktor yang Mempengaruhi Laju Reaksi Ada 4 faktor yang mempengaruhi besarnya nilai laju reaksi, yaitu: 1. Konsentrasi Dalam sesuatu reaksi semakin besar zat konsentrasi reaktan, maka akan semakin mempercepat laju reaksi. Dengan meningkatnya konsentrasi jumlah reaktan, semakin banyak partikel reaktan, semakin banyak peluang untuk bertabrakan, semakin besar. 2. Suhu Laju reaksi akan meningkat dengan meningkatnya suhu reaksi. Kenaikan suhu akan menambah energi molekul kinetik-molekul, akibatnya molekul yang bereaksi menjadi lebih aktif untuk bertabrakan. Hal ini karena gerakan-gerakan molekul semakin cepat pada suhu yang lebih tinggi. 3. Luas Permukaan Reaksi kimia terjadi karena tumbukan yang efektif antar partikel. Terjadi smash berarti ada bidang yang menyentuh (field touch). Jika semakin luas luas permukaan kontak, semakin sering terjadi tumbukan menghasilkan zat yang produknya semakin banyak, sehingga reaksi laju semakin besar. 4. Katalis Katalis adalah zat yang dapat mempercepat reaksi laju tetapi tidak mengalami perubahan kimia yang permanen. Dalam kimia industri skala, katalis akan mempercepat reaksi laju tanpa menghasilkan produk yang tidak diinginkan. c. Katalis dan Prinsip Salah satu yang dapat mempengaruhi laju reaksi adalah penambahan katalis. Katalis adalah zat yang dapat mempercepat laju reaksi, tetapi tanpa mengalami reaksi kimia. Katalis dapat mempercepat laju reaksi dengan mencari jalur alternatif dengan energi aktivasi yang lebih rendah sehingga katalis dapat meningkatkan laju reaksi. Dengan kata lain, penambahan katalis memberikan cara lain untuk reaksi, yang memiliki aktivasi energi lebih rendah, sehingga lebih banyak molekul bertabrakan dengannya suhu normal dan laju reaksi lebih cepat. Aktivasi energi adalah energi minimum yang dibutuhkan reaksi campuran untuk menghasilkan suatu produk. Katalis juga berfungsi sebagai perantara untuk reaktan dan sebagai pengikat. Berikut ini adalah grafik reaksi energi aktivasi dengan penambahan katalis dan tanpa penambahan katalis: Gambar 1. Perbedaan reaksi dengan katalis dan tanpa katalis Berdasarkan gambar di atas, dapat dilihat bahwa penggunaan katalis dapat memberikan alternatif mekanisme lain yang energi aktivasinya lebih rendah, sehingga reaksi dapat berjalan lebih cepat. Pembentukan kompleks aktif akan lebih cepat dicapai dengan penambahan katalis yang menyebabkan reaksi menjadi lebih cepat. Katalis adalah senyawa yang dapat meningkatkan laju reaksi tetapi tidak dikonsumsi oleh reaksi. Katalis banyak digunakan di alam, laboratorium dan industri (Shriver & Atkins, 1999). Katalis adalah zat yang dapat meningkatkan laju reaksi kimia sehingga reaksi dapat berjalan lebih cepat. Dalam reaksi, katalis sebenarnya terlibat, tetapi pada akhir reaksi itu direformasi ke bentuk aslinya. Dengan demikian, katalis tidak memberikan energi tambahan ke sistem dan secara termodinamika tidak dapat mempengaruhi kesetimbangan. Katalis mempercepat reaksi dengan menurunkan energi aktivasi reaksi. Penurunan energi aktivasi terjadi sebagai akibat dari interaksi antara katalis dan reaktan. Katalis menyediakan situs aktif yang berperan dalam proses reaksi. Situs aktif ini dapat berasal dari logam yang disimpan pada pembawa atau dapat berasal dari pembawa itu sendiri. Logam-logam ini umumnya adalah logam transisi yang memberikan orbital d kosong atau elektron tunggal yang akan disumbangkan ke molekul reaktan sehingga terbentuk ikatan baru dengan kekuatan ikatan tertentu (Campbell, 1998). d. Jenis-jenis Katalis - Katalis Asam Basa Jumlah reaksi yang kecepatannya dipercepat oleh adisi asam atau basa, zat yang disebut asam dan basa di sini tidak terbatas pada asam Arrhenius, tetapi juga mencakup asam-basa Bronsted-Lowry dan Lewis. - Biokatalis Jenis proses katalis yang juga penting untuk dipelajari adalah proses yang melibatkan enzim. Enzim adalah katalis biologis. Enzim mengkatalisis sejumlah besar reaksi biologis. Ada dua kategori enzim, yaitu enzim hidrolik yang mengkatalisis proses seperti reaksi ionik, transfer proton dan sebagainya dan enzim oksidasi-reduksi yang mengkatalisis reaksi yang melibatkan transfer elektron. - Katalis Heterogen Seperti pada katalis homogen, kemampuan katalis heterogen dalam mempengaruhi laju adalah melalui terjadinya mekanisme reaksi alternatif dengan energi aktivasi yang lebih rendah. Zat yang biasa digunakan sebagai katalis heterogen adalah logam ( biasanya logam transisi), paduan dan semioksida serta sulfida konduktor. Efektivitas katalis ditentukan berdasarkan jumlah produk reaksi yang terbentuk per satuan waktu per satuan luas permukaan katalis. e. Faktor-faktor yang Mempengaruhi Laju Reaksi Faktor-faktor yang mempengaruhi laju reaksi meliputi: 1. Konsentrasi Konsentrasi dapat mempengaruhi laju reaksi, ini karena lebih banyak partikel memungkinkan tabrakan efektif yang lebih sering antara partikel yang menghasilkan perubahan. Jadi, semakin besar konsentrasi reagen, semakin cepat reaksi akan berlangsung (Mawarnis, 2021). 2. Luas permukaan Area permukaan kontak berkaitan dengan kemudahan atau kesulitan partikel yang bereaksi untuk bertemu. Jika bagian luar permukaan kontak meningkat laju reaksi akan meningkat karena lebih mudah bertemu partikel sehingga jumlah tumbukan efektif meningkat (Mawarnis, 2021). 3. Suhu Suhu berhubungan dengan nilai energi kinetik partikel. Semakin besar suhu, energi kinetik partikel akan meningkat. Partikel memiliki energi kinetik minimum ≥ energi aktivasi yang menyebabkan jumlah tumbukan efektif meningkat dan laju reaksi semakin cepat (Mawarnis, 2021). 4. Tekanan dan volume Peningkatan tekanan akan mengurangi volume, karena ketika tekanan semakin besar jumlah tumbukan yang terjadi akan meningkat. Volume akan semakin kecil yang mengakibatkan jarak masing-masing molekul semakin dekat, sehingga laju reaksi akan lebih cepat (Mawarnis, 2021). 5. Katalis Katalis adalah zat yang ditambahkan ke reaksi untuk mempercepat reaksi. Katalis mempercepat reaksi dengan menyediakan mekanisme reaksi dengan energi aktivitas yang lebih rendah daripada energi aktivasi tanpa katalis. Semakin rendah energi aktivasi, semakin banyak partikel yang memiliki energi kinetik untuk mengatasi penghalang energi aktivasi. Sehingga jumlah tumbukan efektif meningkat yang menyebabkan laju reaksi meningkat (Mawarnis, 2021). f. Pengenceran Pengenceran Langsung, Pengenceran pada prinsipnya hanya menambahkan pelarut saja, sehingga jumlah mol zat terlarut sebelum pengenceran sama dengan jumlah mol zat terlarut setelah pengenceran. Dengan mengatakan jumlah lain zat mmol yang dilarutkan sebelum pengenceran sama dengan jumlah zat mmol yang dilarutkan setelah pengenceran atau jumlah zat Mmol yang dilarutkan sebelum pengenceran sama dengan jumlah zat M yang dilarutkan setelah pengenceran. Rumus pengenceran sederhana sebagai berikut: M1 V1 = M2V2 Keterangan: - M1 = Molaritas larutan sebelum disolusi - V1 = Volume larutan sebelum disolusi - M2 = Larutan molaritas setelah disolusi - V2 = Volume Larutan molaritas setelah disolusi Pengenceran langsung adalah pengenceran yang mana larutan yang akan diencerkan diambil langsung dari induk larutan. Solusi utama yang diambil sebelumnya dihitung sebelumnya menggunakan rumus di on. Untuk mendapatkan konsentrasi yang diinginkan, pengenceran perlu dilakukan perhitungan volume detik yang dibutuhkan, juga seterusnya (Yazid & Lisda, 2006). g. Keunggulan dan Kerugian dari Pngenceran langsung dan Pengenceran Tidak Langsung Keuntungan dari pengenceran langsung adalah kesalahan lebih sedikit, jika terjadi kesalahan dalam satu solusi standar, solusi standar lainnya tidak salah, menghemat waktu dan meminimalkan kesalahan, tetapi kerugiannya adalah bahan yang boros. Pengenceran bertingkat atau indirect dilution, yaitu pengenceran yang tidak berasal dari cairan induk tetapi diambil dari hasil pengenceran sebelumnya. Keuntungan dari pengenceran bertingkat adalah menghemat bahan, tetapi ada kemungkinan kesalahan besar karena menggunakan larutan sebelumnya. h. KI (Kalium Iodida) Kalium iodida adalah garam kristal putih dengan rumus kimia KI, KI dapat menguning ketika dipanaskan di udara atau ketika berdiri di udara lembab untuk waktu yang lama, karena oksidasi iodida menjadi yodium. Kalium iodida bersifat ionik, K+ dan I− . Senyawa ini mengkristal dalam struktur natrium klorida. Senyawa ini diproduksi secara industri dengan mereaksikan KOH dengan yodium. Ini adalah garam putih, yang merupakan senyawa iodida yang paling signifikan secara komersial. Senyawa ini kurang mudah menyerap air sehingga lebih mudah untuk bekerja dengan. Karena ion iodida adalah reduktor yang kurang kuat, I− mudah teroksidasi untuk membentuk I2 oleh oksidator (Sulistiawan, 2018). Menurut Stwertka (2002), kalium iodida memiliki beberapa karakteristik, seperti; Table 1. Karakteristik Iodida Rumus KI Massa Molar 166,00 g / mol Bentuk Kristal padat putih Nomor CAS [7681-11-0] Massa jenis dan fasa 3,13 g/cm3, padatan 128 g/100 ml (6 °C) Kelarutan dalam air 681°C (954 K) Titik lebur 1330°C (1600 K) i. H2SO4 (Asam Sulfat) Penambahan H2SO4 berfungsi untuk membuat reaksi berjalan dalam lingkungan asam karena larutan KI dengan hidrogen peroksida membutuhkan kondisi asam yang optimal. Selain bersifat asam, H2SO4 juga berfungsi untuk menghidrasi H2O2, sehingga yodium terbentuk secara perlahan yang ditandai dengan perubahan warna dari tidak berwarna menjadi biru dan produk sampingnya adalah air. Asam sulfat, H2SO4 adalah asam mineral kuat (anorganik). Ini larut dalam air dalam semua rasio. Asam sulfat 10%, asam sulfat encer biasanya digunakan sebagai bahan pendukung percobaan di laboratorium. Asam ini memiliki viskositas yang cukup tinggi, konduktivitas efektif ion H3SO4+ dan HSO4- tinggi karena mekanisme antar-jemput proton intramolekul, membuat asam sulfat menjadi konduktor yang baik. H2SO4 juga merupakan pelarut yang baik untuk banyak reaksi. j. Ammonium molibdat ((NH4)2Mo4) Amonium molibdat memiliki rumus senyawa (NH4)2Mo4, senyawa ini berbentuk bubuk padat dengan warna putih atau kuning kehijauan dan tidak berbau. Sifat fisik senyawa ini termasuk memiliki massa molar 1163,9 g / mol dan 1235,86 g / mol, berat jenis sekitar 2.498 g / cm3, dan titik leleh 190oC. Dapat dibuat dengan melarutkan molibdenum trioksida dalam cairan amonia berlebih dan penguapan pada suhu kamar sehingga kelebihan amonia akan menguap dan menghasilkan amonium heptamolibdat. Senyawa ini mudah larut dalam air dan asam, tetapi tidak larut dalam alkohol, juga cukup stabil pada tekanan dan suhu normal. k. Hidrogen Peroksida (H2O2) Hidrogen peroksida (H2O2) adalah cairan bening, sedikit lebih kental dari air, yang merupakan zat pengoksidasi kuat. Senyawa ini ditemukan oleh Louis Jacques Thenard pada tahun 1818. Ini memiliki bau asam yang khas dan mudah larut dalam air. Bahan baku pembuatan hidrogen peroksida adalah gas hidrogen (H2) dan gas oksigen (O2). Salah satu keunggulan hidrogen peroksida dibandingkan dengan zat pengoksidasi lainnya adalah ramah lingkungan. Itu tidak meninggalkan residu, hanya air dan oksigen. Kekuatan oksidator juga dapat disesuaikan sesuai kebutuhan. (Bird, 2017). Hidrogen peroksida dengan rumus kimia umum adalah H2O2 yang merupakan senyawa organik yang memiliki sifat pengoksidasi kuat. Hidrogen peroksida memiliki ciri-ciri fisik, yaitu pada fase cair dalam berbagai konsentrasi, larutan yang tidak berwarna, berbau keasaman, dan larut dengan baik dalam air. Ikatan kovalen dalam struktur H-O-O-H membentuk ikatan hidrogen nonpolar yang tidak ditemukan dalam air. Berbagai senyawa peroksigen dapat dibentuk melalui reaksi substitusi hidrogen peroksida dengan pereaksi organik. Senyawa ini digunakan secara komersial sebagai katalis untuk reaksi polimerisasi dan zat pengoksidasi untuk beberapa reaksi khusus. Reaktan utama dan produk dari reaksi ini termasuk agen alkil (alkilhidroperoksida), asam karboksilat dan peroksi, anhidrida asam atau klorida (yaitu, diasil peroksida), keton dan keton peroksida. Hidrogen peroksida banyak digunakan dalam industri kimia. Dalam bidang industri, penggunaan hidrogen peroksida cukup luas, antara lain sebagai thickening agent atau zat pemutih pada industri pulp, kertas dan tekstil serta sebagai oksidator non pencemar (Othmer, 1961). Hidrogen peroksida memiliki peran penting dalam beberapa industri, termasuk: - Penggunaan hidrogen peroksida yang paling menonjol adalah sebagai pemutih bubur kayu. - Sebagai agen pengendalian pencemaran dalam proses pengolahan limbah domestik dan industri. - Digunakan dalam pembuatan sejumlah bahan organik dan anorganik sebagai bahan untuk pembuatan plasticizer dan stabilisator. - Sebagai pereaksi penting dalam pembuatan peroksida organik dan turunan keton sebagai katalis dan oksidator. - Sebagai bahan baku pengolahan limbah yang mengandung sianida dari pencucian bijih emas dan perak pada industri pertambangan (Othmer, 1962). Sifat Fisik (Othmer, 1962) - Formula molekul: H2O2 - Berat molekul: 34,016 gram / mol - Bentuk: Cair - Warna: tidak berwarna - Titik didih: 141 °C - Massa jenis: 1.387 (20 °C, Kg / m3) Sifat kimia - Polutan tertentu dalam air limbah atau air limbah tidak dapat diuraikan sendiri dengan H2O2 tetapi dengan bantuan reagen lain seperti Fe untuk membantu memecah polutan dalam air limbah. H2O2 + Fe2+ → OH + OH- + Fe3+ H2O2 → 2 OH O3 + H2O2 → 2 OH - Ikatan hidrogen dengan air membentuk molekul H2O2 yang akan lebih stabil dalam air. - Sangat kuat sebagai zat pengoksidasi dalam larutan air. l. Larutan Amilum Amilum adalah kelompok polisakarida dengan rumus molekul (C₆H₁₀O₅)ₓ. Polisakarida adalah karbohidrat yang dapat dihidrolisis menjadi monosakarida (Gunawan dan Mulyani, 2004). Berdasarkan sifat kimianya, pati terdiri dari 20% bagian yang larut dalam air (amilosa) dan 80% bagian yang tidak larut dalam air (amilopektin) (Soegiharjo, 2013). Penggunaan larutan pati dalam percobaan ini sebagai indikator dalam menentukan penghentian reaksi. Hal ini dikarenakan produk reaksinya adalah I2, sehingga larutan amilum akan bereaksi dengan I2 membentuk warna biru. VI. Alat dan bahan a. Alat Gelas ukur 10 mL 2 buah Stopwatch 1 buah Tabung reaksi 2 buah Labu ukur 50 mL 1 buah b. Bahan KI 0,5 M 4 tetes Asam sulfat 0,5 M 2 tetes H2O2 10 M (30%) 10 tetes Ammonium Molibdat 1 tetes Amilum 4 tetes Aquades 75 mL VII. Alur Percobaan 1. Pengenceran 10 tetes larutan H2O2 10 M - Dimasukkan ke dalam labu ukur 50 ml - Diencerkan dengan aquades hingga tanda batas - Dikocok hingga homogen Larutan H2O2 encer Reaksi : H2O2 (aq) + H2O (l) → H2O2 (aq) 2 tetes larutan KI 0,5 M - Dimasukkan ke dalam labu ukur 10 ml - Diencerkan dengan aquades hingga tanda batas - Dikocok hingga homogen Larutan KI encer Reaksi : KI (aq) + H2O (l) → KI (aq) 2 tetes larutan (NH4)2 MoO4 - Dimasukkan ke dalam labu ukur 10 ml - Diencerkan dengan aquades hingga tanda batas - Dikocok hingga homogen Larutan (NH4)2 MoO4 encer Reaksi : (NH4)2 MoO4 (aq) + H2O (l) → (NH4)2 MoO4 (aq) 2. Pengujian katalis Ammonium Molibdat 1 tetes larutan H2SO4 1 tetes larutan H2SO4 - Dimasukkan ke dalam tabung reaksi 1 - Ditambahkan 2 tetes larutan kanji - Ditambahkan 1 tetes larutan H2O2 encer - Ditambahkan 5 tetes aquades - Ditambahkan 1 tetes larutan KI - Diamati dan dicatat waktu saat penambahan KI sampai timbul warna biru Hasil - Dimasukkan ke dalam tabung reaksi 2 - Ditambahkan 2 tetes larutan kanji - Ditambahkan 1 tetes larutan H2O2 encer - Ditambahkan 5 tetes aquades - Ditambahkan 1 tetes larutan KI - Diamati dan dicatat waktu saat penambahan KI sampai timbul warna biru Hasil Reaksi menggunakan katalis H2O2(aq) + H2SO4(aq) + 2KI(aq) I2(aq) + KIO4(aq) + 2H2O(l) Reduksi : H2O2(aq) + 2H+(aq) + 2e-(aq) Oksidasi : 2I-(aq) I2(aq) + 2e- H2O2(aq) + 2H+(aq) + 2I-(aq) -1 2H2O(l) -1 2H2O(l) + I2(aq) -2 0 Reduksi Oksidasi Reaksi pembentukan kompleks Amilum dan Iod : (Rohmah & Rini, 2020). Reaksi tanpa katalis : H2O2(aq) + H2SO4(aq) + 2KI(aq)→ I2 (aq) + KIO4 (aq) + 2H2O (l) Reduksi : H2O2(aq) + 2H+(aq) + 2e-(aq) → 2H2O(l) Oksidasi : 2I-(aq) → I2(aq) + 2eH2O2(aq) + 2H+(aq) + 2I-(aq) → 2H2O(l) + I2(aq) -1 -1 -2 0 Reduksi Oksidasi Reaksi pembentukan kompleks Amilum dan Iod : (Rohmah & Rini, 2020). VIII. Hasil Pengamatan No. Prosedur Percobaan Perc. 1. Pengenceran 10 tetes larutan H2O2 10 M Hasil Pengamatan Sebelum Sesudah - H2O2 10 M = - H2O2 10 M + Dugaan/Reaksi - H2O2 (aq) + H2O (l) → larutan tidak aquades = berwarna larutan tidak - KI 0,5 M = berwarna larutan tidak - KI 0,5 M + - (NH4)2 MoO4 (aq) + H2O berwarna aquades = (l) → (NH4)2 MoO4 (aq) - (NH4)2 MoO4 larutan tidak 2 tetes larutan KI 0,5 M = larutan berwarna - Dimasukkan ke dalam labu ukur 10 ml - Diencerkan dengan aquades hingga tanda batas - Dikocok hingga homogen tidak - KI 0,5 M + berwarna aquades = - Aquades = larutan tidak larutan tidak berwarna - Dimasukkan ke dalam labu ukur 50 ml - Diencerkan dengan aquades hingga tanda batas - Dikocok hingga homogen Larutan H2O2 encer Larutan KI encer berwarna 2 tetes larutan (NH4)2 MoO4 - Dimasukkan ke dalam labu ukur 10 ml - Diencerkan dengan aquades hingga tanda batas - Dikocok hingga homogen Larutan (NH4)2 MoO4 encer H2O2 (aq) - KI (aq) + H2O (l) → KI (aq) (Svehla, 1990) Kesimpulan Berdasarkan percobaan telah dilakukan, larutan menjadi encersetelah ditambahkan aquades yang pekat 2. Pengujian katalis Ammonium Molibdat 1 tetes larutan H2SO4 - Dimasukkan ke dalam tabung reaksi 1 - Ditambahkan 2 tetes larutan kanji - Ditambahkan 1 tetes larutan H2O2 encer - Ditambahkan 5 tetes aquades - Ditambahkan 1 tetes larutan KI - Diamati dan dicatat waktu saat penambahan KI sampai timbul warna biru Hasil - H2SO4 = Tabung I - H2SO4 + larutan tidak larutan kanji berwarna = larutan tidak - Larutan kanji berwarna = larutan - H2SO4 + larutan kanji tidak + H2O2 encer berwarna = larutan tidak - H2O2 encer = berwarna larutan tidak - H2SO4 + larutan kanji berwarna + H2O2 encer - Ammonium + aquades = larutan tidak molibdat = berwarna larutan tidak - H2SO4 + larutan kanji berwarna + H2O2 encer - KI encer = + aquades + ammonium larutan tidak molibdat = berwarna larutan tidak berwarna - H2SO4 + larutan kanji + H2O2 encer + aquades + H2O2 (aq) + H2SO4 (aq) + 2KI Berdasarkan percobaan (𝑁𝐻4)2𝑀𝑜𝑂4 (aq) →−−−−−−−−→ I2 (aq) + 2H2O (aq) + K2SO4 (aq) telah dilakukan pada tabung Reduksi: yang 1 dengan menggunakan + - H2O2 (aq) + 2H (aq) + 2e → 2H2O2 (aq) amonium molibdat dapat mempercepat Oksidasi: 2I-(aq) → I2 (aq) + 2e+ laju reaksi antara KI dan - H2O2 yang H2O2 (aq) + 2H (aq) + 2I (aq) ditandai dengan → 2H2O2 (aq) + I2 (aq) perubahan warna menjadi biru pada waktu 6 detik. Sedangkan pada tabung 2 yang tidak menggunakan (Rohmah & Rini, 2020). amonium molibdat reaksi antara ki dan H2O2 ditandai dengan perubahan 1 tetes larutan H2SO4 - Dimasukkan ke dalam tabung reaksi 2 - Ditambahkan 2 tetes larutan kanji - Ditambahkan 1 tetes larutan H2O2 encer - Ditambahkan 5 tetes aquades - Ditambahkan 1 tetes larutan KI - Diamati dan dicatat waktu saat penambahan KI sampai timbul warna biru Hasil ammonium molibdat + KI encer = larutan berwarna biru - T1 = 6 detik Tabung II - H2SO4 + larutan kanji = larutan tidak berwarna - H2SO4 + larutan kanji + H2O2 encer = larutan tidak berwarna - H2SO4 + larutan kanji + H2O2 encer + aquades = larutan tidak berwarna - H2SO4 + larutan kanji + H2O2 encer + aquades + KI encer = larutan berwwarna biru warna menjadi biru pada waktu detik. 406 Dapat disimpulkan bahwa amonium molibdat dapat mempercepat laju reaksi antara KI dan H2O2. - T2 = 406 detik IX. Pembahasan Telah dilakukan praktikum kimia fisika atau kinetika kimia pada hari Kamis, tanggal 29 Februari 2024 yang berjudul “Pengaruh kalilis Ammonium Molibdat dalam Reaksi Kalium Iodida dan Hidrogen peroksida” pada praktikum ini memiliki tujuan untuk mengetahui Pengaruh kalilis Ammonium Molibdat dalam Reaksi Kalium Iodida dan Hidrogen peroksida. Alat yang digunakan dalam percobaan ini adalah Labu ukur 10 mL, labu ukur 50 mL, gelas kimia 100 mL, pipet tetes, tabung reaksi, rak tabung reaksi, dan stopwacth. Sedangkan bahan yang digunakan untuk praktukum ini adalah Larutan H2O2, Larutan KI, Larutan (NH4)2MoO4, larutan H2SO4, Larutan Amilum, dan Aquades. Pada praktikum yang berjudul pengaruh katalis ammonium molibdat dalam reaksi kalium iodida dan hidrogen peroksida ini terdapat 2 langkah percobaan. Langkah yang pertama adalah melakukan pengenceran terhadap larutan hidrogen peroksida (H2O2), kalium iodida (KI), dan ammonium molibdat ((NH4)2MoO4). Tujuan pengencaran pada proses ini adalah untuk menurunkan konsentrasi pada larutan agar tumbukan antarpartikel lebih jarang terjadi sehingga laju reaksi lebih lambat dan dapat diamati. Adapun prinsip dari proses pengenceran adalah menambahkan larutan untuk mengurangi molaritas, mengurangi konsentrasi dari laju reaksi agar tidak pekat dan jumlah mol tetap sama. Prinsip yang digunakan dalam reaksi ini adalah reaksi redoks. Dalam reaksi redoks, terjadi pelaku penurunan dan penaikan bilangan oksidasi yang disebut dengan oksidator dan reduktor. Oksidator dan reduktor merupakan istilah yang sering dijumpai pada reaksi redoks. Oksidator (pengoksidasi) adalah zat yang mengalami penurunan (reduksi) bilangan oksidasi dalam suatu reaksi redoks. Reduktor (pereduksi) adalah zat yang mengalami kenaikan (oksidasi) bilangan oksidasi dalam suatu reaksi redoks. Oksidator dari reaksi ini adalah hidrogen peroksida (H2O2) dan reduktor adalah larutan KI. Pada percobaan pengaruh katalis ammonium molibdat dalam reaksi kalium iodida dan hidrogen peroksida terdapat tahap pengenceran. Larutan yang diencerkan pada tahap ini adalah larutan hadrogen peroksida (H2O2), larutan kalium iodida (KI), dan larutan ammonium molibdat ((NH4)2MoO4). Pengenceran pertama yaitu H2O2 10 M yang merupakan larutan tidak berwarna diambil 10 tetes dan dimasukkan ke dalam labu ukur 50 mL, kemudian ditambahkan dengan aquades yang merupakan larutan tidak berwarna, tujuan dari penambahan aquades adalah untuk mengurangi konsentrasi molaritas H2O2, setelah ditambahkan aquades sampai tanda batas kemudian dikocok sampai homogen dan menghasilkan larutan H2O2 encer yang tidak berwarna. Larutan KI 0,5 M tidak berwarna diambil sebanyak 2 tetes dan dimasukkan ke dalam labu ukur 10 mL, kemudian ditambahkan aquades yang merupakan larutan tidak berwarna, tujuan dari penambahan aquades adalah untuk mengurangi konsentrasi molaritas KI, setelah ditambahkan aquades sampai tanda batas kemudian dikocok sampai homogen dan menghasilkan larutan KI encer yang tidak berwarna. Larutan (NH4)2MoO4 tidak berwarna diambil 2 tetes dan dimasukkan ke dalam labu ukur 10 mL, kemudian ditambahkan aquades yang merupakan larutan tidak berwarna, tujuan dari penambahan aquades adalah untuk mengurangi konsentrasi molaritas (NH4)2MoO4, setelah ditambahkan aquades sampai tanda batas kemudian dikocok sampai homogen dan menghasilkan larutan (NH4)2MoO4 encer yang tidak berwarna. Adapun reaksi dari proses pengenceran pada larutan H2O2, larutan KI, dan larutan (NH4)2MoO4 adalah sebagai berikut: Reaksi H2O2: H2O2 (aq) + H2O (l) → H2O2 (aq) encer Reaksi KI: KI (aq) + H2O (l) → KI (aq) encer Reaksi (NH4)2MoO4 : (NH4)2MoO4 (aq) + H2O (l) → (NH4)2MoO4 (aq) encer (Svehla, 1990). Percobaan selanjutnya adalah pengujian katalis dengan ammonium molibdat. Sebelum dilakukannya percobaan siapkan 2 tabung reaksi, masing-masing tabung reaksi (tabung reaksi I dan II) diteteskan dengan larutan H2SO4 tidak berwarna sebanyak 1 tetes. Tujuan ditambahkan larutan H2SO4 adalah untuk memberikan suasana asam. Selain itu larutan H2SO4 ini akan menhidrasi larutan KI agar membentuk iod dan iod nanti akan bereaksi dengan amilum untuk membentuk kompleks warna biru dan larutan H2SO4 berperan untuk memperlambat laju reaksi dari katalis (ammonium molibdart) sehingga lebih mudah untuk diamati. Setelah itu ditambahkan 2 tetes larutan kanji yang tidak berwarna dengan tujuan karena larutan KI berperan sebagai indikator untuk bereaksi dengan iod agar menghasilkan kompleks yang berwarna biru. Setelah ditambahkannya larutan kanji, selanjutnya ditambahkan hidrogen peroksida (H2O2) larutan tidak berwarna yang berperan sebagai oksidator. Setelah itu ditambahkan 5 tetes aquades yang merupakan larutan tidak berwarna dengan tujuan aquades ini sebagai pelarut untuk mengencerkan larutan selanjutnya. Setelah itu ditambahkan 1 tetes ammonium molibdat ((NH4)2MoO4) pada tabung I untuk membandingkan cepat laju reaksi yang terjadi pada reaksi tersebut. Penambahan aquades dengan tujuan agar mempercepat suatu reaksi karena berperan dengan katalis. Setelah itu ditambahkan 1 tetes larutan KI tidak berwarna sebagai reduktor dan larutan akan berubah menjadi berwarna biru Ketika sudah terjadi laju reaksi. Adapun untuk reaksi redoks yang dihasilkan adalah sebagai berikut: H2O2(aq) + H2SO4(aq) + 2KI(aq) I2(aq) + KIO4(aq) + 2H2O(l) Reduksi : H2O2(aq) + 2H+(aq) + 2e-(aq) Oksidasi : 2I-(aq) I2(aq) + 2e- H2O2(aq) + 2H+(aq) + 2I-(aq) -1 2H2O(l) -1 2H2O(l) + I2(aq) -2 0 Reduksi Oksidasi Reaksi pembentukan kompleks Amilum dan Iod : (Rohmah & Rini, 2020). X. Kesimpulan Berdasarkan percobaan yang telah dilakukan pada pengujian katalis Ammonium Molibdat dan Hidrogen Persida didapatkan hasil bahwa reaksi yang menggunakan katalis Ammonium Molibdat lebih cepat berubahwarna menjadi biru. Pada tabung I yang menggunakan katalis ammonium molibdat,larutan berubah menjadi biru dengan waktu 6 detik dan pada tabung II yang tanpa menggunkan katalis ammonium molibdat larutan berubah warna menjadi biru dengan waktu 406 detik. Dari percobaan tersebut dapat disimpulkan bahwa reaksi yang menggunakan katalis ammonium molibdat laju reaksinya lebih cepat dibandingkan dengan reaksi tanpa menggunkan katalis ammonium molibdat. XI. Saran Penulis menyarankan agar ketika melakukan praktikum menggunkan alat dengan hati-hati dan jangan sampai merusaknya. Teliti dan terampil dalam menggunakan bahan-bahan yang digunakan untuk percobaan dan menganalisis dengan baik agar diperoleh hasil pengamatan yang tepat pada percobaan. Menggunakan jas lab saat melakukan praktikum untuk menghindari hal-hal yang tidak diinginkan. XII. Daftar Pustaka Anonim. 2018. Asam Sulfat. https://id.wikipedia.org/wiki/Asam_Sulfat. Diakses pada tanggal 11 Maret 2018. Atkins, PW 1996. Kimia Fisik Volume 2, Edisi Keempat . Erlangga. Jakarta. Bitds, Tony. 1993. Kimia Fisika untuk Universitas. Gramedia PT. Jakarta. Gunawan, D & Mulyani, S. 2004. Ilmu Obat Alam (Farmakognosi). Jilid 1. Jakarta: Penebar Swadaya. Petrucci, Ralp H. 1985. Kimia Dasar Edisi IV Volume II. Jakarta: Erlangga Purnami, dkk. 2015. Pengaruh Penggunaan Katalis Terhadap Laju Dan Efisiensi Shukri, 1999, Kimia Dasar 2, ITB press, Bandung Stwertka, Albert (2002). Panduan untuk Elemen. Oxford University Press, Amerika Serikat. hlm. 137. ISBN 9780195150261. Diarsipkan dari versi asli tanggal 2017-09-14. Sugiarto,Bambang, dkk. 2014. Kimia Dasar. Surabaya: Fakultas MIPAUniversitas Negeri Surabaya. Supelco. (2022). Lembar Data Keselamatan . Diakses tanggal february 26, 2024, from sigmaaldrich.com: www.sigmaaldrich.com Yazid, E., & Lisda, N. (2006). Panduan Praktikum Biokimia bagi Mahasiswa Analis. Yogyakarta. XIII. Lampiran a. NO 1. Dokumrntasi GAMBAR KETERANGAN Pengenceran H2O2 Pengambilan H2O2 sebanyak 10 tetes dimasukkan kedalam labu ukur 50 mL 3. Penambahan aquadest pada labu ukur 50 mL yang telah berisi 10 tetes larutanH2O2 4. Dikocok hingga homogen Pengenceran KI 6. Pengambilan KI sebanyak 2 tetes dimasukkan kedalam lahu ukur 10 mL 7. Ditambahkan aquadest kedalam labu ukur 10 mL yang telah berisi 2 tetes KI 8. Dikocok hingga homogen Pengenceran Ammonium Molibdat 10. Pengambilan 2 tetes ammonium molibdat dimasukkan kedalam labuukur 10 mL 11. Ditambahkan aquadest kedalam labu ukur 10 mL yang telah ditambahkan 2tetes ammonium molibdat 12. Dikocok hingga homogen