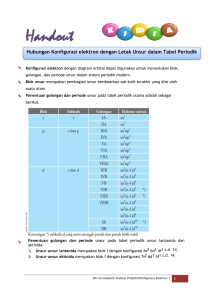
BAHAN AJAR IKATAN KIMIA 1 KOMPETENSI DASAR 3.5 Membandingkan ikatan ion, ikatan 4.5 Merancang dan melakukan percobaan kovalen, ikatan kovalen koordinasi,dan untuk menunjukkan karakteristik ikatan logam serta kaitannya dengan senyawa ion atau senyawa kovalen sifat zat. berdasarkan beberapa sifat fisika. TUJUAN PEMBELAJARAN 1. 2. 3. 4. 5. Menjelaskan kecenderungan unsur mencapai kestabilan Menerapkan struktur Lewis dalam ikatan kimia Menggambarkan susunan elektron valensi atom gas mulia (duplet dan oktet) Mendeskripsikan cara pencapaian kestabilan dengan cara berikatan secara tepat Menjelaskan pengertian ikatan ion dengan tepat, dan memahami proses terbentuknya ikatan ion dengan benar. PETA MATERI Ikatan Kimia Ikatan Kovalen Ikatan ion Ion positif Ion negatif Ikatan Logam Sifat Logam 2 PENDAHULUAN _________________________________________ Pada umumnya unsur-unsur di alam ditemukan dalam bentuk persenyawaan seperti natrium dan klor ditemukan sebagai natrium klorida dalam air laut; silikon dan oksigen sebagai silika dalam pasir; serta karbon, hidrogen, dan oksigen sebagai karbohidrat dalam tumbuhan. Hanya beberapa unsur yang ditemukan tidak sebagai senyawa seperti emas, belerang, dan gas mulia. Senyawa-senyawa mempunyai sifat yang berbeda-beda, ada yang titik lelehnya tinggi, ada yang rendah, ada yang dapat menghantarkan arus listrik, dan tidak menghantarkan arus listrik. Hal ini disebabkan oleh perbedaan cara bergabung antara unsurunsur pembentuknya, dapat melalui ikatan ion atau ikatan kovalen. Ikatan-ikatan tersebut dinamakan ikatan kimia. Sebelum mempelajari berbagai ikatan akan dijelaskan dulu tentang kestabilan unsur-unsur. URAIAN MATERI ________________________________________________ A. Kestabilan Unsur-Unsur Unsur-unsur pada tabel periodik unsur umumnya tidak stabil. Untuk mencapai kestabilannya, unsur-unsur tersebut harus berikatan. Pada tabel periodik unsur terdapat satu golongan yang unsur-unsurnya stabil atau tidak reaktif yaitu golongan gas mulia. Gas mulia terletak pada golongan VIIIA, mempunyai dua elektron pada kulit terluar untuk He dan delapan elektron untuk Ne, Ar, Kr, Xe, Rn. Gaya yang mengikat atom-atom dalam molekul atau gabungan ion dalam setiap senyawa disebut ikatan kimia. Konsep ini pertama kali dikemukakan pada tahun 1916 oleh Gilbert Newton Lewis (1875-1946) dari Amerika dan Albrecht Kossel (1853-1927) dari Jerman (Martin S. Silberberg, 2000). Konsep tersebut adalah: 1. Kenyataan bahwa gas-gas mulia (He, Ne, Ar, Kr, Xe, dan Rn) sukar membentuk senyawa merupakan bukti bahwa gas-gas mulia memiliki susunan elektron yang stabil. 2. Setiap atom mempunyai kecenderungan untuk memiliki susunan elektron yang stabil seperti gas mulia. Caranya dengan melepaskan elektron atau menangkap elektron. 3 3. Untuk memperoleh susunan elektron yang stabil hanya dapat dicapai dengan cara berikatan dengan atom lain, yaitu dengan cara melepaskan elektron, menangkap elektron, maupun pemakaian elektron secara bersama-sama. Perhatikan konfigurasi elektron beberapa unsur gas mulia pada Tabel! Pada tahun 1916 Walter Kossel dan Gilbert N. Lewis secara terpisah menemukan adanya hubungan antara kestabilan gas mulia dengan cara atomatom saling berikatan. Mereka mengemukakan bahwa jumlah elektron pada kulit terluar dari dua atom yang berikatan akan berubah sedemikian rupa sehingga konfigurasi elektron kedua atom tadi sama dengan konfigurasi elektron gas mulia yaitu mempunyai 8 elektron pada kulit terluarnya. Oleh karena itu pernyataan Kossel-Lewis ini disebut aturan oktet. Aturan oktet ini tidak berlaku untuk hidrogen sebab atom H akan membentu konfigurasi elektron seperti He yaitu mempunyai 2 elektron pada kulit terluarnya pada saat membentuk ikatan yang disebut aturan duplet. Dengan demikian aturan duplet dan oktet dapat dituliskan sebagai berikut. Aturan duplet : konfigurasi elektron stabil dengan dua elektron pada kulit terluar. Aturan oktet : konfigurasi elektron stabil dengan delapan elektron pada kulit terluar. Pada saat atom-atom membentuk ikatan, hanya elektron-elektron pada kulit terluar yang berperan yaitu elektron valensi. Elektron valensi dapat digambarkan dengan struktur Lewis atau gambar titik elektron. Contohnya nitrogen memiliki 4 konfigurasi elektron 2.5. Elektron valensi nitrogen adalah 5. Struktur Lewisnya digambarkan: Struktur Lewis, pasangan elektron, dan elektron ikatan untuk beberapa atom dapat dilihat pada Tabel Struktur Lewis berguna untuk memahami penggunaan elektron bersama pada ikatan kovalen. Bagaimana menggambarkan struktur Lewis pada molekul? Perhatikan contoh berikut. Contoh: 1. Struktur Lewis pada H2 H2 terbentuk dari 2 atom H. Atom H mempunyai elektron valensi = 1. Struktur Lewis atom H adalah Hx. Untuk mencapai kestabilan aturan duplet, atom H memerlukan 1 elektron lagi dari atom H yang lain. Struktur Lewis H2 ditulis: 2. Struktur Lewis pada CH4 C mempunyai elektron valensi = 4 dengan struktur Lewis . Untuk mencapai kestabilan sesuai aturan oktet, C memerlukan 4 elektron dari atom H. Struktur Lewis CH4 ditulis: Pada struktur Lewis CH4, H memenuhi aturan duplet dan C memenuhi aturan oktet. Struktur Lewis untuk beberapa molekul lainnya dapat dilihat pada Tabel 5 B. Ikatan Ion Ikatan ion adalah ikatan yang terjadi akibat perpindahan elektron dari satu atom ke atom lain (James E. Brady, 1990). Ikatan ion terbentuk antara atom yang melepaskan elektron (logam) dengan atom yang menangkap elektron (bukan logam). Atom logam, setelah melepaskan elektron berubah menjadi ion positif. Sedangkan atom bukan logam, setelah menerima elektron berubah menjadi ion negatif. Antara ion-ion yang berlawanan muatan ini terjadi tarik-menarik (gaya elektrostastis) yang disebut ikatan ion (ikatan elektrovalen). Ikatan ion merupakan ikatan yang relatif kuat. Pada suhu kamar, semua senyawa ion berupa zat padat kristal dengan struktur tertentu. Dengan mengunakan lambang Lewis, pembentukan NaCl digambarkan sebagai berikut. NaCl mempunyai struktur yang berbentuk kubus, di mana tiap ion Na+ dikelilingi oleh 6 ion Cl– dan tiap ion Cl– dikelilingi oleh 6 ion Na+. Senyawa ion dapat diketahui dari beberapa sifatnya, antara lain: 1. Merupakan zat padat dengan titik leleh dan titik didih yang relatif tinggi. Sebagai contoh, NaCl meleleh pada 801 °C. 2. Rapuh, sehingga hancur jika dipukul. 3. Lelehannya menghantarkan listrik. 4. Larutannya dalam air dapat menghantarkan listrik. 6 Contoh lain pembentukan ikatan ion sebagai berikut. a. Pembentukan MgCl2 Mg (Z = 12) dan Cl (Z = 17) mempunyai konfigurasi elektron sebagai berikut. - Mg : 2, 8, 2 - Cl : 2, 8, 7 Mg dapat mencapai konfigurasi gas mulia dengan melepas 2 elektron, sedangkan Cl dengan menangkap 1 elektron. Atom Mg berubah menjadi ion Mg2+, sedangkan atom Cl menjadi ion Cl–. - Mg (2, 8, 2) ⎯⎯→ Mg2+ (2, 8) + 2 e– (konfigurasi elektron ion Mg2+ sama dengan neon) - Cl (2, 8, 7) + e– ⎯⎯→ Cl– (2, 8, 8) (konfigurasi elektron ion Cl– sama dengan argon) Ion Mg2+ dan ion Cl– kemudian bergabung membentuk senyawa dengan rumus MgCl2. Dengan menggunakan lambang Lewis, pembentukan MgCl2 dapat digambarkan sebagai berikut. b. Ikatan antara atom 12Mg dan 8O dalam MgO Konfigurasi elektron Mg dan O adalah: Mg : 2, 8, 2 (melepas 2 elektron) O : 2, 6 (menangkap 2 elektron) Atom O akan memasangkan 2 elektron, sedangkan atom Mg juga akan memasangkan 2 elektron. 7 c. Ikatan ion pada 19K dan 8O dalam K2O Konfigurasi elektron: K : 2, 8, 8, 1 (melepas 1 elektron) membentuk K+ O : 2, 6 (menerima 2 elektron) membentuk O2– 2 K+ + O2– ⎯⎯→ K2O d. Ikatan ion pada Fe (elektron valensi 3) dengan Cl (elektron valensi 7) membentuk FeCl3 Fe mempunyai elektron valensi 3 akan membentuk Fe3+ Cl mempunyai elektron valensi 7 akan membentuk Cl– Fe3+ + 3 Cl– ⎯⎯→ FeCl3 Catatan! LATIHAN ________________________________________________________ 1. Mengapa unsur-unsur golongan VIIIA (gas mulia) bersifat stabil? 2. Mengapa unsur-unsur selain golongan VIIIA (gas mulia) bersifat tidak stabil? 3. Bagaimana cara unsur-unsur selain golongan VIIIA mencapai kestabilan atau mencapai hukum oktet? 4. Sebutkan macam-macam ikatan kimia yang Anda ketahui! 5. Apa yang dimaksud dengan ikatan ion? 6. Apakah syarat terjadinya ikatan ion? 7. Jelaskan terjadinya ikatan ion dan tulislah ikatan ion yang terjadi pada: a. Mg (Z = 12) dengan F (Z = 9) b. Ba (Z = 56) dengan Cl (Z = 17) c. Ca (Z = 20) dengan S (Z = 16) d. Fe (elektron valensi = 3) dengan Cl (elektron valensi = 7) e. Zn (elektron valensi = 2) dengan Br (elektron valensi = 7) 8 f. Cr (elektron valensi = 3) dengan O (elektron valensi = 6) g. Al (golongan IIIA) dengan S (golongan VIA) h. Ca (golongan IIA) dengan N (golongan VA) i. K (golongan IA) dengan I (golongan VIIA) j. Na (golongan IA) dengan S (golongan VIA) RANGKUMAN _______________________________________________ 1. Ikatan kimia adalah ikatan antara atom-atom untuk membentuk senyawa, sehingga mencapai kestabilan. 2. Atom yang belum stabil menginginkan dirinya agar stabil seperti unsur gas mulia. 3. Oleh karena itu, untuk mencapai kestabilan, suatu atom membentuk konfigurasi gas mulia, yaitu: 1) Duplet, memiliki elektron valensi 2, seperti He. 2) Oktet, memiliki elektron valensi 8, seperti Ne, Ar, Kr, Xe, Rn. Namun, kadang-kadang terjadi penyimpangan oktet, dimana elektron valensi jumlahnya lebih dari 8, namun atom tetap stabil. 4. Ikatan kimia terdiri dari tiga jenis: ikatan ion, ikatan kovalen, dan ikatan logam. 5. Ikatan ion adalah ikatan yang terjadi: 1) Berdasarkan serah terima/perpindahan elektron. 2) Antara ion positif dan ion negatif. 3) Antara unsur logam dan non-logam. 4) Antara unsur golongan IA dan IIA (+) dan golongan VIA dan VIIA (-). 6. Contoh senyawa ion antara lain: NaCl, MgCl2, CaCl2, KOH, KCl, dll. DAFTAR PUSTAKA _____________________________________________ Utami, Budi dkk. 2009. Kimia untuk SMA dan MA Kelas X. Jakarta: CV. Haka Mj. Davi, Poppy K, Sitti Kalsum, Masmiani, dan Hasmiato Syahrul. 2009. Kimia 1 Kelas X SMA dan MA. Jakarta: PT. Remaja Rosdakarya. 9