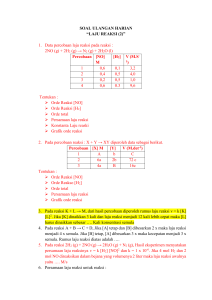
1. Hukum Dasar Kimia Hukum dasar kimia di bagi menjadi : a. Hukum kekekalan massa (Lavoisier): dalam tiap reaksi kimia, jumlah massa zat sebelum dan sesudah reaksi adalah sama. contoh: 1 gr hidrogen dan 8 gr oksigen menjadi 9 gr air. Contoh soal : Sebanyak 23 gram logam natrium direaksikan dengan gas klorin menghasilkan 58,5 gram natrium klorida. Berapa massa gas klorin yang bereaksi? Penyelesaian: Natrium (s) + klorin (g) natrium klorida (s) Berdasarkan Hukum kekekalan massa, maka Massa natrium + massa klorin = massa natrium klorida x = 58,5 g – 23 g = 35,5 g Jadi, massa yag bereaksi adalah 35,5 gram b. Hukum perbandingan tetap (Proust): perbandingan berat tiap-tiap unsur dalam membentuk senyawa selalu tetap. contoh: perbandingan berat unsur C dan S dalam CS2 = 3 : 16. Contoh soal: Perbandingan massa karbon dam massa oksigen dalam senyawa karbon dioksida (CO2) adalah 3 : 8. Tentukan: Berapa gram karbon yang dapat bereaksi dengan 24 gram oksigen? Berapa persen massa karbon dan oksigen dalam senyawa tersebut? Penyelesaian: Massa C : massa O = 3 : 8, dapat ditulis,persamaan ini dapat di tulis 𝑀𝑎𝑠𝑠𝑎 𝐶 3 = 𝑀𝑎𝑠𝑠𝑎 𝑂 8 Massa C Massa C = 3 8 = 3 8 x massa O x 24 = 9 gram Massa C : massa O = 3 : 8 Total perbandingan = 3 + 8 = 11 % Massa C = % Massa C = 3 11 8 11 x 100% = 27,27% x 100% = 72,72% c. Hukum perbandingan berganda(Dalton): untuk massa salah satu unsur dalam beberapa senyawa yang tetap, maka perbandingan massa unsur lain dalam senyawa – senyawa tsb merupakan bilangan bulat & sederhana. Contoh Soal: Gas klorin (Cl2) dan gas oksigen (O2) dapat membentuk empat senyawa biner yang berbeda. Berikut komposisi massa O dan Cl dalam setiap senyawa yang terbentuk. Senyawa Massa O (g) Massa Cl (g) A 0,2256 1,00 B 0,9026 1,00 C 1,3539 1,00 D 1,5795 1,00 Tunjukkan bahwa Hukum Perbandingan Berganda berlaku untuk semua senyawa tersebut. Jika rumus senyawa A adalah Cl2O, tentukan rumus senyawa B, C, dan D. Penyelesaian: Atom yang massanya tetap adalah Cl. Untuk mengetahui perbandingan massa setiap atom O, bagilah setiap massa oksigen dengan massa O yang terkecil, yaitu 0,2256 g. Sehingga menjadi seperti ini: Senyawa Massa O (g) Massa Cl (g) Perbandingan Massa Atom O A 0,2256 1,00 0,2259 g : 0,2256 g = 1,0000 B 0,9026 1,00 0,9026 g : 0,2256 g = 4,0009 C 1,3539 1,00 1,3539 g : 0,2256 g = 6,0001 D 1,5795 1,00 1,5795 g : 0,2256 g = 7,0031 Sehingga Perbandingan massa O dalam senyawa adalah A : B : C : D = 1 : 4 : 6 : 7. ( karena nilai dibelkang koma sangat kecil sehingga dapat di abaikan) a. Hukum perbandingan volume (Gay Lussac): gas – gas yang bereaksi dan volume gas – gas hasil reaksi, jika diukur pada suhu dan tekanan yang sama berbanding sebagai bilangan bulat dan sederhana. Contoh: N2 + 3H2 → 2NH3. 1 liter gas N2 akan membutuhkan 3 liter gas H2 dan akan menghasilkan 2 liter gas NH3 (sesuai dengan perbandingan koefisiennya) Rumus : Volume gas yang dicari = 𝑎𝑛𝑔𝑘𝑎 𝑘𝑜𝑒𝑓𝑖𝑠𝑖𝑒𝑛 𝑦𝑎𝑛𝑔 𝑑𝑖𝑐𝑎𝑟𝑖 𝑎𝑛𝑔𝑘𝑎 𝑘𝑜𝑒𝑓𝑖𝑠𝑖𝑒𝑛 𝑦𝑎𝑛𝑔 𝑑𝑖𝑘𝑒𝑡𝑎ℎ𝑢𝑖 𝑥 𝑣𝑜𝑙𝑢𝑚𝑒 𝑦𝑎𝑛𝑔 𝑑𝑖𝑘𝑒𝑡𝑎ℎ𝑢𝑖 Contoh Soal: Perhatikan persamaan reaksi berikut. C4H8 (g) + O2 (g) CO2 (g) + H2O (g) Jika gas CO2 yang dihasilkan 2,4 liter, tentukan volume gas C4H8, volume gas O2, dan volume gas H2O. Penyelesaian: C4H8 (g) + 6O2 (g) 4CO2 (g) + 4H2O (g) 2,4L Volume gas yang dicari = V C4H8 = V O2 = 6 4 1 4 𝑎𝑛𝑔𝑘𝑎 𝑘𝑜𝑒𝑓𝑖𝑠𝑖𝑒𝑛 𝑦𝑎𝑛𝑔 𝑑𝑖𝑐𝑎𝑟𝑖 𝑎𝑛𝑔𝑘𝑎 𝑘𝑜𝑒𝑓𝑖𝑠𝑖𝑒𝑛 𝑦𝑎𝑛𝑔 𝑑𝑖𝑘𝑒𝑡𝑎ℎ𝑢𝑖 𝑥 2,4 = 0,6 𝐿 𝑥 2,4 = 3,6 𝐿 𝑥 𝑣𝑜𝑙𝑢𝑚𝑒 𝑦𝑎𝑛𝑔 𝑑𝑖𝑘𝑒𝑡𝑎ℎ𝑢𝑖 V H2O = 4 4 𝑥 2,4 = 2,4 𝐿 e. Hukum Avogdro: pada suhu dan tekanan sama semua gas yang volumenya sama mengandung jumlah molekul yang sama pula. Contoh : Gas A dalam wadah bervolume V liter mempunyai jumlah molekul sebanyak a molekul. Gas B dalam wadah bervolume 2V liter mempunyai jumlah molekul sebanyak 2a molekul. 2. Stoikiometri (Perhitungan Kimia) 1. 1 mol = banyaknya zat yang mengandung 6,02 . 1023 partikel (bil. Avogadro). 2. 𝐴𝑟 𝑋 = 𝑚𝑎𝑠𝑠𝑎 𝑟𝑎𝑡𝑎−𝑟𝑎𝑡𝑎 1 𝑎𝑡𝑜𝑚 𝑢𝑛𝑠𝑢𝑟 𝑋 3. 𝑀𝑟 𝑋 = 𝑚𝑎𝑠𝑠𝑎 1 𝑚𝑜𝑙𝑒𝑘𝑢𝑙 𝑠𝑒𝑛𝑦𝑎𝑤𝑎 𝑋 1 𝑥 2 𝑚𝑎𝑠𝑠𝑎 1 𝑎𝑡𝑜𝑚 𝐶−12 1 𝑥 𝑚𝑎𝑠𝑠𝑎 2 1 𝑎𝑡𝑜𝑚 𝐶−12 4. Cara menentukan rumus empiris senyawa: a. Cari massa / persentase massa unsur penyusun senyawa b. Nyatakan massa / prosentase massa tersebut dalam mol dengan memakai Ar sebagai pembagi. c. Cari harga perbandingan unsur-unsur penyusun senyawa tersebut 5. Cara menentukan rumus molekul senyawa: a. Tentukan rumus empirisnya b. Berapa Mr senyawa yang dimaksud, jadikan suatu persamaan dengan variabel 6. Kadar unsur dalam senyawa: Misal CxHyOz, maka : 7. % 𝑘𝑎𝑑𝑎𝑟 𝐶 = 𝑋 .𝐴𝑟 𝐶 𝑀𝑟𝐶𝑥𝐻𝑦𝑂𝑧 𝑥 100% ∶ 𝑏𝑒𝑟𝑎𝑡 𝐶 = % 𝑘𝑎𝑑𝑎𝑟 𝐶 𝑥 𝑏𝑒𝑟𝑎𝑡 𝐶𝑥𝐻𝑦𝑂𝑧 % 𝑘𝑎𝑑𝑎𝑟 𝐻 = 𝑋 . 𝐴𝑟 𝐻 𝑥 100% ∶ 𝑏𝑒𝑟𝑎𝑡 𝐻 = % 𝑘𝑎𝑑𝑎𝑟 𝐻 𝑥 𝑏𝑒𝑟𝑎𝑡 𝐶𝑥𝐻𝑦𝑂𝑧 𝑀𝑟𝐶𝑥𝐻𝑦𝑂𝑧 % 𝑘𝑎𝑑𝑎𝑟 𝑂 = 𝑋 . 𝐴𝑟 𝑂 𝑥 100% ∶ 𝑏𝑒𝑟𝑎𝑡 𝑂 = % 𝑘𝑎𝑑𝑎𝑟 𝑂 𝑥 𝑏𝑒𝑟𝑎𝑡 𝐶𝑥𝐻𝑦𝑂𝑧 𝑀𝑟𝐶𝑥𝐻𝑦𝑂𝑧 8. Gas ideal P . V = n . R . T, dimana: P = Tekanan (atm) V = Volume (liter) R = 0,082 n = Jumlah mol gas T = Suhu (oK) a. Untuk gas-gas yang volumenya sama (P.T sama) mol gas I = mol gas II 𝑚𝑎𝑠𝑠𝑎 𝑔𝑎𝑠 𝐼 𝑚𝑎𝑠𝑠𝑎 𝑔𝑎𝑠 𝐼𝐼 = 𝑀𝑟 𝑔𝑎𝑠 𝐼 𝑀𝑟 𝑔𝑎𝑠 𝐼𝐼 b. Untuk gas-gas yang volumenya tidak sama 𝑣𝑜𝑙𝑢𝑚𝑒 𝑔𝑎𝑠 𝐼 𝑣𝑜𝑙𝑢𝑚𝑒 𝑔𝑎𝑠 𝐼𝐼 = 𝑀𝑜𝑙 𝑔𝑎𝑠 𝐼 𝑀𝑜𝑙 𝑔𝑎𝑠 𝐼𝐼 9. Konsentrasi larutan 𝑀= = 𝑚𝑜𝑙 𝑣𝑜𝑙𝑢𝑚𝑒 𝑘𝑎𝑑𝑎𝑟 𝑥 𝑚𝑎𝑠𝑠𝑎 𝑗𝑒𝑛𝑖𝑠 𝑥 1000 𝑀𝑟 𝑧𝑎𝑡 𝑘𝑎𝑑𝑎𝑟 𝑑𝑎𝑙𝑎𝑚 % 𝑏𝑒𝑟𝑎𝑡 𝑎𝑡𝑎𝑢 % 𝑣𝑜𝑙𝑢𝑚𝑒 Massa jenis dalam gram / ml 10. Pengenceran M1 . V1 = M2 . V2 11. Jika 2 macam / lebih larutan sejenis dicampur, maka 𝑀𝑐𝑎𝑚𝑝𝑢𝑟𝑎𝑛 = 𝑀1 . 𝑉1 + 𝑀2 . 𝑉2 + ⋯ 𝑉1 + 𝑉2 + ⋯ 12. Jika gas tidak dalm keadaan STP: a. Jika diketahui P & T: P.V = n.R.T b. Jika diketahui 2 macam gas dengan Volume & massa atau mol 𝑉1 𝑉2 = 𝑛1 𝑛2 13. Dalam menghaadapi soal hitungan kimia: a. lihat persaman reaksinya setelah disetarakan lebih dahulu: � jika zat dalam keadaan gas semua: perbandingan koefisien = perbandingan volume yang bereaksi. � jika zat tidak dalam keadaan gas semua: perbandingan koefisien = perbandingan mol yang bereaksi. b. jika diketahui 2 data mol pereaksi lengkap, pakai mula-mula(m), reaksi(r), sisa(s) jika diketahui 1 data mol pereaksi lengkap, langsung dikerjakan sesuai langkah a. c. sesuaikan jawaban dengan pertanyaan. catatan: 1 reagen pembatas = reagen yang habis bereaksi (tak ada sisanya). s = solid = padat. aq = aqua = larutan. l = liquid = cair. g = gas = gas. .