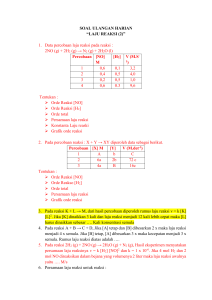
1. Hitunglah faktor gravimetric untuk senyawa berikut . Zat yang ditimbang dicantumkan terlebih dahulu, kemudian zat yang dicari. a. K2PtCl6, Pt b. CaCO3, CaO c. BaSO4, FeS2 a) Diketahui Ditanya Jawab : Ar K = 39 Ar Pt = 195 Ar Cl = 35,5 : Faktor Gravimetri? : Faktor Gravimetri = = Atom relatif Pt Massa relatif K 2 PtCl6 195 486 x 100 % x 100 % = 40,12 % Jadi faktor gravimetri Pt dalam K2PtCl6 adalah sebesar 40,12 % b) Diketahui Ditanya : Ar Ca = 40 Ar C = 12 Ar O = 16 : Faktor Gravimetri ? Jawab : Faktor Gravimetri = = Massarelatif CaO Massa relatif CaCO3 56 100 x 100 % x 100 % = 56 % Jadi faktor gravimetric CaO dalam CaCO3 adalah sebesar 56 % c) Diketahui Ditanya : Ar Ba = 137 Ar S = 32 Ar O = 16 Ar Fe = 56 : Faktor Gravimetri ? Jawab : Faktor Gravimetri = Massa relatif FeS 2 Massa relatif BaSO 4 x 100 % = 120 233 x 100 % = 51,5 % Jadi faktor gravimetri FeS2 dalam BaSO4 adalah sebesar 51,5 % 2. Hitunglah berapa mL ammonia, kerapatan 0,99 g/mL ; 2,3 % berat NH 3, yang akan diperlukan untuk mengendapkan besi sebagai Fe(OH)3 dalam sampel seberat 0,7 gram yang mengandung 2,5 % Fe2O3. Diketahui : Kerapatan NH3 = 0,99 gram/mL %NH3 = 2,3 % berat NH3 Berat sampel = 0,7 gram %Fe2O3 = 2,5 % = 0,025 Ditanya : VNH3 ? Fe 203 160 = Jawab : Faktor gravimetri = Fe ( OH ) 3 107 Reaksi Pengendapan: Fe3+ + 3NH3 +3H2O →Fe(OH)3 (s) + 3NH4+ 3+¿ mol N H 3=3 ×mol F e¿ mol Fe2O3 dalam sampel = ¿ ¿ massa Fe(OH )3 × 2,5 Mr Fe(OH )3 0,70 g × 0,025 g 159,69 l mol 0,0175 g g 159,69 mol = 1,09 × 10-4 mol = 0,000109 mol mol Fe3+ = 2× mol F e 2 O3 ¿ 2× 0,000109 mol = 0,000218 mol mol N H 3 =3 × mol Fe3+ =3 × 0,000218 mol = 0,000654 mol MN H = 3 ¿ × g 1000 × × Mr V kadar × kadar 1000 Mr g ×0,023 mL g 17 mol 1000 × 0,999 = 22,77 = 17 g mol = 1,34 MN H 1,34 = 3 mol L mol L nNH 3 V NH 3 0,000654 mol V NH 3 = V NH 3 g L = 0,000654 mol mol 1,34 L = 0,00048 L = 0,48 mL Jadi, Volume NH3 adalah 0,00048 L atau 0,48 mL 3. Suatu sampel seberat 0,6238 g yang mengandung klorida dilarutkan dan kloridanya diendapkan sebagai AgCl, endapan itu dicuci, dikeringkan, dan ternyata beratnya 0,3571 g. Hitunglah : a. Persentase klorida dalam sampel b. Persentase yang dinyatakan dalam NaCl Diketahui : Berat sampel = 0,6238 gram Berat endapan (AgCl) = 0,357 gram Ditanya : a) Presentase Cl dalam sampel b) Presentase yang dinyatakan dalam NaCl Jawab : a) Ar Cl Mr AgCl Faktor gravimetri = % Cl = = = 35,5 107,9+35,5 = 35,5 143,4 = 0,25 berat endapan x faktor gravimetri berat sampel 0,3571 x 0,25 0,6238 x 100 % = 0,1417 x 100 % = 14,17 % b) x 100 % Faktor gravimetri = Ar Cl Mr NaCl = 35,5 22,9+ 35,5 = 35,5 58,4 = 0,60 % Cl = = berat endapan x faktor gravimetri ( Ar Cl : Mr NaCl) berat sampel 0,3571 x 0,60 0,6238 = 0,1349 x 100 % x 100 % x 100 % = 13,49 % 4. 0,5 g sampel magnetic (Fe3O4) diubah menjadi Fe2O3 yang beratnya 0,4110 g. Berapa persen Fe3O4 dalam magnetic ? Diketahui : Massa Sampel = 0,5000 gram Massa Endapan = 0,410 gram Ditanya : % Fe3O4.....? Jawab : Persamaan Reaksi ; Fe3O4(s) → FeO(s) + Fe2O3(s) Faktor Gravimetri Mr Fe3 O 4 = Mr Fe 2 O 3 231,5386 = 159,6922 =1,45 % Fe3O4 = Berat Fe3 O4 × faktor gravimetri x 100% berat sampel = 0,4110 x 1,45 x 100% 0,5000 = 0,59595 0,5000 x 100% =1,19 x 100% =119 % 5. Hitunglah banyaknya mL sauatu larutan yang mengandung 20 gram BaCl 2/L, yang diperlukan untuk mengendapkan belerangnya sebagai BaSO 4 dalam suatu contoh seberat 0,5 gram yang mengandung 12 %. Diketahui : Kerapatan BaCl2 = 20 gram/L = 0,02 gram/mL Kandungan unsur belerang dalam BaSO4 = 12 % Berat endapan BaSO4 = 0,5 gram Ditanya : Banyaknya volume suatu larutan ? massa mol Ba SO 4= Jawab : Mr ¿ 0,06 g 137,34 +32+ 64 0,06 g 233,34 = ¿ 0,00025 mol Ba SO 4=mol Ba Cl 2 mol BaCl 2=0,00025 mol MBaCl2 ρBa Cl 2 = Mr Ba Cl 2 = g L (137,34+71) = 20 208,34 20 MBaCl2 ¿ 0,096 M Ba Cl = 2 mol L mol BaCl 2 V Ba Cl 2 mol BaCl 2=M Ba Cl ×V BaCl 2 mol BaCl 2 = 2 mol Ba Cl2 M Ba Cl 2 ¿ 0,00025 0,096 ¿ 0,0026 L = 2,6 mL Jadi Volume BaCl2 adalah 0,0026 L atau 2,6 mL 6. Kalsium dalam 0,8432 g sampel diendapkan sebagai CaC2O4. Endapannya dicuci dan dikeringkan menjadi CaCO3 dan diperoleh seberat 0,3426 g. Hitung persentase CaO dalam sampel. Diketahui : Berat sampel (CaC2O4) = 0,8432 gram Berat endapan ( CaCO3) = 0,3462 gram : Persentase CaO dalam sampel : CaCO3 + CO → CaC2O4 CaCO3 → CaO + CO2 Ditanya Jawab Reaksi: Faktor gravimetri = = % CaO = Mr CaO Mr CaC 2 O4 56 =¿ 0,4375 128 berat CaO x faktor gravimetri × massa sampel = 0,3462 x 0,4375 × 100% 0,8432 = 0,1515 × 0,8432 100% 100% = 0,179 x 100% = 17,9% 7. Besi ditentukan dalam suatu contoh dengan mengendapkan oksida hidrous dan membakarnya menjadi Fe2O3 , berapa berat contoh (mg) harus diambil untuk analisa agar setiap mg Fe2O3 merupakan 0,100 % Fe di dalam contoh ? Diketahui : Persentase Fe = 0,1 % Ditanya : berat contoh yang harus diambil untuk analisa 2 x Ar Fe Jawab : Berat Fe = Mr Fe 2 O3 x berat Fe2O3 = 2 x 56 160 x 0,001 %Fe = = 0,007 gram berat Fe berat sampel x 100 % 0,001 = 0,007 berat sampel x 100 % Berat sampel = 0,7 gram = 700 mg 8. Suatu sampel yang beratnya 0,628 g dan terdiri dari NaCl, NaBr, ditambah pengotorpengotor memberikan endapan AgCl dan AgBr yang beratnya 0,5064 g suatu sampel seberat 0,628 g lainnya dititrasi dengan AgNO 3 0,105 M dan memerlukan 28,34 mL. hitunglah persentase NaCl dan NaBr dalam sampel. Diketahui : Sampel pertama X= jumlah mmol NaCl Y= jumlah mmol NaBr Mr NaCl. X + Mr NaBr. Y= 121,6mg 58,5 X + 103 Y =121,6..........(1) Sampel kedua Misal: X+Y = jumlah mmol total Jumlah mmol total = 0,1050 mmol/mL x 28,34 mL= 2,9757 mmol X+Y =2,9757.............(2) Ditanya : Berapa persentase NaCl dan NaBr dalam sampel ? Jawab: 58,5 X + 103 Y =121,6. x1 58,5 X + 103 Y = 121,6 X x 58,5 58,5 X + 58,5 Y =174 + Y =2,9757 44,5 Y = - 52,4 Y = 1,1775 X+Y =2,9757 X=2,9757-1,17 = 1,7982 Diperoleh dari persamaan 1 dan 2 X = 1,7982 = mmol NaCl Y =1,1775 = mmol NaBr Persentase NaCl dan NaBr % NaCl = mg (1,7982 mmol x 58,5 mmol ) x 100 =16,75 %NaBr = mg (1,1775 mmol x 103 mmol ) x 100 =19,31 628 mg 628 mg Jadi , persentase dari NaCl dan NaBr masing-masing adalah 16,75% dan 19,31%