AMPEROMETRI DAN APLIKASINYA
PENDAHULUAN
Amperometri atau voltametri merupakan metoda analisis yang berkembang pesat dibanding
metode analisis yang lain. Hal ini dikarenakan kelebihannya dalam sensitivitas, selektifitas, juga
sederhana alatnya dan mudah penganalisisannya.Amperometri atau voltametri cara kerjanya
didasarkan pada pengukuran arus sebagai fungsi dari potensial yang aplikasi (applied potential)
pada saat terjadi polarisasi pada indicator elektroda atau elektroda kerja (working electrode).
Berbeda dengan potensiometri yang analisisnya berdasarkan pengukuran potensial dilakukan
pada saat arus nol dan tidak terjadi polarisasi.Amperometri atau voltametri berkembang pesat
setelah adanya penemuan polarografi oleh Jaroslav Heyrovsky pada tahun 1920 an.Dimana
Jaroslav Heyrovsky mendapat hadiah nobel atas penemuannya tersebut ditahun 1957.
Pada saat sekarang banyak jenis dari amperometri atau voltametri yang telah ditemukan.Antara
lain voltametri yang merupakan analisis dalam ukuran mikroskala dengan menggunakan mikro
elektroda kerja,disebut juga dengan teknik arus voltase .Potensial dari mikro elektroda kerja
divariasikan dan arus yang dihasilkan dicetak sebagai fungsi dari potensial yang disebut
voltamograf di temukan oleh Christian, 1994.
Kemudian elektroda merkurium tetes (D.M.E) disebut sebagai polarografi (Bassett,J,1984). Lalu
diikuti dengan siklik voltametri yang merupakan tehnik pengukuran potensial dari awal sampai
akhir dan kembali lagi ke awal yang disebut dengan penyapuan (scanning) dari katodik menuju
anodic dan sebaliknya (Khopkar, 1985).Metode yang berdasarkan voltametri yang dikatakan
polarograpi bila elektrodanya terpolarisasi adalah elektroda merkuri atau Drpping Mercury
electrode (D.M.E) digunakan untuk menentukan komposisi dan analisis kuantitatif dari larutan.
ISI
Amperometri atau voltametri mempunyai persamaan dengan potensiometri,yaitu mempunyai
elektroda kerja, dan elektroda pembanding.Bedanya pada voltametri ditambah dengan sebuah
elektoda yaitu elektroda pembantu (auxiliary electrode) sehingga voltameter mempunyai 3 buah
elektroda pada amperometer elektroda pembanding yang mempunyai potensial yang sudah tetap
sehingga kelebihan arus ditangkap oleh elektroda pembantu.Ada beberapa teknik voltametri
yang sering digunakan antara lain :
a. Polarografi.
Polarografi adalah suatu bentuk elektrolisis dimana elektroda kerjanya berupa suatu elektroda
merkuri tetes dan digunakan untuk kurva arus voltase (voltamogram).Aplikasi dari polarografi
ini dapat digunakan pada penentuan kualitatif dan kuantitatif.Polarografi yang sekarang ini
secara luas untuk analisis ion-ion logam dan anion-anion anorganik, seperti IO dan NO. Gugus
fungsi senyawa organic yang mudah teroksidasi atau tereduksi juga dapat dianalisis dengan
polarografi. Gugus fungsi yang digunakan meliputi karbonil, asam karboksilat, dan senyawa
karbon yang memiliki ikatan rangkap (David, 2000).Suatu polarografi manual dapat dengan
mudah dibuat dilaboratorium berdasarkan rangkaian listrik. Selain itu aplikasi dari polarografi
untuk penentuan kualitatif dan kuantitatif pada senyawa organic, anorganik dan sampel biologi.
b. Stripping Voltametri
Salah satu dari teknik voltametri kuantitatif yang lebih penting adalah stripping voltametri, yang
mana terdiri dari 3 teknik yang terkait : anoda, katoda dan absorbs stripping voltametri. Sejak
anodic stripping voltametri ditemukan aplikasinya yang paling luas. Anodik stripping voltametri
terdiri dari dua tahap. Pertama pengontrolan potensial elektrolisis yang mana elektroda kerja,
biasanya tetes merkuri atau lapis tipis merkuri, pada potensial katoda yang cukup untuk melapisi
ion logam pada elektroda. Tahap kedua potensial anoda discan kearah potensial yang lebih
posisitif. Ketika potensial pada elektroda kerja cukup positif analit dilepaskan dari elektroda,
larutan di kembalikan dalam bentuk oksidasi. Arus selama tahap stripping dimonitor sebagai
fungsi dari voltamogram yang sama. Puncak arus yang proporsional pada konsentrasi analit
dalam larutan. Anodik strippng voltametri sangat sensitive pada percobaan yang harus dikontrol
dengan hati-hati jika hasilnya ingin akurat dan tepat.Aplikasi stripping voltametri ini digunakan
untuk analisis reduksi atau oksidasi pada sampel yang potensialnya lebih positif.
c. Siklik voltametri
Biasanya siklik voltametri sangat baik untuk mempelajari senyawa elektroaktif.Siklik voltametri
merupakan teknik voltametri dimana arus diukur selama penyapuan potensial dari potensial awal
sampai potensial akhir dan kembali lagi ke potensial awal, atau disebut penyapuan (scanning)
dapat dibalik kembali setelah reduksi berlangsung. Dimana pada siklik voltametri yang
digunakan potensial elektroda di dalam larutan yang tidak diaduk dan mengukur arus yang
dihasilkan. Sedangkan potensial dalam elektroda kerja dikontrol terhadap referensi elektroda
(SCE ata Ag/AgCl). Aplikasi dari siklik voltametri sekarang ini yang banyak dipakai yaitu :
menganalisis kimia organic, menganalisis elektroanalisis, menganalisis anorganik dan
menganalisis biokimia.
d. Titrasi amperometri
Teknik voltametri yang treakhir yang dipertimbangkan adalah amperometri, yang mana potensial
konstan diaplikasikan pada elektroda kerja, dan arus diukur sebagai fungsi waktu. Karena
potensial tidak discan, amperometri tidak meandorong kearah voltamogram.Suatu titrasi
volumetric dapat dilaksanakan dengan mengukur arus difusi setelah tiap penambahan titran.
Titrasi yang dilakukan dengan cara ini dikenal sebagai titrasi amperometri. Dengan mengalirkan
setiap perubahan volume titran terhadap perubahan arus yang teramati maka akan diperoleh
kurva yang terdiri atas dua garis lurus yang merupakan titik perpotongan yang disebut dengan
titik ekivalen.Peralatan titrasi: Setiap alat polarografi dapat digunakan untuk mengikuti titrasi.
Temperatur harus diawasi dengan cermat. Waktu untuk satu kali titrasi sekitar 10 menit. Banyak
zat-zat yang dapat dianalisis dengan cara ini. Kelebihan cara ini adalah :
- Tidak diperlukan langkah untuk mengkalibrasi galvanometer.
- Tegangan yang dapat diberikan cukup teliti (sampai 1/10 volt).
- Tidak ada efek karakteristik dari kapiler
- Tidak diperlukan unit polarisasi
- Elektroda referens dapat dipilih yang nilai potensial elektrodanya sedemikian rupa sehingga
peristiwa reduksinya tidak memerlukan sumber tegangan dari luar
- Untuk tujuan tersebut separuh sel yang sesuai dapat dipilih.
Sensitivitas dapat diperbaiki dengan mennukar DME dengan elektroda platina (Pt) yang
berputar, sebab dengan berputarnya elektroda platina dengan kecepatan konstan, lapisan difusi
pada permukaan elektroda tidak pernah terbentuk. Akibatnya arus residual dapat ditekan. Titrasi
dilakukan dengan hanya menambahkan titran 3 sampai 4 kali sampai muncul arus difusi (berarti
penitrannya yang tereduksi). Ekstrapolasi antara garis lurus yang dibentuk akibat kenaikan arus
sebagai akibat bertambahnya titran terhadap sumbu volume memberikan titik ekivalen.
Titrasi amperometri lebih sering digunakan daripada titrasi potensiometri. Titrasi bi-amperometri
adalah metode titrasi dimana potensial diberikan terhadap dua elektroda inert yang identik seperti
elektroda platina. Metode ini banyak digunakan dalam titrasi Karl Fisher untuk menentukan
kandungan air suatu materi.Selain itu titrasi amperometri dapat digunakan untuk titrasi
pengendapan maupun titrasi pengompleksan. Umumnya hasil diperoleh serta reprodusibel.
KESIMPULAN
Voltametri atau amperometri adalah merupakan poses elektrolisis dalam ukuran mikroskala
dengan menggunakan mikro elektroda kerja, disebut juga teknik arus volatse.Potensial dari
mikro elektroda kerja divariasikan dan arus yang dihasilkan sebagai fungsi dari potensial.Pada
voltametri terdapat 3 elektroda yang digunakan yaitu : elektroda kerja, elektroda pembanding,
dan elektroda pembantu (auxillary electrode).Ada empat teknik analisis yang digunakan pada
voltametri antara lain :
a. Polarografi
Polarografi adalah suatu bentuk analisis dimana elektroda kerja berupa suatu elektroda merkuri
tetes yang direkam dalam suatu arus voltase (voltamogram). Aplikasi dari polarografi ini
digunakan untuk menganalisis ion-ion logam dan anion-anion anorganik seperti IO dan NO. Juga
untuk menganalisis gugus fungsi senyawa organic seperti karbonil, asam karboksilat dan
senyawa karbonil yang memiliki ikatan rangkap.Sedangkan aplikasi lainnya untuk penentuan
kualitatif dan kuantitatif pada senyawa organic, anorganik dan sampel biologi.
b. Stripping Voltametri
Stripping voltametri adalah teknik voltametri kuantitatif yang terdiri atas tiga teknik yang terkait
: anoda, katoda dan adsorbs stripping voltametri.Anodik stripping voltametri terdiri dari 2
tahap.Dan selama tahap stripping dimonitor sebagai fungsi dari potensial.Aplikasi stripping
voltametri ini digunakan untuk analisis oksidasi atau reduksidari sampel yang potensialnya lebih
positif.
c. Siklik Voltametri
Siklik voltametri merupakan teknik voltametri dimana arus diukur selama penyapuan potensial
dari potensial awal sampai ke potensial akhir dan kembali lagi kepotensial awal, atau disebut
juga penyapuan (scanning) dapat dibalik kembali setelah reduksi berlangsung. Aplikasi dari
siklik voltametri sekarang ini yang banyak dipakai yaitu : menganalisis kimia organic,
menganalisis elektroanalisis, menganalisis anorganik dan menganalisis biokimia.
d. Titrasi Amperometri
Titrasi amperometri adalah suatu analisis dengan mengukur arus difusi setelah tiap penambahan
titran.Kelebihan titrasi amperometri yaitu :
- Tidak diperlukan langkah untuk mengkalibrasi galvanometer.
- Tegangan yang dapat diberikan cukup teliti (sampai 1/10 volt).
- Tidak ada efek karakteristik dari kapiler
- Tidak diperlukan unit polarisasi
- Elektroda referens dapat dipilih yang nilai potensial elektrodanya sedemikian rupa sehingga
peristiwa reduksinya tidak memerlukan sumber tegangan dari luar
- Untuk tujuan tersebut separuh sel yang sesuai dapat dipilih.
Diposkan oleh indah di
Amperometri
Teknik voltametri terakhir yang dipertimbangkan adalah amperometri, yang mana potensial konstan
diaplikasikan pada elektroda kerja, dan arus diukur sebagai fungsi waktu Karena potensial tidak discan,
amperometri tidak mendorong kearah voltammogram.
Gambar 2.5. Sensor amperometri Clark untuk penentuan O2 yang terlarut.
Aplikasi yang penting dari amperometri adalah dalam kontruksi sensor kimia. Sensor amperometri yang
pertama dikembangkan untuk melarutkan O dalam darah, yang mana dikembangkan pada 1956 oleh
L.C. Clark. Bentuk dari sensor amperometri ditunjukkan pada Gambar 2.5 dan sama dengan elektroda
membran pada potensiometri. Contoh lain pada sensor amperometri adalah sensor glukosa (David,
2000).
Potensiometri yaitu pengukuran tunggal terhadap potensial dari suatu aktivitas ion yang diamati, hal ini
terutama diterapkan dalam pengukuran pH larutan (Basset 1994).Proses potensiometri dapat dilakukan
dengan bantuan elektroda indikator dan elektroda pembanding yang sesuai. Dengan demikian, kurva
titrasi yang diperoleh dengan menggambarkan grafik potensial terhadap volume titran yang
ditambahkan, mempunyai kenaikan yang tajam di sekitar titik kesetaraan. Dari grafik itu dapat
diperkirakan titik akhir titrasi. Cara potensiometri ini dapat digunakan bila tidak ada indikator yang cocok
untuk menentukan titik akhir titrasi, misalnya dalam hal larutan keruh atau bila daerah kesetaran sangat
pendek dan tidak cocok untuk penetapan titik akhir titrasi dengan indikator (Rivai, 1995).
-Potensiometri
pH meter dikalibrasi menggunakan bufer dengan cara kalibrasi dua nilai pH. Nilai potensial
bufer diukur. Standardisasi NaOH. Asam oksalat 0.1 N sebanyak 10 ml dimasukkan ke dalam
gelas piala 200 ml. Larutan kemudian diencerkan sampai 100ml dengan akuades. Elektroda gelas
kombinasi dicelupkan dan stirer ditempatkan ke dalam larutan. GGL larutan kemudian dibaca.
Titrasi dengan NaOH 0.1 M dengan penambahan 0.5 ml sampai 15 ml. Penentuan konsentrasi
HCl. HCl 0.1 N 10 ml dimasukkan ke dalam gelas piala 400 ml, diencerkan dengan 100 ml air.
Alat dipasang dan elektroda dihubungkan dengan sumber arus. Titik nol ditetapkan dari
potensiometer dan besar potensial larutan ditetapkan memakai skala 0-100 mV. Larutan
kemudian dititrasi dengan NaOH 0.1 N. Pada 1-5 ml volume titran tiap kali penambahan 1 ml,
kemudian 0.5 ml. Bila mendekati titik ekivalen penambahan 0.1 ml (antara 9-11 ml).
potensiometri
Prinsip Percobaan
Pengukuran kuantitatif dalam kimia analitik secara umum dibedakan menjadi
potensiometri (berdasarkan potensial sel) dan voltammetri (berdasarkan arus sel).(Rouessac
2007) Potensiometri adalah istilah yang digunakan untuk menjelaskan pengukuran potensial atau
voltage dari suatu sel elektrokimia yang terdiri dari elektroda dan larutan. Larutan tersebut berisi
komponen utama yang mempunyai kemampuan mengion.(Harvey 2000) Dasar metode
potensiometri adalah membuat sel elektrik dari analat suatu larutan sehingga perbedaan potensial
sel tersebut berkaitan dengan konsentrasi larutan.(Rouessac 2007)
Metode potensiometri memerlukan setidaknya dua macam elektroda, yaitu elektroda
referensi eksternal yang memiliki potensial konstan dan elektroda selektif ion atau biasa disebut
juga elektroda referensi internal yang digunakan untuk pengukuran dan dipisahkan dari larutan
oleh suatu membran.(Wang 2001) Elektroda yang dipakai pada percobaan adalah elektroda
membran gelas yang digunakan pada potensiometer. Elektrodanya adalah Ag-AgCl yang
dirancang sebaik mungkin sehingga voltage hanya bergantung pada konsentrasi ion H+ yang
terletak di luar tabung elektroda.
Tujuan Percobaan
Percobaan ini bertujuan mengenalkan prinsip potensiometri dan mengaplikasikannya
dalam penentuan konsentrasi suatu zat.
Alat dan Bahan
Alat-alat yang dipakai adalah potensiometer, elektroda kalomel, elektroda gelas,
pengaduk magnet, gelas piala, buret 50 ml, dan pipet volumetrik 10 ml. Bahan-bahan yang
digunakan adalah NaOH 0,1 N, HCl 0,1 N, dan asam oksalat 0,1 N.
Prosedur Percobaan
Kalibrasi pH meter
pH meter dikalibrasi menggunakan bufer dengan cara kalibrasi satu nilai pH, yaitu bufer pH
10. Nilai potensial dari bufer yang disediakan diukur.
Standardisasi NaOH
Sebanyak 10 ml asam oksalat 0,1 N diambil ke dalam gelas piala 200 ml. Larutan kemudian
diencerkan sampai 100 ml dengan akuades. Elektroda gelas kombinasi dicelupkan dan stirer
ditempatkan ke dalam larutan. GGL larutan kemudian dibaca. Titrasi dengan NaOH 0,1 N
dengan penambahan 0,5 ml sampai 10 ml.
Penentuan Konsentrasi HCl
Sebanyak 10 ml HCl 0,1 N diambil dan dimasukkan ke dalam gelas piala 400 ml, diencerkan
dengan 100 ml air. Alat dipasang dan elektroda dihubungkan dengan potensiometer lalau alat
dihubungkan dengan sumber arus. Titiuk nol ditepatkan dari potensiometer dan besar
potensial larutan ditetapkan dengan memakai skala 0-100 mV. Larutan kemudian dititrasi
dengan NaOH 0,1 N. Pada 1-5 ml volume titran tiap kali penambahan 1 ml, kemudian 0,5
ml. Bila mendekati titik ekivalen penambahan 0,1 ml (antara 9-11 ml).
Potensiometri adalah suatu proses pengukuran potensial atau voltase suatu sel
elektrokimia.(Patnaik 2004) Pengukuran potensial yang dilakukan pada percobaan kali ini
merupakan pengukuran potensiometrik langsung yang berdasarkan perbandingan antara
potensial yang terjadi pada saat elektroda indikator dicelupkan pada larutan uji dengan potensial
yang terjadi pada saat dicelupkan pada standar analat. Penentuan titik akhir potensiometri dapat
dilakukan dengan berbagai macam metode, salah satunya dengan membuat kurva antara voltase
sel terhadap volume titran yang ditambahkan. Titik akhir diambil pada titik dengan slope
(kemiringan maksimum). Kenaikan slope akan sampai pada titik akhir dan akan menurun setelah
titik akhir tercapai.
Metode potensiometri digunakan untuk standardisasi NaOH dengan cara titrasi asam
oksalat dengan menggunakan NaOH. Penentuan konsentrasi HCl dilakukan dengan melakukan
titrasi HCl dengan NaOH yang telah distandardisasi dengan metode potensiometri sebelumnya.
Dari data percobaan, diperoleh volume titran dan potensial listrik (E). Terdapat tiga macam
kurva untuk menentukan Titik Ekivalen (TE), yaitu kurva reguler (hubungan volume dan E),
kurva orde pertama (hubungan antara ΔE/ΔV dengan volume), dan kurva orde kedua (hubungan
antara volume dengan Δ(ΔE/ΔV)/ΔV).
POTENSIOMETRI
A. Pendahuluan
Sebagian besar metode analitik didasari pada sifat-sifat elektrokimia larutan . Teknik
analisis elektrokimia merupakan salah satu analisis instrumental, disamping teknik analisis
spektroskopi. Sistem pengukuran dalam analisis elektrokimia didasarkan pada signal-signal
listrik yang timbul sebagai hasil interaksi antara materi dengan listrik baik berupa potensial
maupun hantaran listrik.Beragam teknik analisis elektrokimia telah banyak dipakai dalam
laboratorium sebagai alat-alat instrumen dasar. Berbagai metode elektroanalitik adalah
potensiometri,volltametri,Coulometri,Konduktometri,dan lain-lain.
B. Pembahasan
Potensiometri adalah suatu cara analisis berdasarkan pengukuran beda potensial sel dari
suatu sel elektrokimia. Metode potensiometri digunakan untuk menentukan konsentrasi suatu
ion (ion selective electrode), pH suatu larutan, dan menentukan titik akhir titrasi.
Alat-alat yang diperlukan dalam metode potensiometri adalah :
1. elektrode pembanding (refference electrode)
2.
elektroda indikator ( indicator electrode )
3.
alat pengukur potensial.
Komponen-komponen tersebut disusun membentuk suatu sel potensiometri seperti gambar
berikut ,
Dari gambar dapat dilihat bahwa sel potensiometri disusun dari dua setengah sel yang
dihubungkan dengan jembatan garam yang berfungsi penyeimbangkan muatan larutan pada
masing-masing setengah sel, selain itu juga berfungsi sebagai penghubung antara dua setengah
sel tersebut. Masing-masing setengah sel terdapat elektroda yang tercelup dalam larutan
elektrolit untuk ditentukan konsentrasinya oleh potensial elektrodanya. Pemisahan elektrode ini
diperlukan untuk mencegah terjadinya reaksi redoks spontan dari laruan-larutan elektrolit yang
digunakan dalam sel potensiometri.
Potensiometri digunakan sebagai salah satu metode untuk mengukur
konsentrasi suatu larutan, dalam hal ini hubungan antara potensial sel dan konsentrasi dapat
dijelaskan melalaui persamaan Nerst
E = Eo – RT ln Q
nF
Dimana :
Eo : standar potensial reduksi
R : konsanta gas
T : temperatur ( K )
n : jumlah elektron yang terlibat dalam rekasi reduksi
F : konstanta faraday
Q : reaksi quosien.
Jika temperatur dalam laboratorium 298 K ,maka ln diubah ke log, maka diperoleh
persamaan berikut
E = Eo – 0,05916 log Q
n
Dimana E dinyatakan dalam satuan volt Mengingat bahwa potensial dari sel elektrokimia
potensiometri adalah
Ecell = Ec – Ea
Elemen-elemen yang diperlukan dalam potensiometri antara lain adalah elektroda
pembanding ( acuan ),elektroda Indikator,Jembatan garam dan larutan yang dianalisis.
Elektroda pembanding
Di dalam beberapa penggunaan analisis elektrokimia, diperlukan suatu elektrode dengan
harga potensial setengah sel yang diketahui, konstan, dan sama sekali tidak peka terhadap
komposisi larutan yang sedang diselidiki. Suatu elektrode yang memenuhi persyaratan diatas
disebut elektrode pembanding (refference electrode ). Ada dua jenis elektrode pembanding akan
diuraikan berikut ini.
1. Elektroda pembanding primer
Contoh dari elektroda jenis ini adalah elektroda hidrogen standart.Elektroda ini terbuat dari
platina hitam agar penyerapan gas hidrogen pada permukaan elektroda dapat terjadi secara
maksimal, sehingga reaksi
H2 <====> 2 H+ +
2e
Dapat berlangsung dengan cepat dan reversible. Potensial setengah sel dari elektroda
pembanding primer adalah nol volt.
Elektroda standart hidrogen jarang digunakan dalam proses analisis, tetapi hal ini penting karena
elektroda standart yang digunakan untuk menentukan standart potensial sel pada standart
setengah sel elektrokimia.
2. Elektroda pembanding sekunder
Elektroda standart sekunder adalal elektroda yang sering digunakan dan banyak terdapat di
pasar,karena penggunaannya yang lebih praktis. Ada dua macam elektroda standart
sekunder yaitu elektroda kalomel dan elektroda perak/perak klorida.
a. Elektroda kalomel
Elektroda ini terbuat dari tabung gelas atau plastik dengan panjang ± 10cm dan garis tengah 0,51 cm yang dicelupkan ke dalam air raksa yang kontak dengan lapisan pasta Hg/HgCl2 yang
terdapat pada tabung bagian dalam yang berisi campuran Hg, Hg2Cl2 dan KCl jenuh dan
dihubungkan dengan larutan KCl jenuh melalui lubang kecil.
b. Elektroda perak
Elektroda pembanding yang mirip dengan elektroda calomel,terdiri dari suatu elektroda perak
yang dicelupkan kedalam larutan KCI yang dijenuhkan dengan AgCI. Jika dibandingkan dengan
elektroda kalomel, elektroda perak lebih unggul dalam temperatur yang tinggi. Namun, elektroda
perak/perak klorida mempunyai kecenderungan untuk bereaksi dengan larutan membentuk
kompleks perak yang tidak larut yang memungkinkan menyumbat jembatan garam yang
menghubungkan larutan dan elektroda.
Elektroda indikator
Elektroda indikator dibagi menjadi dua kategori, yaitu : elektroda logam
dan elektroda membran. Elektroda logam dapat dikelompokkan ke dalam elektroda jenis
pertama (first kind), elektroda jenis kedua(second kind),elektroda jenis ketiga(third kind)
1. Elektroda logam
Potensial dari elektroda logam ditentukan dari posisi reaksi redoks ketika elektroda dan larutan
bertemu.terdapat tiga macam elektroda logam yaitu elektroda logam jenis pertama, elektroda
logam jenis kedua, dan elektroda logam jenis ketiga.
a. Elektroda jenis pertama
Elektroda jenis pertama adalah elektroda yang langsung berkeseimbangan dengan kation yang
berasal dari logam tersebut .Contoh,elektroda tembaga.
Cu2+ + 2e <==> Cu(s)
b. Elektroda jenis kedua
Elektroda jenis kedua adalah elektroda yang harga potensialnya bergantung pada konsentrasi
suatu anion yang dengan ion yang berasal dari elektroda endapan suatu ion kompleks yang
stabil.contoh elektroda perak untuk halida, reaksinya dapat ditulis,
AgCl(s) <==> Ag(s) + Cl
c.
Elektroda jenis ketiga
Elektroda jenis ketiga adalah elektroda logam yang harga potensialnya bergantung pada
konsentrasi ion logam lain.
Contoh, elektroda Hg dapatdigunakan untuk menentukan konsentrasi Ca2+ , Zn2+ ,atau Cd2+ yang terdapat
dalam larutan.
2. Elektroda membran
Elektroda membran telah digunakan dan dikembangakan cukup luas,karena dapat
menentukan ion tertentu. Elektroda membran biasa disebut dengan elektroda selektif ion (ion
selective electrode).Elektroda membran juga digunakan untuk penentuan pH dengan mengukur
perbedaan potensial antara larutan pembanding yang keasamannya tetap dan larutan yang
dianalisis.Elektroda membran dibagi empat macam yaitu elektroda membran kaca,elektroda
membran cairan, elektroda padatan dan elektroda penunjuk gas.
a. Elektroda membran kaca
Kualitas paling bagus yang dijual dipasaran untuk elektroda membran kaca terbuat dari Corning
015, sebuah kaca yang terdiri dari 22% Na20, 6% CaO,dan 72% SiO. Ketika dicelupkan ke
dalam larutan berair, maka pada bagian luar dari membran akan terhidrat sampai 10nm sampai
beberapa jam. Hasil hidrasi dari membran menghasilkan muatan negatif, hal ini merupakan
bagian dari fungsi kerja membran silika. Ion natrium, yang mampu bergerak menembus lapisan
hidrat berfungsi sebagai ion penghitung. Ion hidrogen dari larutan berdifusi kedalam membran
dan membentuk ikatan yang lebih kuat dengan membran sehingga mampu menggeser
keberadaan ion Na+ yang mengakibatkan konsentrasiion H+ meningkat pada membran .
Elektroda membran kaca sering dijual dalam bentuk kombinasi antara indikator dan elektroda
pembanding. Penggunaan satu elektroda sangat bermanfaat untuk pengukuran pH.
Kelebihan elektroda kaca :
Larutan uji tidak terkontaminasi
Zat-zat yang tidak mudah teroksidasi & tereduksi tidak berinteferensi
Elektroda ini bisa dibuat cukup kecil untuk disisipkan dalam volume larutan yang sangat kecil.
Tidak ada permukaan katalitis yang kehilangan aktivitasnya oleh kontaminasi seperti platina
pada elektroda hidrogen.
Kelemahan elektroda kaca yaitu Pada kondisi pH yang sangat tinggi (misal NaOH 0,1M dengan
pH = 13) berakibat :
spesifisitas untuk H+ hilang
Ketergatungan tegangan pH berkurang
Potensial menjadi tergantung pada aNa+
b. Elektroda membran padat
Elektroda ini menggunakan polikristal yang terdiri dari satuan kristal garam
anorganik. Elektroda selektif ion polikristal ini dibentuk dari pelet tipis Ag2S atau campuran dari
Ag2S dan garam perak atau logam sulfida.
c.
Elektroda membran cair
Elektroda membran cair adalah suatu fasa cair spesifik yang dibatasi oleh suatu dinding yang
berpori inert. Cairan spesifik tersebut terdiri atas senyawa organik dengan berat molekul yang
tinggi,tidak larut dalam air dan memiliki struktur yang memungkinkan terjadinya pertukaran ion
antara ion bebas dalam larutan yang diukur dengan ion-ion yang terletak pada pusat kedudukan
molekul cairan spesifik tersebut contoh: Na+ , K ,Ca2+ , Pb2+
d. Elektroda penunjuk gas
Elektroda ini dirancang untuk mendeteksi konsentrasi gas yang terlarut dalam larutan.
Titrasi Potensiometri
Proses titrasi potensiometri dapat dilakukan dengan bantuan elektroda indikator dan
elektroda pembanding yang sesuai. Dengan demikian, kurva titrasi yang diperoleh dengan
menggambarkan grafik potensial terhadap volume pentiter yang ditambahkan, mempunyai
kenaikan yang tajam di sekitar titik kesetaraan. Dari grafik itu dapat diperkirakan titik akhir
titrasi. Cara potensiometri ini bermanfaat bila tidak ada indikator yang cocok untuk menentukan
titik akhir titrasi, misalnya dalam hal larutan keruh atau bila daerah kesetaran sangat pendek dan
tidak cocok untuk penetapan titik akhir titrasi dengan indikator .Titik akhir dalam titrasi
potensiometri dapat dideteksi dengan menetapkan volume pada mana terjadi perubahan potensial
yang relatif besar ketika ditambahkan titran.
Reaksi-reaksi yang berperan dalam pengukuran titrasi potensiometri yaitu reaksi
pembentukan kompleks ,reaksi netralisasi dan pengendapan dan reaksi redoks. Pada reaksi
pembentukan kompleks dan pengendapan, endapan yang terbentuk akan membebaskan ion
terhidrasi dari larutan. Umumnya digunakan elektroda Ag dan Hg, sehingga berbagai logam
dapat dititrasi dengan EDTA. Reaksi netralisasi terjadi pada titrasi asam basa dapat diikuti
dengan elektroda indikatornya elektroda gelas.
KESIMPULAN
Potensiometri adalah satu cara elektrokimia untuk analisa ion secara kuantitatif
berdasarkan pengukuran potensial dari elektroda yang peka terhadap ion yang bersangkutan.
Potensiometri digunakan untuk menentukan konsentrasi
Suatu ion,pH larutan , dan titik akhir titrasi. Potensiometri digunakan sebagai salah satu metode
untuk mengukur konsentrasi suatu larutan,yang dijelaskan melalaui persamaan Nerst .
Elemen yang digunakan dalam potensiometri adalah Elektroda pembanding,elektroda
Indikator,Jembatan garam dan larutan yang dianalisis.
Elektroda pembanding dibagi menjadi dua ,yaitu elektroda pembanding primer dan elektroda
pembanding skunder ( elektroda kalomel dan elektroda perak ).
Elektroda Indikator dibagi menjadi dua yaitu elektroda Logam dan elektroda membran.elektroda
Logam terdiri dari tiga macam,antara lain elektroda jenis pertama ,kedua dan ketiga .sedangkan
elektroda membran dibagi menjadi elektroda membran kaca,elektroda membran padat,elektroda
membran cair dan elektroda membran gas.
Proses titrasi potensiometri dapat dilakukan dengan bantuan elektroda indikator dan
elektroda pembanding yang sesuai. Cara potensiometri ini bermanfaat bila tidak ada indikator
yang cocok untuk menentukan titik akhir titrasi .
Radiasi elektromagnetik adalah kombinasi medan listrik dan medan magnet yang berosilasi
dan merambat lewat ruang dan membawa energi dari satu tempat ke tempat yang lain. Cahaya
tampak adalah salah satu bentuk radiasi elektromagnetik. Penelitian teoritis tentang radiasi
elektromagnetik disebut elektrodinamik, sub-bidang elektromagnetisme.
Gelombang elektromagnetik ditemukan oleh Heinrich Hertz. Gelombang elektromagnetik
termasuk gelombang transversal.
Setiap muatan listrik yang memiliki percepatan memancarkan radiasi elektromagnetik. Waktu
kawat (atau panghantar seperti antena) menghantarkan arus bolak-balik, radiasi elektromagnetik
dirambatkan pada frekuensi yang sama dengan arus listrik. Bergantung pada situasi, gelombang
elektromagnetik dapat bersifat seperti gelombang atau seperti partikel. Sebagai gelombang,
dicirikan oleh kecepatan (kecepatan cahaya), panjang gelombang, dan frekuensi. Kalau
dipertimbangkan sebagai partikel, mereka diketahui sebagai foton, dan masing-masing
mempunyai energi berhubungan dengan frekuensi gelombang ditunjukan oleh hubungan Planck
E = Hf, di mana E adalah energi foton, h ialah konstanta Planck — 6.626 × 10 −34 J·s — dan f
adalah frekuensi gelombang.
Einstein kemudian memperbarui rumus ini menjadi Ephoton = hf.
Apa Itu Sinar X-Beberapa orang mungkin mengira jawaban pertanyaan ini sangat sederhana, padahal
sebaliknya. Tahukah Anda apa itu sinar-x sebenarnya?
Profesor Daniel Mittleman dari Fakultas Teknik Elektrik dan Komputer Rice University memberi
penjelasan detailnya. Sinar-x merupakan bentuk radiasi elektromagnetik, seperti cahaya, radiasi
inframerah, gelombang mikro, dan gelombang radio.
Namun dibanding jenis radiasi tersebut, sinar-x lebih enerjik. Foton sinar-x seribu kali lebih enerjik
dibanding foton cahaya tampak. Wilhelm Roetngent pertama kali menggambarkan sinar-x di 1895 dalam
pencapaian yang membuatnya memperoleh Hadiah Nobel pertama dalam bidang Fisika.
Selama Perang Dunia I, sinar-x digunakan untuk keperluan medis. Kebanyakan sinar-x di semesta
muncul ketika atom kembali ke kondisi konfigurasinya. Misalnya, jika elektron diambil dari inti atom,
atom akan memancarkan foton sinar-x sebagai kesetimbangan.
Sumber umum lain sinar-x adalah, proses bremsstrahlung atau ‘radiasi rem’. Sinar-x memancar ketika
cahaya enerjik elektron dengan cepat melambat. Dalam mesin medis, cahaya elektron enerjik
difokuskan pada satu target yang biasanya berupa potongan tungsten.
Ketika elektron melambat, sinar-x bremsstrahlung tercipta. Perangkat semacam ini memproduksi sinar-x
melalui kedua mekanisme tersebut secara terus-menerus.
Terakhir, mesin yang mengakselerasi elektron dalam orbit lingkaran dapat menghasilkan sinar-x. Ketika
elektron berputar, elektron ini memancarkan sinar-x kuat.
Sinar ini bisa digunakan untuk banyak keperluan riset ilmiah. Sejumlah mesin ini sudah ada di Amerika
Serikat dan seluruh dunia, termasuk Advanced Light Source di California, Advanced Photon Source di
Illinois an National Sunchrotron Light Source di New York.
POLAROGRAFI
A. Pendahuluan
Polarografi merupakan metode analisis yang didasarkan pada peristiwa polarisasi dalam
elektrolisis. Sebagaimana diketahui bahwa polarisasi terjadi pengutupan pada elektroda yang
menyebabkan laju kuat arus (i) yang makin berkurang. Metode Gravimetri mulai dikenalkan oleh
Jaroslav Heyrovsky (1922). Polarografi merupakan suatu metode analisis yang didasarkan pada
prinsip elektrolisis pada elektroda mikro tetes air raksa. Selanjutnya teknik polarografi ini
dijadikan dasar bagi pengembangan metode Voltametri. Atau dapat dikatakan metode
Polarografi merupakan sub bagian Voltametri dengan menggunakan elektroda kerja elektroda
tetes merkuri (dropping mercury electrode, DME).
Polarografi dan Voltametri adalah suatu teknik elektroanalisis yang memperoleh informasi dari
analit berdasarkan kurva arus-potensial {i = f(E)}, dengan melakukan pengukuran arus listrik (i)
sebagai fungsi potensial (E) yang diberikan.
B. Prinsip Dasar Hubungan Arus dan Konsentrasi
Dasar dari polarografi adalah elektrolisis dari suatu larutan yang mengandung analit eletroaktif,
artinya zat-zat yang dapat dioksidasi secara listrik (electro oxidable) dan yang dapat direduksi
secara listrik (electro reductible) pada elektroda tetes air raksa. Misalnya dalam larutan
mengandung ion logam, Mnt, maka akan terjadi reaksi reduksi secara listrik :
Mnt + ne + Hg (s) = M (Hg)
Perpindahkan materi yang berlangsung di dalam larutan pada umumnya dapat terjadi dengan 3
cara :
1. Perpindahan secara migrasi
Materi yang bermuatan, karena adanya gaya tarik menarik elektrostatik, maka materi bermuatan
bergerak menuju kutub dengan muatan yang berlawanan, yakni kation-kation menuju katoda dan
anion-anion menuju anoda.
2.
Perpindahan secara difusi
Partikel-partikel mengalir dari daerah yang lebih rapat (pekat) menuju daerah yang lebih
renggang (cucu).
3.
Perpindahan secara konveksi
Pengaruh temperatur dan goyangan atau pengadukan menyebabkan partikel berpindah dari
tempat ke tempat lain.
Dari ketiga jenis perpindahan tersebut menyebabkan laju perpindahan massa yang berimplikasi
pada besarnya arus total (itot) yang terjadi
it = arus total
it = im + id + ik
im = arus migrasi
id = arus difusi
ik = arus konveksi
Dalam polarografi, diusahakan agar arus yang terukur adalah semata-mata berasal dari arus
difusi saja, maka im dan ik harus dihilangkan atau diperkecil. Arus konveksi dapat dikurangi
dengan cara melakukan percobaan tanpa pengadukan dan arus migrasi dikurangi atau ditekan
dengan penggunakan elektrolit pendukung.
Selanjutnya dengan menganggap, hanya arus difusi saja yang ada, untuk luas elektroda sebesar
S, besarnya rapat arus (I) adalah :
I=
Menurut hukum Fick tentang difusi, kecepatan difusi adalah sebanding dengan gradien
konsentrasi, yang dinyatakan sebagai :
atau
I=nFD
i=nFSD
x = jarak dari permukaan elektroda
D = koefisien difusi
Secara skematis difusi partikel pada permukaan elektroda dapat digambarkan sebagai berikut :
Co = konsentrasi analit pada tubuh larutan
Ce = konsentrasi analit pada permukaan elektroda
S = tebal lapisan difusi
Bila (Co-Ce) adalah penurunan konsentrasi analit pada lapisan difusi (s), dan elektroda berada
pada keadaan keseimbangan dinamik, maka harga
sehingga persamaan menjadi :
dapat diganti dengan
,
i=nFSD
Dengan penggunaan E pada elektroda yang divariasikan, maka harga i menjadi naik dan
menyebabkan konsentrasi analit pada permukaan elektroda (Ce) menjadi menurun, sehingga Co
dianggap jauh lebih besar dari Ce, maka
i=
Sebenarnya lapis difusi bukan merupakan tebal yang konstan, tetapi berubah sesuai gradien
konsentrasi
. Misalkan ada dua satuan jarak dari permukaan elektroda yaitu dan x (x + dx).
Flux materi pada permukaan elektroda per satuan luar (fo) dapat dirumuskan sebagai
Pada saat dt ada beda flux dari fx menjadi f(x + dx) di bagian lain dari bidang, maka
Persamaan diferensial orde kedua ini dapat diselesaikan menurut difusi linier semi infisit, yang
menghasilkan hubungan
Bila disubstitusikan pada persamaan i = n F S D
, maka
Apabila dipelajari lebih lanjut pada elektroda tetes air raksa yang diskemakan berikut, ada suatu
keadaan dimana tetes air raksa tumbuh dan kemudian jatuh serta diperbaharui lagi dengan bentuk
yang baru.
Bila waktu hidup air raksa adalah dan waktu tetesnya adalah t, maka volume tetesan adalah
V =
r3
dengan v = volume Hg yang mengalir (dalam satuan C3/detik)
r = jari-jari pada saat
Dengan menganggap bahwa difusi terjadi adalah difusi planar pada elektroda S, maka
S = 4 r2 = 4
= k (m)2/3
m = masa tetes Hg (dalam gr/detik)
= kecepatan Hg
k = tetapan
sehingga besarnya arus i
i = k n F D1/2 . (m . )2/3 .
atau i = k’ n D1/2 m 2/3 1/6 Co
k, k’ = adalah tetapan
Keadaan ini adalah besarnya arus pada saat tepat tetesan akan jatuh. Dengan menggunakan
harga-harga yang ada pada elektroda merkuri dan adanya fluktuasi waktu hidup dari tetesan dan
adanya masalah Inersia, Ilkovie memberikan koreksi terhadap persamaan di atas menjadi
id = 607 . n D1/2 m 2/3 1/6 Co
Dari persamaan tersebut tampak bahwa besarnya arus difusi berbanding lurus dengan konsentrasi
analit dalam larutan (Co).
C. Prinsip Dasar Hubungan Arus Potensial
Untuk reaksi setengah sel
Oks(ag) + ne Red (ag)
dengan Oks = bentuk teroksidasi dan Red = bentuk tereduksi
Untuk elektroda tetes air raksa (ETAR), berlaku hubungan
EETAR = E° –
log
Bila anodanya adalah elektroda kalomel jenuh (EKJ), maka besarnya potensial terpasang :
Eapp = EETAR – EEKJ – IR
Jika IR dianggap kecil, maka :
Eapp= E° –
log
– EEKJ
Pada saat elektrolisis, arus difusi mengandung arti kecepatan mengangkut partikel dari tubuh
larutan ke permukaan elektroda, sehingga untuk mengangkut spesi Oks menuju katoda berlaku
persamaan
i = K’ . VOks
I
= arus yang timbul pada Eapp yang digunakan
Voks = laju migrasi partikel Oks
K’ = tetapan kesebandingan
Apabila laju partikel
VOks = K’ ([Oks]larutan – [Oks]elektroda)
maka : i = k . K’ [(Oks)larutan – (Oks)elektroda]
atau : i = k [(Oks)larutan – (Oks)elektroda]
Telah disinggung sebelumnya bila id = k [Oks]larutan
maka id – i = K [Oks]lar – {K(Oks)lar – K (Oks)elektroda
id – i = K . [Oks]elektroda
[Oks]e =
Untuk keadaan spesi Red : i = kRed (Red)e atau
[Red]e =
, maka persamaan Eapp, menjadi
Eapp = E° – EEKJ –
log .
–
log
Pada keadaan i =
, didefinisikan sebagai Eapp = E1/2 yaitu potensial setengah gelombang,
sebagai potensial yang memberikan arus yang timbul adalah separuh dari arus difusi, maka
E1/2 = E° – EEKJ –
Sehingga
log
Eapp = E1/2 –
log
Dari hubungan antara E dan i, maka diperoleh bentuk voltamogram sebagai berikut :
Dari hubungan antara i dan E, pada polarografi diperoleh polarogram yang umum sebagai
berikut :
Untuk tujuan analisis kualitatif maupun kuantitatif kita dapat mengukur polarogram analit.
Sebagai contoh suatu sampel yang mengandung ion Cd2+ setelah diukur akan mempunyai
polarogram sebagai berikut :
Untuk menentukan kuantitatif analit dalam sampel maka perlu dibandingkan dengan zat standar.
Dengan membandingkan besarnya arus difusi, maka zat analit dapat dihitung melalui
perbandingan id dan konsentrasi secara grafik polarogram yang dihasilkan adalah sebagai berikut
:
D. Instrumentasi Polarografi
1. Mercury Elektroda (Elektroda Merkuri)
Elektroda merkuri merupakan elektroda kerja dalam sistem polarografi, disamping 2 elektroda
yang lain yaitu elektroda pembanding (Ag/AgCe atau kolonel jenuh) dan elektroda pembantu
(Auxiallary elektroda) (Pt atau Au). Ketiga elektroda ditempatkan dalam satu tabung yang
mengandung analit. Adapun bentuk skema elektroda tersebut adalah sebagai berikut :
2. Potensiostat
Potensiostat merupakan bagian instrument yang terdiri dari rangkaian listrik yang berguna untuk
menjaga potensial dan mengatur potensial tetap pada nilai tertentu.
Secara sederhana
3.
Alat pembaca (Readout)
Pada prinsipnya polarografi adalah mengukur arus yang keluar akibat pemberian potensial
tertentu. Alat ukur yang paling sederhana adalah mikroampermeter. Pada perkembangannya
pembacaan arus secara digital bahkan komputerise.
E. Hal-hal Pendukung pada Polarografi
1.
Pelarut dan elektrolit pendukung
Elektrolit pendukung berfungsi untuk menekan arus migrasi, mengontrol potensial agar tahanan
larutan dikurangi serta menjaga kekuatan ion total yang konstal. Polarografi dapat dilakukan
pada fase air dan fase organik. Pada fase air biasanya digunakan elektrolit pendukung garamgaram seperti KCl, KNO3, NH4Cl dan NH4NO3.
Pada polarografi dengan fase organik (seperti : asetonitril, propilen karbonat, dimetil formamid,
dimetil sulfoksid dan alkohol) biasanya dipakai elektrolit pendukung garam tetra alkil amonium.
Sedangkan buffer (seperti asetat, fostat atapun sitrat) digunakan apabila pH larutan sangat perlu
untuk dikontrol.
2. Pengusir Oksigen
Oksigen dapat mengalami reduksi dalam dua tahap, yaitu
O2 + 2H+ + x = H2O2
E = -0,1 Volt
+
H2O2 + 2H + x = 2H2O E = -0,9 Volt
Apabila polarografi digunakan untuk analisis spesi zat yang mempunyai nilai potensial reduksi
sekitar –0,1 Volt dan –0,9 Volt, maka adanya oksigen akan mengganggu pengukuran. Oleh
sebab itu diperlukan zat pengusir gas oksigen. Umumnya untuk kasus ini digunakan gas nitrogen
untuk mengusir gas oksigen.
Soal-soal :
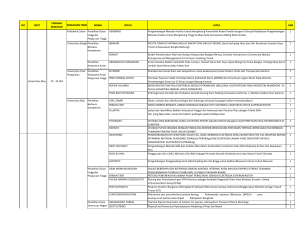
1. Hitunglah konsentrasi Ni (mg/l) dalam larutan sampel berdasarkan data polarografi berikut :
Larutan
Arus pada Eapp
-1.1 Volt
1) 25 ml NaCl 0,2 M diencerkan tepat 50 ml
8,4 A
2) 25 ml NaCl 0,2 M + 10 ml larutan sampel dan
46,3 A
diencerkan tepat 50 ml
3) 25 ml NaCl 0,2 M + 10 ml larutan standar Ni2+ 2.3
68,4 A
10-4 M dan diencerkan tepat 50 ml
2.
*
Elektroda tetes air raksa digunakan untuk menentukan ion Pb2+ secara polarografi. Bila
larutan Pb2+ dengan konsentrasi 1.10-3 M arus difusinya 8,76 A, berapa konsentrasi larutan
sampel yang mempunyai arus difusi 16.31 A yang diukur pada kondisi yang sama
Sesuai hukum i Co
i = k . Co
k=
Pada standar
k=
Pada sampel i C(Pb )
2+
i = k Co
C(Pb2+) =
CPb2+ =
= 16,31 x
= 1,86 10-3 M
Spektrometer Resonansi Magnetik Inti
Label: instrumen kimia, kimiawi
Spektrometer Resonansi Magnetik Inti
Sebelum era 1950 para ilmuwan khususnya yang berkecimpung dalam bidang kimia organik
mersakan kurang puas terhadap apa yang telah dicapai dalam analisis instrumental.
Kekurangpuasan mereka terutama dari segi analisis kuantitatif, penentuan struktur dan gugus
hidrokarbon yang dirasa banyak memberikan informasi.
Pada waktu itu dirasa perlu menambah anggota teknik spektroskopi untuk tujuan lebih banyak
memberikan informasi gugus hidrokarbon dalam molekul. Dua orang ilmuwan dari USA pada
tahun 1951 yaitu Felix Bloch dan Edwardo M. Purcell (dari Harvard university) menemukan
bahwa inti atom terorientasi terhadap medan magnet.
Selanjutnya menurut Bloch dan Purcell setiap proton di dalam molekul yang sifat kimianya berbeda akan
memberikan garis-garis resonansi orientasi magnet yang diberikan berbeda.
Bertolak dari penemuan ini lahirlah metode baru sebagai anggota baru teknik soektroskopi yang diberi
nama “Nuclear Magnetic Resonance (NMR)”.
Para ilmuwan di Indonesia mempopulerkan metode ini dengan nama spektrofotometer Resonansi
Magnet Inti (RMI). Spektrofotometri RMI sangat penting artinya dalam analisis kualitatif, khususnya
dalam penentuan struktur molekul zat organik. Spektrum RMI akan mampu menjawab beberapa
pertanyaan yang berkaitan dengan inti atom yang spesifik seperti:
Gugus apa yang dihadapi?
Di mana lokasinya gugus tersebut dalam molekul?
Beberapa jumlah gugus tersebut dalam molekul?
Siapa dan dimana gugus tetangganya?
Bagaimana hubungan gugus tersebut dengan tetangganya?
Hasil spektoskopi RMI seringkali merupakan penegasan urutan gugus atau susunan atom dalam satu
molekul yang menyeluruh.
Fenomena Resonansi Magnet Inti dan Tingkat energinya
Setiap atom dalam sistem susunan berkala mempunyai lambang tertentu disertai nomor dan bilangan
massa adalah sebuah atom x yang mempunyai nomor atom (a) dan massa relatif (b). Nomor atom
menunjukkan jumah proton dalam inti sedangkan massa atom relatif menunjukkan jumlah netron dan
proton dalam inti atom. Sebagai contoh adalah adalah atom karbon yang massa atom relatifnya (12),
jumlah proton (6) dan netron (6).
Postulat dari Pauli (1924) mengatakan bahwa elektron yang mengelilingi inti atom pada keaadaan asas
akan bergasing, demikian juga inti atom. Setiap lintasan elektron terisi dengan dua elektron yang
berpasangan, artinya memberikan arah gasing yang berbeda. Sehingga elektron yang berpasangan
tersebur tidak terorientasi oleh medan magnet luar atau bersifat diamagnetik.
Jadi ada suatu atom yang bersifat magnetik semata-mata disebabkan ada sisa pergasingan dari inti
atom. Percoaan yang dilakukan oleh Bloch dan Purcell membuktikan bahwa inti atom akan menyerap
radiasi elektromagnetik pada medan magnet luar yang kuat. Kesimpulan dari percobaan ini berarti inti
atom tersebut terorientasi terhadap medan magnet.
Instrumentasi Spektrometer RMI
Bagian yang terpenting dari spektrofotometer RMI adalah :
1)Magnet kutub utara dan selatan yang dapat diubah kekuatannya dalam rentang kecil tertentu. Induksi
medan magnet magnetic flux density dinyatakan dalam standar internasional (SI), yang disimbolkan
sebagai H0, dengan satuan kekuatan dalam Tesla (T). Kekuatan medan magnet RMI harus disesuaikan
terhadap momen magnet inti proton atau Untuk spektrometer RMI umum dipakai Ho = 2,35 T yang
sesuai dengan frekuensi 100 MHz. Ada tiga jenis magnet yang dipakai :
Magnet yang permanen,
Eletromagnet
Magnet superkonduksi
Pemancar (transmisi) frekuensi Radio
2)Pancaran frekuensi Radio (RF) dibuat tetap. Oleh sebab itu spektrum RMI adalah merupakan grafik
yang menunjukkan banyaknya energi yang diabsorpsi oleh inti atom dirajah terhadap kuat medan
magnet luar (Ho).
3)Tempat sampel merupakan tabung gelas yang diletakkan di antara dua magnet utara dan selatan.
Tabung gelas ini tempatnya dalam lilitan kumparan RF. Tabung sampel ini bergasing vertikal,
berkekuatan di atas 25 Hz dengan memakai pemutar turbin udara.
Refractometer adalah alat yang digunakan untuk mengukur kadar / konsentrasi bahan terlarut misalnya
: Gula, Garam, Protein dsb. Prinsip kerja dari refractometer sesuai dengan namanya adalah dengan
memanfaatkan refraksi cahaya. Seperti terlihat pada Gambar di bawah ini sebuah sedotan yang
dicelupkan ke dalam gelas yang berisi air akan terlihat terbengkok. Pada Gambar kedua sebuah sedotan
dicelupkan ke dalam sebuah gelas yang berisi lauran gula. Terlihat sedotan terbengkok lebih tajam.
Fenomena ini terjadi karena adanya refraksi cahaya. Semakin tinggi konsentrasi bahan terlarut (Rapat
Jenis Larutan), maka sedotan akan semakin terlihat bengkok secara proporsional. Besarnya sudut
pembengkokan ini disebut Refractive Index (nD). Refractometer ditemukan oleh Dr. Ernst Abbe seorang
ilmuwan dari German pada permulaan abad 20.
Adapun prinsip kerja dari refractometer dapat digambarkan sebagai berikut :
1. Dari gambar dibawah ini terdapat 3 bagian yaitu : Sample, Prisma dan Papan Skala.
Refractive index prisma jauh lebih besar dibandingkan dengan sample.
2. Jika sample merupakan larutan dengan konsentrasi rendah, maka sudut refraksi akan
lebar dikarenakan perbedaan refraksi dari prisma dan sample besar. Maka pada papan
skala sinar “a” akan jatuh pada skala rendah.
3. Jika sample merupakan larutan pekat / konsentrasi tinggi, maka sudut refraksi akan kecil
karena perbedaan refraksi prisma dan sample kecil. Pada gambar terlihar sinar “b” jatuh
pada skala besar.
Dari penjelasan di atas jelas bahwa konsentrasi larutan akan berpengaruh secara proporsional terhadap
sudut refraksi. Pada prakteknya Refractometer akan ditera pada skala sesuai dengan penggunaannya.
Sebagai contoh Refractometer yang dipakai untuk mengukur konsentrasi larutan gula akan ditera pada
skala gula. Begitu juga dengan refractometer untuk larutan garam, protein dll.
Konsentrasi bahan terlarut sering dinyatakan dalam satuan Brix(%) yaitu merupakan pronsentasi dari
bahan terlarut dalam sample (larutan air). Kadar bahan terlarut merupakan total dari semua bahan
dalam air, termasuk gula, garam, protein, asam dsb. Pada dasarnya Brix(%) dinyatakan sebagai jumlah
gram dari cane sugar yang terdapat dalam larutan 100g cane sugar. Jadi pada saat mengukur larutan
gula, Brix(%) harus benar-benar tepat sesuai dengan konsentrasinya.
Refraktometer adalah alat yang digunakan untuk mengukur kadar/ konsentrasi bahan
terlarut. Misalnya gula, garam, protein, dsb. Prinsip kerja dari refraktometer sesuai dengan
namanya adalah memanfaatkan refraksi cahaya. Refraktometer ditemukan oleh Dr. Ernest Abbe
seorang ilmuan dari German pada permulaan abad 20 (Anonim, 2010).
Indeks bias adalah perbandingan kecepatan cahaya dalam udara dengan kecepatan cahaya
dalam zat tersebut. Indeks bias berfungsi untuk identifikasi zat kemurnian, suhu pengukuran
dilakukan pada suhu 20oC dan suhu tersebut harus benar-benar diatur dan dipertahankan karena
sangat mempengaruhi indeks bias. Harga indeks bias dinyatakan dalam farmakope Indonesia
edisi empat dinyatakan garis (D) cahaya natrium pada panjang gelombang 589,0 nm dan 589,6
nm. Umumnya alat dirancang untuk digunakan dengan cahaya putih. Alat yang digunakan untuk
mengukur indeks bias adalah refraktometer ABBE. Untuk mencapai kestabilan, alat harus
dikalibrasi dengan menggunakan plat glass standart (Anonim, 2010).
Refraktometer Abbe adalah refraktometer untuk mengukur indeks bias cairan, padatan
dalam cairan atau serbuk dengan indeks bias dari 1,300 sampai 1,700 dan persentase padatan 0
sampai 95%, alat untuk menentukan indeks bias minyak, lemak, gelas optis, larutan gula, dan
sebagainnya, indeks bias antara 1,300 dan 1,700 dapat dibaca langsung dengan ketelitian sampai
0,001 dan dapat diperkirakan sampai 0,0002 dari gelas skala di dalam (Mulyono, 1997).
Pengukurannya didasarkan atas prinsip bahwa cahaya yang masuk melalui prisma-cahaya
hanya bisa melewati bidang batas antara cairan dan prisma kerja dengan suatu sudut yang
terletak dalam batas-batas tertentu yang ditentukan oleh sudut batas antara cairan dan alas
Faktor-faktor penting yang harus diperhitungkan pada semua pengukuran refraksi ialah
temperatur cairan dan jarak gelombang cahaya yang dipergunakan untuk mengukur n. Pengaruh
temperatur terhadap indeks bias gelas adalah sangat kecil, tetapi cukup besar terhadap cairan dan
terhadap kebanyakan bahan plastik yang perlu diketahui indeksnya. Karena pada suhu tinggi
kerapatan optik suatu zat itu berkurang, indeks biasnya akan berkurang. Perubahan per oC
berkisar antara 5.10-5 sampai 5.10-4. Pengukuran yang seksama sampai desimal yang ke-4 hanya
berarti apabila suhu diketahui dengan seksama pula.
Perbandingan sinus sudut datang dan sinus sudut bias adalah konstan. Ini dinamakan
hukum Snell, dinamakan sesuai nama matematikawan Belanda Willebrod Snell Von Royen
(1591-1626), dan dinyatakan oleh:
Sinθisinθr=n21
Konstanta n21 disebut indeks bias medium (2) relatif terhadap medium (1). Nilai numerik
konstanta itu tergantung pada sifat dasar gelombang dan pada sifat-sifat kedua media
Indeks refraksi larutan gula tergantung jumlah zat-zat yang terlarut, dan densitas suatu zat
cair, meskipun demikian dapat digunakan untuk mengukur kandungan gula. Cara ini valid untuk
pengukuran gula murni, karena adanya zat selain gula mempengaruhi refraksi terhadap sukrosa.
Oleh sebab itu, pengukuran indeks refraksi dapat digunakan untuk memperkirakan penentuan
kandungan zat kering larutan terutama sukrosa (Anonim, 2010).
IV.
ALAT DAN BAHAN
A.
Alat
1.
Refraktometer
2.
Botol semprot
B.
Bahan
1.
Aquades
2.
Fruktosa
3.
Glukosa
4.
Frutamin
5.
Ale-ale
6.
Capucino
7.
Teh gelas
V.
PROSEDUR KERJA
1.
Meneteskan sampel pada permukaan prisma refraktometer.
2.
Menutup permukaan prisma refraktometer dan membiarkan berkas cahaya memasuki, melewati
senyawa cair dan pengatur prisma.
3.
Menggeser tanda batas dengan memutar knop pengatur hingga memotong titik perpotongan dua
garis diagonal yang saling berpotongan pada layar dan membaca skala indeks biasnya.
Prinsip kerja dari refraktometer yaitu jika sampel merupakan larutan dengan konsentrasi
rendah, maka sudut refraksi akan lebar dikarenakan perbedaan refraksi dari prisma dan sampel
besar. Maka pada papan skala sinar “a” akan jatuh pada skala rendah.
Pada percobaan ini digunakan tujuh sampel minuman yang berbeda-beda, denga indeks
bias berbeda pula. Ketujuh sampel yang digunakan adalah aquades, capucino, teh gelas,
frutamin, ale-ale, fruktosa dan glukosa. Indeks bias dari ketujuh sampel tersebut berturut-turut
adalah 0; 5; 6; 7; 12; 13,2; dan 13,4. Aquades digunakan sebagai kontrol karena indeks biasnya
0.