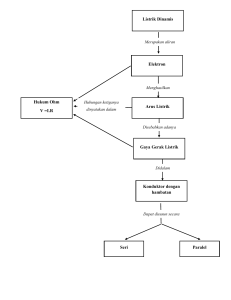
IKATAN KIMIA 1. Aturan Oktet Hampir semua atom membentuk ikatan dengan atom-atom lain. Tetapi ada enam unsur lain yang tidak bersifat demikian, yaitu unsur-unsur gas mulia yang terdiri dari: helium (2He), neon (10Ne), argon (18Ar), krypton (36Kr), xenon (54Xe), dan radon (86Rn). Unsur-unsur gas mulia hampir tidak membentuk ikatan dengan atom lain dan karena tidak reaktifnya maka sering disebut gas inert. Kecuali helium yang memiliki 2 elektron (duplet), semua gas mulia memiliki 8 elektron (oktet) pada kulit terluarnya. Susunan yang demikian menurut Kossel dan Lewis sangat stabil, sehingga atom-atom gas mulia tidak menerima elektron ataupun melepaskan elektron terluarnya. Hal inilah yang menyebabkan mengapa gas mulia sangat stabil. Aturan mengenai kestabilan struktur dikelilingi oleh 8 elektron valensi ini dikemukakan oleh Lewis dan Kossel yang dikenal sebagai aturan oktet: Kebanyakan atom-atom dikelilingi oleh 8 elektron jika atom-atom berikatan dengan atom lain. Aturan oktet tidak berlaku untuk atom H karena atom H hanya dapat dikelilingi oleh 2 elektron. Penyimpangan Aturan Oktet Aturan oktet sangat berguna untuk menerangkan adanya ikatan antara atom-atom dalam suatu molekul, namun ada molekul-molekul yang tidak memenuhi aturan oktet. Pada atom yang electron valensi dalam struktur Lewis adalah ganjil, maka ada dua kemungkinan tentang strukturnya: 1. Paling sedikit terdapat 1 elektron yang tidak berpasangan 2. Paling sedikit 1 atom tidak mempunyai konfigurasi electron oktet Secara umum terdapat dua macam penyimpangan dari aturan oktet: 1. Oktet tak lengkap Terjadi pada molekul dengan atom yang mempunyai kuran dari 8 elektron. Misalnya BF3 Pada atom pusat (B) tidak terpenuhi aturan oktet, karena atom B hanya dikelilingi oleh 6 elektron, namun senyawa ini sangat stabil, dengan kata lain struktur ini tidak salah meskipun tidak memenuhi aturan oktet. 2. Oktet berkembang Terjadi pada molekul dengan atom pusat yang dikelilingi lebih dari 8 elektron. Misalnya PCl5 Pada struktur tersebut, atom pusat (P) dikelilingi 10 elektron, dengan kata lain oktet telah berkembang menjadi 10 elektron. Struktur Lewis untuk molekul tersebut benar meskipun tidak memenuhi aturan oktet. 2. Struktur Lewis Struktur Lewis adalah kombinasi lambang Lewis yang menggambarkan perpindahan atau pemakaian bersama electron di dalam suatu ikatan kimia. Electron valensi memiliki peran paling penting. contoh pembentukan ikatan kovalen tunggal pada senyawa CH4 berikut ini. Konfigurasi elektron atom 6C: 2, 4. Jadi, atom C memiliki 4 elelktron valensi. Pada pembentukan CH4, elektron dari H berpasangan dengan elektron dari atom C. Dalam atom C terdapat empat elektron yang tidak berpasangan sehingga untuk memenuhi kaidah oktet diperlukan empat atom H. Struktur Lewis C dan H Pada setiap atom H yang dilingkari, terdapat dua elektron (duplet) dan pada atom C yang dilingkari terdapat delapan elektron (oktet). Tanda titik (.) dan tanda silang (x) hanya notasi yang digunakan untuk membedakan elektron yang berasal dari atom C dengan elektron yang berasal dari atom H. Perhatikan pula bahwa pasangan elektron yang digunakan bersama dapat ditandai dengan garis. Struktur lewis dalam bentuk garis Ikatan kovalen yang terbentuk pada senyawa CH4, dinamakan ikatan kovalen tunggal. Agar lebih memahami pembentukan ikatan kovalen tunggal , yuk pelajari ulasan berikut ini. a. Struktur Lewis Molekul NH3 Atom 7N memiliki konfigurasi elektron sebagai berikut 7N: 2, 5. Jadi,atom N memiliki elektron valensi dengan distribusi sebagai berikut. Struktur lewis N Atom 7N memiliki tiga elektron valensi tidak berpasangan sehingga untuk memenuhi kaidah oktet diperlukan tiga elektron dari atom H. Struktur lewis NH3 Dalam molekul NH3 terdapat sepasang elektron yang tidak digunakan (elektron bebas) sehingga disebut Pasangan Elektron Bebas (PEB). Tiga pasang elektron yang digunakan bersama oleh atom N dan atom H disebut Pasangan Elektron Ikatan (PEI). b. Struktur lewis Molekul H2O Atom 8O memiliki konfigurasi elektron 8O:2, 6. Jadi, atom O memiliki elektron valensi 6 dengan distribusi sebagai berikut. Struktur lewis O Pada atom O terdapat dua elektron tidak berpasangan sehingga diperlukan dua elektron lain untuk memenuhi kaidah oktet. Struktur lewis H2O Dalam H2O terdapat dua PEB dan dua PEI. Bagaimana struktur lewis molekul yang terbentuk dari atom sejenis, seperti Cl2? c. Struktur Lewis Molekul Cl2 Atom Cl memiliki satu elektron yang tidak berpasangan sehingga pada pembentukan molekul Cl2, elektron-elektron ini akan saling melengkapi untuk memenuhi kaidah oktet. Struktur lewis Cl2 Pada setiap atom Cl yang dilingkari terdapat delapan elektron (memenuhi kaidah oktet).