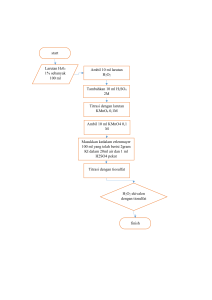
LAPORAN HASIL PRAKTIKUM KIMIA FARMASI I UJI GOLONGAN ALKOHOL NAMA : SUSY ARIYANTI KELAS :C NPM : 19208075 PROGRAM STUDI DIII FARMASI AKADEMI FARMASI BUMI SILIWANG BANDUNG 2020 UJI GOLONGAN ALKOHOL I. TUJUAN a. Mahasiswa dapat mengetahui senyawa yang termasuk alkohol b. Mahasiswa dapat mengetahui reaksi pada uji golongan alkohol II. DASAR TEORI Alkohol adalah Persenyawaan organik yang mempunyai satu atau lebih gugus hidroksil. Karena ikatan hidroksil bersifat kovalen, maka sifat alkohol tidak serupa dengan hidroksida, tetapi lebih mendekati sifat air. Alkohol diberi nama yang berakhiran-ol. Alkohol dapat digolongkan berdasarkan ; 1. Letak gugus OH pada atom karbon 2. Banyaknya gugus OH yang terdapat (jumlah gugus hidroksilnya) 3. Bentuk rantai karbonnya. Oksidasi alkohol sederhana mudah terbakar membentuk gas karbon dioksida dan uap air. Oleh karena itu, etanol digunakan sebagai bahan bakar spirtus (spiritus). Reaksi pembakaran etanol, berlangsung sebagai berikut: dengan zat-zat pengoksidasi sedang, seperti larutan K2Cr2O7 dalam lingkungan asam, alkohol teroksidasi sebagai berikut: 1. Alkohol primer membentuk aldehida dan dapat teroksidasi lebih lanjut membentuk asam karboksilat. 2. Alkohol sekunder membentuk keton. 3. Alkohol tersier tidak teroksidasi. Pembentukan Ester (Esterifikasi) Alkohol bereaksi dengan asam karboksilat membentuk ester dan air. Untuk membedakan suatu alkohol termasuk alkohol primer, sekunder atau tersier dapat dilakukan menggunakan pereaksiLucas.Pereaksi Lucas dibuat dengan dengan mereaksikan asam klorida pekat dan seng klorida. Pengamatan yang terjadi ketika ditambah pereaksi Lucas adalah: 1. Untuk alkohol primer ketika ditembahkan pereaksi Lucas tidak terjadi perubahan karena tidak terjadi reaksi kimia. 2. Pada alkohol sekunder ketika ditambah pereaksi Lucas terjadi reaksi kimia namun sangat lambat. Untuk mempercepat reaksi yang terjadi yaitu dilakukan pemanasan, setelah pemanasan sekitar 10 menit akan terbentuk 2 lapisan. 3. Sedangkan alkohol tersier ketika ditambahkan pereaksi Lucas akan bereaksi denga cepat membentuk alkil klorida yang tak larut dalam larutan III. ALAT DAN BAHAN NO Alat/Bahan Jumlah 1 Tabung Reaksi 5 2 Pipet tetes 5 3 Pembakar spirtus 1 4 Kaki tiga 1 5 Beaker glass 1 6 Spatel logam 1 7 Kassa asbes 1 8 Larutan KI dalam I2 Secukupnya 9 NaOH Secukupnya 10 Metanol Secukupnya 11 K2CrO7 Secukupnya 12 H2SO4 50% Secukupnya 13 Gliserin Secukupnya 14 CuSO4 Secukupnya 15 Serbuk Mentol Secukupnya 16 Vanilin Secukupnya 17 Asam Salisilat Secukupnya 18 H2SO4 pekat Secukupnya 19 Tissu Secukupnya IV. PROSEDUR 1. Reaksi Esterifikasi Metanol dan Asam Salisilat a) Masukkan 1 mL sampel alkohol (metanol) ke dalam tabung reaksi b) Tambahkan 1 spatel asam salisilat, kocok perlahan sampai homogen c) Tambahkan 2-3 tetes H2SO4 pekat, kemudian tutup tabung menggunakan tissue d) Masukkan ke dalam penangas air, biarkan sampai terjadi penguapan e) Amati perubahan yang terjadi dan cium aroma uap yang timbul 2. Reaksi alkohol dengan larutan KI dalam I2 a) Masukkan 1 mL sampel alkohol ke dalam tabung reaksi b) Tambahkan 2-3 tetes larutan KI dalam I2 c) Tambahkan 2-3 tetes NaOH d) Amati perubahan yang terjadi 3. Reaksi alkohol dengan K2CrO7 a) Masukkan 1 mL sampel alkohol ke dalam tabung reaksi b) Tambahkan 2-3 tetes K2CrO7 ke dalam tabung reaksi c) Tambahkan 2-3 tetes H2SO4 50% ke dalam tabung reaksi d) Amati perubahan yang terjadi 4. Reaksi Gliserin dengan CuSO4 a) Masukkan 1 mL gliserin ke dalam tabung reaksi b) Tambahkan 1-2 tetes CuSO4 ke dalam tabung reaksi c) Tambahkan 2-3 tetes NaOH ke dalam tabung reaksi, kocok ad homogen d) Amati perubahan yang terjadi e) 5. Panaskan dalam penangas air, amati perubahan yang terjadi Reaksi mentol a) Masukkan 1 spatel mentol ke dalam tabung reaksi b) Tambahkan 1 spatel vanillin ke dalam tabung reaksi, amati perubahan yang terjadi c) Tambahkan 2-3 tetes H2SO4 50% ke dalam tabung reaksi d) Amati perubahan yang terjadi V. HASIL PENGAMATAN 1. Reaksi Esterifikasi Metanol dan Asam Salisilat Pengamatan No Pereaksi 1 Metanol Sebelum + Asam Larutan bening Sesudah Larutan bening Salisilat 2 + H2SO4 , Panaskan Larutan bening Timbul uap bau gandapura 2. No Uji Reaksi alkohol dengan larutan KI dalam I2 Pereaksi Pengamatan Sebelum 1 Alkohol +Lar. Sesudah KI Larutan bening Larutan coklat Larutan coklat Larutan merah dalam I2 2 + NaOH 3. No Uji Reaksi alkohol dengan K2CrO7 Pereaksi Pengamatan Sebelum Sesudah 1 Alkohol + K2CrO7 Larutan bening Larutan oranye 2 + H2SO4 50% Larutan oranye Larutan hijau 4. No Uji Reaksi gliserin dengan CuSO4 Pereaksi Pengamatan Sebelum 1 2 Sesudah Gliserin + CuSO4+ Bening agak kental Endapan NaOH muda Panaskan Endapan biru muda Endapan biru biru kehijauan 5. Uji Reaksi Mentol dengan H2SO4 Pengamatan No Pereaksi Sebelum 1 Mentol + vanillin Hablur 2 + H2SO4 Sesudah putih berbentuk Larutan agak jarum kuning Larutan agak kuning Larutan oranye VI. REAKSI KIMIA 1. Reaksi metanol dengan asam salisilat 2. Reaksi alkohol dengan larutan KI dalam I2, lalu dengan NaOH C2H5OH + 4I2 + 6NaOH ⇒ CHI3 + HCOONa + 5NaI + 5H2O 3. Reaksi golongan alkohol dengan K2CrO7 4. Reaksi gliserin dengan CuSO4 5. Reaksi Mentol dengan H2SO4 VII. PEMBAHASAN Praktikum kali ini dilakukan percobaan untuk menguji senyawa golongan alkohol. Dilakukan lima kali uji reaksi golongan alkohol. 1. Reaksi Esterifikasi metanol dengan asam salisilat membentuk ester metil salisilat yang berbau gandapura. 2. Reaksi alkohol dengan larutan KI dalam I2 membentuk larutan coklat, kemudian setelah ditambah NaOH membentuk larutan merah dari iodoform. 3. Reaksi alkohol dengan K2CrO7 membentuk larutan oranye, kemudian setelah ditambah H2SO4 membentuk golongan aldehid berupa larutan hijau. 4. Reaksi gliserin dengan CuSO4 membentuk endapan biru muda, kemudian setelah dipanaskan membentuk endapan biru kehijauan. 5. Reaksi Mentol dengan H2SO4 menghasilkan lautan oranye. VIII. KESIMPULAN 1. Reaksi alkohol (metanol) dengan asam salisilat membentuk ester metil salisilat berbau gandapura. 2. Reaksi alkohol dengan larutan KI dalam I2 membentuk larutan coklat, kemudian setelah ditambah NaOH membentuk larutan merah. 3. Reaksi alkohol dengan K2CrO7 membentuk larutan oranye, kemudian setelah ditambah H2SO4 membentuk larutan hijau. 4. Reaksi gliserin dengan CuSO4 membentuk endapan biru muda, kemudian setelah dipanaskan membentuk endapan biru kehijauan. 5. Reaksi Mentol dengan H2SO4 menghasilkan lautan oranye. IX. DAFTAR PUSTAKA 1. https://www.youtube.com/watch?v=HwPmqDYMzv4 Diakses pada tanggal 25-10-2020 pkl 05.30 2. Fessenden. 2006. Kimia Organik EDISI KETIGA Jilid 2. Penerbit Erlangga. Jakarta 3. Fessenden, Ralph J., Joan S. Fessenden. 1982. Kimia Organik. Erlangga. Jakarta. 4. Petrucci, Ralph H., Suminar. 1987. KIMIA DASAR. Penerbit Erlangga. Jakarta 5. https://laporan-praktikum-kimia-farmasi / modul-1.html Diakses pada tanggal 25-10-2020 pkl 06.00