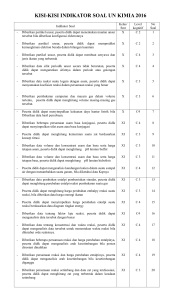
PEMETAAN STANDART ISI SK – KD Nama Sekolah : SMK .................................... Kelas / Semester : XI / 1 dan 2 Mata Pelajaran : KIMIA Standart Kompetensi Kompetensi Dasar 1 2 1. Memahami struktur atom untuk meramalkan sifat-sifat periodik unsur, struktur molekul, dan sifat-sifat senyawa. 1.1. Menjelaskan teori atom Bohr dan mekanika kuantum untuk menuliskan konfigurasi elektron dan diagram orbital serta menentukan letak unsur dalam table periodik. Tahap Berpi kir 3 C2 Indikator 4 Ruang Lingkup Alokasi Waktu 6 7 8 1. Struktur atom, sistem periodik dan ikatan kimia, stoikiometri, larutan non elektrolit dan elektrolit, reaksi oksidasi reduksi, senyawa organic dan makromolekul. 20 C1 Teori atom Bohr. Menjelaskan teori atom mekanika kuantum. C2 Teori mekanika kuantum Menjelaskan pengertian bilangan kuantum. Menggambarkan bentuk-bentuk orbital. C2 Materi Pokok Menjelaskan teori atom Bohr. Menjelaskan kulit dan sub kulit serta hubungannya dengan bilangan kuantum. 1.2. Menjelaskan teori jumlah pasangan elektron disekitar inti atom dan teori hibridisasi untuk meramalkan bentuk molekul. Tahap Berpi kir 5 C1 C1 C2 Menggunakan prinsip Aufbau, aturan Hund dan azas larangan Pauli untuk menuliskan konfigurasi elektron dan diagram orbital. C2 Mengemukakan letak unsur dalam sistem periodik dari konfigurasi elektron unsur tersebut. C2 Menjelaskan bentuk molekul berdasarkan teori pasangan elektron. C2 Meramalkan bentuk molekul berdasarkan teori hibridisasi. C2 Menjelaskan pengertian bilangan kuantum Menggambarkan bentuk-bentuk orbital Menjelaskan kulit dan sub kulit serta hubungannya dengan bilangan kuantum. Konfigurasi elektron (prinsip Aufbau, aturan Hund dan Larangan Pauli) dan hubungannya dengan sistem periodik. Bentuk molekul 25 45 45 45 90 90 90 90 1 2 3 1.3.Menjelaskan interaksi antar molekul (gaya antar molekul) dengan sifatnya. C2 4 Menjelaskan gaya tarik antar molekul 5 C2 6 7 Gaya antar molekul 8 90 (gaya London, gaya Van der Waals dan ikatan hidrogen). Menjelaskan perbedaan sifat fisik (titik C2 45 didih, dan titik beku) berdasarkan perbedaan gaya antar molekul (gaya London, gaya Van Der Waals dan ikatan hidrogen). Menjelaskan sifat fisik senyawa (td dan C2 45 td) berdasarakan gaya London, gaya Van Der Waals dan Mr. 2. Memahami perubahan energi dalam reaksi kimia dan cara pengukurannya. 2.1. Mendiskripsikan perubahan entalpi suatu reaksi, reaksi eksoterm dan reaksi endoterm. C2 Menjelaskan hukum / azas kekekalan C1 energi. energi. Membedakan sistem dan lingkungan. C2 Menjelaskan pengertian entalpi dan C1 perubahan entalpi. Membedakan reaksi eksoterm dan reaksi 2. Termokimia, laju Perubahan entalpi. kesetimbangan, 10 larutan asam – 25 basa, stoikiometri Reaksi eksoterm dan 90 kesetimbangan ion dalam larutan dan C1 10 reaksi dan larutan, P2 suatu reaksi. Menjelaskan macam-macam perubahan Sistem dan lingkungan. endoterm melalui percobaan. Menggambarkan diagram tingkat energi Hukum kekekalan 45 sistem koloid. C2 reaksi endoterm. 45 C1 Perubahan entalpi. 45 entalpi. Menuliskan persamaan termokimia suatu reaksi kimia. 1 2 2.2. Menentukan ΔH reaksi berdasarkan percobaan, Hukum Hess, data perubahan entalpi pembentukan standart dan data energi ikatan. 3 C3 4 Menentukan harga ΔH reaksi melalui 5 6 7 P2 ΔH reaksi 90 C3 Hukum Hess 100 percobaan. Menentukan harga ΔH reaksi dengan 8 menggunakan hukum Hess (diagram Entalpi pembentukan siklus/diagram tingkat energi). Menentukan harga ΔH reaksi dengan C3 90 standart menggunakan data perubahan entalpi Energi ikatan. pembentukan standart. Menentukan harga ΔH reaksi 90 C3 menggunakan data energi ikatan. 3. Memahami kinetika 3.1. Mendeskripsikan C2 Menjelaskan pengertian kemolaran. C1 Menghitung konsentrasi larutan C2 reaksi, kesetimbangan pengertian laju kimia dan faktor-faktor reaksi dengan yang mempengaruhinya melakukan Menjelaskan pengertian laju reaksi C2 serta penerapannya percobaan tentang Menghitung laju reaksi (v). C2 dalam kehidupan sehari- faktor-faktor yang Mengemukakan faktor-faktor yang P2 hari dan industri. mempengaruhi laju mempengaruhi laju reaksi melalui reaksi. percobaan. Kemolaran. reaksi dan 10 10 kesetimbangan, (molaritas). Mengemukakan variable tetap (kontrol) 2. Termokimia, laju Laju reaksi (ungkapan / pengertian). larutan asam – 10 basa, stoikiometri 15 larutan, 90 kesetimbangan ion Faktor-faktor yang C2 mempengaruhi laju dalam larutan dan sistem koloid. 20 reaksi. dan variable bebas (manipulasi) dari data percobaan mengenai faktor-faktor yang mempengaruhi laju reaksi. Menyimpulkan grafik dari data percobaan tentang faktor-faktor yang mempengaruhi laju reaksi. C2 25 1 3. Memahami kinetika 2 3.2. Memahami teori reaksi, kesetimbangan tumbukan kimia dan faktor-faktor (tabrakan) untuk yang menjelaskan faktor- mempengaruhinya faktor penentu laju serta penerapannya dan orde reaksi dan dalam kehidupan terapannya dalam sehari-hari dan industri. kehidupan seharihari. 3 4 5 C2 Menjelaskan pengertian tumbukan yang efektif Menjelaskan peranan energi pengaktifan di dalam reaksi eksoterm / endoterm dengan diagram tingkat energi. Menjelaskan hubungan antara teori tumbukan dengan faktorfaktor yang mempengaruhi laju reaksi (konsentrasi, luas permukaan bidang sentuh, suhu dan katalisator). Membedakan diagram energi potensial dari reaksi kimia dengan menggunakan katalisator dan yang tidak menggunakan katalisator Menjelaskan persamaan laju reaksi. Mengemukakan orde reaksi berdasarkan data hasil eksperimen. Mengemukakan persamaan laju reaksi berdasarkan data hasil percobaan Menghitung laju reaksi suatu reaksi kimia Membaca grafik orde reaksi. C1 Menjelaskan faktor-faktor penentu laju reaksi dalam kehidupan sehari-hari. 6 Teori tumbukan C2 7 8 10 35 C2 90 C2 20 C2 C2 Laju reaksi Orde reaksi C2 C2 20 25 90 C2 C2 25 10 Penerapan faktor-faktor penentu laju reaksi dalam kehidupan sehari-hari. 35 1 2 3 4 5 3.3. Menjelaskan kesetimbangan dan faktor-faktor yang mempengaruhi pergeseran arah kesetimbangan dengan melakukan percobaan. C2 Membedakan reaksi berkesudahan dan reaksi dapat balik melalui percobaan. Menjelaskan reaksi kesetimbangan, keadaan setimbang dan kesetimbangan dinamis melalui demonstrasi reaksi kesetimbangan Fe3+(aq) + SCN-(aq) ⇌ FeSCN2+(aq) Menjelaskan kesetimbangan homogen dan heterogen. Menjelaskan pergeseran kesetimbangan melalui percobaan pengaruh konsentrasi pada kesetimbangan Meramalkan arah pergeseran kesetimbangan dengan menggunakan azas Le Chatelier Menyimpulkan pengaruh perubahan suhu, konsentrasi, tekanan dan volume pada pergeseran kesetimbangan berdasarkan data hasil percobaan. P2 Reaksi berkesudahan dan reaksi dapat balik. 90 P2 Kesetimbangan dinamis. 60 Menyimpulkan pengertian hukum kesetimbangan dan tetapan kesetimbanagan (Kc) berdasarkan data hasil percobaan mengenai konsentrasi pereaksi dan hasil reaksi pada keadaan setimbang Menuliskan persamaan tetapan kesetimbangan (Kc) dari suatu reaksi kesetimbangan homogen dan heterogen. 6 7 8 C2 30 P2 75 C2 Faktor-faktor yang mempengaruhi pergeseran kesetimbangan. 15 C2 Faktor-faktor yang mempengaruhi pergeseran kesetimbangan. 90 C2 Hubungan kuantitatif antara pereaksi dari reaksi kesetimbangan 45 C1 45 1 2 3.4. Menentukan hubu- 3 4 5 C2 Menghitung harga Kc antara reaksi-reaksi yang berkaitan dengan harga Kc penggabungan persamaan reaksi kesetimbangan Menghitung harga Kc berdasarkan konsentrasi kesetimbangan dan sebaliknya. Menuliskan persamaan tetapan kesetimbangan (Kp) dari suatu reaksi homogen dan heterogen. Menghitung harga Kp berdasarkan tekanan parsial gas pereaksi dan hasil reaksi pada keadaan setimbang. Menghitung harga Kp berdasarkan Kc atau sebaliknya. Menghitung harga derajat disosiasi suatu zat pada suatu reaksi kesetimbangan disosiasi. Menjelaskan penerapan prinsip kesetimbangan dalam kehidupan sehari-hari (reaksi kesetimbangan dalam mulut dan tubuh). Menjelaskan kondisi optimum untuk memproduksi bahanbahan kimia di industri (ammonia dan asam sulfat) yang didasarkan pada reaksi kesetimbangan. C2 ngan kuantitatif antara pereaksi dengan hasil reaksi dari suatu reaksi kesetimbangan. 3.5. Menjelaskan penerapan prinsip kesetimbangan dalam kehidupan sehari-hari dan industri. C2 6 Hubungan kuantitatif antara 7 8 25 pereaksi dari reaksi kesetimbangan 75 C2 25 C1 75 C2 C2 45 45 C2 Sistem reaksi kesetimbangan 45 pengikatan darah oleh Hb (hemoglobin), kesetimbangan di mulut. Proses Kontak dan proses Haber Bosch. 45 1 4. Memahami sifat-sifat 2 4.1.Mendeskripsikan larutan asam – basa, teori asam – basa metode pengukuran dengan menentukan dan terapannya. sifat larutan dan menghitung pH larutan. 3 4 5 C2 Menjelaskan pengertian asam dan basa menurut Arrhenius. Menjelaskan pengertian asam dan basa menurut Bronsted dan Lowry. Menuliskan persamaan reaksi asam dan basa menurut Bronsted dan Lowry dan menunjukkan pasangan asam dan basa konjugasinya. Menjelaskan pengertian asam dan basa menurut Lewis. Memperkirakan sifat larutan asam dan basa dengan berbagai indikator. Memperkirakan pH suatu larutan elektrolit yang tidak dikenal berdasarkan hasil pengamatan trayek perubahan warna berbagai indikator asam dan basa. Menjelaskan pengertian kekuatan asam dan menyimpulkan hasil pengukuran pH dari beberapa larutan asam dan basa yang konsentrasinya sama. Menyimpulkan kekuatan asam atau basa dengan derajat pengionan (α) dan tetapan asam (Ka) atau tetapan basa (Kb). Menghitung pH larutan asam atau basa yang diketahui konsentrasinya. Menjelaskan penggunaan konsep pH dalam lingkungan. C1 6 Teori asam – basa 7 2. Termokimia, laju reaksi dan C1 kesetimbangan, larutan asam – basa, C2 8 45 45 45 stoikiometri larutan, kesetimbangan ion dalam larutan dan C1 C2 C2 sistem koloid. Sifat larutan asam dan basa Derajat keasaman C2 C2 45 90 90 90 Derajat keasaman 180 Derajat ionisasi, tetapan asam dan tetapan basa Aplikasi konsep pH dalam pencemaran. 135 45 1 4 2 4.2. Menghitung banyaknya pereaksi dan hasil reaksi dalam larutan elektrolit dari hasil titrasi asam – basa. 4.3. Menggunakan kurva perubahan harga pH pada titrasi asam basa untuk menjelaskan larutan penyangga dan hidrolisis. 4.4. Mendeskripsikan sifat larutan penyangga dan peranan larutan penyangga dalam tubuh makhluk hidup. 3 C3 C2 C3 4 Menentukan konsentrasi asam atau basa melalui percobaan titrasi asam – basa Menggunakan data titrasi untuk menghitung konsentrasi asam atau basa pada reaksi penetralan. Menentukan kadar asam asetat sebagai contoh cuka dan membandingkan hasilnya dengan kadar yang tercantum pada label botolnya. 5 P2 6 Stoikiometri larutan titrasi asam - basa 7 dan 8 90 C3 90 C3 90 Membandingkan grafik hasil titrasi asam kuat dan basa kuat, asam kuat dan basa lemah, asam lemah dan basa kuat untuk menjelaskan larutan penyangga dan hidrolisis. Menjelaskan pengertian dan komposisi larutan penyangga. Menjelaskan pengertian hidrolisis garam. C2 Grafik titrasi asam – basa 45 C1 Larutan penyangga 30 C1 Hidrolisis garam 15 Membedakan larutan penyangga dan bukan penyangga melalui percobaan. Menghitung pH atau POH larutan penyangga. Menghitung pH larutan penyangga dengan penambahan sedikit asam atau sedikit basa atau dengan pengenceran. Menjelaskan fungsi larutan penyangga dalam tubuh makhluk hidup. P2 Larutan penyangga 90 C3 90 C3 135 C2 45 1 2 3 4 5 4.5. Menentukan jenis garam yang mengalami hidrolisis dalam air dan pH larutan garam tersebut.Menggunak an kurva perubahan harga pH pada titrasi asam basa untuk menjelaskan larutan penyangga dan hidrolisis. C3 C3 4.6. Memprediksikan terbentuknya endapan dari suatu reaksi berdasarkan prinsip kelarutan dan hasil kali kelarutan. C3 Menentukan ciri-ciri beberapa jenis garam yang dapat terhidrolisis dalam air melalui percobaan. Menuliskan reaksi hidrolisis beberapa jenis garam. Menjelaskan hubungan antara tetapan hidrolisis (Kh), tetapan ionisasi air (Kw) dan konsentrasi OH- atau H+ larutan garam yang terhidrolisis. Menghitung pH larutan garam yang terhidrolisis Menentukan hubungan tetapan hasil kali kelarutan dengan tingkat kelarutan atau pengendapanya. Menghitung kelarutan suatu elektrolit yang sukar larut berdasarkan data harga Ksp atau sebaliknya. Menjelaskan pengaruh penembahan ion senama dalam larutan. Menghitung kelarutan suatu elektrolit yang sukar larut dalam larutan yang mengandung ion senama. Menghitung pH larutan dari harga Ksp-nya atau sebaliknya. Meramalkan terbentuknya endapan berdasarkan harga Ksp. C1 6 7 Hidrolisis garam 8 90 Sifat-sifat garam yang terhidrolisis 45 C2 45 C3 90 C3 C3 C2 2. Termokimia, laju reaksi dan kesetimbangan, larutan asam – basa, stoikiometri larutan, kesetimbangan ion dalam larutan dan sistem koloid. 45 90 45 C3 90 C3 90 C3 90 1 2 5. Menjelaskan sistem dan sifat koloid serta penerapannya dalam kehidupan sehari-hari. 5.1. Mengelompok-kan sifat-sifat koloid dan penerapannya dalam kehidupan sehari-harI 3 4 5 C3 Menjelaskan peristiwa-peristiwa terjadinya muatan listrik pada partikel koloid. Menjelaskan kestabilan koloid dan peristiwa elektroforesis. Mencontohkan peristiwa seharihari yang berhubungan dengan sifat koloid. Menjelaskan proses penjernihan air dengan cara penambahan koagulan melalui percobaan. Membedakan koloid liofil dan liofob serta sifatnya dengan contoh yang ada di lingkungan. Menjelaskan peranan koloid di dalam industri (kosmetik makanan, farmasi ) Menjelaskan proses pembuatan koloid melalui percobaan C2 C2 5.2. Membuat berbagai sistem koloid dengan bahan-bahan yang ada disekitarnya. 6 7 Sifat-sifat koloid 45 C2 45 C2 90 P2 45 45 C2 C2 C2, P2 8 Peranan koloid dalam kehidupan. Pembuatan koloid Mengetahui Kepala SMK .................................... Lamongan, Juli 2017 Guru Mata Pelajaran …………………………………….. ……………………………… 90 180