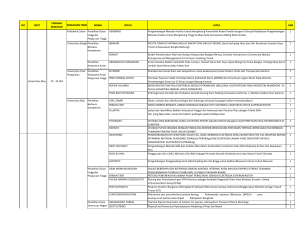
ELEKTRODA PADA SEL ELEKTROKIMIA Definisi Elektroda adalah konduktor listrik padat yang membawa arus listrik menjadi padatan non-logam, atau cairan, atau gas, atau plasma, atau vakum. Elektroda biasanya merupakan konduktor listrik yang baik, tetapi harus berupa logam. - Anoda adalah elektroda yang menarik anion, dinyatakan positif Katoda adalah elektroda yang menarik kation, dinyatakan negative Dalam sebuah tabung elektron, anoda disebut pelat, dan elemen konduktor yang mengatur aliran elektron di dalam tabung juga disebut elektroda. Dalam sel elektrokimia, reaksi reduksi dan oksidasi berlangsung di elektroda. Elektroda tempat reduksi terjadi disebut katoda. Oksidasi terjadi di anoda. Peran elektroda sebagai katoda atau anoda tergantung pada arah sel beroperasi. Jika sebuah sel dialihkan dari operasi galvanis (yaitu mengeluarkan energi seperti baterai) ke elektrolisis (energi dimasukkan ke sel) maka katoda akan menjadi anoda dan sebaliknya. Contoh elektroda: - Ada dua jenis yaitu reaktif dan inert Elektroda inert tidak bereaksi Elektroda inert yang umum digunakan adalah platina, emas, grafit, dan rodium Elektroda reaktif yang umum adalah seng, tembaga, timbal, dan perak Elektroda adalah komponen vital dalam sel elektrokimia karena mereka mengangkut elektron yang dihasilkan dari satu setengah sel ke sel lainnya, yang menghasilkan produksi muatan listrik. Jenis-Jenis - - - - Elektroda Logam-Ion Logam Berisi logam yang berada pada kesetimbangan dengan larutan ionnya. Elektroda Redoks Elektroda yang melibatkan Rx Redoks di dalamnya. Elektroda Amalgam Larutan logam dalam Hg cair. Pada elektroda ini amalgam logam M akan berada dalam kesetimbangan dengan ionnya (M2+). Elektroda Membran Mengandung membrane semi-premeabel. Menggerakkan muatan listrik dari suatu titik ke yang lain diperlukan beda potensial listrik. Beda potensial ini diukur antara dua elektroda yaitu pengukurnya dan pembandingnya. Elektroda Logam-Garam Tak Larut Berisi logam M yang berada dalam kesetimbangan dengan garam sangat sedikit larutnya Mv+ Xvserta mengandung garam atau asam terlarut dalam anion Xz-. Elektroda Gas Berisi gas yang berada dalam kesetimbangan dengan ion-ion dalam larutan. Elektroda Non-Logam – Non-Gas Berisi unsur selain logam dan gas. Potensial Potensial elektroda suatu unsur yang mengalami reaksi redoks akan bernilai sama, tetapi tandanya berbeda. Potensial elektroda salam elektrokimia menurut IUPAC adalah gaya gerak listrik dari suatu sel yang dibangun oleh dua elektroda. Sisi kiri diagram sel adalah elektroda hydrogen standar, dan bagian kanannya adalah elektroda yang dimaksud. Potensal elektroda dibagi berdasarkan elektroda pada reaksi redoks, yaitu: - Elektroda yang cenderung mengalami reduksi dibandingkan elektroda hydrogen (H2) memiliki potensial positif (Esel = +) Elektroda yang cenderung mengalami oksidasi dibadingkan elektroda hydrogen (H2) memiliki potensial negatif (Esel = -) Nernst Equation Dalam elektrokimia, Nernst Equation dapat digunakan untuk menentukan potensial reduksi setengah sel dalam sel elektrokimia. Persamaan ini juga dapan menentukan tegangan total (GGL) untuk sel elektrokimia penuh. Rumus pada persamaan Nernst menghubungkan nilai numerik gradien konsentrasi dengan gradien listrik yang menyeimbangkannya. Rumus dari persamaan Nernst ini sebagai berikut: Persamaan Nernst memberikan rumus yang menghubungkan gaya gerak listrik sel tidak standar dengan konsentrasi spesies dalam larutan: Dalam persamaan ini: E = GGL dari sel non-standar R = Konstanta Gas E0 = GGL sel standar T = Temperatur (K) z = jumlah mol electron F = konstanta Faraday Electrical Double Layer Disebut juga Lapisan Ganda Listrik. Disasumsikan bahwa tidak ada reaksi trf electron yang terjadi di elektroda dan larutan hanya terdiri dari elektrolit. Struktur ini muncul di permukaan suatu benda saat terkena fluida. Benda tersebut bisa berupa partikel padat, gelembung gas, tetesan cairan, atau benda berpori. Lapisan Pertama, muatan permukaan (baik positif atau negatif), terdiri dari ion yang teradsorpsi ke objek akibat reaksi kimia. Lapisan kedua, terdiri dari ion yang tertarik ke muatan permukaan melalui gaya Coulomb, yang electrically menyaring lapisan pertama. Maka lapisan ini terkait secara longgar thd objek. (lapisan difus) Polarisasi Polarisasi merupakan perubahan potensial dari keadaan stabil, misalnya dari potensial elektroda rangkaian terbuka sebagai hasil dari aliran arus. Hal ini juga mengacu pada perubahan potensial elektroda selama elektrolisis, sehingga potensial dari sebuah anoda menjadi lebih mulia, dan bahwa katoda lebih aktif, dibandingkan potensial masing-masing reversibel. Sering dilakukan dengan pembentukan lapisan pada permukaan elektroda. - - - Polarisasi Elektroda Ketika pori-pori suatu benda terisi mineral logam, maka ion positif dan negative yang seharusnya menyebar berdasar arus yang melewatiya di mana, ion positif mengalir seara degan arah arus mengalir sedangkan ion negative akan berlawanan arus. Polarisasi Membrane Muncul karena adanya mineral lempung yang memiliki pori kecil pada suatu kontak antar mineral lempung dengan air dalam suatu batuan Polarisasi Terinduksi/Terimbas Pada metode polarisasi terimbas arus dinjeksikan melalui elektrode arus pada selang waktu tertentu kemudian dihentikan. REFERENSI Electrode | electronics | Britannica. (2020). In: Encyclopædia Britannica. [online] Available at: https://www.britannica.com/science/electrode [Accessed 23 Oct. 2020]. Administrator (2013). The Electrical Double Layer | Department of Chemical Engineering and Biotechnology. [online] Cam.ac.uk. Available at: https://www.ceb.cam.ac.uk/research/groups/rgeme/Edu/the-electrical-double-layer [Accessed 23 Oct. 2020]. Lumenlearning.com. (2020). The Nernst Equation | Introduction to Chemistry. [online] Available at: https://courses.lumenlearning.com/introchem/chapter/the-nernst-equation/ [Accessed 23 Oct. 2020]. Admin (2018). Electrodes. [online] BYJUS. Available at: https://byjus.com/chemistry/electrodes/ [Accessed 23 Oct. 2020].