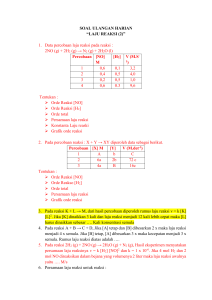
HUKUM HESS • Hukum Hess berkaitan dengan reaksi-reaksi yang dapat dilangsungkan menurut dua atau lebih cara (lintasan). Hukum Hess ditemukan oleh G. Henry Hess pada tahun 1840 melalui beberapa percobaan. Bunyi Hukum Hess: “kalor reaksi tidak bergantung pada jalannya reaksi (tahapan reaksi), tetapi hanya bergantung pada keadaan awal dan akhir.” Contohnya reaksi antara karbon (grafit) dengan oksigen membentuk karbondioksida. “Misalkan, kita mempunyai 1 mol karbon dan 1 mol oksigen. Kedua zat ini dapat bereaksi membentuk 1 mol karbon dioksida”. Reaksinya dapat dilangsungkan menurut dua cara sebagai berikut. Cara 1 : reaksi satu tahap 1 mol karbon direaksikan dengan 1 mol oksigen, sehingga membentuk 1 mol karbon dioksida. C(s) + O2(g) → CO2(g) Cara 2 : reaksi dua tahap Tahap-1 : satu mol karbon mula-mula direaksikan dengan ½ mol oksigen (setengah mol oksigen masih tersisa) sehingga terbentuk 1 mol karbon monoksida. C(s) + ½ O2(g) → CO(g) Tahap 2: gas karbon monoksida yang terbentuk pada tahap 1 direaksikan dengan ½ mol oksigen yang tersisa, sehingga terbentuk 1 mol karbon dioksida. CO(g) + ½ O2(g) → CO2(g) CO(g) + ½ O2(g) C(s) + ½ O2(g) C(s) + O2(g) ∆H 1 CO2 (g) Tahap 1 : C(s) + ½ O2(g) → CO(g) Tahap 2 : CO(g) + ½ O2(g) → CO2(g) ________________________________+ C(s) + O2(g) → CO2(g) Maka: ∆H1= ∆H2 + ∆H3+ ∆H4 Contoh soal: 1. Perhatikan diagram reaksi berikut! Berdasarkan diagram tersebut, berapakah nilai x? Jawab: Menurut Henry Hess, “Kalor yang diserap atau dibebaskan oleh suatu reaksi tidak tergantung pada jalannya reaksi, tetapi tergantung pada keadaan awal dan akhir reaksi”. Ini berarti: ∆H3 = ∆H1 + ∆H2 -398 = X + (-100) X = -398 + 100 = -298 kJ Jadi, nilai X adalah -298 kJ. 2. Perhatikan persamaan termokimia berikut: 2H2(g) + O2(g) → 2H2O(l) ∆H = -136 Kkal H2(g) + O2(g) → H2O2(l) ∆H = -44,8 Kkal Hitunglah ∆H untuk reaksi, 2H2O2 → 2H2O + O2 Jawab: Untuk mendapatkan reaksi tersebut, kita gabungkan reaksi pada tahap 1 dan tahap 2 sehingga diperoleh: 2H2 + O2 → 2H2O ∆H = -136 Kkal H2 + O 2 → H2O2 ∆H = -44,8 Kkal Reaksi: 1. Tetap 1. 2H2(g) + O2(g) → 2H2O(l) ∆H = -136 Kkal 2. Di balik (∆H bernilai +) 2. (H2O2(l) ∆H= 44,8 Kkal) dikali 2 → H2(g) + O2(g) _____________________________________+ 2H2O2 1. 2H2(g) + O2(g) → 2H2O(l) ∆H = -136 Kkal 2. H2(g) + O2(g) → H2O2(l) ∆H = -44,8 Kkal (dibalik) H2O2(l) → H2(g) + O2(g) ∆H = -44,8 Kkal _____________________________________+ 2H2O2 → 2H2O + O2 ∆H = ? Kkal ∆H= (44,8 Kkal) → 2H2O + O2 1. 2H2(g) + O2(g) → 2H2O(l) 2. 2H2O2(l) ∆H = ? Kkal ∆H = -136 Kkal → 2H2(g) + 2O2(g) ∆H= 89,6 Kkal _____________________________________+ 2H2O2 → 2H2O + O2 ∆H = -46,4 Kkal Jadi, ∆H untuk reaksi 2H2O2 → 2H2O + O2 sebesar -46,4 Kkal. 3. Dari diagram tingkat energi tentukan energi pada penguapan 2 mol air dalam tubuh yang di perlukan Tugas : C(s)+ O2(g) ⎯⎯→ CO2(g) ΔH= –94 kJ H2(g)+ O2(g) ⎯⎯→ 2 H2O(g) ΔH= –136 kJ 3C(s)+ 4 H2(g) ⎯⎯→ C3H8(g) ΔH= –24 kJ Tentukan ΔH pada reaksi C3H8(g)+ 5 O2(g) ⎯⎯→3 CO2(g)+ 4 H2O(g)!