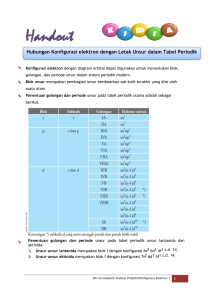
RANGKUMAN MATERI AJAR KELAS X SMA PROGRAM IPA Materi: SISTEM PRIODIK UNSUR *KHUSUS UNTUK PARA PENIMBA ILMU Oleh: Najmia Rahma, S.Pd. Sohibnya Kimia yaa... Sistem Periodik Unsur Siapa yang belum pernah dengar Sistem Periodik Unsur? Sepertinya kalau melihat kalian sudah sering, karena kimia tidak lepas dari deretan kotak-kotak berisikan simbol unsur-unsur. Benar! Yang seperti ini lho! Hingga tahun 2018 ini sudah ditemukan sejumlah 118 macam unsur, lebih dari setengahnya ditemukan sekitaran tahun 1800 – 1900. Selama periode tersebut para ahli lama-kelamaan menyadari ada kemiripan sifat dari masing-masing unsur tersebut, baik sifat fisik maupun sifat kimianya! Karena banyak sekali unsur-unsur yang ditemukan, para ahli seluruh dunia tergerak untuk mengelompokkan unsur-unsur tersebut supaya lebih mudah membaca kemiripan sifatnya. Banyak sekali pendapat mengenai pengelompokan unsur-unsur di abad ke-19 yang akan kita bahas sekarang. Tapi, tenang…. tidak akan semuanya kita bahas, hanya sekelumit sejarah saja…. PERKEMBANGAN Tabel PERIODIK UNSUR Pada zaman dahulu kala, tampilan Tabel Periodik Unsur belum seperti yang sekarang sering kalian lihat, mengingat masih sedikitnya unsur-unsur yang baru ditemukan. Para ilmuwan seperti John Newlands menyusun tabel periodik pertama yang disusun berdasarkan massa atom relatifnya. Maka pada tahun 1865 Newlands menerbitkan “Hukum Oktaf” pada tabel periodiknya. Hukum ini menyatakan bahwa, unsur-unsur yang disusun mendatar dari kiri ke kanan akan menunjukkan sifat yang sama dan terjadi secara berulang-ulang pada setiap 8 unsur. Beliau menyusun tabel periodik dari unsur Hidrogen (H) hingga Thorium (Th) yang ke-90. Jika diurutkan akan terlihat seperti ini: John Newlands Pada baris pertama terlihat unsur-unsur yang tersusun dari H, Li, G, Bo, C, N, dan O. Ada 7 unsur bukan? Nah, unsur yang ke-8 yakni F memiliki kemiripan sifat dengan unsur pertama H, dan begitu seterusnya. Tapi masalahnya, Hukum Oktaf ini dianggap konyol oleh kawan-kawan seprofesi Newlands dan juga The Society of Chemists tidak terima dengan apa yang dinyatakan oleh beliau. Seseorang yang memperbaiki kekonyolan Newlands tersebut adalah Dmitri Mendeleev, seorang warga Rusia yang dalam tidurnya bermimpi tentang suatu ide, dan kemudian terjaga dengan suatu gagasan, “bagaimana jika unsur-unsur didaftar berdasarkan KENAIKAN MASSA ATOM DENGAN PERPINDAHAN BARIS PADA INTERVAL TERTENTU...?” (Criddle & Gonick, 2005: 15) Hasilnya adalah semacam tabel dengan unsur-unsur diatur dalam baris-baris. Dmitri Mendeleev Mendeleev sangat terobsesi dengan penyusunan tabel periodik unsurnya. Dengan amat-sangat tekun beliau mencari, mencatat sifat-sifat yang dimiliki setiap unsur. Pada akhirnya inilah yang ia peroleh dari ketekunannnya Pada tabel periodik unsur Mendeleev, unsur-unsur dengan sifat yang mirip disusun secara vertikal (dari atas ke bawah) yang kemudian disebut grup. Massa atom mengalami kenaikan dari atas ke bawah dalam satu grup. Tabel periodik Mendeleev dianggap AJAIB dan sangat meyakinkan karena mampu memperkirakan unsur-unsur yang belum ditemukan pada saat itu. Ia mengetahui adanya lubanglubang bertanda-tanya dalam tabelnya dan berhasil meramalkan UNSUR-UNSUR BARU yang akan mengisinya. (Criddle & Gonick, 2005: 15) Satu hal yang tidak terprediksi oleh Mendeleev hanyalah Gas Mulia, makanya mereka tidak memiliki tempat dalam tabel periodik unsurnya. Barulah setelah lumayan banyak unsur yang ditemukan, daftar Mendeleev diperbaiki dan di-per-indah tampilannya oleh Moseley. Susunan tabel periodik yang disusun beliau berkembang lebih baik dan akhirnya didapatkan bentuk seperti sekarang. Dalam sistem periodik modern yang disusun oleh Moseley terdapat jalur mendatar yang disebut PERIODE dan jalur yang tegak lurus yang disebut GOLONGAN. Keterangan lainnya dapat kalian lihat di bawah ini: H.G.J. Moseley SIFAT-SIFAT KEPERIODIKAN UNSUR Sifat-sifat apa saja yang berulang secara berkala dalam setiap baris dan kolom dalam tabel periodik unsur? Bagaimana kecenderungan yang kita dapatkan sepanjang deretan unsur tersebut? Mari kita bahas sekarang! Tahukah kalian bahwa ukuran atom sangatlah bervariasi? Namun, dalam suatu tabel periodik unsur ukuran mereka memiliki kecenderungan tertentu pada satu golongan maupun satu periode. Dalam satu periode, kita bergerak dari kiri ke kanan, atom-atom menjadi semakin kecil, dan dalam satu golongan, dari atas ke bawah, atom-atom menjadi semakin besar. Alasan: saat bergerak ke kanan, muatan inti yang lebih besar menarik elektron mendekat, saat bergerak ke bawah, elektron-elektron luar berada di kulit yang lebih tinggi, oleh sebab itu berjarak makin jauh dari inti atom (Craddle & Gonick, 2005: 39) Sumber gambar: Whitten, 2004: 245 Kita mulai dari pembahasan mengenai Energi Ionisasi itu sendiri. Adalah tidak lain tidak bukan merupakan ENERGI YANG DIBUTUHKAN ATOM UNTUK MELEPAS SATU SAJA ELEKTRON TERLUARNYA (VALENSI). Ah, cuma satu koq! Lepas saja dia, gampang kan melepasnya? Gak perlu banyak energi Model atom Natrium (11Na) Kita ambil contoh, unsur Natrium (Na) pada Golongan IA memiliki 1 elektron valensi yang terjauh dari inti. Unsur-unsur yang seperti ini rupanya memiliki energi ionisasi yang rendah. Saking rendahnya energi ionisasi mereka, mereka mampu melepaskan dengan sangat mudah 1 elektron terluar mereka. Dengan demikian, golongan mereka sangat mudah untuk menjadi KATION, alias atom yang bermuatan POSITIF (X+). Kecenderungan energi ionisasi atom-atom dalam sistem periodik unsur dapat dilihat pada tabel berikut: Energi Ionisasi Pertama Beberapa Unsur (Sumber: Whitten, 2004: 243) Dari data tersebut, terlihat bahwa ENERGI IONISASI DALAM SATU PERIODE (DARI KIRI KE KANAN) CENDERUNG SEMAKIN MEMBESAR, sedangkan DALAM SATU GOLONGAN (DARI ATAS KE BAWAH) CENDERUNG SEMAKIN KECIL. Nah, kebalikan dari Energi Ionisasi, Afinitas Elektron ini mengenai KESEDIAAN SI ATOM UNTUK MENERIMA SATU SAJA ELEKTRON dan membentuk ANION. Kalian tahulah apa itu anion! Bentar ya, kita siapsiap ngelepasin energi dulu! Boleh ikutan gabung?? Model Atom Klor (17Cl) Dengan kata lain, afinitas elektron merupakan JUMLAH ENERGI YANG DISERAP ATOM KETIKA ELEKTRON DITAMBAHKAN DALAM WUJUD GAS. Nilai positif jika energi diserap, dan negatif jika energi dilepas. Besarnya afinitas elektron sulit untuk diketahui. Bahkan beberapa unsur tidak memiliki afinitas ketika ditambahkan elektron ke dalamnya. Berikut merupakan tabel yang menunjukkan nilai afinitas elektron untuk beberapa unsur yang telah diketahui: Nilai Afinitas Elektron Beberapa Unsur (Sumber: Whitten, 2004: 247) Dari tabel tersebut, maka kita simpulkan bahwa AFINITAS ELEKTRON DALAM SATU PERIODE (DARI KIRI KE KANAN) SEMAKIN NEGATIF, sedangkan DALAM SATU GOLONGAN (DARI ATAS KE BAWAH) SEMAKIN BERKURANG KENEGATIFANNYA. Kecenderungan afinitas elektron menunjukkan pola yang sejalan dengan Energi ionisasi. Baiklah, jika afinitas elektron sulit untuk diketahui besarannya, ini ada istilah lain yang mempermudahnya, KEELEKTRONEGATIFAN, yakni KECENDERUNGAN ATOM DALAM MENARIK PASANGAN ELEKTRON YANG DIGUNAKAN BERSAMA DALAM BERIKATAN e— e— Unsur-unsur yang memiliki keelektronegatifan tinggi (non logam) cenderung menarik elektron dan membentuk anion, sedangkan unsur-unsur yang keelektronegatifannya rendah (logam) cenderung melepaskan elektron dan membentuk kation. Berikut ini merupakan nilai keelektronegatifan unsur-unsur dalam sistem perodik: Keelektronegatifan Unsur-unsur (Sumber: Whitten, 2004: 250) Jika kita lihat kecenderungannya, maka NILAI KEELEKTRONEGATIFAN UNSUR DALAM SATU PERIODE (DARI KIRI KE KANAN) SEMAKIN MEMBESAR, sedangkan DALAM SATU GOLONGAN (DARI ATAS KE BAWAH) SEMAKIN MENGECIL. Mungkin sifat-sifat keperiodikan yang sudah kita tadi lebih mudah jika kesimpulannya kita buat seperti ini: Terjadi peningkatan Terjadi penurunan hmm... Oke, baiklah! Kita sudahi dulu saja pembahasan mengenai sifat-sifat keperiodikan unsur ini. Kita beranjak ke bagian seru dari sistem periodik unsur ini! MEMPREDIKSIKAN GOLONGAN DAN PERIODE SUATU UNSUR Kali ini kita akan meramal Seperti yang sudah kalian semua ketahui, bahwasannya suatu unsur memiliki identitas alamatnya masing-masing yang dapat dilihat dari Golongan dan Periode. Nah, bagaimana kita dapat memprediksi Golongan dan Periode tersebut? Pembicaraan kita selanjutnya tidak jauh beda dengan meramal.... Seperti meramal dengan kartu tarot, kita pun butuh aturan dalam meramalkan lokasi para unsur. Kita cukup tahu NOMOR ATOMnya saja, maka kita mampu menentukan golongan dan periode para unsur tersebut yang diawali dengan mengKONFIGURASIkan terlebih dahulu elektronnya. Aturan konfigurasi elektron sudah kalian pelajari pada BAB sebelumnya, yakni Struktur Atom. Kalian harus ingat kembali Aturan Aufbau ini Ada 5 aturan dalam menentukan golongan dan periode suatu unsur. Kita lihat oneby-one: Jika konfigurasi elektron berakhir pada subkulit “s” maka golongan ditentukan dari jumlah elektron pada subkulit “s” dan merupakan golongan utama Ca Langsung kasih contoh aja yaa... misalkan kita akan meramalkan lokasinya si 20 alias si kalsium. Jangan nyontek dulu ke tabel periodik lho!!! Nah, yang wajib kalian lihat pertama kali adalah nomor atom Ca terlebih dahulu, yakni 20. Setelah itu diapain?? Langsung saja: LANGKAH 1 konfigurasikan elektronnya! Kalau lupa, baca lagi materi Struktur Atom. Nantinya akan kita dapat seperti ini: LANGKAH 2 kelompokkan berdasarkan kulitnya! Untuk langkah kedua ini kalian bisa lihat bagaimana pengelompokkannya pada halaman sebelumnya, pas sekali di Aturan AUFBAU. Tangga paling dasar merupakan kulit pertama, tangga kedua dari bawah merupakan kullit kedua, dst. Biar lebih gampang kita pakai warna saja untuk mengelompokkannya. Jadinya seperti ini: Segini doang yang diambil Nah, kulit terakhir (yang berisi elektron valensi) ditempati oleh 4s2 saja. Inilah yang akan menunjukkan Golongan dan Periode si 20Ca. Langsung saja, kita ke...... 3 LANGKAH Identifikasi Golongan! Jumlahkan seluruh elektron pada kulit terakhirnya. Angka-angka mungil yang disuperscript merupakan elektron Golongan II Karena berakhir di subkulit “s”, maka golongannya pasti golongan utama, yakni A. Dari contoh tersebut, maka 20Ca berada pada Golongan IIA. Duanya biasakan pakai angka Romawi yaa... 4 LANGKAH Identifikasi Periode! Lihat nomor kulitnya saja. Angka GEDE yang selalu di depan tempatnya Periode 4 Ca Unsur 20 terletak pada Golongan IIA dan Periode 4 Silakan kalian buktikan sendiri pada Tabel Periodik Unsur. Benarkah unsur yang berada pada Golongan IIA dan Periode 4 memiliki nomor arom 20 dan merupakan unsur kalsium (Ca)??? Sekarang kita berangkat ke aturan selanjutnya... Jika konfigurasi elektron berakhir pada subkulit “p” maka golongan ditentukan dari jumlah elektron pada subkulit “s” dan “p” dan merupakan golongan utama Kali ini pun sama saja, lebih enak dipahami kalau langsung ketemu sama contohnya. Cl Kita akan meramalkan posisi, alias Golongan dan Periode miliknya si 17 , atau nama lainnya adalah Klor. Seperti biasa langsung saja kita lihat berapa nomor atomnya? Ada 17 bukan? Kalau begitu kita masuk ke langkah-langkahnya: 1 LANGKAH konfigurasikan elektronnya! Dapatnya begini nanti... LANGKAH 2 kelompokkan berdasarkan kulitnya! Lagi-lagi Aturan AUFBAU... Ambil semua ini Fokus ramalan kita seperti biasa ada di kulit terakhir, alias para elektron valensi. Tapi, di kulit terakhir itu ada 2 subkulit, yakni subkulit s dan subkulit p. Jadi, darimana kita tentukan golongannya? OK, kita ambil saja SELURUH ELEKTRON YANG ADA DI KULIT TERAKHIRNYA! 3 LANGKAH Identifikasi Golongan! Untuk mengetahui Golongan ke berapanya, kita jumlahkan saja seluruh elektron pada kulit terakhirnya 2+5=7 Golongan VII Karena berakhir di subkulit s dan subkulit p, maka golongannya pasti golongan utama, yakni A. Dari contoh tersebut, maka 17 Cl berada pada Golongan VIIA 4 LANGKAH Identifikasi Periode! Seperti biasa, lihat nomor kulitnya saja Periode 3 Unsur 17 Cl terletak pada Golongan VIIA dan Periode 3 Sekarang kalian buktikan dengan melihat Tabel Periodik Unsur. Benarkah unsur yang berada pada Golongan VIIA dan Periode 3 memiliki nomor arom 17 dan merupakan unsur klor (Cl)??? Tadi itu baru 2 aturan, sekarang kita beranjak pada aturan ke........ Jika konfigurasi elektron berakhir pada subkulit “d” maka golongan ditentukan dari jumlah elektron pada subkulit “s” dan “d” dan merupakan golongan transisi Kali ini yang akan kita ramalkan letak Golongan dan Periode adalah si 25 Mangan. Ok, nomor atom si dia adalah 25, soo...... Mn alias 1 LANGKAH konfigurasikan elektronnya! Dapatnya begini nanti... LANGKAH 2 kelompokkan berdasarkan kulitnya! Ayo..ayo!! Aturan AUFBAUnya pakai! Ambil semuanya Baiklah, kulit terakhir Mn memiliki 2 subkulit, yakni subkulit s dan subkulit d. Nah, kalau ada dua begini seperti biasa Golongan kita tentukan dari SELURUH ELEKTRON YANG ADA DI KULIT TERAKHIRNYA 3 LANGKAH Identifikasi Golongan! Mari kita jumlahkan saja seluruh elektron pada kulit terakhirnya 2+5=7 Golongan VII Karena berakhir di subkulit s dan subkulit d, maka golongannya pasti golongan transisi, yakni B. Dari contoh tersebut, maka 25 Mn berada pada Golongan VIIB 4 LANGKAH Identifikasi Periode! Coba lihat nomor kulitnya saja. 25Mn memiliki dua angka yang berbeda, yakni 4 dan 3. Nah, untuk menentukan periodenya ambil saja angka terbesarnya atau angka yang paling depan, yaitu 4 Periode 4 Unsur 25 Mn Abaikan saja! terletak pada Golongan VIIB dan Periode 4 Buktikan sendiri dengan melihat Tabel Periodik Unsur! Kita sudah babat habis 3 aturan, sekarang kita menuju aturan ke... Jika konfigurasi elektron berakhir pada subkulit “d” dan penjumlahan pada subkulit “s” dan “d” melebihi 10, maka golongan ditentukan dari jumlah elektron pada subkulit “s” dan merupakan golongan transisi Cu Contoh kali ini adalah 29 alias Cuprum atau lebih kita kenal dengan Tembaga. Nomor atomnya 29, begini jadinya.... 1 LANGKAH konfigurasikan elektronnya! Dapatnya begini kan? Tapi konfigurasi tersebut belum stabil. Bisa kalian lihat, subkulit d hanya ada 9 elektron. Dia akan stabil jika terdapat 10 elektron atau 5 elektron. Disini kita gunakan aturan setengah penuh. Maka, konfigurasi elektronnya menjadi seperti ini: LANGKAH 2 kelompokkan berdasarkan kulitnya! Pakai Aturan AUFBAUnya! Ambil segini Baiklah, kulit terakhir Cu juga memiliki 2 subkulit, yakni subkulit s dan subkulit d. Seperti biasa, kalau ada dua begini Golongan kita tentukan dari SELURUH ELEKTRON YANG ADA DI KULIT TERAKHIRNYA 3 LANGKAH Identifikasi Golongan! Mari kita jumlahkan saja seluruh elektron pada kulit terakhirnya 1 + 10 = 11 Perlu kalian ketahui, Golongan tidak ada yang 11. Jika terjadi penjumlahan yang lebih dari 10, maka Golongan kita tentukan hanya dari subkulit snya saja. Jadi kita dapat Golongan 1. Karena berakhir di subkulit s dan subkulit d, maka golongannya pasti golongan transisi, yakni B. Dari contoh tersebut, maka 29 Golongan IB Cu berada pada 4 LANGKAH Identifikasi Periode! Periodenya kita ambil saja angka terbesar dari kulit terakhir itu atau angka yang paling depan. Ada 4 dan 3, maka kita ambil yang 4 Periode 4 Unsur 29 Cu Abaikan yang ini terletak pada Golongan IB dan Periode 4 Betul tidak? Buktikanlah! Tinggal 1 aturan lagi nih... Jika konfigurasi elektron berakhir pada subkulit “d” dan jumlahnya 8 atau 9 atau 10, maka termasuk golongan VIIIB Ni Langsung saja kita ramalkan nasib 28 alias Nikel yakni logam yang kuat, tahan panas, dan tahan karat, mungkin kalian akrab jika dikatakan bahwa nikel ini sering digunakan untuk campuran produk-produk stainless steel. Dapat kalian lihat nomor atom Nikel adalah 28, jadi beginilah pada akhirnya.... 1 LANGKAH konfigurasikan elektronnya! Ayo coba konfigurasikan dulu oleh kalian masing-masing. Cocok tidak dengan yang satu ini? Langsung menuju aturan 2, masing ingatkah kalian? LANGKAH 2 kelompokkan berdasarkan kulitnya! Aturan AUFBAU Ambil segini Baiklah, kulit terakhir Ni juga memiliki 2 subkulit, yakni subkulit s dan subkulit d. Seperti biasa, kalau ada dua begini Golongan kita tentukan dari SELURUH ELEKTRON YANG ADA DI KULIT TERAKHIRNYA 3 LANGKAH Identifikasi Golongan! Mari kita jumlahkan saja seluruh elektron pada kulit terakhirnya 2 + 8 = 10 Maka terjadilah penjumlahan yang sama dengan 10, dengan demikian Golongan kita tembak langsung saja, yakni VIII. subkulit s dan subkulit d, maka golongannya pasti golongan transisi, yakni B. Dari contoh tersebut, maka 28 Golongan VIIIB Ni berada pada 4 LANGKAH Identifikasi Periode! Seperti biasa, untuk menentukan periode kita ambil saja angka terbesar dari kulit terakhir itu atau angka yang paling depan. Ada 4 dan 3, maka kita ambil yang 4 Periode 4 Abaikan yang ini Unsur 28 Ni terletak pada Golongan VIIIB dan Periode 4 Bagaimana? Sudah pahamkah kalian mengenai ramal-meramal Golongan dan Periode unsur-unsur ini?? Cobalah kalian adakan challenge dengan teman-teman yang lain untuk meramalkan golongan dan periode unsur-unsur yang berbeda. Sebenarnya, dari kelima aturan yang sudah dijelaskan sebelumnya, unsurunsur memiliki blok-blok tempat tinggalnya masing-masing. Jika kalian sadar, unsur-unsur Golongan IA dan IIA merupakan penghuni blok s, unsurunsur Golongan IIIA hingga VIIIA (kecuali Helium) merupakan penghuni blok p, seluruh unsur Golongan transisi, yakni IB hingga VIII B merupakan penghuni blok d, sedangkan unsur-unsur yang termasuk yang tidak kita bahas kali ini. Sepertinya pembahasan kita sudah beres. Jika kalian kurang puas bertanyalah pada orang yang tepat, atau kalian cari sumber bacaan yang lainnya. INGAT, ilmu tidak diambil hanya dari satu sumber saja! Daftar Pustaka Criddle, C. dan Gonick, L. (2011). Kartun Kimia. Jakarta: KPG (Kepustakaan Populer Gramedia). Sudarmo, U. (2013). Kimia untuk SMA/MA Kelas X. Surakarta: Erlangga. Whitten, K. W., R. E. Davis, L. Peck, G. G. Stanley. (2004). General Chemistry Seventh Edition. Stamford: Thomson Brooks/Cole. Dan artikel serta sumber gambar lainnya dari internet