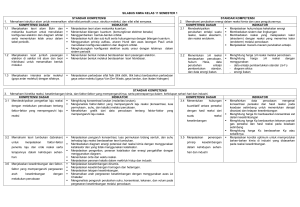
LEMBAR KEGIATAN SISWA (LKS) : 1. ……………………………….. Anggota 2. ………………………………... 3. ………………………………… 4. ………………………………… 5. ………………………………… Kelas : Konsentrasi Vs Kesetimbangan Tujuan Menentukan pengaruh konsentrasi terhadap reaksi kesetimbangan kimia Dasar Teori Pengaruh konsentrasi terhadap kesetimbangan akan kita pelajari dengan mengamati reaksi kesetimbangan antara ion besi (III) (Fe3+) dengan ion tiosianat (SCN-). Fe3+ (aq) + kuning SCN- (aq) tidak berwarna [FeSCN]2+ (aq) merah darah Dari persamaan reaksi kesetimbangan di atas, pembentukan [FeSCN]2+ ditandai dengan munculnya warna merah darah. Perubahan intensitas warna terkait dengan konsentrasi menunjukkan arah pergeseran kesetimbangan. Semakin merah warna larutan, berarti konsentrasi Fe3+ dan SCNsemakin besar (bertambah), sehingga kesetimbangan bergeser ke kanan/arah produk dan sebaliknya. Larutan NaOH yang ditambahkan ke dalam campuran Fe3+ dan SCN- akan mengikat ion Fe3+. Larutan NaOH mengandung ion Na+ dan ion OH-, dimana ion OH- akan mengikat ion Fe3+ membentuk endapan Fe(OH)3, akibatnya Fe3+ yang bereaksi dengan SCN- berkurang, sehingga kesetimbangan bergeser ke kiri/ ke pereaksi Alat dan Bahan Alat gelas kimia 50 mL 1 buah tabung reaksi 4 buah pipet tetes 3 buah gelas ukur 25 mL 1 buah rak tabung reaksi 1 buah batang pengaduk 1 buah Bahan FeCl3 0,1 M KSCN 0,1 M NaOH 0,1 M Akuades Cara Kerja 1. Tuangkan 20 mL air suling ke dalam gelas kimia 50 mL, lalu tambahkan 3 tetes larutan KSCN 0,1 M dan 3 tetes larutan FeCl3 0,1 M. Aduk larutan hingga homogen 2. Bagi larutan ke dalam 4 tabung reaksi dengan volume sama banyak. Tabung kesatu digunakan sebagai pembanding warna tabung 2, 3 dan 4. Catat warna keempat tabung reaksi tersebut 3. Tambahkan 2 tetes larutan KSCN 0,1 M ke dalam tabung kedua. Goyang secara perlahan tabung tersebut dan bandingkan warnanya dengan warna pembanding (tabung 1) 4. Tambahkan 2 tetes larutan FeCl3 0,1M ke dalam tabung ketiga. Goyang secara perlahan tabung tersebut dan bandingkan warnanya dengan warna pembanding (tabung 1) 5. Tambahkan 2 tetes larutan NaOH 0,1M ke dalam tabung keempat. Goyang secara perlahan tabung tersebut dan bandingkan warnanya dengan pembanding (tabung 1) Tabel Pengamatan Warna sebelum Nomor tabung Perlakuan perlakuan (mulamula) 1 2 3 4 Warna setelah perlakuan (diberi penambahan zat) Warna Pergeseran Arti dibandingkan kesetimbangan Perla tabung kesatu (ke kanan, ke kuan (lebih tua, sama, kiri atau tidak atau lebih muda) bergeser) Pertanyaan 1. Dalam sistem kesetimbangan pada percobaan ini, terdapat tiga komponen yaitu Fe 3+, SCN-, dan [FeSCN]2+. Berdasarkan hasil percobaan, apa yang terjadi dalam sistem kesetimbangan jika : a. Konsentrasi SCN- diperbesar? ______________________________________________________________________ b. Konsentrasi Fe3+ diperbesar? ______________________________________________________________________ c. Konsentrasi ion Fe3+ diperkecil? ______________________________________________________________________ 2. Ke arah manakah kesetimbangan bergeser jika konsentrasi salah satu komponen diperbesar? __________________________________________________________________________ 3. Ke arah manakah kesetimbangan bergeser jika konsentrasi salah satu komponen diperkecil? __________________________________________________________________________ Kesimpulan Suhu Vs Kesetimbangan Tujuan Menentukan pengaruh suhu terhadap reaksi kesetimbangan kimia melalui pengamatan demonstrasi. Dasar Teori Pengaruh suhu terhadap kesetimbangan akan kita pelajari dengan mengamati reaksi kesetimbangan antara N2O4 dan NO2. Persamaan reaksi kesetimbangan tersebut adalah sebagai berikut: N2O4 (g) H = +58,1 K NO2 (g) coklat muda coklat tua Pada keadaan setimbang, campuran kedua gas menghasilkan warna coklat. Pada reaksi tersebut, pembentukan NO2 ditandai dengan perubahan warna yaitu warna coklat menjadi semakin coklat tua. Adapun pembentukan N2O4 ditandai dengan perubahan warna yaitu warna coklat menjadi semakin coklat muda. Reaksi ke kanan (pembentukan NO2) merupakan reaksi endoterm karena menyerap panas sehingga H berharga positif. Sedangkan reaksi ke kiri (pembentukan N2O4) merupakan reaksi eksoterm karena melepaskan panas sehingga H berharga negatif. Perhatikan demonstrasi tentang kesetimbangan N2O4 dan NO2 ! Isilah tabel pengamatan berikut ! Tabel Pengamatan Warna No Sebelum Tabung Perlakuan (mula-mula) 1 2 3 Warna setelah Perlakuan perlakuan Gas yang Pergeseran (dipanaskan/ (setelah diduga kesetimbangan (ke didinginkan) dipanaskan/ terbentuk endoterm/eksoterm) didinginkan) Pertanyaan 1. Berdasarkan tabel pengamatan, apa yang terjadi dalam sistem kesetimbangan jika: a. Suhu dinaikkan (dipanaskan) _____________________________________________________________________ b. Suhu diturunkan (didinginkan) _____________________________________________________________________ 2. Ke manakah kesetimbangan bergeser jika suhu dinaikkan? ________________________________________________________________________ 3. Ke manakah kesetimbangan bergeser jika suhu didinginkan? ________________________________________________________________________ Kesimpulan PENGARUH PERUBAHAN TEKANAN DAN VOLUME TERHADAP PERGESERAN KESETIMBANGAN KIMIA a. Perhatikan gambar yang terdapat pada LKS b. Diskusikan setiap pertanyaan dengan teman sekelompokmu Molekul CH4 Molekul H2O Molekul H2 Molekul CO Kesetimbangan mula-mula Keadaan setelah tekanan diperbesar tetapi belum mencapai kesetimbangan Kesetimbangan baru setelah tekanan diperbesar Pertanyaan : 1. Gambar di atas menggambarkan reaksi kesetimbangan antara gas karbon monoksida dengan gas hidrogen menghasilkan gas metana dan uap air. Tuliskan persamaan reaksi dari sistem kesetimbangan tersebut! Jawab………………………………………………………………………………………………… …………………………………………………………………………….. 2. Bagaimana komposisi molekul-molekul gas pada kesetimbangan mula-mula? Jawab………………………………………………………………………………………………… …………………………………………………………………………….. 3. Setelah tekanan pada sistem kesetimbangan diperbesar maka sistem membentuk sistem kesetimbangan yang baru. Jelaskan perubahan yang terjadi setelah terbentuk kesetimbangan baru ditinjau dari komposisi molekul-molekul gasnya! Jawab………………………………………………………………………………………………… …………………………………………………………………………….. 4. Setelah tekanan diperbesar terjadi perubahan komposisi molekul-molekul gas pada sistem kesetimbangan yang baru. Hal ini menunjukan sistem mengalami pergeseran, bagaimana arah pergeseran kesetimbangan apabila tekanan diperbesar? Jawab………………………………………………………………………………………………… …………………………………………………………………………….. 5. Jelaskan bagaimana pengaruh tekanan terhadap pergeseran kesetimbangan kimia! Jawab………………………………………………………………………………….. ………………………………………………………………………………………… 6. Bagaimana hubungan antara tekanan dengan volume pada suhu tetap? Jawab………………………………………………………………………………………………… ………………………………………………………………..…………… 7. Jelaskan pengaruh perubahan volume terhadap pergeseran kesetimbangan kimia! Jawab……………………………………………………………………………………………….. ……………………………………………………………………………… 8. Pada suatu sistem kesetimbangan mempunyai komposisi molekul-molekul gas, jumlah molekul yang berada di ruas kiri sama dengan jumlah molekul yang berada di ruas kanan. Jelaskan pengaruh perubahan tekanan dan volume terhadap sistem kesetimbangan tersebut! Jawab……………………………………………………………………………………………….. ……………………………………………………………………………… Kesimpulan :