Efek Fotovoltaik Pada Sel Fotoelekttrokimia
advertisement

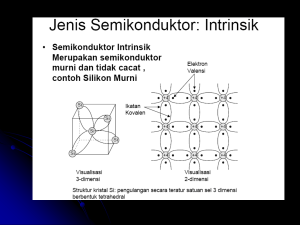
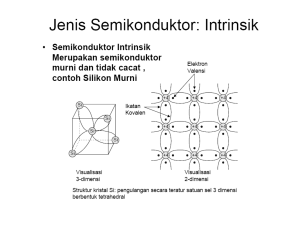
2 aplikasi sel surya. Perumusan Masalah Apakah sel fotoelektrokimia berbasis fotoelektroda timah sulfida dan elektrolit polimer padat kitosan/PEG/KI+I2 dapat menghasilkan efek fotovoltaik? Hipotesis Sistem sel fotoelektrokimia berbasis fotoelektroda timah sulfida dan elektrolit polimer padat kitosan/PEG/KI+I2 dapat menghasilkan efek fotovoltaik yaitu mengonversi energi cahaya menjadi energi listrik secara langsung. TINJAUAN PUSTAKA Semikonduktor Bahan zat padat diklasifikasikan menjadi isolator, semikonduktor, dan konduktor. Pada isolator, semikonduktor, dan konduktor terdapat pita energi yang memperbolehkan keberadaan elektron, yaitu pita valensi berenergi rendah yang terisi penuh dan pita konduksi berenergi tinggi yang kosong. Celah energi atau yang disebut juga band gap (Eg) merupakan pita energi yang memisahkan pita valensi dan pita konduksi pada suatu bahan. Besarnya celah energi dapat menentukan sifat suatu bahan. Elektron yang terdapat pada pita valensi dapat loncat menuju pita konduksi dengan menyerap sejumlah energi yang melebihi celah energi.12 Bahan isolator, semikonduktor, dan konduktor memiliki pita energi dengan celah energi yang berbeda. Pada bahan isolator terdapat celah energi yang besar antara pita valensi dan pita konduksi sehingga dibutuhkan energi yang besar untuk menaikkan elektron dari pita valensi ke tingkat yang lebih tinggi. Hal ini mengakibatkan bahan isolator memiliki konduktivitas yang rendah. Pada bahan konduktor, pita energinya tumpang-tindih sehingga elektron pada pita valensi dengan mudah naik ke tingkat energi yang lebih tinggi. Dengan demikian, bahan konduktor memiliki konduktivitas yang tinggi.12 Pada bahan semikonduktor, celah energinya relatif kecil. Celah energi yang kecil ini memungkinkan sebuah elektron memasuki tingkat energi yang lebih tinggi. Perpindahan elektron ini dapat terjadi karena pengaruh suhu, penyinaran dan pemberian tegangan. Ketika bersuhu rendah (T = 0 K), bahan semikonduktor akan berperilaku seperti bahan isolator. Ketika bersuhu tinggi, elektron pada pita valensi akan memperoleh energi kinetik yang memudahkan elektron melompat ke pita konduksi sehingga pada pita konduksi terdapat elektron yang dapat bergerak bebas dan berpartisipasi dalam konduksi listrik. Dengan demikian, bahan semikonduktor memiliki konduktivitas yang cukup tinggi. Konduktivitas listrik bahan semikonduktor berada diantara bahan konduktor dan isolator. Resistivitas semikonduktor berkisar antara 10-6 -104 Ωm.13 Ketika semikonduktor diiradiasi dengan cahaya yang energinya lebih besar dari celah energi semikonduktor (hv ≥ Eg), elektron dari pita valensi dapat tereksitasi ke pita konduksi. Elektron yang melompat dari pita valensi ke pita konduksi menjadi pembawa muatan negatif, sedangkan lubang (hole) pada pita valensi merupakan pembawa muatan positif. Pada umumnya, pembuatan semikonduktor murni dicampurkan dengan bahan lain. Bahan ini disebut sebagai bahan pengotor atau dopant. Semikonduktor yang tidak diberi dopant disebut semikonduktor intrinsik, sedangkan yang diberi dopant disebut semikonduktor ekstrinsik. Semikonduktor ekstrinsik terdiri dari dua tipe, yaitu tipe-n dan tipe-p. Semikonduktor tipe-n memiliki elektron sebagai pembawa muatan mayoritas. Semikonduktor tipe ini memiliki kelebihan elektron (atom donor). Hal ini mengakibatkan kelebihan elektron di dalam kristal sehingga semikonduktor menjadi bermuatan negatif. 2 3 Semikonduktor tipe-p memiliki hole sebagai pembawa muatan mayoritas. Semikonduktor tipe ini atom pengotornya kekurangan elektron (atom akseptor). Hal ini menyebabkan kekosongan di dalam kristal sehingga semikonduktor menjadi bermuatan positif.14 Gambar 1 menunjukkan semikonduktor intrinsik dan ekstrinsik (tipe-p dan tipe-n) untuk silikon, dimana boron sebagai semikonduktor tipe-p dan fosfor sebagai semikonduktor tipe-n. Atom Tambahan (Boron) Hole Tambahan Atom Tambahan (Fosfor) Elektron Tambahan Gambar 1. Semikonduktor silikon intrinsik dan ekstrinsik (tipe-p dan tipe-n).15 Semikonduktor Timah Sulfida Timah sulfida adalah senyawa kimia dari timah (Sn) dan sulfida (S) dengan rumus kimia SnS. Senyawa yang terdiri atas timah dan sulfida memiliki fase yang bervariasi diantaranya SnS, SnS2, Sn2S3, dan Sn2S4.9 SnS (timah (II) sulfida) terdapat di alam sebagai mineral herzenbergite dan SnS2 (timah (IV) sulfida) terdapat di alam sebagai mineral berndtite. SnS dan SnS2 dapat dibuat dengan mereaksikan timah dengan sulfida, timah (II) klorida dengan hidrogen sulfida atau timah (IV) klorida dengan hidrogen sulfida. SnS berwarna coklat tua, bersifat tidak larut dalam air, tetapi larut dalam asam klorida pekat.16 SnS memiliki struktur kristal kubik dan ortorombik.6, 9 Sedangkan SnS2 memiliki struktur kristal heksagonal.17 Senyawa timah sulfida memiliki sifat optik dan listrik yang cocok untuk aplikasi sel surya selain untuk piranti optoelektronik lainnya. Timah sulfida memiliki koefisien absorpsi yang tinggi sehingga sebagian besar cahaya dapat diabsorpsi dalam bentuk film.8 SnS merupakan semikonduktor tipep yang berfungsi sebagai material penyerap cahaya dalam aplikasi fotovoltaik.8 Struktur pita energi dari SnS ideal ketika digabung dengan material konduktif-bermuatan yang memiliki lebar celah pita ~2.4 eV dalam susunan heterojunction. Celah energi SnS berada pada rentang 1.3-1.83 eV. Pada rentang celah energi ini SnS menghasilkan efisiensi (konversi) maksimum. Celah energi untuk transisi langsung dan tidak langsung dapat berbeda tergantung pada kondisi sintesis dan lamanya deposisi.6 Celah energi SnS2 berada pada rentang 2.05-2.4 eV.7 SnS2 dapat digunakan sebagai semikonduktor pada sistem fotoelektrokimia.18 Film SnS dapat dibuat dengan melarutkan thin dichloride dihidrat dan thioacetamide dengan agen kompleks seperti trisodium citrate (TSC), triethanolamine (TEA), dan ammonium hidroksida di dalam etilen glikol dan aquades yang dipanaskan pada suhu antara 60-80oC. Reaksi kimia dari film SnS dengan menggunakan kompleks TEA adalah sebagai berikut: [Sn(TEA)]2+ + CH3CSNH2 + 2OH- → SnS + TEA + CH3CONH2 + H2O (1) Selama deposisi, ion Sn2+ membentuk ikatan dengan ligand-TEA untuk membentuk [Sn]TEA. Ligand-TEA berperan untuk mencegah munculnya bentuk yang tidak diinginkan material seperti [Sn(OH)2] yang timbul akibat terjadinya presipitasi pada kompleks, selanjutnya kompleks dipecah untuk membuat ikatan dengan ion S- dan komponen lain pembentuk SnS. Peran TSC yakni sebagai agen kompleks sama halnya dengan TEA. Persamaan yang serupa dapat ditulis dengan mengganti TEA dengan TSC.6 3 4 Sistem Sel Fotoelektrokimia Potensial elektrokimia Sel fotoelektrokimia merupakan sistem sel surya yang didasarkan pada persambungan antara semikonduktor dan elektrolit. Sel fotoelektrokimia terdiri atas elektroda kerja (working electrode), elektroda lawan (counter dan elektroda yang electrode), mengandung kopel redoks (elektrolit cair atau padat). Elektroda kerja dapat berupa bahan semikonduktor sehingga disebut juga elektroda semikonduktor. Elektroda semikonduktor dapat berbentuk lapisan tipis yang dideposisikan pada substrat kaca ITO.19 Elektroda semikonduktor seperti SnS berperan sebagai fotoelektroda atau fotoanoda yang berfungsi menyerap energi foton sedangkan elektroda lawan (counter electrode) seperti ITO berperan sebagai katoda. Baik elektroda semikonduktor maupun elektroda lawan dicelupkan ke dalam larutan elektrolit yang mengandung kopel redoks. Larutan yang digunakan mengandung kompleks redoks seperti sulfida, selenida, iodida, tellurida, dan sebagainya.19 Selanjutnya, kedua elektroda tersebut dihubungkan dengan rangkaian luar seperti yang ditunjukkan oleh Gambar 2. Pada semikonduktor, potensial elektrokimia elektron (Eredoks) ditunjukkan oleh level Fermi. Perubahan potensial elektrokimia berhubungan dengan perubahan dalam posisi level Fermi yang bergantung pada energi referensi yaitu energi elektron pada keadaan vakum. Sedangkan untuk elektrolit yang mengandung kopel redoks, potensial elektrokimia (Eredoks) dari suatu elektron ditentukan oleh potensial redoks.20 e- R Potensial elektrokimia dari sistem redoks ini biasanya mengacu pada normal hydrogen elektrode (NHE) sebagai referensi. Proses yang terjadi pada sel fotoelektrokimia secara kuantitatif adalah level Fermi dari semikonduktor dan elektrolit ditempatkan pada skala energi. Penggunaan skala energi absolut, energi dari kopel redoks (EF, redoks) diberikan oleh Persamaan (2) : EF, redoks = Eref - Eredoks (2) dimana Eredoks merupakan potensial redoks terhadap NHE dan Eref merupakan energi elektroda referensi terhadap level vakum. Nilai dari Eref untuk NHE20 biasanya adalah -4,5 eV sehingga Persamaan (2) dapat ditulis sebagai berikut : EF, redoks = -4,5 eV - Eredoks Mekanisme Konversi Fotoelektrokimia Larutan elektrolit cahaya Elektroda semikonduktor Elektroda counter Gambar 2. Sel fotoelektrokimia.20 (3) Energi Sel Konversi energi sel fotoelektrokimia memanfaatkan efek fotovoltaik yang dihasilkan dari persambungan semikonduktor-elektrolit. Persambungan semikonduktor-elektrolit identik dengan persambungan semikonduktor-logam (dioda Schottky)19 seperti yang diperlihatkan pada Gambar 3. Ketika persambungan semikonduktor tipe-n - elektrolit disinari cahaya, foton yang mempunyai energi lebih besar dari celah pita diserap sehingga elektron terlepas dari pita valensi dan bergerak menuju pita konduksi. Elektron 4 5 tereksitasi tersebut bergerak ke bagian dalam semikonduktor akibat adanya gaya tolak dari ruang muatan negatif di antarmuka elektrolit dan persambungan. Kemudian elektron meninggalkan semikonduktor melalui kontak ohmik (rangkaian luar). Elektron tersebut diinjeksikan pada elektroda lawan untuk menghasilkan reaksi reduksi, dimana akseptor A direduksi menjadi donor Ayang kemudian bergerak menuju elektroda semikonduktor untuk mendonasikan elektron melalui reaksi oksidasi kepada hole di permukaan persambungan. Pada saat yang sama, pada pita valensi terbentuk hole yang berdifusi ke daerah deplesi untuk selanjutnya berekombinasi dengan elektron yang didonasikan oleh ion donor dari elektrolit. Karena elektron dan hole bergerak dalam arah yang belawanan, arus yang kontinyu akan mengalir selama sel disinari dan terhubung dengan rangkaian luar.20 Gambar 3. Persambungan semikonduktor – logam.21 Jenis spesies redoks yang digunakan tergantung dari tipe semikonduktor dan posisi pita energi. Untuk semikonduktor tipe-n, pembawa minoritas diinjeksikan untuk menghasikan reaksi oksidasi sedangkan pada semikonduktor tipe-p pembawa minoritas diinjeksikan untuk menghasilkan reaksi reduksi. Oksidasi untuk semikonduktor tipe-n akan terjadi dari hole pada pita valensi jika level fermi dari elektrolit berada di atas level pita valensi sedangkan reduksi untuk semikonduktor tipe-p akan terjadi dari elektron-elektron pada pita konduksi jika level fermi elektrolit berada di bawah level pita konduksi.20 Ketika terjadi kontak antara semikonduktor tipe-p dengan elektrolit, maka terjadi pertukaran elektron dengan cepat antara jenis redoks dan elektroda yang disebabkan oleh perbedaan potensial elektrokimia yang ditunjukkan oleh level fermi. Level fermi awal dalam semikonduktor lebih rendah dari level fermi awal elektrolit sehingga akan terjadi pertukaran elektron dari elektrolit ke semikonduktor. Proses ini berhenti ketika level fermi keduanya sama yakni ketika mencapai kesetimbangan. Pada saat kesetimbangan tersebut dihasilkan daerah lapisan muatan negatif pada semikonduktor yang disebut juga daerah deplesi (karena daerah dideplesi oleh pembawa muatan mayoritas). Daerah deplesi dalam semikonduktor tipe-p dibentuk dengan menurunnya pita valensi dan konduksi untuk menghasilkan potensial penghalang yang melawan pertukaran hole ke dalam elektrolit. Daerah bermuatan tersebut disebut daerah Helmholtz yang juga terdapat dalam elektrolit yang berdampingan dengan elektroda padat antarmuka dan berperan dalam pembelokan pita pada semikonduktor saat keadaan setimbang dengan elektrolit. Keadaan sebelum dan setelah kontak pada persambungan semikonduktor tipe-p - elektrolit dapat dilihat pada Gambar 4 dan Gambar 5.20 Gambar 4. Persambungan semikonduktor tipe-p - elektrolit sebelum terjadi kontak. 5 6 Sel Fotoelektrokimia Berbasis Timah Sulfida dan Kitosan/PEG/KI+I2 Gambar 5. Persambungan semikonduktor tipe-p - elektrolit setelah terjadi kontak. Fotogenerasi menyebabkan level fermi pada semikonduktor kembali pada posisi asalnya sebelum persambungan semikonduktor-elektrolit terbentuk. Elektron dan hole bergerak dalam arah yang berlawanan. Pada saat rangkaian terbuka, antara elektroda semikonduktor yang disinari dan elektroda lawan dihasilkanlah fotovoltase sehingga timbul arus. Fotovoltase yang dihasilkan diantara kedua elektroda sama dengan perbedaan antara level fermi pada semikonduktor dan potensial redoks pada elektrolit. Pada kondisi rangkaian tertutup, level fermi dalam sistem sama dan tidak ada fotovoltase yang muncul diantara kedua elektroda.20 Model sel fotoelektrokimia persambungan semikonduktor tipe-p - elektrolit pada keadaan disinari ditunjukkan oleh Gambar 6. Gambar 6. Model sel fotoelektrokimia persambungan semikonduktor tipe-p elektrolit pada keadaan disinari.19 Sel fotoelektrokimia berbasis fotoelektroda timah sulfida dan elektrolit polimer padat kitosan/PEG/KI+I2 adalah sel fotovoltaik yang memanfaatkan fenomena fotoelektrokimia. Sel fotoelektrokimia ini terdiri dari lapisan timah sulfida (SnS) sebagai semikonduktor tipe-p yang dibentuk pada substrat kaca ITO yang bersifat sebagai penangkap atau penyerap cahaya sehingga dapat menghasilkan aliran elektron. Pada permukaan film SnS dilakukan penetesan gel elektrolit kitosan/PEG/KI+I2 yang selanjutnya ditutup dengan subtrat kaca ITO dan dikeringkan pada suhu kamar. Pengukuran tegangan dilakukan di bawah cahaya matahari menggunakan voltmeter. Voltmeter dipasangkan pada substrat ITO yang dilapisi SnS sebagai kontak di permukaan dan dan substrat kaca ITO tanpa lapisan SnS sebagai kontak di dasar. Prinsip dasar sel surya ini adalah foton yang datang diserap oleh elektroda semikonduktor sehingga membangkitkan elektron dan hole dalam senyawa semikonduktor tersebut. Konversi energi cahaya menjadi energi listrik pada sel fotoelektrokimia dihasilkan melalui pembangkitan elektron oleh cahaya dalam kisaran cahaya tampak. Penyerapan foton oleh atom atau molekul menghasilkan lompatan elektron dari keadaan dasar ke keadaan eksitasi yang memiliki tingkat energi yang lebih tinggi. Cahaya yang dibutuhkan untuk transisi tersebut harus memiliki energi foton yang lebih besar atau sama dengan selisih energi antara dua keadaan (hv ≥ Eg). Keadaan ini biasanya disebut sebagai celah energi (energy gap). Jika foton yang diserap memiliki energi lebih besar dari celah pita energi maka foton mampu membuat elektron berpindah dari pita valensi ke pita konduksi. Pemisahan pembawa muatan antara hole dan elektron menghasilkan arus faradaik melalui konduktor pada rangkaian luar. Arus 6 7 faradaik muncul akibat perubahan senyawa redoks dalam elektrolit. Efek langsung dari fotolektrokimia ialah perubahan potensial (rangkaian terbuka) atau perubahan arus (rangkaian tertutup) pada sistem elektroda sebagai hasil dari penyinaran.19 Elektrolit Polimer Padat Elektrolit berbasis polimer cocok untuk aplikasi dalam sistem elektrokimia karena memiliki sifat mekanis yang baik, dapat membentuk film, dan sebagai kontak yang baik dengan bahan elektroda. Secara umum, elektrolit polimer dapat diklasifikasikan menjadi tiga kategori yaitu elektrolit polimer kering padatan, elektrolit polimer komposit, dan elektrolit polimerplasticized.22 Elektrolit polimer padat dapat digunakan sebagai alternatif untuk menggantikan elektrolit cair. Elektrolit ini berbentuk padatan atau seperti gel. Elektrolit polimer padat dikenal sebagai bahan padat yang memiliki kemampuan untuk menghantarkan arus listrik dengan cara pergerakan ion dan memiliki fungsi yang sama seperti larutan elektrolit.23 Penambahan elektrolit padat dapat mencegah kebocoran larutan dan mengatasi permasalahan penyegelan pada sel fotoelektrokimia. Elektrolit polimer padat sering digunakan dalam pembuatan sel fotoelektrokimia padat. Elektrolit polimer pada dasarnya terdiri atas polimer dan garam yang secara bersama membentuk pasangan redoks. Contohnya PEO-KI-I2, kitosan-PEONH4I-I2, I2-PEONH4I, PVC-LiClO4, dan kitosan-PVA-KOH.23,24 Adapun ciri yang harus dimiliki oleh suatu polimer agar dapat berfungsi sebagai host dalam elektrolit polimer24 adalah: - Memiliki atom atau kumpulan atom yang cukup untuk mendonorkan elektron sehingga dapat membentuk ikatan koordinasi dengan kation. - Memiliki hambatan yang kecil terhadap pemutaran ikatan sehingga memungkinkan pergerakan ion pada ikatan polimer. Kitosan Kitosan merupakan bahan dasar polielektrolit yang mengandung gugus amina dan gugus hidroksil yang banyak digunakan sebagai bahan molekul transport aktif suatu anion dalam larutan. Kitosan memiliki sifat mudah terdegradasi, biocompatible, dan tidak beracun. Kitosan tidak larut dalam air, larutan alkali pada pH di atas 6,5 dan pelarut organik, tetapi dapat larut cepat dalam asam organik encer seperti asam asetat, asam format, asam sitrat, dan mineral lain kecuali sulfur. Kitosan dalam media asam juga dapat menjadi polielektrolit melalui protonasi gugus amina.25 Oleh karena sifat kristalin kitosan, bagian kristalin pada kitosan akan menghalangi masuknya molekul air ke dalam membran kitosan sehingga menghambat transport ion hidroksida di dalam membran. Hal ini didukung dengan adanya gugus polar dan non polar yang dikandungnya sehingga kitosan dapat digunakan sebagai pengental, pengikat, penstabil, pembentuk tekstur, dan pembentuk gel. Bila kitosan dilarutkan di dalam asam, maka kitosan akan menjadi polimer kationik dengan struktur linear sehingga dapat digunakan dalam proses flekulasi dan pembentukan film. Kelebihan polielektrolit kationik dibandingkan dengan koagulan lain adalah lebih sedikitnya jumlah flok yang dihasilkan karena polielektrolit tidak membentuk endapan. Flok yang terbentuk lebih kuat dan tidak membutuhkan pengaturan pH.25 Adanya gugus amina dan karboksil yang terikat mengakibatkan kitosan mempunyai reaktivitas kimia yang baik dan penyumbang sifat elektrolit kation sehingga dapat berperan sebagai amino exchange. Gambar 7 (halaman 8) menunjukkan struktur kitosan. 7 8 Lapisan yang dihasilkan dari deposisi dengan metode CBD relatif tebal. Deposisi akan berhenti ketika terjadi kesetimbangan antara lapisan pada substrat dan larutan.11 Gambar 9 memperlihatkan komponen alat dan bahan yang digunakan pada metode CBD. Gambar 7. Struktur kitosan.26 Polietilen Glikol (PEG) Polietilen glikol (PEG) termasuk dalam golongan alkohol dengan dua buah gugus-OH berulang yang merupakan bahan yang sesuai dengan sebagian besar pelarut organik serta dapat dilarutkan dalam air. PEG memiliki bentuk berupa padatan hingga cairan kental atau gel bergantung pada komposisi dan berat molekulnya. PEG tidak beracun, tidak menyebabkan iritasi pada kulit, dan tidak mudah menguap karena memiliki titik didih yang tinggi. PEG pada umumnya digunakan pada industri tekstil sebagai bahan pewarna, logam, obat-obatan, kosmetik, resin, salah satu bahan pembuat cat, dan berbagai aplikasi lain.27 Struktur kimia PEG ditunjukkan pada Gambar 8. Termometer Larutan Magnetic Stirrer Gambar 9. Komponen alat dan bahan yang digunakan pada metode CBD.11 BAHAN DAN METODE Waktu dan Tempat Penelitian Penelitian ini dilakukan pada bulan Oktober 2010 sampai Februari 2012. Bertempat di Laboratorium Biofisika Material Departemen Fisika IPB. Alat dan Bahan Gambar 8. Struktur polietilen glikol.27 Metode Chemical Bath Deposition (CBD) Chemical bath deposition (CBD) merupakan metode deposisi yang didasarkan pada proses reduksi kimia dimana elektron yang diperlukan dalam reaksi akan disediakan oleh senyawa yang berfungsi sebagai pereduksi dalam larutan. Film hasil deposisi akan menempel pada permukaan substrat yang dicelupkan dalam larutan. Hasil deposisi tersebut akan terus mengkatalisasi reaksi reduksi sehingga proses deposisi menjadi autokatalis. Peralatan yang digunakan adalah gelas ukur, gelas piala, neraca analitik, sudip, selotip, hot plate, pengaduk magnetik, furnace, multimeter digital, power supply, spectrophotometer UVVis GenesysTM 10 Series, X-Ray Diffractometer SHIMADZU, dan I-V meter KHETLEY 2400. Bahan-bahan yang digunakan adalah substrat kaca ITO, detergen, etanol, etilen glikol, aquades, thin dichloride dihidrat (SnCl2.2H2O), larutan ammonium hidroksida (NH4OH), thioacetamide (CH3CSNH2), trisodium citrate (C6H5Na3O7), triethanolamine (N[CH2CH2OH]3), kitosan padat, asam asetat (CH3COOH) 1%, larutan elektrolit KI+I2, dan PEG. 8 9 Tahapan Penelitian Karakterisasi XRD Pembuatan Film Timah Sulfida Karakterisasi XRD dilakukan untuk mengetahui struktur kristal yang terbentuk dan memastikan SnS telah tumbuh pada substrat. Spektra difraksi sinar-X memberikan informasi tentang fase kristal yang terbentuk dan tingkat kristalinitasnya. Jenis fase kristal sampel ditunjukkan oleh puncak difraksi pada sudut 2θ. Spektra dari hasil analisis difraksi sinar X dicocokan nilai 2θ pada data JCPDS sehingga akan diketahui fase kristal sampel. Mula-mula substrat kaca ITO dibersihkan dengan detergen dan dibilas dengan etanol. Perlakuan ini bertujuan untuk menghilangkan lemak yang menempel pada substrat. Potongan substrat berukuran 1,5x1 cm diletakkan secara vertikal dan dilekatkan pada sisi bagian dalam gelas ukur. Film timah sulfida (SnS) dideposisi dengan menggunakan metode CBD. Pembuatannya yaitu dengan mencampurkan 0.1 M thin dichloride dihidrat, 0.1 M thioacetamide, dan 0.1 M trisodium citrate ke dalam 15 ml etilen glikol yang diaduk menggunakan pengaduk magnetik dengan laju 500 rpm selama 5 menit pada suhu 30oC. Secara perlahan ditambahkan 1 ml triethanolamine, 5 ml ammonium hidroksida dan 15 ml aquades dengan tambahan waktu pengadukan 15 menit. Selanjutnya, larutan dimasukkan ke dalam wadah air dan diaduk dengan laju 550 rpm selama 1 jam pada suhu 80oC. Hasil deposisi berupa film SnS yang berwarna cokelat, lalu substrat dengan film SnS tersebut dibersihkan dari sisa larutan dengan aquades dan dikeringkan pada suhu kamar. Sampel film SnS yang dibuat diberikan kode sesuai dengan Tabel. Setelah itu dilakukan proses pemanasan (annealing) di dalam furnace selama 1 jam untuk sampel S2, S3, dan S4 masing-masing dengan annealing 100oC, 200oC, dan 300oC sedangkan sampel S1 tidak diberikan perlakuan annealing. Setelah proses annealing, terjadi perubahan warna pada ketiga sampel dari yang sebelumnya berwarna coklat terang menjadi lebih coklat. Tabel Kode Film SnS Kode Film S1 S2 S3 S4 Keterangan tanpa annealing annealing 100oC annealing 200oC annealing 300oC Karakterisasi Serapan Optik Karakterisasi serapan dilakukan untuk mengetahui besar serapan film tipis terhadap cahaya. Hasil karakterisasi ini dapat menentukan celah energi dari bahan semikonduktor. Analisis celah energi dilakukan secara manual dengan menggunakan kurva serapan (absorbansi) sehingga panjang gelombang absorpsi bahan yang disebut dengan absorption edge wavelength (λedge) dapat ditentukan. Dari data panjang gelombang pita absorpsi tersebut besar celah energi dapat dihitung dengan menggunakan persamaan berikut: Eg hc edge (4) Keterangan : Eg adalah celah energi (eV) dimana 1 eV = 1,6x10-19 J, h adalah konstanta Planck (6,63x 10-34 J.s), c adalah kecepatan cahaya di ruang hampa (3x108 m/s) dan edge adalah panjang gelombang tepi absorpsi (nm). Pembuatan Elektrolit Polimer Padat Elektrolit polimer padat yang digunakan merupakan campuran larutan kitosan, PEG dan larutan KI+I2. Larutan elektrolit polimer dibuat dengan melarutkan 0.25 g kitosan ke dalam 10 ml asam asetat 1% selanjutnya ke dalam larutan tersebut ditambahkan 0.25 gram PEG. Proses pelarutan dilakukan dengan menggunakan hotplate dan pengaduk magnetik dengan laju stirring 350 rpm pada suhu 60oC hingga menghasilkan 9