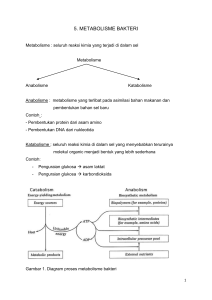
PRINSIP ENERGI METABOLISME
advertisement

PRINSIP ENERGI METABOLISME TUJUAN PEMBELAJARAN • MENGETAHUI PRINSIP REAKSI OKSIDASI PADA SIKLUS KREBS • MENGETAHUI SUMBER RESIDU ASETIL • MENGETAHUI LOKASI ENZIM PADA MITOKONDRIA • MENGETAHUI KOMPONEN RANTAI PERNAPASAN • MENGETAHUI PROSES PEMBENTUKAN ATP PADA RANTAI PERNAPASAN • MENGETAHUI TRANSFORMASI ATP MENJADI BENTUK ENERGI LAIN • MENGETAHUI PRINSIP INHIBISI DALAM PEMBENTUKAN ATP KASUS • SEJAK MUSIM PENGHUJAN, HAMPIR TIAP PAGI ADI MENGALAMI SESAK NAPAS. OLEH DOKTERNYA, ADI DIBERI OBAT STEROID UNTUK MERINGANKAN GEJALA SESAK NAPAS YANG DIDERITANYA. NAMUN SEJAK RUTIN MEMAKAN OBAT TERSEBUT, ADI MERASA TENAGANYA TIDAK SEKUAT DULU LAGI. MASALAH • BAGAIMANA PROSES PEMBENTUKAN ENERGI DI DALAM TUBUH? • APA HUBUNGAN OBAT STEROID DENGAN PENURUNAN ENERGI? • APA YANG HARUS DILAKUKAN OLEH ADI AGAR TIDAK MENGALAMI SERANGAN SESAK NAPAS NAMUN TIDAK HARUS MEMAKAN OBAT STEROID? MATERI • SIKLUS KREBS • SUMBER RESIDU ASETIL • MITOKONDRIA • SUMBER UTAMA EKUIVALEN PEREDUKSI • KOMPONEN RANTAI PERNAPASAN • ENERGETIKA • INHIBITOR SIKLUS KREBS • NAMA LAIN: • SIKLUS ASAM SITRAT • SIKLUS ASAM TRIKARBOKSILAT • DEFINISI: RANGKAIAN REAKSI OKSIDASI RESIDU ASETIL DALAM MITOKONDRIA ASETIL-KoA (C2) SIKLUS KREBS KoA OKSALO ASETAT (C4) CO2 SITRAT (C6) CO2 SUMBER RESIDU ASETIL • GLIKOGEN TRIGLISERIDA STEROID • GLUKOSA ASAM LEMAK PIRUVAT ASETIL-KoA LAKTAT ASAM AMINO GLUKOGENIK KOLESTEROL ASETO ASETIL-KoA BENDA KETON KREBS CYCLE ASAM AMINO KETOGENIK APA HUBUNGAN SIKLUS KREBS DENGAN PEMBENTUKAN ENERGI? OKSIDASI BIOLOGI SEJARAH • WARBURG : OKSIDASI ADALAH PENGGUNAAN OKSIGEN • WIELAND : REDUKSI ADALAH PELEPASAN HIDROGEN • LAVOISER : OKSIDASI → H20 + CO2 • PASTEUR : FERMENTASI GLUKOSA OLEH RAGI • KEILIN : SISTIM SITOKROM (OKSIDASI → REDUKSI) • 2 MEMBRAN MITOKONDRIA • LUAR : LICIN, PERMEABEL NON SELEKTIF • DALAM: KRISTA, PERMEABEL SELEKTIF • LOKASI ENZIM • • • • MEMBRAN LUAR RUANG ANTARA MEMBRAN MEMBRAN DALAM MATRIKS 1. • 2. RUANG ANTARA MEMBRAN • • • 3. ADENILAT SIKLASE NUKLEOSID DIFOSFOKINASE SULFID OKSIDASE MEMBRAN DALAM • • • 4. MITOKONDRIA SITOKROM b5 (REDUKTASE) MEMBRAN LUAR UBIQUINON SITOKROM b, c1, c, a, aa3 ATP-ASE MATRIKS • • • • FAKTOR OKSIDASI FOSFORILASI ENZIM SIKLUS ASAM SITRAT ENZIM OKSIDASI ASAM LEMAK ENZIM SINTESIS PROTEIN RANTAI PERNAPASAN • LOKASI : MITOKONDRIA ~ PUSAT ENERGI SEL • DEFINISI: RANGKAIAN REAKSI ENZIM & CARRIER → MENGANGKUT EKUIVALEN PEREDUKSI DARI SUBSTRAT KE MOLEKUL OKSIGEN SUMBER UTAMA EKUIVALEN PEREDUKSI MITOKONDRIA SIKLUS Β-OKSIDASI ASAM LEMAK KREBS RANTAI PERNAPASAN KH PIRUVAT NAD Deh. FAD Deh. SITOKROM SUMBER EKSTRA MITOKONDRIA O2 •PROLIN •GLUTAMAT KOMPONEN RANTAI PERNAPASAN •KOLIN •SUKSINAT •MALAT •PIRUVAT LIPOAT •ISOSITRAT NAD FMN α-KETOGLUTARAT GLISEROL 3-P FAD FAD ATP Q ATP Sit b c1 FAD •ASIL-KoA •SARKOSIN •DIMETIL GLISIN c ATP a aa3 O2 KOMPONEN RANTAI PERNAPASAN PEMBENTUKAN ENERGI: 1. KOENZIM NAD → 3 ATP 2. KOENZIM FAD 3. KOENZIM GDP → 1 ATP → 2 ATP BERAPA JUMLAH ATP YANG DIHASILKAN UNTUK SETIAP OKSIDASI 1 MOLEKUL ASETIL-KOA? ENERGETIKA KARBOHIDRAT LIPID PROTEIN ASETIL-KoA OKSALOASETAT SITRAT NADH + H+ NAD+ ISOSITRAT MALAT NAD+ SIKLUS KREBS NADH + H+ α-KETOGLUTARAT FUMARAT NAD+ FADH2 GTP GDP FAD SUKSINAT NADH + H+ SUKSINIL-KoA SETIAP 1 ASETIL-KOA JUMLAH IKATAN FOSFAT BERENERGI TINGGI: • OKSIDASI NADH PADA =9 RANTAI PERNAPASAN • OKSIDASI FADH2 PADA =2 RANTAI PERNAPASAN • OKSIDASI PADA =1 TINGKAT SUBSTRAT PRINSIP ENERGETIKA ATP REAKSI EKSERGONIK (PRODUKSI ENERGI) REAKSI ENDERGONIK (PEMAKAIAN ENERGI) ADP Pi Pi TRANSFORMASI ATP • KIMIA : SINTESIS SENYAWA • MEKANIK : KONTRAKSI OTOT • LISTRIK : KERJASYARAF • ELEKROTERMAL : POMPA ION • CAHAYA : CAHAYA PHOTON • SUHU : MENGATUR SUHU TUBUH APAKAH INI KARENA SAYA SUDAH MAKAN 2 TELUR??? 1. INHIBITOR PADA RANTAI PERNAPASAN LIPOAT NAD FMN Q (-) I Sit b c1 (-) II c a aa3 O2 (-) III FAD I. AMOBARBITAL, PIERICIDIN A, STEROID II. DIMERCAPROL, ANTIMYCIN A III. H2S, CN, CO ROTENON, INHIBITOR 2. PADA OKSIDASI FOSFORILASI • OLIGOMYCIN • ATRKTILOSIDA 3. “UNCOUPLER” OKSIDASI FOSFORILASI • 2,4 DINITROFENOL • PENTAKLOROFENOL • DINITROKREOSOL BERAPA JUMLAH ATP YANG DIHASILKAN UNTUK SETIAP OKSIDASI 1 MOLEKUL GLUKOSA? ENZIM • Enzim merupakan senyawa organik bermolekul besar yang berfungsi untuk mempercepat jalannya reaksi metabolisme di dalam tubuh tumbuhan tanpa mempengaruhi keseimbangan reaksi • Enzim tidak ikut bereaksi, struktur enzim tidak berubah baik sebelum dan sesudah reaksi tetap • Enzim sebagai biokatalisator • Bagian enzim yang aktif adalah sisi aktif dari enzim TATA NAMA ENZIM • Enzim diberi nama sesuai dengan nama substrat dan reaksi yang dikatalisis • Biasanya ditambah akhiran ase • Enzim dibagi ke dalam 7 golongan besar Klas Oksidoreduktase (nitrat reduktase) Transferase (Kinase) Hidrolase (protease, lipase, amilase) Tipe reaksi memisahkan dan menambahkan elektron atau hidrogen memindahkan gugus senyawa kimia Liase (fumarase) membentuk ikatan rangkap dengan melepaskan satu gugus kimia Isomerase (epimerase) Ligase/sintetase (tiokinase) Polimerase (tiokinase) mengkatalisir perubahan isomer memutuskan ikatan kimia dengan penambahan air menggabungkan dua molekul yang disertai dengan hidrolisis ATP menggabungkan monomer-monomer sehingga terbentuk polimer SUSUNAN ENZIM • Komponen utama enzim adalah protein • Protein yang sifatnya fungsional, bukan protein struktural • Tidak semua protein bertindak sebagai enzim Enzim protein sederhana Protein Enzim Enzim Konjugasi Protein + Bukan Protein Protein = apoenzim Organik = Koenzim Bukan protein = Gugus prostetik Anorganik = kofaktor CONTOH KOENZIM 1. NAD (koenzim 1) 2. NADP (koenzim 2) 3. FMN dan FAD 4. Cytokrom: cytokrom a, a3, b, b6, c, dan f 5. Plastoquinon, plastosianin, feredoksin 6. ATP: senyawa organik berenergi tinggi, mengandung 3 gugus P dan adenin ribose • Pengertian Enzim Enzim ialah senyawa protein yang disintesiskan di dalam sel secara biokimiawi. Enzim merupakan biokatalis yaitu senyawa yang diproduksi oleh organisme. Dalam mempelajari enzim kita pasti sering bertemu dengan yang namanya koenzim,holoenzim dan apoenzim. • Koenzim adalah molekul organik yang nonprotein diperlukan untuk bekerjanya enzim. Example:Vit,NAD,koenzim A. • Holoenzim adalah enzim lengkap yang terdiri dari enzim dan koenzim. • Apoenzim adalah bagian protein dari holoenzim. SIFAT ENZIM • Enzim dibentuk dalam protoplasma sel • Enzim beraktifitas di dalam sel tempat sintesisnya (disebut endoenzim) maupun di tempat yang lain diluar tempat sintesisnya (disebut eksoenzim) • Sebagian besar enzim bersifat endoenzim 1. Enzim bersifat koloid, luas permukaan besar, bersifat hidrofil 2. Dapat bereaksi dengan senyawa asam maupun basa, kation maupun anion 3. Enzim sangat peka terhadap faktor-faktor yang menyebabkan denaturasi protein misalnya suhu, pH dll 4. Enzim dapat dipacu maupun dihambat aktifitasnya 5. Enzim merupakan biokatalisator yang dalam jumlah sedikit memacu laju reaksi tanpa merubah keseimbangan reaksi 6. Enzim tidak ikut terlibat dalam reaksi, struktur enzim tetap baik sebelum maupun setelah reaksi berlangsung 7. Enzim bermolekul besar 8. Enzim bersifat khas/spesifik • Suhu: optimum 300C, minimum 0 0C, maksimum 400C • Logam, memacu aktifitas enzim: Mg, Mn, Co, Fe • Logam berat, menghambat aktivitas enzim: Pb, Cu, Zn, Cd, Ag • pH, tergantung pada jenis enzimnya (pepsin aktif kondisi masam, amilase kondisi netral, tripsin kondisi basa) • Konsentrasi substrat, substrat yang banyak mulamula memacu aktifitas enzim, tetapi kemudian menghambat karena: penumpukan produk (feed back effect) • Konsentrasi enzim, peningkatan konsentrasi enzim memacu aktifitasnya • Air, memacu aktifitas enzim • Vitamin, memacu aktifitas enzim Penghambatan aktifitas enzim ada dua tipe: 1. Kompetitif: zat penghambat mempunyai struktur yang mirip dengan substrat sehingga dapat bergabung dengan sisi aktif enzim. Terjadi kompetisi antara substrat dengan inhibitor untuk bergabung dengan sisi aktif enzim (misal feed back effect) 2. Non kompetitif: zat penghambat menyebabkan struktur enzim rusak sehingga sisi aktifnya tidak cocok lagi dengan substrat • Spesifik: hanya cocok untuk satu macam substrat saja atau sekelompok kecil substrat yang susunanya hampir sama dan fungsinya sama E5 A E1 B E2 E4 C E3 D