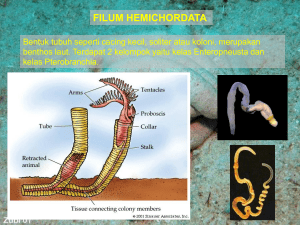
IDENTIFIKASI BAKTERI Escherichia coli DAN Shigella sp
advertisement

IDENTIFIKASI BAKTERI Escherichia coli DAN Shigella sp. TERHADAP JAJANAN CILOK PADA LINGKUNGAN SD NEGERI DI CIRENDEU, PISANGAN, DAN CEMPAKA PUTIH Laporan penelitian ini ditulis sebagai salah satu syarat untuk memperoleh gelar SARJANA KEDOKTERAN Oleh: Aris Rivaldi Wicaksono NIM : 1113103000017 PROGRAM STUDI PENDIDIKAN DOKTER FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN UIN SYARIF HIDAYATULLAH JAKARTA 1438H/2016M LEMBAR PERNYATAAN KEASLIAN KARYA Dengan ini saya menyatakan bahwa: 1. Laporan penelitian ini merupakan hasil karya asli saya yang diajukan untuk memenuhi salah satu persyaratan memperoleh gelar strata 1 di UIN Syarif Hidayatullah Jakarta. 2. Semua sumber yang saya gunakan dalam penulisan ini telah saya cantumkan sesuai dengan ketentuan yang berlaku di UIN Syarif Hidayatullah Jakarta. 3. Jika dikemudian hari terbukti bahwa karya ini bukan karya asli saya atau merupakan hasil jiplakan dari karya orang lain, maka saya bersedia menerima sanksi yang berlaku di UIN Syarif Hidayatullah Jakarta. Ciputat, 18 Oktober 2016 Materai 6000 Aris Rivaldi Wicaksono ii IDENTIFIKASI BAKTERI Escherichia coli DAN Shigella sp. PADA CILOK YANG DIJUAL DI LINGKUNGAN SD NEGERI DI KELURAHAN CIRENDEU, PISANGAN, DAN CEMPAKA PUTIH Laporan Penelitian Diajukan kepada Program Studi Kedokteran dan Profesi Dokter, Fakultas Kedokteran dan Ilmu Kesehatan untuk Memenuhi Persyaratan Memperoleh Gelar Sarjana Kedokteran (S.Ked) Oleh : Aris Rivaldi Wicaksono NIM. 1113103000017 Menyetujui, Dosen Pembimbing 1 Dosen Pembimbing 2 Yuliati, S.Si, M.Biomed 19690915 200801 2 022 dr. Achmad Lutfhi, Sp.B, KBD NIP. NIP. 19660420 199412 1 001 PROGRAM STUDI KEDOKTERAN DAN PROFESI DOKTER FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN UIN SYARIF HIDAYATULLAH JAKARTA 1438H/ 2016M iii LEMBAR PENGESAHAN Laporan Penelitian berjudul IDENTIFIKASI BAKTERI Escherichia coli DAN Shigella sp. PADA CILOK YANG DIJUAL DI LINGKUNGAN SD NEGERI DI KELURAHAN CIRENDEU, PISANGAN, DAN CEMPAKA PUTIH yang diajukan oleh Aris Rivaldi Wicaksono (NIM 1113103000017), telah diujikan dalam sidang di Fakultas Kedokteran dan Ilmu Kesehatan pada 18 Oktober 2016. Laporan penelitian ini telah diterima sebagai salah satu syarat memperoleh gelar Sarjana Kedokteran (S.Ked) pada Program Studi Kedokteran dan Profesi Dokter. Jakarta, 18 Oktober 2016 DEWAN PENGUJI Ketua Sidang Yuliati, S.Si, M.Biomed NIP. 19690915 200801 2 022 Pembimbing I Pembimbing II Yuliati, S.Si, M.Biomed NIP. 19690915 200801 2 022 dr. Achmad Lutfhi, Sp.B, KBD NIP. 19660420 199412 1 001 Penguji I Penguji II dr. Intan Keumala Dewi, Sp.MK NIDN. 2004107302 dr. Riva Auda, Sp.A, M.Kes NIP. 19761217 200801 2 015 PIMPINAN FAKULTAS Dekan FKIK UIN Kaprodi PSKPD Prof. Dr. H. Arif Sumantri, M.Kes NIP. 19650808 198803 1002 dr. Achmad Zaki, M.Epid, SpOT NIP. 19780507 200501 1 005 iv KATA PENGANTAR Bismillahirrahmanirrahiim Assalamu’alaikum Warahmatullahi Wabarakatuh Dengan mengucapkan puji dan syukur kehadirat Allah SWT yang telah memberikan rahmat dan karunia-Nya. Alhamdulillah saya dapat menyelesaikan penelitian dan penulisan skripsi ini. Shalawat serta salam selalu tercurahkan kepada junjungan besar Nabi Muhammad SAW serta kepada keluarga, para sahabat dan seluruh ummatnya sampai akhir zaman. Dalam pembuatan laporan penelitian ini, penulis merasakan kesulitan , kebingungan, kegundahan ketika prosesnya tidak sesuai dengan yang dibayangkan dan direncanakan. Namun dengan segala dukungan, doa dan bimbingan dari berbagai pihak, hambatan tersebut tidak menurunkan semangat saya untuk segera menyelesaikan laporan ini. Oleh sebab itu, pada kesempatan ini penulis mengucapkan terima kasih kepada seluruh pihak, diantaranya: 1. Prof. Dr. H. Arif Sumantri, M.Kes selaku Dekan Fakultas Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri Syarif Hidayatullah Jakarta. 2. dr. Achmad Zaki, M.Epid, Sp.OT , selaku Ketua Program Studi Kedokteran dan Profesi Dokter Fakultas Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri Syarif Hidayatullah Jakarta. 3. dr. Flori Ratna Sari, Ph.D, selaku Penanggung Jawab Riset untuk PSKPD angkatan 2013 4. Bu Yuliati, S.Si, M.Biomed dan dr. Achmad Luthfi, Sp.B, KBD selaku Dosen Pembimbing, yang telah memberi pengarahan dan bantuan dalam bentuk apapun kepada penulis hingga laporan penelitian ini dapat selesai dengan baik. Terima kasih atas waktu, tenaga dan pemikiran yang telah ibu dan dokter berikan untuk kelancaran penelitian saya. 5. Dr. Femmy Nurul Akbar, Sp.PD KGEH, selaku Pembimbing Akademik yang memberikan doa dan dukungannya kepada penulis. 6. Kedua orangtuaku tercinta, Sawiono dan Titik Nur Qomariyah yang selalu memberikan dukungan penuh atas apa yang saya jalani v 7. Seluruh keluarga Uyung, mas Hafiz dan dedek Uwais yang selalu memberikan semangat 8. Sahabat tercinta Saris, Fahmi, Bagus, Inul dan Yusuf yang selalu support di tiap waktu. 9. Zenitra Hizba R, Risna Wahyu AP, Zahrotu Romadon teman sekelompok riset saya, yang selalu saling support dan membantu satu sama lain, tanpa kalian aku tak berdaya. 10. Tak terlupakan teman-teman OREO CIMSA UIN 2015-2016 yang selalu dapat membuat hati merasa nano-nano di sela-sela kegiatan perkuliahan 11. Kak Novi, Mas Irul, Mas piyo, dan Bapak Satpam Pascasarjana yang membantu kelancaran saya melakukan penelitian di Laboratorium Mikrobiologi kapanpun waktunya. 12. Teman sejawat saya yang selama ini menempuh pendidikan preklinik bersama dan akan terus bersama sampai lulus nanti. Semoga kita selalu kompak dalam kebaikan dan kesuksesan “TREITZ PSKPD 2013” 13. Semua pihak yang tidak dapat disebutkan satu per satu yang telah memperlancar proses pengerjaan laporan penelitian ini Penelitian ini masih jauh dari kata sempurna, karena itu saya sangat mengharapkan kritik dan saran atas kurang dan kekeliruan dalam penelitian ini, agar penelitian ini dapat terus dilanjutkan dan bermanfaat untuk berbagai pihak. Demikian laporan penelitian ini saya tulis, semoga dapat memberikan manfaat bagi penulis khususnya dan para pembaca pada umumnya. Ciputat, 18 Oktober 2016 Aris Rivaldi vi ABSTRAK Aris Rivaldi Wicaksono. Program Studi Kedokteran dan Profesi Dokter. Identifikasi Bakteri Escherichia coli dan Shigella sp. pada Cilok yang Dijual di Lingkungan SD Negeri di Kelurahan Cirendeu, Pisangan, dan Cempaka putih. 2016. Latar Belakang: Angka Kejadian Luar Biasa (KLB) keracunan di Indonesia tahun 2015 sebanyak 61 kejadian, penyebab KLB keracunan di Sekolah Dasar (SD) umumnya disebabkan oleh kontaminasi bakteri patogen. Pada tahun 2014 sebanyak 23,82% Pangan Jajanan Anak Sekolah (PJAS) di Indonesia dinyatakan tidak memenuhi syarat oleh Bapan Pengawas Obat dan Makanan (BPOM). Cilok merupakan salah satu makanan jajanan yang sering ditemui di lingkungan SD, perlu diwaspadai kemungkian cilok dapat menyebabkan keracunan pangan oleh bakteri (foodborne disease). Tujuan penelitian ini untuk mengidentifikasi bakteri Escherichia coli dan Shigella sp. pada jajanan cilok pada SD Negeri di kelurahan Cirendeu, Pisangan, dan Cempaka Putih. Metode penelitian menggunakan desain deskriptif cross sectional. Hasil menunjukkan semua 5 sampel cilok (100%) yang diuji tidak melebihi ambang batas aman sebesar 1 x 105 CFU/gram dan teridentifikasi Escherichia coli dan Shigella sp. pada cilok yang diuji. Kesimpulan menunjukkan bahwa terdapat 1 sampel dari 5 sampel cilok mengandung Escherichia coli (20%) dan terdapat 3 sampel dari 5 sampel cilok mengandung Shigella sp. (60%). Kata kunci: Cilok, Escherichia coli, Shigella sp., Uji biokimia, pewarnaan Gram, foodborne disease vii ABSTRACT Aris Rivaldi Wicaksono. Medical Education Study Program. Bacterial Identification’s of Escherichia coli and Shigella sp. in Cilok Street Food in Elementary School Cirendeu, Pisangan, dan Cempaka Putih. 2016. Background :There are 61 poison outbreak incidence that recorded in Indonesia, cause of poison outbreak in primary school was contamination of bacterial pathogens. On 2014, there was 23,82% of street foods on primary school children in Indonesia cannot not fulfilled requirement by BPOM. Cilok is one of the street food which often be seen around primary school, it need to watch out the possibility cilok can cause food poisoning (foodborne disease). The objective of this study study was descriptif cross sectional. The aim of this study was to identification of Escheria coli dan Shigella sp on cilok in primary school of Cirendeu, Pisangan and Cempaka Putih. The results showed all 5 samples (100%) are not exceeding the safe level for 1 x 105 CFU/gram and identified contamination of Escherichia coli and Shigella Sp. Conclution of this study shows that in 5 samples there is 1 positive confirmed result of Escherichia coli (20%) and 3 samples expected as Shigella sp. (60%). Key words : Cilok, Escherichia coli, Shigella sp., Bacterial biochemical test, Gram staining, foodborne disease viii DAFTAR ISI LEMBAR JUDUL ................................................................................................... i LEMBAR PERNYATAAN KEASLIAN KARYA ................................................ ii LEMBAR PERSETUJUAN PEMBIMBING ........................................................ iii LEMBAR PENGESAHAN ................................................................................... iv KATA PENGANTAR ............................................................................................ v ABSTRAK ............................................................................................................ vii ABSTRACT ......................................................................................................... viii DAFTAR ISI .......................................................................................................... ix DAFTAR TABEL ................................................................................................. xii DAFTAR GAMBAR ........................................................................................... xiii DAFTAR LAMPIRAN ........................................................................................ xiv DAFTAR SINGKATAN ...................................................................................... xv PENDAHULUAN .................................................................................................. 1 1.1 Latar Belakang ......................................................................................... 1 1.2 Rumusan Masalah .................................................................................... 3 1.3 Tujuan Penelitian ...................................................................................... 3 1.3.1 1.4 Tujuan Umum ................................................................................... 3 Manfaat Penelitian .................................................................................... 4 TINJAUAN PUSTAKA ......................................................................................... 5 2.1. Landasan Teori ......................................................................................... 5 2.1.1. Makanan jajanan dan Pencemarannya ........................................................ 5 2.1.2 Cilok sebagai Makanan Jajanan .............................................................. 7 2.1.3 Bakteri Escherichia coli.......................................................................... 8 2.1.4 Bakteri Shigella sp ................................................................................ 14 2.1.5 Metode perhitungan bakteri ................................................................. 16 2.1.6 Uji Biokimia ......................................................................................... 17 2.2. Kerangka Teori ............................................................................................ 24 2.3. Kerangka Konsep ......................................................................................... 25 2.4. Definisi Operasional .................................................................................... 26 BAB III ................................................................................................................. 27 METODE PENELITIAN ...................................................................................... 27 ix 3.1 Desain Penelitian .......................................................................................... 27 3.2 Lokasi dan Waktu Penelitian ........................................................................ 27 3.3 Populasi dan Sampel Penelitian .................................................................... 27 3.3.1 Populasi Penelitian................................................................................ 27 3.3.2 Sampel Penelitian ................................................................................. 27 3.4 Variabel Penelitian........................................................................................ 28 3.5 Alat dan Bahan Penelitian ........................................................................... 28 3.5.1 Alat Penelitian....................................................................................... 28 3.5.2 Bahan Penelitian ................................................................................. 28 3.6. Cara Kerja Penelitian ................................................................................... 28 3.6.1. Tahap Persiapan ................................................................................... 28 3.6.2. Pembuatan Media dan Penanaman Sampel ......................................... 29 3.7 Alur Penelitian .............................................................................................. 35 3.8 Managemen Data .......................................................................................... 35 BAB IV ................................................................................................................. 36 HASIL DAN PEMBAHASAN ............................................................................. 36 4.1 Hasil dan Pembahasan ............................................................................ 36 4.1.1. Hasil Perhitungan Koloni Bakteri dengan Metode TPC ................. 36 4.1.2 Identifikasi Bakteri terhadap Sampel dengan Media Spesifik dan Pewarnaan Gram ............................................................................................ 39 4.1.3 Uji Konfirmasi dengan Menggunakan Uji Biokomia ..................... 42 4.2 Keterbatasan Penelitian ................................................................................ 51 KESIMPULAN DAN SARAN ............................................................................. 52 5.1 Kesimpulan ............................................................................................. 52 5.2 Saran ....................................................................................................... 52 DAFTAR PUSTAKA ........................................................................................... 54 LAMPIRAN .......................................................................................................... 60 x DAFTAR BAGAN Bagan 2.1 Kerangka Teori...............................................................................24 Bagan 2.2 Kerangka Konsep .......................................................................... 25 Bagan 3.1 Alur Penelitian ..............................................................................35 xi DAFTAR TABEL Tabel 2.1 Definisi Operasional 26 Tabel 4.1 Jumlah Koloni Setiap Sampel Sesuai Rumus 37 Tabel 4.2 Interpretasi Penghitungan pada Setiap Sampel 37 Tabel 4.3 Identifikasi Bakteri Berdasarkan Warna Koloni yang Dihasilkan 39 Tabel 4.4 Hasil Uji Biokimia pada Tiap Koloni pada Media EMB 43 Tabel 4.5 Hasil Uji Biokimia pada Tiap Koloni pada Media SSA 48 xii DAFTAR GAMBAR Gambar 2.1 Makanan Jajanan Cilok 8 Gambar 2.2 Struktur dan Antigen Bakteri Escherichia coli 10 Gambar 2.3 Patogenesis EPEC 12 Gambar 2.4 Patogenesis Shigella sp 15 Gambar 2.5 Hasil Uji MR 18 Gambar 2.6 Hasil Uji VP 19 Gambar 2.7 Hasil Uji SIM 20 Gambar 2.8 Hasil Uji Sitrat 21 Gambar 2.9 Hasil Uji TSIA 22 Gambar 4.1 Pertumbuhan Koloni pada Media NA dengan Pengenceran 10-3 dan 10-4 36 Gambar 4.2 Hasil Koloni pada Media EMB dan SSA 41 Gambar 4.3 Hasil Perwarnaan Gram pada Media EMB dan SSA.....................42 Gambar 4.4 Hasil Uji Biokimia Fermentasi Karbohidrat, Uji TSIA dan Uji IMVIC pada Koloni Hijau Kilap Logam Gambar 4.5 47 Hasil Uji Biokimia Fermentasi Karbohidrat, Uji TSIA dan Uji IMVIC pada Koloni Putih Transparan xiii 51 DAFTAR LAMPIRAN Lampiran 1 Alat dan Bahan Penelitian 59 Lampiran 2 Cara Kerja Penelitian 63 Lampiran 3 Hasil Total Plate Count 65 Lampiran 4 Hasil Perhitungan Penelitian 67 Lampiran 5 Riwayat Penulis 68 xiv DAFTAR SINGKATAN ALT : Angka Lempeng Total BPOM : Badan Pengawas Obat dan Makanan CNF : Cytotoxic Necrotizing Factor DAEC : Diffusely Adherent Escherichia coli EAEC : Enteroagregative Escherichia coli EHEC : Enterohemorrhagic Escherichia coli EIEC : Enteroinvasive Escherichia coli EMB : Eosin Methylen Blue ETEC : Enterotoxigenic Escherichia coli EPEC : Enteropathogenic Escherichia coli FAO : Food and Agriculture Organization KKU : Karbol Kristal Ungu KLB : Kejadian Luar Biasa LT : Labile Toxin MR : Methyl Red NA : Nutrient Agar NB : Nutrient Broth PJAS : Pangan Jajanan Anak Sekolah SIM : Sulfur Indole Moility SPC : Standart Plate Count xv SSA : Salmonella Shigella Agar ST : Stabile Toxin Stx : Shiga Toxin TPC : Total Plate Count TSIA : Triple Sugar Iron Agar VP : Voges Proskauer WHO : World Health Organization xvi BAB I PENDAHULUAN 1.1 Latar Belakang Makanan pangan jajanan anak sekolah (PJAS) di Indonesia diketahui mengalami perburukan, hal ini ditunjukkan dengan data perbandingan menurut Badan Pengawas Obat dan Makanan (BPOM) tahun 2014 terjadi penurunan profil PJAS dari tahun 2013 yakni dari 80,79% turun menjadi 76,18%. Menurut laporan BPOM tahun 2013 terdapat 7 jenis pangan yang diuji yaitu: bakso, jelly/agaragar/produk gelatin lainnya, minuman es (es mambo, lolipop, es lilin, es cendol, es campur, dan sejenisnya), mie, minuman berwarna dan sirup, kudapan (makanan gorengan seperti bakwan, sosis, batagor, empek-empek, cilok, lontong, dan lainlain), makanan ringan (kerupuk, keripik, produk ekstrusi dan sejenisnya). Lalu semua sampel tersebut diuji dan teridentifikasi 4 makanan tertinggi yang tidak layak konsumsi yaitu minuman berwarna dan sirup, kategori es, jelly atau agaragar, dan bakso.1,2,3 Menurut BPOM tahun 2013 penurunan keadaan PJAS tersebut bisa dikarenakan penggunaan bahan berbahaya untuk pangan, penggunaan bahan tambahan pangan melebihi batas maksimal, tercemar logam berat melebihi batas maksimal, kualitas mikrobiologis yang tidak sesuai dengan syarat. Penyebab penurunan keadaan PJAS pada tahun 2014 dibandingkan dengan tahun 2013 adalah dari tingginya pencemaran mikrobiologi.2,3 Menurut laporan BPOM tahun 2015 terjadi Kejadian Luar Biasa (KLB) keracunan pangan dan tercatat 61 kejadian/kasus yang berasal dari 34 Provinsi menunjukkan proporsi angka kesakitan dan angka kematian pada kasus KLB keracunan makanan pada periode Januari-Desember tahun 2015 bahwa jumlah kasus tertinggi terjadi di Provinsi Jawa Barat dengan frekuensi sebanyak 12 KLB, lalu pada provinsi Banten terjadi KLB sebanyak 3 frekuensi. Kemudian untuk jenis pangan penyebab KLB keracunan makanan tertinggi berasal dari rumah tangga sebanyak 25 kejadian (40,98%), lalu disusul dari pangan jajanan sebanyak 14 kejadian (22,95%), pangan jasa boga sebanyak 13 kejadian (21,31%), dan pada 1 2 pangan olahan sebanyak 9 kejadian (14,75%). Menurut tempat/lokasi kejadian KLB keracunan pangan pada tahun 2015 tertinggi berasal dari tempat tinggal sebanyak 20 kejadian (32,79%), disusul berturut-turut lembaga pendidikan sebanyak 17 kejadian (27,87%), kantor/pabrik sebanyak 8 kejadian (13,11%), tempat terbuka sebanyak 7 kejadian (11,48%), asrama/pesantren sebanyak 4 kejadian (6,56%), dan lain-lain seperti hotel, masjid, panti asuhan, restoran, dan gedung pertemuan masing-masing sebanyak 1 kejadian (1,64%). Pada KLB keracunan makanan di Sekolah Dasar umumnya disebabkan oleh pangan jajanan yang terkontaminasi bakteri patogen.4 Menurut Peraturan Pemerintah Republik Indonesia Nomor 28 tahun 2004 tentang Keamanan, Mutu, dan Gizi Pangan memberikan wewenang kepada BPOM untuk melaksanakan pengawasan mutu, keamanan dan gizi pangan yang beredar di Indonesia. Menurut laporan BPOM tahun 2013, higiene dan sanitasi masih menjadi masalah serius dalam produksi pangan di Indonesia. Hal ini dibuktikan dengan temuan kandungan mikroba dalam sampel pangan yang nantinya makanan tersebut dapat menimbulkan penyakit (foodborne disease).3,5 Terjadinya foodborne disease dapat disebabkan oleh tertelannya bahan makanan yang tercemar bahan kimia atau mikroorganisme. Mikroorganisme penyebab foodborne disease salah satunya adalah bakteri. Beberapa bakteri penyebab foodborne disease pada negara berkembang diantaranya adalah Escherichia coli strain Enterotoxigenic (10-20%), Escherichia coli strain Enteropatogenik (1-5%) dan Shigella sp. (5-15%). Escherichia coli biasanya ditemukan di saluran pencernaan manusia, sementara itu kebanyakan strain merupakan strain merugikan. Infeksi Escherichia coli biasanya ditransmisikan melalui makanan atau minuman yang terkontaminasi feces. Sumber makanan yang tersering mengalami kontaminasi Escherichia coli adalah daging yang tidak matang dan susu mentah. Bakteri Shigella merupakan genus bakteri yang dapat menyebabkan diare berdarah/disentri, bakteri ini transmisi ke manusia melalui konsumsi makanan dan air yang terkontaminasi, dan sering terdapat pada salad atau sayuran mentah. Kedua bakteri ini bisa menyebabkan penyakit diare akut.6,7,8,9,10 3 Cilok dapat mengalami kontaminasi bakteri penyebab foodborne disease. Oleh karena hal tersebut peneliti melakukan identifikasi bakteri Escherichia coli dan Salmonella sp. pada jajanan cilok yang dijual di lingkungan Sekolah Dasar Negeri di Kelurahan Cirendeu, Pisangan dan Cempaka Putih untuk mengetahui apakah cilok aman dikonsumsi oleh anak Sekolah Dasar. 1.2 Rumusan Masalah 1. Apakah terdapat cemaran bakteri pada jajanan cilok yang dijual di sekitar lingkungan SD Negeri di Cirendeu, Pisangan, dan Cempaka Putih? 2. Apakah terdapat bakteri Shigella sp. dan Escherichia coli pada pengujian uji biokimia pada koloni yang tumbuh di media spesifik? 1.3 Tujuan Penelitian 1.3.1 Tujuan Umum Untuk mengetahui adanya bakteri Escherichia coli dan Shigella sp. pada jajanan cilok yang dijual di lingkungan SD Negeri di Cirendeu, Pisangan, dan Cempaka Putih. 1.3.2 Tujuan Khusus 1. Untuk mengetahui jumlah koloni bakteri pada jajanan cilok dengan berbagai konsentrasi yang dijual di lingkungan SD Negeri Cirendeu, Pisangan, dan Cempaka Putih. 2. Untuk mengkonfirmasi adanya bakteri Shigella sp. dan Escherichia coli melalui pengujian uji biokimia pada jajanan cilok yang dijual di lingkungan SD Negeri di Cirendeu, Pisangan, dan Cempaka Putih. 4 1.4 Manfaat Penelitian 1. Dapat menerapkan ilmu pengetahuan yang telah didapat selama menjalani pendidikan di Program Studi Pendidikan Dokter FKIK UIN Syarif Hidayatullah Jakarta. 2. Menambah pengetahuan dan wawasan peneliti mengidentifikasi dan mengisolasi bakteri dari makanan dalam serta uji biokimia bakteri. 3. Memperoleh pengalaman dalam proses pembuatan karya ilmiah yang berhubungan dengan ilmu kedokteran. 4. Sebagai syarat kelulusan pendidikan pre-klinik Program Studi Pendidikan Dokter FKIK UIN Syarif Hidayatullah Jakarta. BAB II TINJAUAN PUSTAKA 2.1. Landasan Teori 2.1.1. Makanan jajanan dan Pencemarannya Makanan jajanan menurut FAO (Food and Agricultural Organization) adalah makanan dan minuman yang dipersiapkan dan atau dijual oleh pedagang kaki lima di jalanan dan di tempat-tempat keramaian umum lain yang langsung dimakan atau dikonsumsi tanpa pengolahan atau persiapan lebih lanjut.11 Makanan yang dikonsumsi yang berasal dari makanan jajanan bisa berpotensi menjadi makanan tidak aman dan bisa menyebabkan penyakit atau disebut dengan foodborne disease. Foodborne disease bisa disebabkan oleh keracunan toksin atau bahan kimia yang berbahaya bagi tubuh, tetapi penyebab tersering foodborne disease disebabkan oleh bakteri, virus, dan parasit. Beberapa bakteri yang bisa menyebabkan foodborne disease seperti Campylobacter sp., Clostridium botulinum, Clostridium perfringens, Escherichia coli, Listeria monocytogenes, Salmonella sp., Shigella sp., Vibrio sp.6,11,12 Berbagai macam makanan bisa tercemar oleh bakteri, termasuk juga cilok yang terbuat dari daging ayam, tepung kanji, telur dan berbagai macam rempah. Daging ayam termasuk sumber bahan makanan protein yang mengandung kadar air tinggi dan nutrien sehingga dapat menunjang pertumbuhan bakteri. Komposisi daging yaitu air 56%, lemak 24%, protein 22%, dan bukan protein terlarut (karbohidrat, garam organik, nitrogen terlarut, mineral dan vitamin) 3,5% serta sering mengandung bakteri yang dapat meningkatkan pertumbuhan bakteri lain. Faktor intrinsik yang menunjang pertumbuhan bakteri pada daging terdiri dari air, nutrisi, kondisi pH daging sekitar 5,6-5,8 setelah penyembelihan yang menyebabkan bakteri tumbuh dengan baik karena hampir seluruh bakteri tumbuh optimal pada pH 7 dan tidak tumbuh di pH <4 atau >9. Pada faktor ekstrinsik yang menunjang pertumbuhan bakteri termasuk kandungan oksigen, suhu serta kondisi daging. Selain itu, pertumbuhan utama bakteri berasal dari bahan 5 6 makanan. Bakteri yang terdapat pada hewan hidup dapat bertahan hingga proses pengolahannya selesai, proses penyembelihan dan pemotongan ayam dapat meningkatan penularan bakteri dari satu unggas ke unggas lainnya. Bakteri yang biasanya terdapat pada daging yaitu Campylobacter, Salmonella sp., Escherichia coli., Yersinia enterolitic., dan Listeria monocytogenes. Selain bahan-bahan untuk membuat cilok juga terdapat bahan pendamping saat memakan cilok seperti saus tomat, kecap, sambal, dan bumbu penyedap rasa.13,14 Menurut Karlah, Fatimawali dan Novel (2014) pada penelitian analisis cemaran bakteri coliform yang menggunakan sampel saus tomat pada jajanan bakso tusuk yang dijual di daerah Manado dengan menggunakan metode Angka Lempeng Total (ALT) menunjukkan bahwa pada 12 sampel saus tomat yang digunakan, semua sampel dinyatakan dinilai tidak memenuhi syarat kesehatan mutu berdasarkan SNI 01-3546-2004 tentang batas cemaran mikroba. Untuk menghindari terjadinya pencemaran makanan oleh mikroorganisme yang menyebabkan foodborne disease, beberapa hal bisa dilakukan menurut WHO (World Health Organization) diantaranya menjaga agar tetap tetap bersih, pisahkan makanan matang dan mentah, masak dengan utuh/matang, simpan makanan pada suhu yang tepat, gunakan air dan bahan mentah yang aman.16 Menjaga kebersihan sebelum, saat, dan setelah mengolah makanan merupakan hal yang esensial, contohnya adalah dengan mencuci tangan sebelum memegang makanan dan saat menyiapkan makanan, cuci tangan setelah pergi ke toilet, cuci dan desinfeksi semua permukaan dan peralatan yang digunakan untuk menyiapkan makanan, lindungi area dapur dan makanan dari serangga, hama dan binatang lain.16 Untuk memisahkan bahan mentah dan matang bisa dengan memisahkan daging mentah dan makanan laut dari makanan yang lain, gunakan peralatan yang terpisah seperti pisau dan talenan untuk memproses bahan mentah, simpan makanan di dalam kontainer untuk menghindari kontak antara bahan mentah dan makanan yang sudah matang.16 Beberapa cara untuk memastikan makanan telah dimasak secara secara matang ialah dengan; masak makanan sampai matang khususnya bahan daging, unggas, makanan laut dan telur, masak makanan seperti sup dan rebusan untuk 7 memastikan bahwa makanan telah dimasak sampai 700C, panaskan makanan yang telah dimasak secara merata.16 Berikut cara untuk menjaga makanan pada suhu yang aman yaiu dengan tidak tinggalkan makanan yang telah dimasak pada suhu ruang selama lebih dari 2 jam, masukkan dalam lemari es segera semua makanan yang telah dimasak dan bahan yang tidak bertahan lama, pertahankan suhu makanan diatas 600C saat disajikan, tidak menyimpan makanan terlalu lama di dalam lemari es, tidak mencairkan makanan beku pada suhu ruang.16 Untuk penggunaan air dan bahan mentah yang aman bisa dengan cara menggunakan air yang aman atau masak air untuk memastikan agar aman, pilih makanan yang segar, memilih makanan yang telah diproses untuk keamanan seperti susu pasteurisasi, mencuci buah dan sayuran khususnya jika dimakan mentah, jangan gunakan makanan melebihi batas tanggal kadaluarsa.16 2.1.2 Cilok sebagai Makanan Jajanan Makanan jajanan sekolah yang aman adalah makanan yang tidak menggunakan bahan makanan dilarang untuk pangan, tidak mengandung cemaran logam berat melebihi batas maksimal, tidak menggunakan bahan tambahan pangan melebihi batas maksimal, dan kualitas mutu biologis yang memenuhi syarat.17 Menurut Judarwanto Widodo (2011) tentang perilaku makan anak sekolah menyatakan bahwa makanan jajanan pada anak usia sekolah menyumbang asupan energi sebanyak 36%, zat besi 52%, dan protein 29%, dalam hal tersebut peranan makanan jajanan cukup signifikan dalam menyumbang energi dan zat-zat gizi pada anak usia sekolah. Pada pemeriksaan mutu pangan jajanan anak Sekolah Dasar oleh BPOM tahun 2013, cilok dikategorikan sebagai makanan kudapan bersama dengan bakwan, tahu goreng, sosis, batagor, empek-empek, lontong, dan lain-lain. Cilok adalah sebuah makanan khas Jawa Barat yang terbuat dari tepung tapioka yang kenyal dengan tambahan bumbu pelengkap seperti sambal kacang, kecap, dan saus. Bentuk cilok berupa bulat seperti bakso, pada cilok di dalamnya berisikan telur atau daging cincang. Karena terbuat dari bahan tepung tapioka, tekstur cilok 8 terasa kenyal saat dikonsumsi. Cilok termasuk jenis makanan tepung dan olahannya menurut pedoman kriteria cemaran pada pangan siap saji dan industri BPOM 2012.3,19,20 Menurut Riyanto Agus dan Dian A. (2012) pada penelitian mengenai faktor yang mempengaruhi kandungan Escherichia coli pada makanan jajanan SD di daerah Cimahi dengan meneliti sampel makanan jajanan anak sekolah seperti cilok dan hubungan variabel terkait menyatakan cilok bisa terkontaminasi oleh bakteri karena kebersihan orang yang mengolah makanan, peralatan yang digunakan untuk mengolah makanan, bahan makanan yang digunakan, dan sarana penjualan. Gambar 2.1 Makanan Jajanan Cilok Sumber: Iklimah (2015) Perpustakaan digital Budaya Indonesia 2.1.3 Bakteri Escherichia coli 2.1.3.1 Morfologi dan Taksonomi dan Sifat Pertumbuhan Escherichia coli Escherichia coli termasuk ke dalam bakteri Gram-Negatif, motil, berflagel tipe peritrik berbentuk batang dan tumbuh dengan baik pada media agar MacConkey (MAC). Escherichia coli bisa tumbuh secara aerobik maupun anaerobik. Dapat memfermentasi semua D-glukosa, dan mayoritas memproduksi gas dari fermentasi substratnya dan juga bisa memfermentasi karbohidrat.22 9 Taksonomi Escherichia coli menurut Strum, Tasha dan Cabrillo College (2015). Kingdom : Bacteria Divisi : Proteobacteria Kelas : Gamma Proteobacteria Ordo : Enterobacteriales Famili : Enterobacteriaceae Genus : Escherichia Spesies : Escherichia coli Kelompok genus dari Escherichia dikelompokkan ke dalam famili Enterobacteriaceae, Escherichia coli dan bakteri feses coliform lain mayoritas terdapat pada limbah dan air yang terkontaminasi oleh limbah. Karenanya infeksi sering terjadi saat tertelan makanan dan minuman yang terkontaminasi oleh air yang tidak diproses sebelumnya. Maksud air yang diproses sebelumnya adalah dimasak atau di lakukan penyaringan sehingga mikroba yang terkandung dalam air tersebut bisa hilang/berkurang sesuai batas ambang bakteri. Kebersihan personal juga berperan penting dalam penyebaran infeksi terkait Escherichia coli. Beberapa kasus penyakit infeksi yang berhubungan dengan infeksi Escherichia coli yang telah diketahui diantaranya; diare, septikemia, gastroenteritis dan meningitis neonatus. Juga terdapat 70% kasus yang berkaitan dengan infeksi saluran kemih.24 Bakteri Escherichia coli pada tubuh manusia dapat tumbuh berlebihan jika mengonsumsi makanan yang terkontaminasi oleh feses, beberapa bahan atau produk makanan yang sering terkontaminasi seperti daging mentah, daging yang tidak sempurna dalam proses pengolahan, susu, pangan, atau air. Saat bakteri ini tumbuh berlebih maka bisa berubah sifatnya menjadi patogen, Escherichia coli yang patogen dapat tumbuh pada suhu rendah yaitu sekitar 70C dan pada suhu tinggi yaitu sekitar 440C, tetapi pertumbuhan Escherichia coli lebih optimal pada suhu antara 350C-370C, pH optimum 7-7,5. Selain itu, Escherichia coli relatif sensitif terhadap panas, dapat hidup ditempat lembab, dan akan mati pada proses 10 pemasakan makanan dengan suhu yang relatif tinggi atau dengan proses pasteurisasi.25,26,27 2.1.3.2 Patogenesis Escherichia coli Mayoritas dari strain Escherichia coli dapat menghasilkan endotoxin, enterotoxin yang labil terhadap panas dan enterotoxin yang stabil terhadap panas. Biasanya yang bisa menghasilkan toksin tersebut berasal dari Escherichia coli strain group O. Faktor virulensi lain termasuk fimbriae dan vili yang dibantu dengan tambahan hemolisin, dan substansi seperti Shiga-toxin (shiga toxin menghambat sintesis protein dan menyebabkan kematian sel). Terdapat 2 antigen lain selain antigen O yaitu antigen H dan antigen K yang diproduksi oleh group strain lain.28 Vili pada bakteri Escherichia coli berperan dalam faktor virulensi sebagai mediator untuk penempelan pada permukaan epitel manusia. Mayoritas Escherichia coli mengekspresikan vili tipe 1 atau vili pada umumnya. Vili tipe 1 mengikat sisa D-mannosa yang umumnya terdapat pada permukaan epitel manusia dan hal ini bertindak sebagai pengikat dengan berbagai variasi tipe sel. Vili yang bertindak sebagai pengikat pada sel enterosit ditemukan diantara penyakit diare yang disebabkan oleh Escherichia coli.29 Gambar 2.2 Struktur dan Antigen Bakteri Escherichia coli Sumber: Ahmad Nafees, dkk 2014 11 Escherichia coli dapat memproduksi berbagai jenis protein eksotoksin yang ditemukan diantara famili Enterobacteriaceae. Beberapa toksin yang bisa diproduksi Escherichia coli diantaranya adalah pore-forming sitotoxin, inhibitor sistesis protein, dan sejumlah toksin yang bisa menganggu jalur pembawa pesan (messenger pathway) pada sel inang. Toksin yang termasuk dalam jenis poreforming sitotoxin salah satunya ialah α-hemolisin yang bisa masuk ke dalam membran plasma dari berbagai sel inang dengan cara yang mirip dengan Streptolysin O dan α-toxin Staphylococcus aureus. Toksin tersebut bisa menyebabkan kebocoran plasma yang nantinya akan menyebabkan kematian sel. Sampai saat ini telah diketahui terdapat toksin yang diproduksi dan menyangkut dengan α-hemilisin yaitu cytotoxic necrotizing factor (CNF). CNF ini bekerja dengan cara menganggu protein G yang menyebabkan berbagai macam efek seperti penyusunan ulang sitoskeleton dan apoptosis.28 Toksin labil yang diproduksi juga oleh Escherichia coli, maksud dari labil toksin ialah sifat fisiknya terhadap panas yang labil, toksin ini jika menyerang sel enterosit menyebabkan stimulasi sekresi klorida keluar dari sel dan menghambat absorbsi NaCl, pada akhirnya akan menyebabkan sekresi air dan elektrolit ke dalam lumen usus. Toksin stabil juga menyebabkan sekresi cairan dan elektrolit ke dalam lumen usus.28 Menurut sifat virulensinya dalam menginfeksi saluran pencernaan, terdapat beberapa macam golongan Escherichia coli dengan berbagai patogenesis diare yang berbeda. Klasifikasinya sebagai berikut: 1.) ETEC (Enterotoxigenic Escherichia coli). Berhubungan dengan penyakit diare baik pada anak maupun orang dewasa, khususnya menyerang bayi. Jenis ini terdapat pada daerah tropis maupun sub tropis. Infeksi ETEC sering disebut juga dengan traveler’s diarrhea, karena orang yang terinfeksi biasanya pasca bepergian dari negara industri ke negara berkembang. Gejala yang terlihat jelas pada ETEC adalah nyeri perut, diare, dan seringkali disertai mual dan muntah. Transmisi ETEC melalui konsumsi air dan makanan yang terkontaminasi oleh manusia yang terinfeksi, yang merupakan resiko tinggi terkena infeksi adalah makanan yang belum dimasak seperti salad, dan asinan 12 daging atau sayur. Patogenesis diare ETEC disebabkan oleh strain Escherichia coli yang memproduksi toksin stabil dan/atau toksin labil pada proksimal usus halus. Pada ETEC toksin stabil lebih dominan dari pada toksin labil, penempalan pada permukaan mikrovili dimediasi oleh berbagai macam faktor Kolonisasi (CF/Colonizing Factor) vili yang penting untuk pengantaran toksin yang efisien ke enterosit target. Bakteri yang masih tersisa di permukaan vili enterosit menyebabkan aktivasi “adenylate cyclase-stimulating” yang akan menyebabkan aksi toksin membuat aliran elektrolit dan air dari enterosit ke lumen intestinal. Mukosa menjadi hiperemis tapi tidak terdapat lesi/cedera dan tidak terdapat inflamasi atau invasi pada diare ETEC.22,28,29,30 2.) EPEC (Enteropathogenic Escherichia coli) Merupakan penyebab terbesar diare pada bayi, hal ini utamanya didukung saat keadaan sanitasi yang buruk. Infeksi terjadi saat lahir dengan cara sel bakteri menempel ke mukosa usus halus yang nantinya menyebabkan mual, muntah, demam dan diare berair.29,30 Gambar 2.3 Patogenesis EPEC Sumber: Ahmad Nafees, dkk 2014 Patogenesis awalnya dengan penempelan EPEC ke enterosit usus halus dengan vili “bundle-forming”, lalu lesi berkembang dengan degenerasi brush border lokal, kehilangan mikrovili, dan perubahan pada morfologi sel. Pada akhirnya akan menyebabkan kerusakan mitokondria dan menginduksi apoptosis, hubungan perubahan morfologi dengan diare 13 tidak diketahui tetapi sekresi protein yang diinjeksikan menyebabkan perubahan transport elektrolit melewati membran lumen.29,30 3.) EHEC (Enterohemorrhagic Escherichia coli). Penyakit klasik yang disebabkan oleh EHEC menyebabkan diare berair yang berkembang menjadi diare berdarah disertai nyeri perut, ada dengan/tanpa demam subfebris. Patogenesis EHEC sama seperti EPEC kecuali pada EHEC mempunyai vili tersendiri untuk menempel pada vili yang lebih erat ikatannya pada mukosa usus besar dari pada di usus halus dan pada EHEC tidak membentuk mikro koloni lokal pada mukosa usus. EHEC menghasilkan 2 toksin yaitu verotoksin I dan verotoksin II, verotoksin I merupakan toksin yang identik diproduksi oleh Shigella dysentriae atau disebut sebagai Shiga toxin (Stx). Produksi Stx menyebabkan terjadinya trombosis kapiler dan inflamasi pada tempat kolonisasi pada mukosa yang bisa menuju ke penyakit colitis hemoragik.28,30 4.) EIEC (Enteroinvasive Escherichia coli) Tanda infeksi EIEC berupa demam, nyeri perut yang berat, diare berair dan malaise. Patogenesis EIEC sama seperti Shigella sp. yang diawali dengan penetrasi, lalu invasi dan kemudian destruksi mukosa usus. Strain EIEC menginvasi sel kolon dan menyebabkan diare berair, tetapi beberapa juga bisa menyebabkan diare berdarah karena hasil dari destruksi mukosa yang sampai pada bagian pembuluh darah.22,28 5.) Enteroadherent Escherichia coli Terdapat 2 jenis enteroadherent Escherichia coli yaitu Enteroagregative Escherichia coli (EAEC) dan Diffusely Adherent Escherichia coli (DAEC). EAEC ditandai dengan diare berair yang berkepanjangan (>14 hari), bisa disertai lendir dan darah, EAEC membentuk mukus tebal berupa biofilm bakteri pada permukaan usus yang akan menyebabkan diare. Diare pada DAEC berhubungan dengan infeksi saluran kemih dan diare pada anak-anak di negara berkembang, juga berhubungan dengan pielonefritis akut pada wanita hamil dan sistitis pada anak-anak.28 14 2.1.4 Bakteri Shigella sp 2.1.4.1 Morfologi, Taksonomi dan Sifat Pertumbuhan Shigella sp Bakteri Shigella termasuk ke dalam famili Enterobacteriaceae, terdapat 4 subgroup Shigella yaitu; subgroup A atau Shigella dysentriae, subgroup B atau Shigella flexneri, subgroup C atau Shigella boydii, dan subgroup D atau Shigella sonnei. Semua genus Shigella termasuk bakteri batang-Gram negatif, coccobasil yang tumbuh baik pada agar MAC Conkey, nonmotil, tidak mendekarboksilasi lysin, tidak menggunakan sitrat, malonat maupun sodium asetat (tidak berlaku pada Shigella flexneri), dan tidak menghasilkan H2S. Shigella sp. bertanggung jawab atas terjadinya penyakit disentri atau shigellosis.22,28,31,32 Klasifikasi bakteri Shigella sp. menurut Kanneth Todar (2012) : Kingdom :Bacteria Filum :Proteobacteria Kelas :Gammaproteobacteria Ordo :Enterobacteriales Famili :Enterobactericeae Genus :Shigella Spesies :Shigella dysenteriae, Shigella flexneri, Shigella boydii, Shigella sonnei Shigella sp. merupakan bakteri fakultatif anaerob, tetapi bisa tumbuh lebih baik pada keadaan aerob, bentuk koloni pada media berbentuk konveks, sirkular, warna transparan dengan pinggiran yang utuh dengan diameter mencapai 2 mm pada inkubasi 24 jam. Semua memfermentasi D-glukosa tanpa produksi gas, pada strain Shigella sonnei bisa memfermentasi sukrosa dan laktosa pada inkubasi yang lebih lama.22,31 2.1.4.2 Patogenesis Shigella sp. Shigella sp. merupakan bakteri yang tahan asam sehingga bisa melewati asam lambung dan mencapai bagian usus, mulanya pada usus bakteri Shigella sp. menginvasi sel M, kemudian bakteri akan bermultifikasi di dalam sel dan 15 mendorong tubuh bakteri melewati sitoplasma sel dan akan menginvasi sel yang berdekatan. Saat bakteri mulai memasuki sel enterosit akan difagosit oleh makrofag, tetapi Shigella sp. dapat menginduksi makrofag untuk terjadi apoptosis.29 Gambar 2.4 Patogenesis Shigella sp. Sumber: Ahmad Nafees, dkk 2014 Makrofag yang apoptosis mengeluarkan bakteri Shigella sp. yang akan mengalami transport retrogard melalui bagian basolateral pada mukosa menuju ke enterosit, lalu akan terjadi proses invasi yang difasilitasi oleh membran luar polipeptida dan akan bereproduksi di dalam enterosit yang menyebabkan enterosit apoptosis. Invasi akan berlanjut dari sel satu ke sel yang lainnya dan menetap sampai pada bagian mukosa kolon dan jarang menyebar ke peredaran darah, invasi Shigella sp. akan menghancurkan enterosit yang akan membentuk ulkus pada mukosa yang umumnya terbentuk di kolon, ulkus akan menyebabkan perdarahan oleh karena itu pada uji feses menandakan tanda klasik disentri yang hasilnya menunjukkan terdapat sel darah putih, sel darah merah, bakteri dan lainlain. Shigella dysentriae juga memproduksi “shigatoxin” yang dapat menyebabkan kerusakan pada tempat kolonisasi di epitel usus yang akan 16 menyebabkan diare dengan BAB cair sebagai tanda awal terjadinya shigellosis dan sindrom hemolitik-uremic, tetapi ini jarang terjadi.22,29,31 2.1.5 Metode perhitungan bakteri Terdapat metode perhitungan bakteri secara langsung maupun tidak langsung. Metode dengan cara langsung yaitu petrof hausser cell counter, mikroba dihitung dengan alat haemocytometer secara keseluruhan baik yang masih hidup ataupun mati, cara tidak langsung dapat dilakukan dengan berbagai cara seperti hitung cawan (plate count), pengukuran berat kering sel, filtrasi atau penyaringan, pengukuran konsumsi nutrien, dan pengukuran aktivitas metabolisme.34,35 Perhitungan koloni bakteri pada cawan dapat dilakukan dengan perhitungan Standar Plate Count (SPC), salah satu metode yang digunakan adalah Uji Total Plate Count (TPC). Uji TPC merupakan uji yang bertujuan untuk mendeteksi kuantitas/jumlah dari sel-sel bakteri yang ada pada bahan yang diujikan, setiap koloni yang terbentuk baik besar maupun kecil dan menjalar yang bergabung akan dianggap menjadi satu koloni. Uji TPC dimulai dari pengenceran bahan yang dijadikan sampel, lalu dihomogenisasi dengan media cair NB dengan pengenceran 100 sampai pengenceran 10-7, kemudian hasil pengenceran diinokulasi dalam media padat NA dengan menggunakan metode spread plate lalu diinkubasi dalam suhu 370C selama 24 jam. Setelah diinkubasi koloni bakteri yang tumbuh akan dihitung dengan menggunakan colony counter atau hitung manual dengan kriteria inklusi jumlah bakteri dalam 1 cawan adalah 30-300 koloni. Setelah menghitung jumlah koloni dalam 1 cawan dan termasuk dalam kriteria inklusi maka akan dimasukkan ke rumus sebagai berikut.34,35 17 Koloni per ml = jumlah koloni x 1 Konsentrasi pengenceran Contoh sampel 1: Pada pengenceran 10-2 Jumlah koloni=163 Koloni per ml= 163 x 1 10-2 Koloni per ml= 163 x 102 Koloni per ml= 16.300 Setelah menentukan koloni per ml pada setiap pengenceran, selanjutnya dapat menghitung jumlah kuman pada satu sampel dengan rumus sebagai berikut.34,35 Bakteri (CFU/gram) = Akumulasi total koloni dalam satu sampel Jumlah pengenceran yang dihitung 2.1.6 Uji Biokimia 2.1.6.1 Fermentasi Karbohidrat Fermentasi merupakan proses oksidasi secara anaerob yang membutuhkan karbohidrat sebagai substratnya. Fermentasi karbohidrat harus mengandung senyawa yang bisa dioksidasi dan difermentasi oleh bakteri, hasil dari proses fermentasi berbeda-beda tergantung sifat dari tiap bakteri. Ka v vcdrbohidrat yang sering digunakan dalam uji ini adalah glukosa, laktosa, maltosa, mannitol, dan sukrosa. 18 Kaldu karbohidrat digunakan untuk mengetahui apakah bakteri menghasilkan asam dan gas, untuk mengetahui proses fermentasi menghasilkan asam bisa dideteksi dengan cara melihat apakah terjadi penurunan pH dengan menggunakan indikator. Indikator yang digunakan biasanya brom timol biru atau brom kresol ungu. Jika terjadi penurunan pH maka akan terjadi perubahan warna media menjadi warna kuning, tetapi jika pH diatas 7 maka akan berwarna biru pada brom timol biru atau ungu pada brom kresol ungu. Selain uji pembentukan asam setelah proses fermentasi, pembentukan gas juga diuji dan untuk itu digunakan tabung durham yang bila terbentuk gas maka gas akan masuk ke dalam tabung durham dan akan terlihat seperti gelembung udara yang terperangkap dalam tabung durham. Setelah masa diinkubasi maka dapat diamati perubahan warna dan pembentukan gas dalam tabung yang bisa digunakan sebagai acuan dalam identifikasi bakteri.28,30 Gambar 2.5 Hasil Uji MR: (a). Tidak ada inokulasi, (b).Positif, (c). Negatif Sumber: Cappuccino James G, Sherman N, 2014 2.1.6.2 Uji MR-VP Tujuan uji MR yaitu untuk mengetahui apakah bakteri mampu untuk menggunakan glukosa monosakarida heksosa sebagai substrat utama untuk menghasilkan energi pada mikroorganisme enterik, hasil akhir dari produksi energi akan bervariasi setiap mikroorganisme. Tes MR akan mendeteksi tingginya 19 konsentrasi asam sebagai produk akhir. Indikator MR akan berubah menjadi merah pada kisaran pH 4, pada pH 6 tetap akan menunjukkan adanya asam tetapi dengan sedikit konsentrasi ion hidrogen dan indikator akan berubah menjadi warna kuning yang berarti negatif.36 Tujuan uji VP yaitu untuk mengetahui kemampuan bakteri untuk menghasilkan produk akhir yang bersifat tidak asam atau ber-pH netral seperti asetil metil karbinol. Reagen yang digunakan pada test ini menggunakan reagen Barrit yang berisi campuran alkohol α-naftol dan 40% larutan potasium hidroksida (KOH). Reaksi ini bisa terjadi dengan adanya katalis α-naftol dan kelompok guanida yang ada pada pepton di media MR-VP, hasilnya berupa kompleks warna pink mawar. Hasil positif pada VP ditunjukkan dengan adanya warna pink mawar yang bertahan sampai 15 menit saat ditambahkan reagen Barrit, hasil negatif ditunjukan dengan tidak terjadi perubahan warna menjadi pink mawar.36 Gambar 2.6. Hasil Uji VP: (a). Tidak ada inokulasi, (b). Negatif, (c). Positif Sumber: Cappuccino James G, Sherman N, 2014 2.1.6.3 Uji SIM Media agar SIM mengandung substrat triptofan yang akan dikonversi menjadi indol, asam piruvat dan amonia dengan bantuan enzim triptopanase. Adanya produksi indol dideteksi dengan penambahan reagen Kovac yang menghasilkan lapisan warna merah cherri. 20 Indol positif ditunjukkan dengan perubahan warna merah cherri saat dilakukan penambahan reagen kovac. Dan hasil negatif ditunjukkan dengan tidak berubahnya warna SIM agar menjadi merah cherri saat penambahan reagen Kovac yang menunjukkan tidak terjadinya hidrolisis triptofan.36 Gambar 2.7. Hasil Uji Produksi Indol: (a). Tidak ada inokulasi, (b). Negatif, (c). Positif Sumber: Cappuccino James G, Sherman N, 2014 2.1.6.4 Uji Sitrat Tujuan uji sitrat adalah untuk mengetahui apakah bakteri dapat menggunakan sitrat sebagai sumber karbon untuk sumber energinya karena tidak bisa memfermentasi glukosa dan atau laktosa. Kemampuan ini tergantung adanya permease sitrat yang berguna sebagai transport sitrat masuk ke dalam sel, sitrat aktif saat terdapat enzim sitrase yang akan memproduksi asam oksaloasetik dan asetat. Produk tersebut kemudian secara enzimatik akan dirubah menjadi asam piruvat dan karbon dioksida, selama proses ini media agar menjadi bersifat basa yang berasal dari proses penggabungan karbon dioksida dengan sodium dan air yang membentuk sodium bikarbonat yang bersifat basa. Keadaan basa ini akan mengubah indikator bromtimol blue yang ada pada media agar menyebabkan perubahan warna dari hijau menjadi biru Prussian gelap. Hasil positif sitrat setelah diinkubasi adalah dengan tumbuhnya koloni pada bagian lereng disertai perubahan warna menjadi biru, hasil positif akan terlihat dengan tidak adanya pertumbuhan koloni pada bagian lereng dengan warna hijau.36 21 Gambar 2.8. Hasil uji Sitrat: (a). Hasil negatif tidak ada pertumbuhan di lereng, (b). Hasil positif ada pertumbuhan pada lereng Sumber: Cappuccino James G, Sherman N, 2014 2.1.7.5 Uji TSIA Tujuan uji TSIA adalah untuk membedakan genus yang berbeda-beda dari Enterobacteriaceae, yang semua termasuk dari bakteri batang Gram-negatif yang bisa memfermentasi glukosa dengan memproduksi asam dan membedakan Enterobacteriaceae dari bakteri batang Gram-negatif usus lainnya. Perbedaan terletak pada pola fermentasi karbohidrat dan produksi hidrogen sulfida. Untuk melihat pola penggunaan karbohidrat, pada bagian lereng TSIA mengandung laktosa dan sukrosa dengan konsentasi 1% dan glukosa dengan konsentasi 0.1 %. Indikastor asam basa juga ditambahkan berupa phenol red untuk mengetahui fermentasi karbohidrat yang diindikasikan dengan perubahan warna media dari merah-orange ke warna kuning yang menandakan adanya produksi asam. Pada lereng TSIA dibutuhkan inokulasi dengan prosedur “stab-and-streak” yang dilakukan dengan cara memasukkan ose jarum yang streril secara lurus dari lereng ke dasar media TSIA. Berikut hasil inkubasi aktivitas fermentasi bakteri.36 22 1. Lereng alkali (merah) dan dasar asam (kuning) dengan atau tanpa produksi gas (pecahnya dasar agar). Hal ini menandakan hanya terjadi fermentasi glukosa dengan pembentukan asam pada permukaan lereng yang dioksidadi secara cepat. Produksi alkali muncul karena penggunaan pepton dalam media. Pada dasar TSIA reaksi asam dipertahankan karena hasil dari penurunan tensi oksigen dan pertumbuhan yang lambat dari bakteri.36 2. Lereng asam (kuning) dan dasar asam (kuning) dengan atau tanpa produksi gas. Hal ini menandakan telah terjadi fermentasi laktosa dan atau sukrosa. Karena 2 substansi ini ada dengan konsentrasi yang tinggi maka akan digunakan juga sebagai substrat untuk melanjutkan aktivitas fermentasi dengan mempertahankan reaksi asam baik pada lereng maupun dasar.36 3. Lereng alkali (merah) dan dasar alkali (orange-merah). Hal ini menandakan bahwa tidak terjadi fermentasi, pepton mengalami katabolisme secara aerobik dan atau aerobik yang mengakibatkan pH alkali karena asil dari produksi ammonia. Jika hanya terjadi degradasi aerobik pada pepton maka reaksi alkali hanya terjadi pada bagian lereng. Jika terjadi penggunaan pepton secara aerobik dan anaerobik maka reaksi alkali ada pada bagian lereng dan dasar.36 Gambar 2.9. Hasil Uji TSIA (a). Tidak terjadi inokulasi, (b). Lereng basa dan dasar asam dengan H2S, (c). Lereng basa dan dasar asam, (d). Lereng asam dan sadar asam dengan gas, dan (e). Lereng asam dan dasar asam Sumber: Cappuccino J G, Sherman N, 2014 23 Untuk mendapatkan hasil yang akurat pada uji TSIA diharapkan inkubasi selama 18-24 jam, pada media agar TSIA juga mengandung sodium tiosulfat yang merupakan substrat untuk produksi hidrogen sulfida, dan ferrosulfat untuk mendeteksi hasil akhir tanpa warna. Pada mikroorganisme yang bisa memprosukdi H2S akan menunjukkan warna hitam pada bagian dasar karena hasil dari endapan ferro sulfida yang tidak larut. Berikut hasil reaksi TSIA pada beberapa mikrooganisme.36 1. Lereng asam dengan dasar asam tidak menghasilkan H2S, contoh bakteri nya yaitu Escherichia, Klebsiella, Enterobacter 2. Lereng asam dengan dasar asam menghasilkan H2S, contoh bakteri nya yaitu Citrobacter, Arizona, beberapa Proteus sp. 3. Lereng alkali dengan dasar asam idak menghasilkan H2S, contoh bakteri nya yaitu Shigella,dan beberapa Proteus sp. 4. Lereng alkali dengan dasar asam memproduksi H2S, contoh bakteri nya yaitu mayoritas Salmonella, Arizona, Citrobacter. 5. Lereng alkali dengan dasar alkali tidak menghasilkan H2S, contoh bakteri nya yaitu Alcaligenes, Pseudomonas, Acinetobacter. 24 2.2. Kerangka Teori Jajanan Cilok Bahan Makanan Kebersihan Peralatan Penjualan Pengolahan Terbuat dari kanji,daging dan telur Sarana Higienitas penjual kurang Tempat pertumbuhan mikroorganisme Higienitas buruk Pertumbuhan dan perkembangan bakteri Foodborne disease Infeksi pangan Bakteri Escherichia coli Sekresi toksin LT dan ST Peningkatan permeabilitas sel epitel usus Perpindahan cairan ke lumen usus Diare Shigella sp. invasi di mukosa kolon Pengeluaran Shigatoxin Kerusakan epitel usus membentuk ulkus Diare berdarah 25 2.3. Kerangka Konsep Sampel Cilok Pengenceran Pembiakan pada media NA Pembiakan pada media spesifik (EMB dan SSA) Penghitungan koloni bakteri Jumlah koloni bakteri Pewarnaan Gram Bakteri Escherichia coli dan Shigella sp. teridentifikasi Uji Biokimia Perubahan pada masing-masing media yang diuji 26 2.4. Definisi Operasional Tabel 2.1 Definisi Operasional No. 1. 2. 3. 4. 5. Variabel Cilok Enterobacterichiae Definisi operasional Makanan yang terbuat dari tepung tapioka, telur atau daging cincang yang biasanya disajikan dengan saus kacang atau saus tomat, kecap, sambal dan bumbu penyedap rasa. Bakteri Gram negatif, berbentuk batang pendek (coccobasil) seperti Escherichia coli dan Shigella sp. Pertumbuhan koloni bakteri Kemampuan tumbuh bakteri dalam media NA Pewarnaan Gram Pewarnaan differensial untuk menentukan sifat dan morfologi bakteri Uji Biokimia Kemampuan bakteri memfermentasi karbohidrat, uji IMViC Alat ukur Hasil ukur Skala ukur - - - Mikroskop Warna dan bentuk bakteri - Spidol, colony counter, dan hitungan manual Pewarna KKU, Lugol, alkohol 96%, safranin, mikroskop Manual Jumlah area tumbuh koloni Numerik Gram (-) atau Gram (+) Kategorik Warna dan bentuk media - BAB III METODE PENELITIAN 3.1 Desain Penelitian Penelitian bersifat deskriptif dengan menggunakan metode penelitian Cross Sectional. 3.2 Lokasi dan Waktu Penelitian Penelitian ini dilakukan di Laboratorium Mikrobiologi Fakultas Kedokteran dan Ilmu Kesehatan UIN Syarif hidayatullah Jakarta, pada bulan Januari 2016 sampai dengan Juli 2016. 3.3 Populasi dan Sampel Penelitian 3.3.1 Populasi Penelitian Penjual cilok yang berada di lingkungan Sekolah Dasar Negeri di kelurahan Cirendeu, Pisangan, dan Cempaka Putih. 3.3.2 Sampel Penelitian Sampel berupa cilok yang diambil dari penjual cilok di lingkungan Sekolah Dasar Negeri di kelurahan Cirendeu, Pisangan, dan Cempaka Putih. Sampel cilok terdiri dari: 1. Sampel 1 : Cilok dengan saus tomat, kecap, sambal, dan bumbu penyedap rasa 2. Sampel 2 : Cilok dengan saus tomat, kecap, sambal, dan bumbu penyedap rasa 3. Sampel 3 : Cilok dengan saus kacang, sambal, dan kecap 4. Sampel 4 : Cilok dengan saus tomat, kecap, sambal, dan bumbu penyedap rasa 5. Sampel 5 : Cilok dengan saus tomat, kecap, sambal, dan bumbu penyedap rasa 27 28 3.4 Variabel Penelitian Variable penelitian ini adalah cilok (variable bebas) dan Eschericia coli, Shigella sp. (variable terikat). 3.5 Alat dan Bahan Penelitian 3.5.1 Alat Penelitian Alat-alat yang digunakan dalam penelitian ini adalah gelas beker (250 mL, 500 mL dan 1000 mL), tabung erlenmeyer (500 mL), tabung ukur (100 mL dan 10 mL), tabung reaksi, rak tabung reaksi, cawan petri, bunsen, spatula, pinset, pipet, ose, batang L, korek api, tip (1000 μL dan 100 μL), mikropipet (1000 μL dan 100 μL), blender, autoklaf, oven, inkubator, kulkas, laminar, vortex, timbangan, hot plate,magnetic stir, tisu, kapas, handscoon, masker, minyak immerse, mikroskop, dan swab kapas kering. 3.5.2 Bahan Penelitian Bahan yang digunakan pada penelitian ini adalah cilok, media NB, NA, SSA, dan EMB, larutan untuk pewarnaan Gram (kristal karbol ungu, lugol, alkohol 90%, safranin), serbuk bom chresol, reagen KOH, reagen methyl red, dan reagen erlich atau kovac. 3.6. Cara Kerja Penelitian 3.6.1. Tahap Persiapan 3.6.1.1. Sterilisasi Alat dan Bahan A. Sterilisasi basah Bahan dan alat yang di sterilisasi dalam autoklaf yaitu media (NA, EMB, dan akuades) dalam tabung erlenmeyer, (gula-gula, indol, MR-VP, sitrat, TSIA, dan NB) dalam tabung reaksi, dan tip. Media yang dimasukkan ke dalam tabung reaksi dan tip terlebih dahulu dibungkus dengan plastik tahan panas, lalu dimasukkan ke dalam autoklaf selama ± 1-2 jam. 29 B. Sterilisasi kering Bahan dan alat yang di sterilisasi dalam oven seperti pinset, spatula dan cawan petri. Sebelum dimasukan ke dalam oven telah dibungkus dengan kertas. Kemudian masukkan ke dalam oven ± 1 jam hingga mencapai suhu 150˚C. 3.6.1.2. Pengambilan dan Persiapan Sampel Sampel dibeli di penjual cilok di SD Negeri yang terdapat di kelurahan Cirendeu, Pisangan, dan Cempaka Putih, sampel dibeli kisaran pukul 09.00-12.00 WIB. Jika tidak langsung digunakan sampel yang telah dibeli dimasukkan di lemari es dengan suhu 30 C, sehingga kondisi sampel tidak mengalami perubahan. Ketika sampel akan digunakan sebelumnya terlebih dahulu diblender sampai halus dan encer, lalu ditimbang sebanyak 10 gram. 3.6.2. Pembuatan Media dan Penanaman Sampel 3.6.2.1. Pembuatan Media NB dan Pengenceran Media NB ditimbang sebanyak 4 gr, lalu dimasukkan ke dalam gelas beker yang telah berisi akuades 306 mL, kemudian panaskan pada hotplate selama ± 15 menit, 150˚C. Setelah itu masukkan ke dalam tabung reaksi masing-masing 9 mL sebanyak 14 tabung dan masing-masing 90 mL pada 2 tabung erlenmeyer 250 mL dan tutup semua tabung dengan kapas. Masukkan seluruh tabung reaksi ke dalam plastik lalu sterilisasi bersama tabung erlenmeyer di autoklaf selama ± 1-2 jam, kemudian masukkan ke dalam kulkas bersuhu 3˚C. Setelah media siap digunakan persiapkan sampel, yaitu dengan memblender sampel sampai halus dan tercampur, lalu sampel ditimbang dengan ukuran 10 gram, kemudian disiapkan 7 tabung yang berisi masing-masing 9 mL NB dan media NB 90 mL dalam tabung erlenmeyer. Kemudian sampel sebanyak 10 gr dimasukkan ke dalam tabung erlenmeyer berisi 90 mL NA divortex sampai homogen, setelah homogen ambil 1 ml campuran NB dan sampel dengan menggunakan menggunakan tip 1000 μL dan dimasukan pada tabung reaksi ke-1 dengan pengenceran 10-1. Dari tabung reaksi ke-1 yang telah berisi media NB 9 mL dan sampel 1 mL di vortex hingga homogen dan diambil 1 ml dengan 30 mengunakan tip 1000 μL dan dimasukan pada tabung ke-2, lalu di vortex hingga homogen. Dilakukan hal yang sama pada tabung-tabung selanjutnya sampai dengan tabung ke-6. Pada tabung ke-7 isi dengan 9 mL NB tanpa sampel yang nantinya digunakan sebagai kontrol negatif. 3.6.2.2. Pembuatan Media NA dan Penanaman Sampel Media NA ditimbang sebanyak 8 gr, lalu dimasukkan ke dalam gelas beker yang telah berisi akuades 560 mL, kemudian panaskan pada hotplate selama ± 20 menit, 150˚C. Setelah itu masukkan ke dalam tabung erlenmeyer 500 mL dan tutup dengan kapas, kemudian sterilisasi di autoklaf selama ± 1-2 jam. Setelah itu, tuang media ke dalam cawan petri masing-masing ± 20 mL dan dinginkan, bila telah mengeras masukkan ke dalam kulkas bersuhu 3˚C. Setelah tahap pengenceran, ambil 0,1 mL dengan mikropipet diambil dari tabung reaksi yang telah di vortex ulang dengan konsentari 10-1, 10-2, 10-3, 10-4, 10-5 (sesuai dengan koloni bakteri yang dihasilkan) dan kontrol negatif. Ambil 0,1 mL dan diletakkan pada 2 cawan petri lalu diberikan label sesuai dengan pengenceran, contoh: 1-1, 1-2 sampai dengan 4-1, 4-2. Pada kontrol negatif, teteskan 0,1 mL NB dari tabung reaksi ke 7 lalu diletakkan pada satu cawan petri dan diberi label “kontrol”. Rendam batang L dalam larutan alkohol, lalu setiap akan digunakan keluarkan batang L dari larutan alkohol, kemudian dilewatkan diatas api 1-2 kali, diamkan sebentar hingga sudah tidak panas kemudian goreskan batang L diatas media untuk meratakan larutan sampel yang telah diteteskan. Kemudian inkubasi cawan selama 24 jam, lalu lakukan hitung jumlah koloni yang terbentuk. 3.6.2.3. Pembuatan Media EMB dan Penanaman Sampel Media EMB ditimbang sebanyak 1,5 gr, masukkan ke dalam gelas beker yang telah berisi 40 mL akuades, lalu panaskan pada hotplate selama ± 20 menit, 150˚C. Kemudian masukkan ke dalam tabung erlenmeyer 250 mL dan tutup dengan kapas. Setelah itu sterilisasi di autoklaf selama ± 1-2 jam, kemudian tuang media ke dalam cawan petri masing-masing ±20 mL dan dinginkan, bila telah mengeras masukkan ke dalam kulkas bersuhu 3˚C. 31 Setelah tahap pengenceran dan penanaman larutan sampel pada media NA. Ambil 0,1 mL dengan menggunakan mikropipet pada tabung reaksi dengan pengenceran 10-1, lalu diletakkan pada media EMB. Rendam batang L dalam larutan alkohol, lalu setiap akan digunakan keluarkan batang L dari larutan alkohol, kemudian dilewatkan diatas api 1-2 kali, diamkan sebentar hingga sudah tidak panas kemudian goreskan batang L diatas media untuk meratakan larutan sampel yang telah diteteskan. Kemudian cawan diinkubasi selama 24 jam, setelah itu amati koloni yang tumbuh yang selanjutnya dilakukan pewarnaan dan uji biokimia. 3.6.2.4. Pembuatan Media SSA dan Penanaman Sampel Masukkan akuades 40 mL ke dalam tabung erlenmeyer 250 mL dan tutup dengan kapas, lalu sterilisasi di autoklaf selama ± 1-2 jam. Timbang media SSA sebanyak 2,4 gr, lalu masukkan media SSA ke dalam tabung erlenmeyer yang telah di sterilisasi, kemudian dipanaskan pada hotplate selama ± 15 menit, 150˚C. setelah itu, tuang media ke dalam cawan petri masing-masing ±20 mL dan dinginkan, bila telah mengeras masukkan ke dalam kulkas bersuhu 3˚C. Setelah tahap pengenceran dan penanaman larutan sampel pada media NA. Ambil 0,1 mL dengan menggunakan mikropipet pada tabung reaksi dengan pengenceran 10-1, lalu diletakkan pada SSA. Rendam batang L dalam larutan alkohol, lalu setiap akan digunakan keluarkan batang L dari larutan alkohol, kemudian dilewatkan diatas api 1-2 kali, diamkan sebentar hingga sudah tidak panas kemudian goreskan batang L diatas media untuk meratakan larutan sampel yang telah diteteskan. Kemudian cawan diinkubasi selama 24 jam, setelah itu amati koloni yang tumbuh yang selanjutnya dilakukan pewarnaan dan uji biokimia. 3.6.2.5. Identifikasi Bakteri dengan Pewarnaan Gram Bakteri yang telah tumbuh di media spesifik EMB Agar, dan SSA dilakukan pewarnaan Gram. Mula-mula panaskan ose di atas api, ambil NaCl dengan menggunakan ose dan teteskan di atas kaca objek yang telah diberi batas bentuk oval dibagian bawahnya dengan spidol. Panaskan ose di atas api kembali, dinginkan dan ambil koloni bakteri dalam cawan media lalu oleskan pada kaca 32 objek dan ratakan dengan NaCl yang telah diteteskan sebelumnya (tidak melewati batas). Keringkan dengan dilewatkan di atas api 2-3 kali atau diamkan hingga mengering dengan sendirinya. Teteskan Gentian Violet atau Kristal Karbol Ungu (KKU), diamkan selama 5 menit, bilas dengan air mengalir. Teteskan lugol, diamkan selama 3 menit, bilas dengan air mengalir. Teteskan alkohol 96%, hingga tidak ada lagi larutan ungu yang luntur. Teteskan safranin, diamkan selama 45 detik hingga 1 menit, bilas dengan air mengalir. Keringkan dengan menggunakan tisu kering dengan tidak mengusap bagian atas gelas objek. Teteskan minyak immersi, lihat di bawah mikroskop dengan menggunakan pembesaran 100x. 3.6.2.6. Pembuatan dan Identifikasi Koloni dengan Uji Biokimia 1. Fermentasi karbohidrat Serbuk gula-gula (glukosa, laktosa, maltosa, mannitol, dan sukrosa) ditimbang sebanyak 1 gr dan air pepton 1 gr, lalu masukkan ke tabung erlenmeyer (250 mL) yang telah berisi 100 mL akuades, kemudian dipanaskan pada hotplate selama ± 15 menit, 1500C. Selama memanaskan masukkan sebuk bom chresol purple secukupnya hingga warna menjadi ungu homogen. Setelah dipanaskan tuang ke dalam tabung reaksi sebanyak 4 ml dan masukkan tabung durham ke dalam tabung reaksi, lalu masukkan seluruh tabung reaksi ke dalam plastik kemudian sterilisasi di autoklaf selama ± 1-2 jam, setelah itu masukkan ke dalam kulkas bersuhu 30C. Panaskan ose lalu tunggu hingga dingin, ambil koloni bakteri (dari media spesifik SSA dan EMB) lalu masukkan ke dalam tiap tabung reaksi yang berisi uji gula-gula dan kocok hingga koloni menyebar. Lakukan tahap ini pada koloni yang berbeda. Lalu inkubasi tabung selama 24 jam pada suhu 350C. Setelah 24 masa inkubasi akan terjadi reaksi dan perubahan pada warna uji gula-gula, hasil (+) ditunjukkan dengan warna uji gula-gula berubah menjadi kuning yang menandakan keadaan asam dengan atau tanpa pembentukan gas pada tabung durham. 33 2. SIM Serbuk media SIM ditimbang sebanyak 4 gr, lalu masukkan ke dalam tabung erlenmeyer (250 mL) yang telah berisi 100 mL akuades, kemudian panaskan pada hotplate selama ± 15 menit, 150˚C. Setelah dipanaskan masukkan ke dalam tabung reaksi sebanyak 4 mL, lalu masukkan seluruh tabung reaksi ke dalam plastik kemudian sterilisasi di autoklaf selama ± 1-2 jam, kemudian masukkan ke dalam kulkas bersuhu 30C. Panaskan ose jarum dan diamkan hingga idak panas, lalu tusuk lurus tepat di tengah pada media uji SIM, lalu inkubasi selama 24 jam pada suhu 300-350C. Amati terjadinya perubahan dengan memberikan 1 mL larutan reagen erlich atau kovac pada tabung, perubahan yang terjadi berupa warna cincin merah pada uji SIM. 3. MR-VP Serbuk media MR-VP ditimbang sebanyak 5 gr, lalu masukkan ke dalam tabung erlenmeyer (250 mL) yang telah berisi 100 mL akuades, kemudian panaskan pada hotplate selama ± 15 menit, 150˚C. Setelah dipanaskan masukkan ke dalam tabung reaksi sebanyak 4 mL, lalu masukkan seluruh tabung reaksi ke dalam plastik kemudian sterilisasi di autoklaf selama ± 1-2 jam, kemudian masukkan ke dalam kulkas bersuhu 30C. Panaskan ose bulat di atas bunsen, lalu ambil koloni dan masukkan ke dalam tabung reaksi berisi MR dan kocok agar koloni menyebar, kemudian inkubasi selama 24 jam pada suhu 300-350C. Amati terjadinya perubahan dengan memberikan 1 ml reagen methyl red pada tabung. Hasil (+) berupa warna cincin merah pada keadaan asam dan berubah menjadi kuning pada keadaan basa. Panaskan ose bulat diatas bunsen, lalu ambil koloni dan masukkan ke dalam tabung reaksi berisi VP dan kocok agar koloni menyebar, kemudian inkubasi selama 24 jam pada suhu 300-350C. Amati terjadinya perubahan dengan memberikan 1 ml reagen KOH pada tabung. Perubahan yang bisa terlihat adalah perubahan menjadi warna merah pada medium. 34 4. Uji Sitrat Serbuk media sitrat ditimbang sebanyak 3 gr, lalu masukkan ke dalam tabung erlenmeyer (250 mL) yang telah berisi 100 mL akuades, kemudian panaskan pada hotplate selama ± 15 menit, 150˚C. Setelah dipanaskan masukkan ke dalam tabung reaksi sebanyak 4 mL, lalu masukkan seluruh tabung reaksi ke dalam plastik kemudian sterilisasi di autoklaf selama ± 1-2 jam, kemudian masukkan ke dalam kulkas bersuhu 30C. Ambil koloni bakteri dengan ose jarum yang sebelumnya telah dipanaskan, diamkan sebentar lalu oleskan ose tersebut pada bagian lempeng media sitrat, kemudian inkubasi selama 24 jam pada suhu 370C. Amati perubahan warna, perubahan yang tampak adalah perubahan warna media menjadi biru yang menandakan adanya peningkatan pH. 5. TSIA Serbuk media TSIA ditimbang sebanyak 3 gr, lalu masukkan ke dalam tabung erlenmeyer (250 mL) yang telah berisi 100 mL akuades, kemudian panaskan pada hotplate selama ± 15 menit, 150˚C. Setelah dipanaskan masukkan ke dalam tabung reaksi sebanyak 4 mL, lalu masukkan seluruh tabung reaksi ke dalam plastik kemudian sterilisasi di autoklaf selama ± 1-2 jam, kemudian masukkan ke dalam kulkas bersuhu 30C. Panaskan ose jarum dan diamkan sebentar hingga tidak terlalu panas, lalu ambil koloni pada media spesifik, kemudian letakkan koloni dengan cara tusuk lurus (stab) dan diratakan pada bagian lempengnya. Setelah itu inkubasi selama 24 jam pada suhu 300-350C dan amati terjadinya perubahan. Perubahan menjadi warna hitam menandakan terbentuknya gas H2S, merah menandakan basa, dan warna kuning menandakan asam. 35 3.7 Alur Penelitian Sampel cilok yang dihaluskan Pengenceran dengan media NB 90 ml Pengenceran 10-1 9 ml Pengenceran 10-2, 10-3 ,10-4 Media SSA dan EMB agar Kontrol negatif Media NA Inkubasi selama 24 jam, suhu 37˚C Penghitungan koloni bakteri Menghitung jumlah koloni bakteri Uji biokimia Terjadi perubahan warna dan bentuk pada medium Pewarnaan Gram Lihat bakteri dalam mikroskop (100x) 3.8 Managemen Data Data penelitian dari identifikasi bakteri Escherichia coli serta Salmonella sp. pada cilok, dijelaskan secara deskriptif berbentuk tabel untuk menjelaskan jumlah koloni bakteri yang diperoleh dari makanan cilok, serta hasil uji biokimia terhadap koloni yang tumbuh pada media SSA dan EMB Agar. BAB IV HASIL DAN PEMBAHASAN 4.1 Hasil dan Pembahasan 4.1.1. Hasil Perhitungan Koloni Bakteri dengan Metode TPC Berdasarkan hasil inokulasi sampel pada media NA, tampak beberapa koloni bakteri seperti tampak pada gambar berikut. Pengenceran 10-4 Pengenceran 10-3 Gambar 4.1 Pertumbuhan Bakteri pada Media NA dengan konsentrasi 10-3 dan 10-4 Pada gambar 4.1 terlihat beberapa koloni bakteri yang berbentuk bulat, berwarna putih dan tersusun tidak beraturan. Koloni yang terbentuk merupakan hasil dari pertumbuhan bakteri dari media NA yang merupakan media universal. Pada media NA dilakukan perhitungan jumlah koloni bakteri untuk menentukan jumlah bakteri yang tumbuh, tetapi dengan cara ini tidak dapat menentukan jenis bakterinya. Setiap koloni dalam lempeng agar dihitung, kemudian untuk menentukan jumlah koloni bakteri pada setiap sampel, dilakukan perhitungan sesuai rumus perhitungan koloni sehingga didapatkan hasil jumlah bakteri pada setiap sampel cilok yang dapat dilihat pada tabel berikut. 36 37 Tabel 4.1 Jumlah Koloni Setiap Sampel Sesuai Rumus Sampel Konsentrasi 10-1 10-2 10-3 10-4 Kontrol Sampel 1 ~ 68 x 102 38 x 103 7 x 104 0 Sampel 2 1 97 x 10 57 x 102 25 x 103 6 x 104 0 Sampel 3 Sampel 4 Sampel 5 ~ ~ 23 x 103 8 x 104 0 ~ 64 x 102 50 x 103 19 x 104 0 ~ 24 x 102 19 x 103 12 x 104 0 Keterangan: ~: terlalu banyak untuk dihitung Kontrol: Media NA yang dicampur dengan NB Sehingga apabila dihitung menggunakan rumus Coloni Form Unit, akan didapatkan jumlah rerata bakteri pada masing-masing sampel adalah sebagai berikut. Tabel 4.2 Interpretasi Penghitungan pada Setiap Sampel Sampel 1 2 3 4 5 Rata-Rata Jumlah Bakteri (CFU/gram) 2,2 x 104 3,3 x 103 8 x 103 2,8 x 104 1,2 x 104 Keterangan Tidak melebihi ambang batas Tidak melebihi ambang batas Tidak melebihi ambang batas Tidak melebihi ambang batas Tidak melebihi ambang batas Keterangan: CFU : Coloni Form Unit Sampel 1 : SDN Cirendeu 01 Sampel 2 : SDN Cempaka putih 03 Sampel 3 : SDN Cirendeu 02 Sampel 4 : SDN Cempaka Putih 02 Sampel 5 : SDN Pisangan 01 Berdasarkan tabel 4.2 dapat disimpulkan bahwa pada sampel 4 memiliki hasil rata-rata jumlah bakteri tertinggi dibandingkan dengan sampel lain, yaitu 2,8 x104 CFU/gram,dan hasil terendah terdapat pada sampel 2 sebesar 3,3 x103 CFU/gram. Berdasarkan pedoman kriteria cemaran pada pangan siap saji dan pangan industri rumah tangga dari BPOM tahun 2012 cilok dimasukkan ke dalam kategori makanan tepung dan olahannya yang memiliki ambang batas cemaran maksimum 1 x 105 38 koloni/g menggunakan parameter Uji ALT (Angka Lempeng Total), dengan kondisi seperti ini dapat dinyatakan bahwa semua sampel cilok yang diuji layak untuk dikonsumsi karena hasil dari uji ALT semua sampel tidak melebihi ambang batas.37 Berbeda dengan penelitian yang dilakukan oleh Fauziah Riska R. (2013) dengan menggunakan 13 sampel cilok dan 30 sampel bakso, penelitian ini menggunakan metode TPC. Hasil dari penelitian diperoleh 92% sampel cilok dan 70% sampel bakso memiliki kandungan TPC diatas ambang batas maksimum menurut standart SNI yaitu melebihi 1 x 105 CFU/g dengan hasil kandungan TPC tertinggi pada sampel 39 sebesar >1010 CFU/g, sehingga dapat disimpulkan ternyata sebanyak 70% sampel cilok tidak layak dikonsumsi. Penelitian lain dilakukan oleh Wariyah Chatarina dan Dewi Sri H. (2014) yang meneliti 134 sampel makanan dan minuman yang termasuk didalamnya cilok pada sekolah dasar di Kabupaten Kulon Progo menggunakan metode Angka Lempeng Total (ALT) diperoleh hasil bahwa dari 134 sampel yang diteliti, sebanyak 51,06% pada makanan dan 58,07% pada minuman sampel PJAS dinyatakan tidak memenuhi syarat. Menurut keputusan dirgen POM No. 03726/B/SK/VII/89 tentang batas maksimum cemaran mikroba dalam makanan. Penelitian yang dilakukan oleh Aref (2016) yang meneliti 15 sampel bakso bakar menggunakan metode TPC (Total Plate Count) diperoleh hasil bahwa sebanyak 53,33% dari total sampel bakso bakar memiliki kandungan TPC diatas ambang batas maksimum yang ditetapkan oleh Standar Nasional Indonesia (SNI) 01-3818-2009, artinya lebih dari setengah sampel yang diteliti tidak layak dikonsumsi. Menurut Riyanto Agus dan Abdillah A. D. (2012) faktor yang mempengaruhi kandungan Escherichia coli pada makanan jajanan SD di Cimahi Selatan seperti makanan cakue, cireng, cilok, mi goreng, dan sosis goreng dengan pengukuran variabel penjamah makanan, peralatan, bahan 39 makanan, penyajian, dan sarana penjualan dengan metode observasi dan wawancara serta uji pemeriksaan bakteriologik. Hasil penelitian diperoleh hanya 4 variabel yang berhubungan bermakna dengan kandungan bakteri Escherichia coli yaitu kebersihan orang yang mengolah makanan, peralatan makanan, bahan makanan, dan sarana penjualan makanan. Dari hasil analisa tersebut, sehingga diperlukan penelitian lebih lanjut mengenai higienitas dan sanitasi pada penjual dan lingkungan penjualan makanan jajanan cilok. 4.1.2 Identifikasi Bakteri terhadap Sampel dengan Media Spesifik dan Pewarnaan Gram Hasil isolasi bakteri ke dalam media spesifik SSA dan EMB kemudian diinkubasi selama 24 jam pada suhu 35-360C, maka terbentuk koloni seperti hasil berikut: Tabel 4.3 Identifikasi bakteri berdasarkan warna koloni yang dihasilkan Sampel 1 Sampel 2 Sampel 3 Pengambilan Ke-1 Ke-2 Ke-1 Pink, ungu Ke-2 Ke-1 Ungu Ungu Ke-2 Ungu, hitam, pink Ke-1 Sampel 4 Ke-2 Sampel 5 EMB Tidak tumbuh Tidak tumbuh Ke-1 Ke-2 Pink, ungu, hijau kilap logam Pink, ungu, hitam, hijau kilap logam Hitam, pink, ungu Hitam, pink, ungu SSA Tidak tumbuh Putih transparan Putih transparan, pink, putih dengan titik hitam Pink Putih transparan, pink Pink, putih dengan titik hitam Pink Pink Pink Pink Berdasarkan tabel 4.3 hasil isolasi bakteri pada media EMB tumbuh koloni berwarna pink, ungu, hitam, dan hijau kilap logam. Menurut Hardy Diagnostic (2016) dan Jawetz E. (2012) media EMB digunakan untuk isolasi bakteri batang Gram-negatif dan membedakan bakteri yang dapat memfermentasi laktosa atau tidak. Koloni bakteri berwarna ungu menunjukkan bahwa bakteri mampu memfermentasi laktosa, beberapa contoh bakteri yang dapat memfermentasi laktosa pada 40 EMB seperti Enterobacter sp., dan Escherichia coli, tetapi pada Escherichia coli biasanya sering terbentuk warna koloni ungu yang disertai hijau kilap logam. Pada koloni berwarna pink terbentuk karena bakteri tidak mampu memfermentasikan laktosa, contoh bakterinya seperti Salmonella sp. dan Shigella sp., tetapi menurut Hardy Diagnostic (2016) juga menjelaskan bahwa koloni bakteri Salmonella sp. dan Shigella sp. dapat terlihat tembus/transparan dengan warna kuning atau tidak berwarna (colorless). Berdasarkan penelitian (tabel 4.3) makanan cilok yang mengandung Escherichia coli diduga sebesar 20%. Berbeda dengan penelitian yang dilakukan oleh Djodjoka J. A., Malonda N., dan Punuh M. I. (2014) di lingkungan Sekolah Dasar kota Manado yang menggunakan 7 sampel bakso tusuk dengan metode MPN, ternyata tidak ditemukan kuman Escherichia coli pada uji penegasan. Penelitian juga dilakukan oleh Novianti Dewi (2015) di pasar tradisional kota Palembang yang menggunakan 5 sampel baso dengan metode MPN, ternyata tidak ditemukan Escherichia coli pada uji penegasan. Berdasarkan hasil penelitian pada tabel 4.3. bakteri yang diisolasi pada media SSA menghasilkan koloni putih transparan, pink, putih dengan titik hitam. Menurut Hardy Diagnostic (2016) dan Aryal Sagar (2016) menyatakan bahwa pada media SSA menghasilkan koloni berwarna putih transparan/colorless dikarenakan hasil dari aktifitas bakteri yang tidak bisa menfermentasi laktosa, contoh seperti Shigella sp., contoh bakteri lain yang berwarna transparan/ colorless ialah Proteus sp. dan beberapa spesies Salmonella sp., tetapi biasanya disertai dengan titik hitam pada tengah koloni. Berdasarkan hal tersebut diatas, bahwa koloni yang berwarna putih transparan diduga bakteri Shigella sp., koloni berwarna pink menunjukkan bahwa bakteri bisa memfermentasi laktosa, diduga bakteri tersebut adalah Escherichia coli, Enterobacter, dan Klebsiella. 41 Menurut penelitian yang dilakukan oleh Sulaeman Pratiwi L. (2015) terdapat bakteri Shigella sp. sebesar 100% (6 sampel) pada sampel telur balado yang diuji, menunjukkan hasil inokulasi pada media SSA berupa koloni bakteri berwarna bening/transparan. SSA EMB Gambar 4.2. Hasil koloni pada media spesifik SSA dan EMB. Berdasarkan isolasi bakteri pada media EMB (tabel 4.3.) ada yang menghasilkan koloni berwarna hijau kilap logam, menurut Hardy Diagnostic (2016) koloni tersebut sesuai dengan ciri khas bakteri Escherichia coli. Artinya sampel cilok yang mengandung bakteri Escherichia coli terdapat sebanyak 1 sampel dari 5 sampel yang diuji, diduga sampel cilok yang mengandung Escherichia coli sebesar 20%. Pada media SSA dari hasil isolasi bakteri (tabel 4.3.) ada yang menghasilkan koloni berwarna putih transparan, menurut Hardy Diagnostic (2016) koloni tersebut sesuai dengan ciri khas bakteri Shigella sp. Artinya sampel cilok yang mengandung bakteri Shigella sp. terdapat sebanyak 3 sampel dari 5 sampel yang diuji, diduga sampel cilok yang mengandung Shigella sp. sebesar 60%. Pada penelitian ini, setelah bakteri diisolasi pada media SSA dan EMB, maka dapat diketahui bakteri tersebut adalah Escherichia coli dan dapat diduga bakteri Shigella sp., selanjutnya dilakukan pewarnaan Gram 42 untuk mengetahui sifat dan morfologi bakteri. Hasil pewarnaan dapat dilihat sebagai berikut. A B Gambar 4.3. Hasil Pewarnaan. a.) pada Media Spesifik EMB, b.) pada Media Spesifik SSA Berdasarkan hasil pengamatan mikroskop dengan pembesaran 100x didapatkan hasil pewarnaan Gram dari bakteri Escherichia coli dari media EMB dengan ciri-ciri bakteri berbentuk coccobasil, sususan tunggal, dan bersifat Gram negatif (bakteri berwarna merah), pada bakteri Shigella sp. pada media SSA dengan bentuk coccobasil, susunan tunggal, dan bersifat Gram negatif (bakteri berwarna merah). 4.1.3 Uji Konfirmasi dengan Menggunakan Uji Biokomia 1. Uji Biokimia pada Media EMB Setelah dilakukan isolasi pada media spesifik dan pewarnaan Gram, identifikasi bakteri dikonfirmasi dengan melakukan uji biokimia. Berikut hasil uji biokimia pada tiap koloni pada media spesifik EMB: 43 Tabel 4.4 Hasil Uji Biokimia pada tiap koloni pada media EMB Warna koloni Uji Biokimia Hijau kilap logam Pink Hitam Ungu Glukosa Laktosa Maltosa Mannitol Sukrosa Indol Motilitas MR VP Sitrat TSIA +g +g +g +g +g + + +/+ gas +g +g +g + + +/+ +g +g +g +g + + -/+ +g + +g +g + + + -/+ gas Berdasarkan tabel 4.4., hasil uji biokimia pada koloni hijau kilap logam dapat memfermentasi semua karbohidrat disertai pembentukan gas, menurut Mahon C. R., Lehman D. C.,dan Manuselis G. (2015) apabila bakteri mampu memfermentasi dapat dilihat dengan adanya perubahan warna ungu menjadi kuning karena media mengandung indikator berupa phenol red yang bereaksi jika bakteri bersifat asam, asam yang terbentuk kemudian diubah menjadi H2 dan CO2 sehingga menghasilkan gas yang bisa dilihat pada tabung durham, hal ini sesuai dengan uji fermentasi karbohidrat pada bakteri Escherichia coli yang dapat meragi semua jenis karbohidrat. Berdasarkan hasil penelitian ini (tabel 4.4.) bakteri yang diisolasi pada media EMB menghasilkan koloni yang berwarna hijau kilap logam menghasilkan uji TSIA (+/+g), hal ini sesuai dengan hasil uji fermentasi karbohidrat koloni bakteri yang berwarna hijau kilap logam (tabel4.4) yang dapat meragi glukosa, laktosa dan sukrosa. Menurut Mahon C. R., Lehman D. C.,dan Manuselis G. (2015) hasil uji TSIA pada bakteri Escherichia coli yaitu (-/+ gas atau -/+ atau +/+g), berdasarkan tabel 4.4. koloni yang berwarna hijau kilap logam hasil uji TSIA (+/+ gas), artinya hasil uji TSIA yang dilakukan peneliti pada koloni yang berwarna hijau kilap logam sesuai dengan ciri khas bakteri Escherichia coli. Menurut 44 Acharya Tankeshwar (2013) hasil uji TSIA pada bakteri Escherichia coli yaitu +/+ gas, berdasarkan hal tersebut pada uji TSIA pada koloni hijau kilap logam menunjukkan hasil sesuai dengan bakteri Escherichia coli. Hasil uji biokimia menurut MacWilliam, Maria. P. Strurm, L. Tasha. (2013) dalam penelitian Kurniawan Arri (2013) pada hasil uji biokimia Escherichia coli menunjukkan bahwa pada uji indol positif dan menurut Acharya Tankeshwar (2013) pada hasil uji IMViC bakteri Escherichia coli yaitu (+, +, -, -), hal ini tidak sesuai dengan yang dilakukan oleh peneliti karena pada hasil uji IMViC pada koloni yang berwarna hijau kilat logam didapatkan hasil (-, +, -, -), menurut Cappuccino James G. dan Sherman Natalie (2014) dikarenakan pada uji indol untuk hasil positif membutuhkan waktu inkubasi selama 24-48 jam dengan penambahan reagen erlich sebanyak 5-10 tetes, tetapi pada penelitian yang dilakukan pada penelitian ini lama inkubasinya hanya 24 jam dan penambahan reagen erlich sebanyak 2 tetes, memungkinkan bakteri yang terdapat pada media SIM belum tumbuh pada batas minimal yang diperlukan, sehingga menunjukkan hasil negatif ketika ditambahkan reagen Kovac. Hasil uji IMViC pada koloni yang berwarna hijau kilat logam didapatkan hasil (-, +, -, -), menurut Mahon C. R., Lehman D. C.,dan Manuselis G. (2015) hasil IMViC pada bakteri Escherichiae yaitu (+/-, +, , -), artinya hasil uji IMViC pada koloni yang berwarna hijau kilat logam sesuai dengan hasil uji IMViC bakteri Escherichia coli, dikarenakan hasil uji indol bisa positif atau negatif. Berdasarkan kesesuaian hasil uji biokimia pada koloni hijau kilap logam dengan hasil uji biokimia bakteri Escherichia coli, pada penelitian ini dapat terkonfirmasi koloni yang berwarna hijau kilap logam merupakan bakteri Escherichia coli. Hasil uji fermentasi karbohidrat pada koloni yang berwarna pink pada Tabel 4.3. menunjukkan bakteri dapat memfermentasi glukosa, 45 mannitol dan sukrosa, hal ini sesuai menurut Acharya Tankeshwar (2013) bahwa bakteri yang tidak memfermentasi laktosa akan berwarna pink/tidak berwarna (colorless) pada EMB agar, contoh bakteri yang tidak memfermentasi laktosa dan dapat tumbuh pada media EMB agar seperi Salmonella sp. dan Shigella sp. Hasil isolasi koloni yang berwarna pink (tabel 4.4.) menunjukkan hasil uji TSIA (+/+), hal ini tidak sesuai dengan hasil uji fermentasi karbohidrat koloni bakteri yang berwarna pink (tabel 4.4), karena bakteri tidak bisa memfermentasi laktosa. Menurut Cappuccino James G. dan Sherman Natalie (2014) bakteri yang tidak bisa memfermentasi laktosa akan memberikan hasil -/+ dengan atau tanpa H2S. Hasil uji IMViC pada koloni yang berwarna pink (tabel 4.4.) menunjukkan hasil (-, +, -, -), menurut Mahon C. R., Lehman D. C.,dan Manuselis G. (2015) hasil IMViC tersebut sesuai seperti pada bakteri Salmonella sp., Shigella sonnei, beberapa spesies Yersinia sp., dan Proteus Penneri. Hasil uji fermentasi karbohidrat pada koloni yang berwarna hitam (tabel 4.4) menunjukkan bahwa bakteri dapat memfermentasi glukosa, laktosa, maltosa, dan mannitol. Hal ini sesuai menurut Hardy Diagnostic (2016) bahwa koloni bakteri yang tumbuh pada EMB jika dapat memfermentasi laktosa akan menghasilkan warna coklat hingga biruhitam, contoh bakteri yang memiliki kemampuan memfermentasi laktosa yang dapat tumbuh pada EMB agar seperti Escherichia coli dan Enterobacter sp. Hasil uji TSIA pada koloni yang berwarna hitam (tabel 4.4) yaitu (/+), hal ini sesuai dengan hasil uji fermentasi karbohidat koloni bakteri yang berwarna hitam (tabel4.4) yang tidak bisa meragi sukrosa. Menurut Cappuccino James G. dan Sherman Natalie (2014) bakteri yang tidak dapat memfermentasi sukrosa tetapi bisa memfermentasi glukosa akan 46 memberikan hasil (-/+) pada uji TSIA, beberapa contoh bakteri dengan hasil uji TSIA (-/+) seperti Shigella sp. dan beberapa Proteus sp. Hasil uji IMViC pada koloni yang berwarna hitam (tabel 4.4.) adalah (-, -, -, +), hal tersebut tidak sesuai menurut Cappuccino James G. dan Sherman Natalie (2014) bahwa bakteri akan memberikan hasil (+) pada MR dan negatif pada VP, hal ini berlaku sebaliknya dengan inkubasi selama 24-48 jam. Pada hasil uji biokimia koloni yang berwarna hitam menunjukkan hasil negatif baik pada MR maupun VP, kemungkinan terjadi hasil negatif palsu antara uji VP atau MR karena pada penelitian hanya dilakukan inkubasi selama 24 jam yang dapat menyebabkan jumlah bakteri masih terlalu sedikit untuk dapat bereaksi dengan MR atau VP saat ditambahkan reagen. Hasil uji fermentasi karbohidrat pada koloni yang berwarna ungu pada tabel 4.4 menunjukkan bahwa bakteri memiliki kemampuan untuk memfermentasi glukosa, maltosa, mannitol,dan sukrosa. Menurut Hardy Diagnostic (2016) bakteri yang dapat tumbuh pada media EMB agar dan dapat memfermentasikan sukrosa tetapi tidak memfermentasikan laktosa dapat menghasilkan warna koloni biru-hitam, contoh bakteri seperti Yersinia enterocolitica. Hasil uji TSIA pada koloni yang berwarna ungu (tabel 4.4) yaitu (/+ gas), hal ini sesuai dengan hasil uji fermentasi karbohidrat koloni bakteri yang berwarna ungu (tabel 4.4) karena bakteri dapat memfermentasi glukosa tetapi tidak bisa memfermentasi laktosa. Menurut Scarlab (2005) menjelaskan contoh bakteri dengan uji TSIA (-/+ gas) seperti Klebsiella pneumoniae, Salmonella choleraesuis, Proteus mirabilis, dan Morganella morganii. Hasil uji IMViC pada koloni yang berwarna ungu (tabel 4.4.) adalah (-, +, -, +), menurut Mahon C. R., Lehman D. C.,dan Manuselis G. (2015) hasil IMViC tersebut sesuai seperti pada bakteri Salmonella 47 choleraesuis, Pragia fontium, Escherichia blattae,dan Klebsiella pneumoniae. Dari hasil uji biokimia koloni yang berwarna ungu (tabel 4.4) menurut Mahon C. R., Lehman D. C., dan Manuselis G. (2015) menjelaskan bahwa bakteri Salmonella choleraesuis dapat meragi glukosa, mannitol dan maltosa tetapi tidak memfermentasi laktosa dan sukrosa, tetapi menurut Scarlab (2005) bakteri Salmonella choleraesuis dapat memfermentasi laktosa atau sukrosa sehingga menyebabkan hasil uji TSIA (-/+ gas), berdasarkan hal tersebut dapat disimpulkan koloni yang berwarna ungu mendekati ciri khas hasil uji biokimia dengan bakteri Salmonella choleraesuis. Gambar 4.5. hasil uji biokimia Fermentasi Glukosa, uji TSIA, dan IMViC pada koloni hijau kilap logam 2. Uji Biokimia pada Media SSA Berikut hasil uji biokimia pada koloni yang tumbuh pada media SSA yang disajikan dalam tabel berikut. 48 Tabel 4.5 Hasil Uji Biokimia pada tiap koloni pada media SSA Uji Biokimia Pink Glukosa Laktosa Maltosa Mannitol Sukrosa Indol Motilitas MR VP Sitrat TSIA +g +g +g +g + + -/+ Warna Koloni Putih Pink bertitik hitam transparan +g +g +g + + +g +g +g + + + + -/+ gas -/+ H2S Pada hasil uji biokimia koloni putih transparan pada tabel 4.5. didapatkan hasil tidak memfermentasi laktosa, hal ini sesuai menurut Tankeshwar Acharya (2013) yang menjelaskan bahwa Shigella sp. tidak memfermentasikan laktosa. Menurut MacWilliam, Maria. P. Strurm, L. Tasha. (2013) dalam penelitian Arri Kurniawan (2013) pada hasil uji biokimia Shigella sp. dapat memfermentasi glukosa, sukrosa dan maltosa, tetapi menurut Connie R. Mahon dkk (2015) menjelaskan bahwa pada 4 spesies Shigella sp. yaitu Shigella boydii, Shigella dysentriae, Shigella flexneri, dan Shigella sonnei semua menunjukkan tidak menfermentasi sukrosa dan laktosa, tetapi memfermentasi mannitol dan hanya Shigella sonnei yang dapat memfermentasi maltosa. Pada uji TSIA koloni putih transparan menunjukkan uji TSIA (-/+ gas), hal ini sesuai dengan hasil uji fermentasi karbohidrat koloni yang berwarna putih transparan (tabel 4.5.) yang dapat memfermentasikan glukosa dan tidak memfermentasikan laktosa, menurut Scarlab (2005) menjelaskan bahwa pada hasil pengujian TSIA bakteri Shigella sp. dapat memfermentasi glukosa disertasi pembentukan asam dan gas, dan tidak memfermentasi laktosa. Uji IMViC pada koloni putih transparan (tabel 4.5.) adalah (- - - -), hasil ini tidak sesuai dengan Shigella sp. menurut MacWilliam, Maria. P. Strurm, L. Tasha. (2013) dalam penelitian Arri Kurniawan (2013) yang 49 memiliki hasil Uji IMViC (- + - -), menurut James G. Cappuccino dan Natalie Sherman (2014) uji MR dilakukan dengan inkubasi selama 48 jam, tetapi di penelitian melakukan inkubasi selama 24 jam, sehingga kemungkinan terjadi kurangnya waku inkubasi yang menyebabkan hasil uji MR negatif. Hasil uji fermentasi karbohidrat pada koloni yang berwarna pink menunjukkan bakteri mampu memfermentasi glukosa, maltosa, mannitol, dan sukrosa tetapi tidak bisa memfermentasi laktosa. Menurut Hardy Diagnostic (2016) koloni bakteri yang tumbuh pada media SS agar jika tidak memfermentasi laktosa akan memberikan warna transparan/colorless dan koloni bakteri yang memfermentasi laktosa akan berwarna pink, berdasarkan hal tersebut berbeda dengan hasil pada koloni yang berwarna pink (tabel 4.5) karena tidak bisa memfermentasi laktosa tetapi terbentuk koloni yang berwarna pink. Menurut Aryal Sagar (2016) menjelaskan bahwa contoh koloni bakteri yang tidak memfermentasi laktosa seperti Shigella sp. akan menghasilkan warna koloni transparan/colorless dan Salmonella sp. akan menghasilkan warna transparan/colorless disertai titik hitam. Hasil uji TSIA pada koloni yang berwarna pink (tabel 4.5.) yaitu (/+), hal ini sesuai dengan hasil fermentasi karbohidrat koloni yang berwarna pink (tabel 4.5.) yang bisa memfermentasikan glukosa yan bersifat asam tetapi tidak bisa memfermentasi laktosa. Menurut Scarlab contoh bakteri dengan hasil uji TSIA (-/+) adalah Salmonella choleraesuis dan Shigella sp., menurut Mahon C. R., Lehman D. C.,dan Manuselis G. (2015) menjelaskan contoh bakteri dengan hasil uji TSIA (-/+) adalah Providencia rettgeri, Morganella morganii, Citrobacter sp., Escherichi coli, Yersinia pestis, dan Serratia sp. Hasil uji IMViC pada koloni yang berwarna pink yaitu (-, +, -, +), menurut Mahon C. R., Lehman D. C.,dan Manuselis G. (2015) menjelaskan contoh bakteri dengan hasil uji IMViC (-, +, -, +) seperti Citrobacter gillenii. 50 Dari hasil uji biokimia koloni yang berwarna pink (tabel 4.5) berdasarkan hasil uji TSIA dan IMViC mendekati ciri khas uji biokimia pada bakteri Citrobacter gillenii, tetapi menurut Mahon C. R., Lehman D. C.,dan Manuselis G. (2015) menjelaskan bakteri Citrobacter gillenii dapat meragi semua jenis karbohidrat, tetapi pada hasil uji fermentasi koloni yang berwarna pink (tabel 4.5.) menunjukkan tidak memfermentasi laktosa. Hasil fermentasi karbohidrat pada koloni bakteri yang berwarna putih titik hitam (tabel 4.5.) menunjukkan bahwa bakteri dapat memfermentasi glukosa, maltosa, mannitol dan sukrosa tetapi tidak memfermentasi laktosa, hal ini sesuai dengan penelitian Aryal Sagar (2016) yang menjelaskan bahwa contoh koloni bakteri tidak memfermentasi laktosa seperti Salmonella sp. akan menghasilkan warna transparan/colorless disertai titik hitam. Hasil uji TSIA pada koloni yang berwarna putih dengan titik hitam (tabel 4.5.) ialah (-/+ H2S), hal ini sesuai dengan hasil fermentasi karbohidrat pada koloni bakteri yang berwarna putih dengan titik hitam karena memfermentasi glukosa yang menghasilkan asam tetapi tidak memfermentasikan laktosa. Menurut Scarlab (2005) menjelaskan bahwa contoh bakteri dengan hasil TSIA (-/+ H2S) seperti Salmonella enteritidis dan Salmonella typhi. Hasil uji IMViC pada koloni bakteri yang berwarna putih dengan titik hitam adalah (-, +, -, +), menurut Mahon C. R., Lehman D. C.,dan Manuselis G. (2015) menjelaskan contoh bakteri dengan hasil IMViC (-, +, -, +) adalah Salmonella enterica. Dari hasil uji biokimia koloni yang berwarna putih dengan titik hitam (tabel 4.5) berdasarkan hasil uji fermentasi, IMViC, dan TSIA mendekati ciri khas uji biokimia pada bakteri Salmonella sp. 51 Gambar 4.6. Hasil uji biokimia fermentasi Glukosa, TSIA, dan IMViC pada koloni putih transparan 4.2 Keterbatasan Penelitian Dalam melakukan penelitian, peneliti menemukan beberapa keterbatasan penelitian, yaitu: 1. Tidak meneliti kebersihan dan sanitasi pembuatan dan penjualan jajanan cilok 2. Tidak diketahui penyakit foodborne disease yang disebabkan kontaminasi bakteri Escherichia coli dan Shigella sp. menyebabkan manifestasi klinis seperti diare/disentri. 3. Tidak meneliti hubungan cemaran bakteri dengan kondisi klinis anak sekolah dasar, sehingga tidak dapat diketahui apakah makanan jajanan cilok dapat menyebabkan keracunan makanan. 4. Penelitian ini tidak melakukan pengulangan pada uji biokimia dan tidak dilakukan kontrol positif untuk memastikan hasil yang diuji sehingga memungkinkan adanya hasil negatif palsu atau positif palsu pada hasil uji biokimia. BAB V KESIMPULAN DAN SARAN 5.1 Kesimpulan Kesimpulan dalam penelitian ini yaitu sebagai berikut: 1. Semua sampel cilok yang diuji menunjukkan cemaran bakteri dengan perhitungan Total Plate Count (TPC) tidak melebihi ambang batas yang telah ditentukan oleh BPOM RI tahun 2012 dengan batas cemaran maksimum 1 x 105. 2. Terkonfirmasi pada sampel 4 cilok yang diuji mengandung bakteri Escherichia coli, dan diduga pada sampel 2, 4, dan 5 sampel cilok yang diuji mengandung bakteri Shigella sp. 3. Pada sampel cilok 1 dan 3 tidak mengandung bakteri Escherichia coli dan Shigella sp. 4. Sampel cilok dengan bumbu kacang dan tidak bumbu kacang tidak mempengaruhi banyaknya jenis bakteri. 5.2 Saran Sesuai dengan keterbatasan penelitian, peneliti memberikan saran sebagai berikut: 1. Penelitian lebih lanjut mengenai faktor yang mempengaruhi kontaminasi bakteri pada jajanan cilok 2. Penelitian lebih lanjut mengenai manifestasi foodborne disease hasil dari makanan yang tercemar bakteri pada anak sekolah dasar 3. Dilakukan kontrol positif pada uji biokimia bakteri Shigella sp. dan Escherichia coli dan melakukan pengulangan uji biokimia pada koloni yang sama. 52 53 DAFTAR PUSTAKA 1. Badan POM RI. Dialektika TVRI Bandung; Keamanan Pangan Jajanan; 2016 [cited 2016 mei 20] Available from: http://www.pom.go.id/new/index.php/view/berita/8036/DialektikaTVRI-Bandung---Keamanan-Pangan-Jajanan.html 2. Badan POM RI. Laporan Kinerja Badan POM Tahun; 2014 [cited 2016 Mei 28]. Available from: http://www.pom.go.id/ppid/2015/R2TN2014.pdf 3. Badan POM RI. Informasi Kandungan Gizi Pangan Jajanan Anak Sekolah; 2013 [cited 2016 Mei 8]. Available from: http://klubpompi.pom.go.id/id/petunjuk-pedoman/infromasikandungan-gizi 4. Badan POM RI. Laporan Tahunan Badan POM ; 2015 [cited 2016 Mei 05]. Available from: http://www.pom.go.id/ppid/2016/kelengkapan/laptah2015.pdf 5. Kemenkes RI. Situasi pangan jajanan anak sekolah. Infodatin pusat data dan informasi kesehatan RI; 2014. [cited 2016 Mei 8]. Available from: www.depkes.go.id/resources/download/pusdatin/infodatin/infodatin-pjas.pdf 6. WHO. Foodborne disease; 2016 [cited 2016 september 12]. Available from: http://www.who.int/topics/foodborne_diseases/en/ 7. WHO. Dysentery; 2016 [cited 2016 september 12]. Available from: http://www.who.int/topics/dysentery/en/ 8. WHO.Escherichia coli infections; 2016 [cited 2016 september 12]. Available from: http://www.who.int/topics/escherichia_coli_infections/en/ 9. WHO.Penyakit bawaan makanan: suatu permasalahan kesehatan dan ekonomi global; [cited 2016 Mei 19]. Available from: who.int/iris/bitstream/10665/42428/3/9794487074_chapter1_ind.pdf 10. Food Safety. Shigella; 2016 [cited 2016 Oktober 2]. Available from: https://www.foodsafety.gov/poisoning/causes/bacteriaviruses/shigella/ 54 55 11. Riadi Muchlisin, Definisi Makanan Jajanan; 2016 [cited 2016 Mei 05]. Available from: http://www.kajianpustaka.com/2013/11/definisi-dan-kandunganberbahaya-dalam.html 12. CDC. Foodborne Germs and Illness. [cited 2016 oktober 13] Available from http://www.cdc.gov/foodsafety/foodborne-germs.html 13. Siagian A. Mikroba Patogen pada makanan dan sumber pencernaannya. USU institutional Repository. 2001 Juni. cited 2016 Mei 14. Betty dan Yendri. Cemaran mikroba terhadap telur dan daging ayam. Dinas Peternakan Provinsi Sumatra Barat, Padang. 2007. 15. Mansauda Karlah L. R., Fatimawali, Kojong Novel. 2014. Analisis Cemaran Bakteri Coliform pada Saus Tomat Jajanan Bakso Tusuk yang Beredar di Manado. Jurnal Ilmiah Farmasi – UNSRAT Vol. 3 No. 2 Mei 2014 ISSN 2302 – 2493 16. WHO. Prevention of Foodborne Disease: The Five Keys to Safer Food [cited 2016 Mei 28] Available from: http://who.int/topics/food_safety/flyer_keys_en.pdf 17. Kemenkes RI. Situasi pangan jajanan anak sekolah. Infodatin pusat data dan informasi kesehatan RI. 7 april 2014. 18. Judarwanto, Widodo. Perilaku Makan Anak Sekolah 2012. [cited 2016 Mei 19] Available from: http://gizi.depkes.go.id/wp-content/uploads/2012/05/perilaku-makananak-sekolah.pdf 19. Iklimah. Perpustakaan Digital Budaya Indonesia; 2015 [cited 2016 September 20]. Available from: http://budaya-indonesia.org/Cilok-1/ 20. Kokim. Perpustakaan Digital Budaya Indonesia;2016 [cited 2016 September 20]. Available from: http://budaya-indonesia.org/Cilok-Bandung/ 21. Riyanto Agus, Abdillah A. D. Faktor yang Memengaruhi Kandungan E. coli Makanan Jajanan SD di Wilayah Cimahi Selatan.2012 56 22. Jorgensen James H., dkk.2015.Manual of Clinical Microbiology 11th Edition. Washington, DC: ASM PRESS. Page 685-699 23. Strum, Tasha dan Cabrillo College. E. coli Gram Stain. 2015. [cited 2016 September 22] Available from: http://www.microbeworld.org/component/jlibrary/?view=article&id=1 3348 24. Mishra Saroj K., Agrawal Dipti. 2013. A Concise Manual of Pathogenic Microbiology. Hoboken, New Jersey: Wiley-Blackwell, page 71-75 25. Motarjemi. 2006. Dasar-dasar keamanan pangan untuk petugas kesehatan. Jakarata: EGC. 26. Yersi Tangahu. Uji kuantitatif cemaran bakteri pada makaan siomay di kota gorontalo. Fakultas farmasi. UG. 2014. 27. Safriana. Perilaku memilih jajanan pada siswa sekolah dasar di SD negeri garot kecamatan darul imarah kabupaten aceh besar tahun. Fakultas kesehatan masyarakat. UI. 2012. 28. Mahon Connie R., Lehman Donald C., Manuselis George. 2015. Texbook of Diagnostic Microbiology 5th Edition, Missouri: Saunders Elsevier, page 421-451 29. Ahmad Nafees, dkk. 2014. Sherris Medical Microbiology 6th Edition. Unites States: McGraw Hill Education, page 579-598 30. Pommerville Jeffey C. 2011. Alcamo’s Fundamental of Microbiology 9th Edition.United States of America: Jones and Barlett Publisher, page 351-358 31. Kayser Fritz H., dkk. 2005. Medical Microbiology. New York: Thieme Stuttgart, page 278-289 32. Jawetz, Melnick, & Adelberg. 2012. Mikrobiologi kedokteran. Penerjemah: aryandhito Widhi Nugroho, dkk. Ed. 25 Jakarta: EGC Halaman 223-236 33. Todar, Kanneth. 2012. Todar’s Online Textbook of Bacteriology. [cited 2016 September 22] Available from: http://textbookofbacteriology.net/Shigella.html 57 34. Harti AS, Dra., M.S.i. MIKROBIOLOGI KESEHATAN: Peran Mikrobiologi dalam Bidang Kesehatan. Edisi 1. Yogyakarta: Andi. 2015. Halaman 184-105 35. Hartono, Andry. Penyakit Bawaan makanan: Fokus Pendidikan Kesehatan. Jakarta. EGC. 2006. Halaman 58-1 36. Cappuccino James G, Sherman Natalie. 2014. Microbiology: A Laboratory Manual 10th Edition, Unites States of America: Pearson. Halaman 153-177 37. BPOM. Pedoman kriteria cemaran pada pangan siap saji dan industri BPOM 2012. [cited 2016 oktober 15] Available from: http://standarpangan.pom.go.id/ 38. Fauziah Riska Rian. Kajian Keamanan Pangan Bakso dan Cilok yang Beredar di Lingkungan Universitas Jember Ditinjau dari Kandungan Boraks, Formalin dan TPC. FTP. Universitas Jember. 2013 39. Wariyah Chatarina, Dewi Sri Hartati C. Cemaran Mikrobia pada Pangan Jajanan Anak Sekolah (PJAS) di Wilayah Kabupaten Kulon Progo - DIY . Fakultas Agroindustri. Universitas Mercu Buana Yogyakarta. 2014 40. Aref. Analisis Aspek Mikrobiologi Bakso Bakar yang Dijual di Kecamatan Tampan. Fakultas Pertanian dan Peternakan. Universitas Islam Negeri Sultan Syarif Kasim Riau. 2016 41. Hardy diagnostic. Instruction For Use EMB AGAR. [cited 2016 September 29] Available from: https://catalog.hardydiagnostics.com/cp_prod/Content/hugo/EMBAgar .htm 42. Djodjoka Jilbi A., Malonda Nancy S.H, Punuh Maureen I. Identifikasi Bakteri Escherichia coli pada Jajanan Bakso Tusuk di Sekolah Dasar Kota Manado. Fakultas Kesehatan Masyarakat. Universitas Sam Ratulangi Manado. 2014 43. Novianti Dewi. Pemeriksaan Kandungan Bakteri Escherichia coli pada Jajanan Bakso Tusuk di Pasar Tradisional Kota Palembang. Fakultas MIPA. Universitas PGRI Palembang. 2015 58 44. Hardy diagnostic. Instruction For Use SS AGAR. [cited 2016 September 29] Available from: https://catalog.hardydiagnostics.com/cp_prod/Content/hugo/SSAgar.ht m 45. Aryal Sagar. Salmonella Shigella (SS) Agar- compotition, Principle, Uses, Preparation and Result Interpretation. [cited 2016 September 29] Available from: http://www.microbiologyinfo.com/salmonella-shigella-ss-agarcomposition-principle-uses-preparation-and-result-interpretation/ 46. Sulaeman, Pratiwi Linda. Deteksi Bakteri Escherichia coli dan Shigella sp Dalam Telur Balado Serta Resistensinya terhadap Beberapa Antibiotik. Fakultas Kedokteran dan Ilmu Kesehatan UIN Syarif Hidayatullah Jakarta. 2015. 02/08/2016 47. Acharya Tankeshiwar. Triple Sugar Iron Agar (TSI) : Principle, Procedure adn Interpretation [cited 2016 September 29] Available from: https://microbeonline.com/triple-sugar-iron-agar-tsi-principleprocedure-and-interpretation/ 48. Kurniawan Arri. Deteksi Bakteri Patogen dalam Es Balok yang di jual di Depot Es Balok di Pasar Tradisional Bandar Lampung. Fakultas Kedokteran. Universitas Lampung. 2013 49. Acharya Tankeshiwar. IMViC Test: Principle, Procedure and Results [cited 2016 September 29] Available from: http://microbeonline.com/imvic-tests-principle-procedure-and-results/ 50. Acharya Tankeshiwar. Eosin Methylene Blue (EMB) Agar : Composition, uses and colony characteristics. [cited 2016 oktober 12] from: https://microbeonline.com/eosin-methylene-blue-emb-agarcomposition-uses-colony-characteristics/ 51. Scarlab. Triple Sugar Iron Agar (TSI Agar) [cited 2016 oktober 12] Available from: http://www.scharlabmagyarorszag.hu/katalogus/01-192_TDS_EN.pdf 59 52. Acharya Tankeshiwar. Shigella: Disease, properties, pathogenesis and laborator diagnosis [cited 2016 September 29] Available from https://microbeonline.com/shigella-disease-properties-pathogenesisand-laboratory-diagnosis/ 60 LAMPIRAN Lampiran 1 Alat dan Bahan Penelitian Timbangan digital Blender Hotplate Vortex Laminar air flow Kulkas penyimpanan media steril Kulkas nonsteril Rak tabung reaksi Rak tabung reaksi 61 Lampiran 1 Alat dan Bahan Penelitian Gelas beker 500 ml Tabung erlenmeyer 500 ml Tabung ukur 100 ml Mikropipet 1000 µl Cawan petri Batang L Spatula Ose bulat dan jarum Bunsen 62 Lampiran 1 Alat dan Bahan Penelitian Set pewarnaan Gram Mikroskop Sampel Cilok Media NB Media NA Media SSA Media EMB Autoklaf 63 Lampiran 1 Alat dan Bahan Penelitian Oven Indikator uji biokimia Inkubator 64 Lampiran 2 Cara Kerja Penelitian Timbang media Pembuatan uji biokimia Sterilisasi alat di oven Pembuatan media Stir pada hot plate Penuangan pada tabung reaksi Sterilisasi media Sampel di blender Penimbangan sampel 65 Lampiran 2 Cara Kerja Penelitian Vortex sampel Isolasi sampel pada cawan petri(NA,EMB, SSA) Pengenceran pada media NB Uji biokimia koloni Vortex pengenceran media NB 66 Lampiran 3 Hasil Total Plate Count 10-1 (1) 10-1 (2) 10-2 (1) 10-2 (2) 10-3 (1) 10-3 (2) 10-4 (1) 10-4 (2) Kontrol 67 Lampiran 3 Hasil Total Plate Count Media SSA Media EMB 68 Lampiran 4 Hasil Perhitungan Penelitian Konsentrasi Sampel 1 Sampel 2 Sampel 3 Sampel 4 Sampel 5 P1 P2 P1 P2 P1 P2 P1 P2 P1 P2 -1 ~ 96 62 108 133 ~ ~ 144 188 236 -1 10 ke 2 ~ ~ 118 99 82 ~ 154 117 96 ~ 10-2 ke 1 48 62 58 71 52 ~ 40 67 12 26 10-2 ke 2 10 ke 1 103 57 31 65 7 115 47 99 27 30 -3 37 39 23 34 18 26 46 24 5 59 -3 10 ke 2 53 21 12 28 8 37 120 8 3 6 10-4 ke 1 18 0 15 0 4 1 29 18 7 18 10-4 ke 2 1 7 7 0 21 2 24 3 4 17 Kontrol 0 0 0 0 0 0 0 0 0 0 10 ke 1 Jumlah Koloni pada Setiap Pengambilan Konsentrasi Sampel 1 Sampel 2 Sampel 3 Sampel 4 Sampel 5 P1 P2 P1 P2 P1 P2 P1 P2 P1 P2 ~ ~ 90 104 108 ~ ~ 131 142 ~ 10-2 76 60 45 68 30 ~ 44 83 20 28 10 -3 45 30 18 31 13 32 83 16 4 33 10 -4 10 4 11 0 13 2 27 11 6 18 0 0 0 0 0 0 0 0 0 0 10 -1 kontrol Tabel Jumlah Rata-rata Koloni Bakteri Setiap Konsentrasi pada setiap Pengambilan Sampel Sampel Sampel 1 Sampel 2 Sampel 3 Sampel 4 Sampel 5 10-1 ~ 97 x 101 ~ ~ ~ 10-2 68 x 102 57 x 102 ~ 64 x 102 24 x 102 10-3 38 x 103 25 x 103 23 x 103 50 x 103 19 x 103 10-4 7 x 105 6 x 104 8 x 104 19 x 104 12 x 104 Kontrol 0 0 0 0 0 Konsentrasi Tabel Jumlah Koloni pada Setiap Sampel 69 Lampiran 5 Riwayat Penulis DAFTAR RIWAYAT HIDUP NAMA : Aris Rivaldi Wicaksono Jenis kelamin : Laki-Laki Tempat, tanggal lahir : Gresik, 10 Desember 1995 Agama : Islam Alamat : Jl. Raya BalongPanggang Gresik No.4 Email : [email protected] Riwayat pendidikan : 1. TK Hidayatul Ummah Balongpangang Gresik 1999-2001 2. MI Hidayatul Ummah Balongpangang Gresik 2001-2007 3. MTs Negeri Gresik 2007-2010 4. MA.Unggulan Amanatul Ummah Mojokerto 2010-2013 5. PSKPD FKIK UIN Syarif Hidayatullah Jakarta 2013-Sekarang