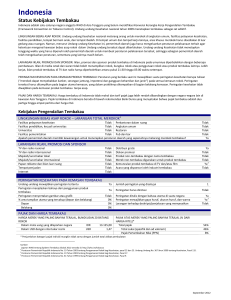
Aktivitas antibakteri ekstrak tembakau temanggung varietas
advertisement

AKTIVITAS ANTIBAKTERI EKSTRAK TEMBAKAU TEMANGGUNG VARIETAS GENJAH KEMLOKO SKRIPSI PRATIWI EKA PUSPITA F34063211 FAKULTAS TEKNOLOGI PERTANIAN INSTITUT PERTANIAN BOGOR BOGOR 2011 ANTIBACTERIAL ACTIVITY OF TEMANGGUNG TOBACCO EXTRACT VARIETY GENJAH KEMLOKO 1) Meika Syahbana Rusli, 2)Suryani, and 1)Pratiwi Eka Puspita 1) Department of Agroindustrial Technology, Faculty of Agricultural Technology 2) Department of Biochemistry, Faculty of Mathematic and Natural Science Bogor Agricultural University, Dramaga Campus, PO BOX 220, Bogor, West Java Indonesia ABSTRACT Utilization of tobacco extract as bactericide based on prediction of antibacterial compound which would be found on tobacco leaves from Temanggung. The objective of this research is to study the potential of antibacterial activity from Temanggung local tobacco leaves extract. The raw materials in this research include upper and middle leaves of tobacco and under leaves of tobacco. The tobacco extracts were prepared by soxhletation method using ethanol. Then, the extracts were evaluated by phytochemical analysis and antibacterial activity test. The yield of tobacco leaves ethanol extract of upper and middle leaves of tobacco was better (22.20%) compare with under leaves of tobacco (14.42%) in wet basis. Those extracts yield were predicted higher than actual value because there are moisture content on upper and middle leaves of tobacco (12.37%) and under leaves of tobacco (10.69%). Phytochemical test showed that tobacco leaves ethanol extract of upper and middle leaves of tobacco contained of alkaloid, flavonoid, terpenoid, and steroid. It is difference with tobacco leaves ethanol extract of under leaves of tobacco which contained alkaloid, flavonoid, and terpenoid. Those compounds were predicted as bioactive materials which have an antibacterial activity. Antibacterial activity test has been done with extracts of upper and middle leaves of tobacco. The result showed that extracts was better to inhibit E. coli than S. aureus on concentration 80-100% (w/v). Beside that, upper and middle leaves of tobacco have a similar activity antibacterial on concentration of 20-60% (w/v). Meanwhile, activity antibacterial on concentration of 20% (w/v) were classified to low activity and have a medium activity on concentration of 40-60% (w/v) to S. aureus and E. coli. Keywords: leave tobacco extract, antibacterial activity, S. aureus, E. coli PRATIWI EKA PUSPITA. F34063211. Aktivitas Antibakteri Ekstrak Tembakau Temanggung Varietas Genjah Kemloko. Di bawah bimbingan Meika Syahbana Rusli dan Suryani. 2011. RINGKASAN Pemanfaatan ekstrak tembakau sebagai bakterisida telah lama dikembangkan. Hal itu didasari adanya senyawa antibakteri yang terkandung dalam daun tembakau. Penelitian ini bertujuan membuktikan potensi ekstrak tembakau varietas Genjah Kemloko asal Temanggung sebagai senyawa sediaan antibakteri yang merupakan pemanfaatan alternatif dari tembakau. Penelitian ini telah berlangsung sejak September hingga Oktober tahun 2010 di Laboratorium Kimia Analitik dan Biokimia IPB. Bahan baku yang digunakan dalam penelitian ini adalah daun tembakau varietas Genjah Kemloko yang telah dijemur di bawah sinar matahari selama 2 hari dan dihaluskan hingga berukuran 60 mesh dalam kondisi kering. Daun tembakau tersebut terdiri atas sampel daun yang dipetik di bagian atas, tengah, dan bawah pada batang tanaman. Penelitian diawali dengan mengukur kadar air kedua sampel. Selanjutnya, dilakukan ekstraksi tembakau menggunakan metode soxletasi dengan pelarut etanol. Metode soxletasi dilakukan dengan cara melarutkan tembakau serbuk (TS) sebanyak 10 g dalam 100 ml pelarut dan dimasukkan dalam alat soxlet. Refluksi soxletasi berlangsung hingga 6 kali siklus selama 90 menit. Setelah diperoleh ekstrak tembakau kemudian dilakukan pengukuran rendemen dan uji fitokimia (alkaloid, flavonoid, terpenoid, dan steroid). Penelitian dilanjutkan dengan melakukan pengujian aktivitas antibakteri yang diawali dengan kegiatan peremajaan bakteri. Peremajaan bakteri dilakukan dengan meregenerasi bakteri S. aureus dan E. coli dalam media LB masing-masing 10 ml dan diinkubasi bergoyang (shaker incubator) selama 24 jam pada suhu 37oC, 200 rpm. Remajaan kultur bakteri ditumbuhkan pada cawan Petri yang berisi media nutrient agar (NA) dengan mengambil sebanyak 50 µL bila nilai kerapatan optikalnya (OD)>1 dan 100 µL bila ODnya<1. Media didiamkan hingga memadat, lalu dilubangi menggunakan gel puchner sebanyak 5 lubang. Pengujian aktivitas antibakteri terhadap bakteri S. aureus dan E. coli dilakukan dengan cara menumbuhkan remajaan bakteri dalam media NA sebanyak 50 µL bila ODnya>1 dan 100 µL bila ODnya<1. Media didiamkan hingga padat. Media lalu dilubangi menggunakan gel puchner sebanyak 7 lubang. Masing-masing lubang diisi pengenceran ekstrak dengan berbagai konsentrasi (20% b/v, 40% b/v, 60% b/v, 80% b/v, 100% b/v), kontrol negatif (DMSO) dan kontrol positif (tetrasiklin 10%). Sebanyak 50 µL dari masing-masing ekstrak diletakkan pada lubang yang telah dibuat. Media tersebut diinkubasi pada suhu 37oC selama 24 jam. Zona bening yang terbentuk merupakan indikator aktivitas antibakteri. Kadar air daun tembakau campuran bagian atas dan tengah serta bagian bawah secara berturut-turut adalah 12.37% dan 10.69%. Adanya nilai kadar air tersebut akan berpengaruh terhadap nilai rendemen ekstrak yang dihasilkan. Rendemen esktrak etanol daun tembakau campuran bagian atas dan tengah lebih tinggi (22.20% (b/b)) dibandingkan dengan bagian bawah (14.42% (b/b)) yang diperhitungkan dengan basis basah. Namun demikian, kemungkinan nilai rendemen yang sebenarnya lebih rendah daripada nilai yang ditunjukkan pada hasil penelitian. Tingginya rendemen ekstrak tembakau diduga dipengaruhi oleh adanya kadar air pada rendemen ekstrak yang belum terpisahkan. Sementara itu, hasil uji fitokimia secara kualitatif menunjukkan bahwa ekstrak etanol daun tembakau campuran bagian atas dan tengah mengandung senyawa flavonoid, alkaloid, terpenoid, dan steroid. Hal itu berbeda dengan ekstrak etanol daun tembakau bagian bawah yang hanya mengandung senyawa flavonoid, alkaloid, dan terpenoid. Di antara keseluruhan senyawa tersebut, alkaloid diduga terdapat dalam jumlah besar sedangkan flavonoid dan terpenoid terdapat dalam jumlah sama pada daun tembakau secara kualitatif. Dengan demikian, dapat diduga bahwa alkaloid paling berperan sebagai komponen bioaktif yang memiliki aktivitas antibakteri. Uji aktivitas antibakteri hanya dilakukan terhadap ekstrak etanol daun tembakau campuran bagian atas dan tengah, sedangkan pengujian aktivitas antibakteri oleh ekstrak etanol daun tembakau bagian bawah tidak dilakukan. Hal itu berdasarkan pertimbangan bahwa data yang diperoleh kurang layak untuk diuji lebih lanjut. Pada pengujian daya hambat ekstrak terhadap bakteri, diketahui bahwa ekstrak etanol daun tembakau campuran bagian atas dan tengah dengan konsentrasi 80% b/v dan 100% b/v lebih baik aktivitasnya dalam menghambat pertumbuhan bakteri E. coli (diameter daya hambatnya adalah 7 mm) dibandingkan S. aureus (diameter daya hambatnya adalah 8 mm). Hal itu dikarenakan dinding sel bakteri S. aureus lebih tipis dibandingkan E. coli sehingga mudah dirusak oleh ekstrak etanol daun tembakau campuran bagian atas dan tengah. Ekstrak etanol daun tembakau pada konsentrasi 20% b/v tergolong lemah dalam hal kemampuannya menghambat S. aureus dan E. coli dan tergolong sedang pada konsentrasi 40%-60% (b/v). Diameter zona hambat yang terbentuk pada berbagai variasi konsentrasi 20% b/v, 40% b/v, 60% b/v, 80% b/v, dan 100% b/v terhadap S. aureus dan E. coli secara berturut-turut adalah 4 mm, 6 mm, 6 mm, 7 mm, 7 mm dan 4 mm, 6 mm, 6 mm, 8 mm, 8 mm. Sementara itu, uji kontrol negatif menggunakan DMSO menunjukkan tidak adanya penghambatan pertumbuhan bakteri dan uji kontrol positif menggunakan tetrasiklin 10% menunjukkan daya hambat kuat (29 mm dan 37 mm) terhadap S. aureus dan E. coli. Penelitian ini menunjukkan bahwa ekstrak etanol daun tembakau campuran bagian atas dan tengah tidak memiliki aktivitas antibakteri yang kuat terhadap S. aureus dan E. coli. Perlu dilakukan penelitian lebih lanjut mengenai penentuan senyawa bioaktif ekstrak daun tembakau asal Temanggung yang memiliki aktivitas antibakteri paling optimum. AKTIVITAS ANTIBAKTERI EKSTRAK TEMBAKAU TEMANGGUNG VARIETAS GENJAH KEMLOKO SKRIPSI Sebagai salah satu syarat untuk memperoleh gelar SARJANA TEKNOLOGI PERTANIAN pada Departemen Teknologi Industri Pertanian Fakultas Teknologi Pertanian Institut Pertanian Bogor Oleh PRATIWI EKA PUSPITA F34063211 FAKULTAS TEKNOLOGI PERTANIAN INSTITUT PERTANIAN BOGOR BOGOR 2011 Judul Skripsi : Aktivitas Antibakteri Ekstrak Tembakau Temanggung Varietas Genjah Kemloko Nama : Pratiwi Eka Puspita NRP : F34063211 Menyetujui, Pembimbing I Pembimbing II Dr. Ir. Meika Syahbana Rusli, M.Sc. Agr NIP. 19620505 198903 1 027 Dr. Suryani, SP, M.Sc NIP. 19681031 200604 2 001 Mengetahui : Ketua Departemen Prof. Dr. Ir. Nastiti Siswi Indrasti NIP. 19621009 198903 2 001 Tanggal lulus : Februari 2011 PERNYATAAN MENGENAI SKRIPSI DAN SUMBER INFORMASI Saya menyatakan dengan sebenar-benarnya bahwa skripsi dengan judul: Aktivitas Antibakteri Ekstrak Tembakau Temanggung Varietas Genjah Kemloko adalah hasil karya saya sendiri dengan arahan Dosen Pembimbing Akademik, dan belum diajukan dalam bentuk apapun pada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini. Bogor, Februari 2011 Yang membuat pernyataan Nama : Pratiwi Eka Puspita NRP : F34063211 BIODATA PENULIS Pratiwi Eka Puspita. Lahir di Temanggung, 22 Februari 1989 dari ayah Yekti Toto Raharjo dan ibu Gati Nurhidayati, sebagai anak pertama dari empat bersaudara. Penulis menamatkan SMA pada tahun 2006 dari SMA Negeri 1 Temanggung dan pada tahun yang sama diterima di IPB melalui jalur Undangan Masuk IPB. Penulis memilih Departemen Teknologi Industri Pertanian, Fakultas Teknologi Pertanian. Selama mengikuti perkuliahan, penulis aktif dalam berbagai kegiatan termasuk menjadi pengurus LDK Al-Hurriyah. Penulis melaksanakan Praktik Lapangan pada tahun 2009 di PT. Takasago Indonesia, Purwokerto, Jawa Tengah dengan judul “Teknologi Proses Redistilasi Minyak Nilam di PT. Takasago Indonesia dan Teknologi Penyulingan Industri Kecil Minyak Nilam di Purwokerto”. KATA PENGANTAR Segala puji teruntuk Allah swt yang telah melimpahkan segala rahmatNya sehingga penulisan skripsi yang berjudul “Aktivitas Antibakteri Ekstrak Tembakau Temanggung Varietas Genjah Kemloko” dapat terselesaikan dengan baik. Penelitian ini dilaksanakan di Laboratorium Kimia Analitik dan Biokimia, FMIPA IPB, sejak bulan September hingga Oktober 2010. Dengan telah selesainya penelitian hingga tersusun skripsi ini, penulis ingin menyampaikan penghargaan dan terima kasih yang sebesar-besarnya kepada: 1. 2. 3. 4. Ayahanda, ibunda, adik-adik, dan keluarga besar yang telah banyak memberikan dukungan. Dr. Ir. Meika Syahbana Rusli, M.Sc. Agr sebagai dosen pembimbing utama. Dr. Suryani, M.Sc sebagai dosen pembimbing pendamping. Pak Prayoga Suryadarma dan Pak Bambang yang telah banyak memberikan inspirasi selama di kampus. 5. Pak Abdullah, Mbak Farida, Mbak Hidayah, Mbak Mitha, Mbak Listya, dan Mbak Eli yang telah mengajarkan banyak hal. 6. Teman-teman kosan Wahdah Indah, Mbak Linda, Yanti, Mbak Eva, Olif, Sarah, Made, Irma, Nisa, Simaw, Eka, Icha, dan Oni. 7. Teman-teman kosan Pondok Dewi, Okta, Risti, Ida, Dian, Siti, Wahyu, Rini, Sarah, Iyong, Tiara, dan Erlin. 8. Tim Humairoh seluruh angkatan, termasuk Dian, Umul, Manik, Dina, Resti, dan Icha. 9. Spesial untuk teman-teman seperjuangan LDK Al-Hurriyah 10. Teman-teman TIN 43 IPB. 11. Adik-adik Aisyah 45, Reni, Rathi, Dila, Ayu, Siti, dan Alya. 12. Adik-adik asistensi PAI 46, Aktris, Jideng, Intan, Fatia, Sarah, Santi, April, Anggun, Tria, Rizka, dan Aya. 13. Teman-teman Forces dan Himalogin. 14. Teman-teman FIM dan FLP. 15. Tim dahsyat dalam tur perlombaan, Vika, Iqbal, Dhaniar, Riska, Rinda, dan Ahmad. 16. Kimura-sensei dan Rie-san atas apresiasinya. 17. Serta setiap pribadi yang telah banyak memberikan doa dan senyum kepada penulis. Akhirnya penulis berharap semoga tulisan ini bermanfaat dan memberikan kontribusi yang nyata terhadap perkembangan ilmu pengetahuan. Bogor, Februari 2011 Pratiwi Eka Puspita iii DAFTAR ISI Halaman KATA PENGANTAR .....................................................................................................................iii DAFTAR ISI....................................................................................................................................iv DAFTAR TABEL............................................................................................................................. v DAFTAR GAMBAR .......................................................................................................................vi I. PENDAHULUAN .........................................................................................................................1 A. LATAR BELAKANG .........................................................................................................1 B. TUJUAN .............................................................................................................................. 2 II. TINJAUAN PUSTAKA ...............................................................................................................3 A. BOTANI TEMBAKAU .......................................................................................................3 B. TEMBAKAU TEMANGGUNG.......................................................................................... 5 C. EKSTRAKSI DAUN TEMBAKAU....................................................................................8 D. POTENSI ANTIBAKTERI EKSTRAK DAUN TEMBAKAU ..........................................9 III. METODOLOGI ........................................................................................................................ 13 A. BAHAN DAN ALAT ........................................................................................................13 B. WAKTU DAN TEMPAT PENELITIAN ..........................................................................14 C. PROSEDUR PENELITIAN............................................................................................... 14 IV. HASIL DAN PEMBAHASAN.................................................................................................17 A. EKSTRAK ETANOL DAUN TEMBAKAU ....................................................................17 B. KOMPONEN FITOKIMIA EKSTRAK ETANOL DAUN TEMBAKAU ....................... 18 C. AKTIVITAS ANTIBAKTERI EKSTRAK DAUN TEMBAKAU TERHADAP BAKTERI S. aureus DAN E. coli..................................................................................... 21 V. SIMPULAN DAN SARAN .......................................................................................................25 A. SIMPULAN ....................................................................................................................... 25 B. SARAN .............................................................................................................................. 25 DAFTAR PUSTAKA ..................................................................................................................... 26 LAMPIRAN....................................................................................................................................29 iv DAFTAR TABEL Halaman Tabel 1. Komposisi senyawa pada daun Tembakau.......................................................................... 9 Tabel 2. Perbedaan bakteri Gram positif dan negatif ...................................................................... 11 Tabel 3. Perbandingan diameter zona hambat (mm) aktivitas antibakteri oleh ekstrak dan minyak atsiri daun tembakau jenis Prilep.......................................................................... 12 Tabel 4. Perbandingan diameter zona hambat (mm) aktivitas antibakteri oleh ekstrak dan minyak atsiri daun tembakau jenis Oltja ........................................................................... 12 Tabel 5. Hasil uji fitokimia ekstrak etanol daun tembakau sampel A dan B................................... 19 Tabel 6. Diameter zona hambat (mm) ekstrak etanol daun tembakau sampel A terhadap bakteri S. aureus dan E. coli.......................................................................................................... 22 v DAFTAR GAMBAR Halaman Gambar 1. Sampel daun tembakau yang digunakan sebagai bahan pengujian aktivitas antibakteri....................................................................................................................... 13 Gambar 2. Diagram alir penelitian .................................................................................................. 14 Gambar 3. Hasil uji alkaloid ........................................................................................................... 19 Gambar 4. Hasil uji flavonoid ......................................................................................................... 20 Gambar 5. Hasil uji steroid dan terpenoid....................................................................................... 21 Gambar 6. Zona hambat ekstrak etanol daun tembakau sampel A terhadap bakteri S. aureus dan E. coli....................................................................................................................... 23 vi DAFTAR LAMPIRAN Halaman Lampiran Lampiran Lampiran Lampiran Lampiran Lampiran Lampiran Lampiran Lampiran Lampiran Lampiran Lampiran 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. 12. Prosedur pengukuran kadar air .............................................................................. 30 Kadar air daun tembakau sampel A dan B............................................................. 30 Prosedur ekstraksi daun tembakau dengan metode soxletasi .................................31 Rendemen hasil soxletasi daun tembakau sampel A dan B ...................................31 Prosedur pengujian alkaloid................................................................................... 32 Prosedur pengujian flavonoid ................................................................................ 32 Prosedur pengujian steroid dan terpenoid .............................................................. 33 Prosedur pembuatan media NA ............................................................................. 34 Prosedur pembuatan media LB .............................................................................. 34 Prosedur peremajaan bakteri.................................................................................. 35 Prosedur uji aktivitas antibakteri ...........................................................................36 Diameter zona hambat (mm) ekstrak etanol daun tembakau sampel A terhadap bakteri S. aureus ....................................................................................................37 Lampiran 13. Diameter zona hambat (mm) ekstrak etnol daun tembakau sampel A terhadap bakteri E. coli........................................................................................................37 vii I. PENDAHULUAN A. LATAR BELAKANG Pemanfaatan tembakau secara umum digunakan sebagai bahan baku rokok yang selama ini menjadi kontroversi. Isu tersebut terkait dengan peranan tembakau yang merupakan komoditi perkebunan dengan nilai jual tinggi tetapi pemanfaatannya menimbulkan dampak yang negatif. Tidak hanya ditinjau dari segi kesehatan, industri rokok juga dianggap tidak mampu memberikan kesejahteraan yang cukup menjanjikan bagi para petani. Oleh karena itu, perlu dilakukan konversi pemanfaatan tembakau menjadi produk lain yang memiliki nilai ekonomi tinggi sehingga dapat dijadikan substitusi produk rokok. Sesungguhnya, pemanfaatan alternatif tembakau secara tradisional telah banyak diaplikasikan oleh masyarakat di antaranya adalah penggunaannya sebagai obat tanaman. Umumnya, oleh sebagian masyarakat, daun tembakau yang diekstrak untuk dijadikan obat tanaman adalah sisa-sisa daun yang tidak terpakai dalam produksi rokok. Hal itu dinilai lebih ekonomis karena harganya lebih rendah dibandingkan tembakau yang digunakan sebagai bahan baku rokok. Dalam penggunaannya, ekstrak tembakau tersebut ditambahkan dengan bahan lain seperti deterjen atau ekstrak cabe untuk membantu efektivitas pemanfaatannya. Campuran itu lalu digunakan untuk membasmi penyakit seperti, karat pada buncis dan gandum, kamur kentang, yang disebabkan oleh bakteri. Pada penelitian ilmiah sebelumnya, telah diketahui bahwa daun tembakau dapat dimanfaatkan sebagai bakterisida nabati karena sifatnya yang dapat menghambat bakteri. Hal itu dibuktikan oleh Palic et al. (2002) yang menunjukkan adanya aktivitas antibakteri minyak atsiri daun tembakau jenis Prilep terhadap E. coli, S aureus, dan P. aeruginosa. Diketahui bahwa bakteri-bakteri tersebut merupakan flora normal pada manusia yang terkadang dapat menimbulkan penyakit bagi manusia. Misalnya saja, E. coli yang banyak terdapat pada kotorankotoran hewan dan bila berpindah ke manusia dapat menyebabkan gangguan saluran pencernaan (Andriani 2008). Sama halnya, S. aureus yang tergolong flora normal yang banyak dijumpai pada susu perahan sehingga dapat menimbulkan keracunan pangan pada manusia, dikenal dengan istilah enterotoksin. Bakteri ini juga menimbulkan penyakit pada hewan, yaitu mastitis (Purnomo et al. 2006). Adapun, P. aeruginosa merupakan bakteri patogen yang dapat menimbulkan beberapa infeksi. Di antaranya, infeksi pada luka yang menimbulkan nanah hijau kebiruan, infeksi pada saluran kemih, infeksi pada saluran napas yang mengakibatkan pneumonia dan disertai nekrosis, infeksi pada mata dan penyakit otitis eksterna ringan pada perenang (Evita 2006). Penelitian sebelumnya yang juga terkait dengan pengujian aktivitas antibakteri daun tembakau telah dilakukan oleh Pavia et al. (2000) yang menguji pengaruh nikotin daun tembakau terhadap E. coli, Klebsiella pneumoniae, Listeria monocytogenes, Viridans streptococci, Cryptococcus neoformans, Borrelia burgdorferi, S. aureus, Mycobacterium phlei, dan Candida albicans. Data hasil penelitian tersebut menunjukkan adanya pengaruh positif nikotin dalam menghambat bakteri Gram positif dan negatif. Berdasarkan beberapa penelitian sebelumnya, perlu dilakukan pengujian aktivitas antibakteri menggunakan ekstrak kasar daun tembakau lokal asal Temanggung. Hal itu sebagai upaya aplikasi produk alternatif tembakau lokal yang dapat langsung dimanfaatkan oleh masyarakat sehingga dapat menambah nilai ekonomis. Dengan demikian, diharapkan bahwa penelitian ini 1 dapat mendukung hipotesis yang mengungkapkan adanya kinerja positif bakterisida nabati daun tembakau. Kegiatan yang dilakukan dalam penelitian ini adalah mengekstrak daun tembakau asal Temanggung dan dilanjutkan dengan menguji komponen fitokimianya serta mengaitkan pengaruhnya terhadap daya aktivitas antibakteri ekstrak daun tembakau pada bakteri uji Gram positif (S. aureus) dan Gram negatif (E. coli). B. TUJUAN Penelitian ini bertujuan untuk mengetahui aktivitas antibakteri ekstrak tembakau asal Temanggung yang berpotensi digunakan sebagai antiseptik. 2 II. TINJAUAN PUSTAKA A. BOTANI TEMBAKAU Tembakau adalah tanaman musiman yang tergolong tanaman perkebunan. Tanaman tersebut dapat diklasifikasikan sebagai berikut. Familli : Solanaceae Subfamili : Nicotianae Genus : Nicotianae Spesies : Nicotiana tabacum (Goodspread 1954) 1. Bagian-bagian tanaman tembakau (Cahyono 1998) a. Akar Tanaman tembakau berakar tunggang menembus ke dalam tanah sampai kedalaman 50-75 cm, sedangkan akar kecilnya menyebar ke samping. Tanaman tembakau juga memiliki bulu akar. Perakarannya dapat tumbuh dan berkembang baik dalam tanah yang gembur, mudah menyerap air, dan subur. b. Batang Batang tembakau agak bulat, lunak tetapi kuat, makin ke ujung makin kecil. Ruas batang mengalami penebalan yang ditumbuhi daun dan batang tanaman tidak bercabang atau sedikit bercabang. Pada setiap ruas batang selain ditumbuhi daun juga tumbuh tunas ketiak daun dengan diameter 5 cm. Fungsi dari batang adalah tempat tumbuh daun dan organ lainnya, tempat jalan pengangkutan zat hara dari akar ke daun, dan sebagai jalan menyalurkan zat hasil asimilasi ke seluruh bagian tanaman. c. Daun Bentuk daun tembakau adalah bulat lonjong, ujungnya meruncing, tulang daun yang menyirip, bagian tepi daun agak bergelombang dan licin. Daun bertangkai melekat pada batang, kedudukan daun mendatar atau tegak. Ukuran dan ketebalan daun tergantung varietasnya dan lingkungan tumbuhnya. Daun tembakau tersusun atas lapisan palisade parenchyma pada bagian atasnya dan spongy parenchyma pada bagian bawah. Jumlah daun dalam satu tanaman berkisar 28-32 helai, tumbuh berselang-seling mengelilingi batang. Daun tembakau secara umum dapat diklasifikasikan menurut letaknya pada batang yang dimulai dari bawah ke atas, yaitu: daun pasir (zand blad/lugs), kaki (voet blad/cutters), tengah (midden blad/leaf), dan atas (top blad/tips). Bagian dari daun tembakau yang mempunyai nilai tertinggi adalah bawah dan tengah menyusul daun atas, sedang daun pasir dan pucuk hampir tidak bernilai kecuali untuk tembakau rajangan (Abdullah 1982). d. Bunga Bunga tembakau merupakan bunga majemuk yang terdiri dari beberapa tandan dan masing-masing berisi 15 bunga. Bunga berbentuk terompet dan panjang. Warna bunga merah jambu sampai merah tua pada bagian atasnya, sedangkan bagian lain berwarna putih. Kelopak memiliki 5 pancung, benang sari berjumlah 5 tetapi yang satu lebih pendek dan melekat pada mahkota bunga. Kepala putik atau tangkai putik terletak di 3 e. 2. atas bakal buah di dalam tabung. Letak kepala putik dekat dengan benang sari dengan kedudukan sama tinggi. Buah Buah tembakau akan tumbuh setelah tiga minggu penyerbukan. Buah tembakau berbentuk lonjong dan berukuran kecil berisi biji yang sangat ringan. Biji dapat digunakan untuk perkembangbiakan tanaman. Jenis-jenis tanaman tembakau (Susilowati 2006) a. Tembakau cerutu Tembakau cerutu dikenal ada 3 macam sesuai dengan fungsinya pada pembuatan rokok cerutu, yaitu: Tembakau pengisi Tembakau ini adalah jenis Vorstenland yang berdaun banyak, berwarna hijau, ketebalan daun tipis hingga sedang, daun terkulai sehingga kedudukannya tampak mendatar dan habitus piramidal. Tembakau pembalut Tembakau ini adalah jenis Besuki yang ramping, ketinggiannya sedang hingga tinggi, daunnya oval, kedudukan daun pada batang agak tegak, jarak daun satu dengan lainnya agak berjauhan, luas daun sedang hingga lebar, habitus silindris, ketebalan daun tipis, daunnya lunak dan memiliki aroma yang khas. b. Tembakau pembungkus Tembakau ini adalah jenis Deli dengan keadaan tanaman yang kokoh dan besar, ketinggian tanaman sedang, daunnya tipis dan elastis, bentuk daun bulat dan lebar, kedudukannya pada batang tampak mendatar, bermahkota tipe silindris, warna daun cerah. Tembakau sigaret Dalam industri rokok tembakau sigaret digunakan untuk bahan baku pembuatan rokok sigaret, baik sigaret putih maupun kretek. Tembakau Virginia Tembakau ini bersosok ramping, ketinggian tanaman sedang sampai tinggi, daun berbentuk lonjong yang ujungnya meruncing, warna daun hijau kekuningan, daun bertangkai pendek, kedudukan daun pada batang tegak, jarak antara daun satu dengan yang lain cukup lebar, daya adaptasinya luas terhadap tanah dan iklim. Tembakau Oriental/Turki Tembakau ini unggul pada aromanya yang harum dan khas sehingga disebut juga aromatic tobacco. Tembakau Oriental digunakan oleh semua pabrik rokok sebagai campuran yang dapat meningkatkan mutu rokok sigaret. Tembakau Burley Tembakau ini bercirikan warna daun hijau pucat, batang dan ibu tulang daun berwarna putih krem, dan tergolong ukuran besar (90-160 cm2), lebih banyak berbentuk silindris dibandingkan piramida, tinggi tanaman sekitar 180 cm. Tembakau sigaret yang lain Tembakau jenis Rembang, Kasturi, Garut, Madura, Payakumbuh, dan Bugis banyak digunakan sebagai campuran tembakau sigaret. 4 c. d. e. Tembakau pipa Tembakau pipa digunakan untuk pipa dan meliputi tembakau Lumajang. Tembakau Lumajang dibedakan menjadi tembakau Lumajang Na Oogst (NO)/sawah yang ditanam di sawah dan tembakau Lumajang Vor Oogst (VO)/tegal yang ditanam di tanah kering. Ciri-ciri tembakau Lumajang adalah tinggi, ramping, dan daun agak tegak. Tembakau asepan Tembakau ini diolah dengan cara pengasapan. Biasanya memiliki daun tebal, berat, kuat, berminyak, berwarna gelap. Tembakau asli Tembakau ini diusahakan oleh rakyat. Hasil panen diolah dengan dirajang dan dijemur matahari. Kegunaan tembakau rakyat adalah untuk bahan baku pembuatan rokok sigaret kretek. B. TEMBAKAU TEMANGGUNG Tembakau yang berkembang di masyarakat kab. Temanggung terdiri atas varietas Genjah Kemloko dan Genjah Kenongo. Tembakau Temanggung varietas Genjah Kemloko berasal dari desa Kemloko Kecamatan Tlogomulyo Kabupaten Temanggung yang menurut produsen rokok besar adalah tembakau terbaik di Temanggung bahkan di Indonesia. Varietas tersebut dikembangkan oleh Balai Penelitian Tembakau dan Tanaman Serat di Malang menjadi Kemloko 1, Kemloko 2, dan Kemloko 3. Tembakau jenis Kemloko 1 dan Kemloko 2 adalah jenis tanaman tembakau yang dibudidayakan pada dataran rendah sedangkan Kemloko 3 khusus untuk dataran tinggi. Tembakau varietas lainnya yang ada adalah Gober Togog, Genjah Kenanga, Crumpung, dan Genjah Mawar. Namun demikian, varietas tersebut tidak terlalu dikenal di Temanggung. Berikut ini deskripsi beberapa galur Tembakau Temanggung varietas Kemoloko yang banyak dibudidayakan di daerah Temanggung (Deptan 2011). 1. Kemloko 1 Nomor seleksi : 2258/2/1/1 Asal : Kemloko (lokal) Habitus : Kerucut Tinggi tanaman : 145,23 – 174,01 Panjang ruas (cm) : 4,69 – 6,81; makin keatas makin panjang Warna batang : Hijau Bulu batang : Berbulu Jumlah daun : 19,63 – 24,49 lembar Sudut daun : Tegak (35,25 – 56,75o) Ujung daun : Runcing Tepi daun* : Berombak, daun atas tidak menggulung daun bawah menggulung Permukaan daun : Rata, agak bergelombang Tebal daun* : Tipis Warna daun : Hijau Phylotaxy* : 3/8 putar ke kanan Tangkai daun : Duduk, tidak bertangkai Sayap : Sempit licin Telinga : Sempit, memeluk batang Panjang daun : 41,18 – 49,18 cm 5 2. Lebar daun Bentuk daun* Index daun Umur berbunga Warna mahkota bunga Warna kepala sari Bentuk buah Warna biji Umur panen Potensi hasil Indek mutu Kadar nikotin Kadar gula Ketahanan terhadap - Penyakit lanas - Penyakit nematoda - Penyakit layu bakteri - Hama Aphis sp : 21,57 – 27,17 cm : Lonjong, lebar meruncing : 0,482 : 67,96 – 81,44 hst : Merah muda sampai merah : Krem : Bulat telur : Coklat : 98 – 122 hari : 787,82 – 1011,46 Kg/Ha : 37,34 – 47,18 : 3,75 – 8,65% : 3,89% : : Tahan : Tahan : Rentan : Tahan Kemloko 2 Asal Metode penulisan Habitus Tinggi tanaman (cm) Panjang ruas Warna batang Bulu batang Jumlah daun (produksi) Sudut daun Ujung daun Tepi daun Permukaan daun Tebal daun Warna daun Phylotaxi* Tangkai daun Sayap* Telinga Panjang daun Lebar daun Bentuk daun Index daun Umur berbunga Warna mahkota bunga Warna kepala sari Bentuk buah : Persilangan : Sindoro 1 x Coker 51 : Back Cross 3 kali : Silindris : 137,77 – 149,57 : Rapat : Hijau : Berbulu : 18,43 – 21,10 lembar : Tegak : Runcing : Berombak : Rata : Tipis : Hijau : 2/5 : Duduk : Sempit : Lebar : 47,52 – 51,77 cm : 22,32 – 25,95 cm : Lonjong : 0,501 – 0,502 : 94,76 – 100,00 hst : Merah muda : Krem : bulat telur 6 Warna biji Umur panen Potensi hasil Indek mutu Indek tanaman Kadar nikotin (%) Kadar gula (%) Ketahanan terhadap penyakit - Bakteri P.solanacearum - Jamur P. Nicotianane - Nematoda Meloidogyne ssp : Coklat : 120 – 140 hst : 704 ± 280 Kg/Ha : 40,28 ± 5,42 : 28,38 ± 12,81 : 5,52 ± 3,46 % : 2,96% (relatif sedang) : : Tahan :: Tahan Keterangan : * Pembeda sifat antara Kemloko 1 dan Kemloko 2 3. Kemloko 3 Asal Metode penulisan Habitus Tinggi tanaman (cm) Panjang ruas Warna batang Bulu batang Jumlah daun (produksi) Sudut daun Ujung daun Tepi daun Permukaan daun Tebal daun Warna daun Phylotaxi* Tangkai daun Sayap* Telinga Panjang daun Lebar daun Bentuk daun Index daun Umur berbunga Warna mahkota bunga Warna kepala sari Bentuk buah Warna biji Umur panen Potensi hasil Indek mutu Indek tanaman Kadar nikotin (%) : Persilangan : Sindoro 1 x Coker 51 : Back Cross 2 kali : Silindris : 148,77 – 164,43 : Rapat : Hijau : Berbulu : 18,90 – 21,97 lembar : Tegak : Runcing : Berombak : Rata : Tipis : Hijau : 3/8 : Duduk : Lebar : Lebar : 37,57 – 49,15 cm : 20,99 – 24,96 cm : Lonjong : 0,505 – 0,508 : 89,33 – 99,33 hst : Merah muda : Krem : Bulat telur : Coklat : 119 – 139 hst : 695 ± 160 Kg/Ha : 36,01 ± 7,01 : 25,50 ± 9,49 : 6,02 ± 3,72 % 7 Kadar gula (%) : 1,98% (relatif sedang) Ketahanan terhadap penyakit : - Bakteri P.solanacearum : Sangat tahan - Jamur P. Nicotianane :- Nematoda Meloidogyne ssp : Tahan Keterangan : * Pembeda sifat antara Kemloko 2 dan Kemloko 3 C. EKSTRAKSI DAUN TEMBAKAU Ekstraksi daun tembakau menghasilkan ekstrak daun tembakau yang berupa senyawa volatil dan semi volatil yang menjadi penentu standar kualitas tembakau dengan kekhasan aroma yang dimilikinya. Jenis senyawa pada ekstrak tersebut beragam komposisinya di setiap hasil ekstrak, tergantung karakteristik perlakuan pendahuluan bahan yang dikenakan sebelumnya. Menurut Peng et al. (2004), adanya proses fermentasi daun tembakau berpengaruh terhadap hasil ekstrak yang dihasilkan. Senyawa volatil dan semi volatil pada tembakau dapat diperoleh melalui metode ekstraksi pelarut (solvent extraction) dan distilasi (distillation) (Podlejski et al. 1983). Umumnya, digunakan pelarut etanol untuk mnghasilkan komponen bioaktif dari daun tembakau pada metode ekstraksi pelarut (Xin et al. 2006). Sementara itu, metode distilasi hanya menggunakan pelarut berupa air (Podlejski et al 1983). Namun demikian, adanya kombinasi kedua metode tersebut (steam distillation and extraction) merupakan metode terbaik yang paling umum digunakan (Peng et al. 2004). Steam distillation secara khusus tidak efektif digunakan karena memerlukan banyak pelarut dan kemungkinan terjadinya kehilangan (loss) pada produk juga besar (Blanch et al. 1993). Begitu pula metode headspace co-distillation yang tidak efektif karena rendemen akhirnya tidak optimal. Efektivitas penggunaan metode SDE (steam distillation and extraction) untuk ekstraksi tembakau dibandingkan metode SD (steam distillation) dan HCD (headspace co-distillation) dapat dilihat berdasarkan jumlah rendemen yang tinggi pada metode SDE yaitu 445.48 ml/100 g, 228.42/100 g ml, dan 315.72 ml/100 g (Peng et al. 2004). Metode ekstraksi pelarut umumnya menggunakan kondisi suhu 50˚C dengan refluks hingga 4 kali berpelarut diklorometan selama 3 jam (Wu et al. 1992). Sementara itu metode SDE menggunakan suhu 60˚C selama 2.5 jam (Schultz et al. 1997). Dibandingkan kedua metode tersebut, metode HCD memerlukan suhu yang paling tinggi yaitu 130˚C selama 3 jam (Kim et al. 1982). Sementara itu, metode SDE-2 tahap berperan penting dalam menangkap senyawa aromatik pada tembakau berupa solanon dibandingkan metode tradisional. Metode tersebut terdiri atas ekstraksi SDE selama 4 jam pada pH 5.5. Setelah itu ekstrak diasamkan hingga pH 2.5 dengan penambahan diklorometan (Yaqin et al. 2006). Ekstraksi tembakau juga dapat dilakukan dengan cara hidrodistilasi dan superkritik CO2 (Stojanovic et al. 2000). Ekstraksi superkritik CO2 bahkan telah dipatenkan sebagai cara terbaik untuk menghilangkan senyawa nikotin pada hasil ekstraksi tembakau oleh Roselius et al. (1979). Ekstraksi superkritik CO2 itu pada tembakau Oltja dapat menghasilkan rendemen hingga 1.8% dan 2.5% untuk daun tembakau bagian tengah dan atas (Stojanovic et al. 2000). Kandungan senyawa dalam ekstrak daun tembakau dapat diketahui dengan penggunaan gas chromatography-mass spectrometry (GC-MS) (Cai et al 2002). Berdasarkan analisis GC-MS diketahui bahwa ekstrak tembakau mengandung alkaloid (Andersen et al. 1280). Gabungan 8 alkaloid dan nitrat dengan bentuk nitrosamin dapat menimbulkan risiko karsinogenik (Brunnemann et al. 1991). Kandungan nikotin yang juga merupakan senyawa alkaloid pada tembakau yang digunakan sebagai rokok dikenal dapat memicu timbulnya penyakit kanker paruparu, sesak nafas, gigi kuning, kerusakan jaringan, leukoplakia, resiko kanker mulut, dan penurunan kemampuan indra pengecap (DerMarderosian 2001). Secara sederhana, komposisi kimia ekstrak daun tembakau dapat dilihat pada Tabel 1. Namun demikian, tembakau juga dikenal sebagai tanaman herbal yang bermanfaat. Hal itu dapat diperkuat dengan diketahuinya senyawa kimia pada tembakau yang bersifat antioksidan (Miller 1973) dan juga antibakteri (Khidyrovaet al. 2002). Senyawa antibakteri pada tembakau yang diketahui berdasarkan penelitian sebelumnya misalnya flavonoid (Machado et al. 2010) dan minyak atsiri (essential oil) (Palic et al. 2002). Minyak atsiri tersebut dapat diperoleh melalui proses distilasi air selama 4 jam yang kemudian diekstrak menggunakan kloroform dan selanjutnya dikeringkan dengan anhidrat Na2SO4. Pelarut yang tersisa dapat dihilangkan dengan cara vakum distilasi. Total rendemen minyak atsiri berdasarkan perlakuan itu dapat mencapai 0.13% untuk daun bagian atas dan 0.05% untuk daun bagian tengah (Stojanovic et al. 2000). Sementara itu, penelitian sebelumnya terkait rendemen ekstrak daun tembakau terhadap Tembakau Virginia, Burley, dan Turkish adalah 0.18 %, 0.40%, dan 0.08% disertai adanya aroma yang khas. Adanya aroma yang khas itu dipengaruhi oleh komposisi senyawa minyak atsiri yang terdiri atas neophytadien sebagai senyawa utama untuk daun tembakau bagian tengah dan atas (20.4% dan 20.7%). Tabel 1. Komposisi senyawa pada daun Tembakau Komponen Total nitrogen Protein nitrogen (protein) Nikotin Nitrogen dari asam α-amino Air terlarut karbohidrat Selulosa Pektin Polypentose Minyak atsiri Resin yang diektrak menggunakan benzena Resin yang diektrak menggunakan petroleum eter Polyphenol Volatile karbonil (asetaldehid) Asam organic Asam oxalic Asam citric Asam malat Asam volatile pH dari air yang terekstrak Abu Sumber: Podlejski & Olejniczak (1983) Komposisi (% bk) 2,20 1,58 0,67 0,30 25,9 12,3 13,4 4,90 0,13 7,42 6,20 4,39 0,26 9,12 2,18 1,27 4,57 1,12 5,54 15,4 D. POTENSI ANTIBAKTERI EKSTRAK DAUN TEMBAKAU Senyawa kimia dalam tanaman dapat bersifat antibakteri yaitu mampu menghambat pertumbuhan bakteri (Pelczar & Chan 1998). Hal itu diuraikan oleh Pelczar et al. (1993) bahwa 9 beberapa senyawa metabolit sekunder yang meliputi fenol dan senyawa fenolik, alkaloid, dan minyak atsiri (essential oil) memiliki sifat antibakteri. Antibakteri digambarkan sebagai produk alami organik dengan berat molekul rendah dibentuk oleh mikroorganisme dan tumbuhan yang aktif melawan mikoroganisme lain pada konsentrasi rendah. Pengembangan aktivitas ini melalui jumlah terbatas dari mekanisme antibakteri yang dapat mempengaruhi sintesis dinding sel, integritas membran sel, sintesis protein, replikasi DNA dan repair, transkripsi, dan metabolit intermediate (Wax et al. 2008). Berdasarkan cara kerjanya, antibakteri dibedakan menjadi bakterisidal dan bakteriostatik. Bakteriostatik adalah zat yang bekerja menghambat pertumbuhan bakteri sedangkan bakterisidal adalah zat yang bekerja mematikan bakteri. Beberapa zat antibakteri bersifat bakteriostatik pada konsentrasi rendah dan bersifat bakterisidal pada konsentrasi tinggi (Chomnawang et al 2005). Mekanisme penghambatan mikroorganisme oleh senyawa antibakteri dapat disebabkan oleh beberapa cara, antara lain: 1. 2. 3. Menganggu pembentukan dinding sel Mekanisme ini disebabkan karena adanya akumulasi komponen lipofilat yang terdapat pada dinding atau membran sel sehingga menyebabkan perubahan komposisi penyusun dinding sel. Terjadinya akumulasi senyawa antibakteri dipengaruhi oleh bentuk tak terdisosiasi. Pada konsentrasi rendah molekul-molekul phenol yang terdapat pada minyak thyme kebanyakan berbentuk tak terdisosiasi, lebih hidrofobik, dapat mengikat daerah hidrofobik membran protein, dan dapat melarut baik pada fase lipid dari membran bakteri. Bereaksi dengan membran sel Komponen bioaktif dapat mengganggu dan mempengaruhi integritas membran sitoplasma yang dapat mengakibatkan kebocoran materi intraseluler. Misalnya senyawa fenol dapat mengakibatkan lisis sel dan menyebabkan denaturasi protein, menghambat pembentukan protein sitoplasma dan asam nukleat, dan menghambat ikatan ATP-ase pada membran sel. Menginaktivasi enzim Mekanisme yang terjadi menunjukkan bahwa kerja enzim akan terganggu dalam mempertahankan kelangsungan aktivitas bakteri sehingga mengakibatkan enzim memerlukan energi dalam jumlah besar untuk mempertahankan kelangsungan aktivitasnya. Akibatnya energi yang dibutuhkan untuk pertumbuhan menjadi berkurang sehingga aktivitas bakteri menjadi terhambat atau jika kondisi ini berlangsung lama akan mengakibatkan pertumbuhan bakteri terhenti (inaktif). Efek senyawa antibakteri dapat menghambat kerja enzim jika mempunyai spesifitas yang sama antara ikatan komplek yang menyusun struktur enzim dengan komponen senyawa antibakteri. Metabolit sekunder akan memblok biosintesis dinding sel dengan menghambat kerja enzim dalam mensintesis komponen berbeda dari dinding sel. Jika metabolit ini dapat mempengaruhi integritas membran sel maka akan mengacaukan strukturnya atau menghambat fungsi dari membran bakteri tersebut. Antibakteri yang mempengaruhi sintesis protein bertindak sebagai perusak unit ribosom, mengikat pada unit 50S dan mencegah translasi dan mengikat unit 30S menyebabkan terjadinya kesalahan translasi, memproduksi racun, dan mempengaruhi protein. Senyawa antibakteri akan mempengaruhi fungsi replikasi DNA dan repair, menghambat enzim girase, dan topoisomerase dan Nmetiltransferase. Akhirnya, beberapa senyawa antibakteri mengganggu metabolisme 10 4. intermediate dengan menghambat enzim dalam biosintesis dari substansi berbeda (Berdy 2005). Menginaktivasi fungsi material genetik Komponen bioaktif dapat mengganggu pembentukan asam nukleat (RNA dan DNA) dan menyebabkan terganggunya transfer informasi genetik yang selanjutnya akan menginaktivasi atau merusak materi genetik sehingga terganggunya proses pembelahan sel untuk pembiakan. Kemampuan suatu zat antibakteri tersebut dipengaruhi oleh faktor antara lain: (1) konsentrasi zat antibakteri; (2) waktu penyimpanan; (3) suhu lingkungan; (4) sifat-sifat fisik dan kimia makanan termasuk kadar air, pH, jenis, dan jumlah senyawa di dalamnya (Fardiaz 1989). Mekanisme kerjanya secara umum adalah merusak dinding sel (seperti penisilin; sefalosporin; dan vankomisin), mengganggu permeabilitas sel (seperti penisilin, sefalosporin, vankomisin), dan menghambat sintesis protein dan asam nukleat (seperti kloramfenikol; rifampisin; dan asam) (Fardiaz et al. 1987). Pengujian aktivitas antibakteri dapat dilakukan dengan menggunakan bakteri uji S. aureus (Gram positif) dan E .coli (Gram negatif). Perbandingan sifat kedua jenis bakteri tersebut disajikan pada Tabel 2. Tabel 2. Perbedaan bakteri Gram positif dan negatif Ciri-ciri Struktur dinding sel Komposisi dinding sel Kerentanan terhadap penisilin Resisten terhadap gangguan fisik Perbedaan Gram positif Gram negatif Tebal (5-80 nm) dan Tipis (10-15 nm) dan berlapis tunggal berlapis tiga (multi) (mono) Kandungan lipid Kandungan lipid rendah (1-4%), tinggi (11-21%), peptidoglikan peptidoglikan di berlapis tunggal, dan dalam lapisan kaku, komponen utama jumlah sedikit (10% lebih besar dari 50% berat kering) berat kering Lebih rentan Kurang rentan Lebih resisten Kurang resisten Sumber : Pelczar & Chan (1998) Staphylococcus aureus S.aureus tergolong bakteri Gram positif, berbentuk kokus dengan diameter 0.7-0.9 µm, pola penataan sel berbentuk bola berpasangan, dapat hidup secara aerob maupun anaerob fakultatif, bersifat non motil dan tidak membentuk spora. Bakteri ini sering ditemukan pada makanan berprotein tinggi. Koloni bakteri ini berwarna putih sampai kuning keemasan. Tumbuh optimum pada suhu 37ºC, pH 7.0-7.5, dan tumbuh dengan baik pada larutan NaCl 15% (Todar 2004). S. aureus dapat menyebabkan penyakit. Bakteri ini memiliki kemampuan melakukan pembelahan, dan menyebar luas ke dalam jaringan serta mampu memproduksi bahan ekstra 11 seluler seperti katalase, koagulase, eksotoksin, lekosidin, toksineksfoliatif, Toksin Syndroma Shock Toxic, dan enterotoksin (Brooks et al 2001). Escherichia coli E. coli merupakan mikroba dari famili Enterobactericeae yang normal terdapat di saluran pencernaan hewan dan manusia. Bakteri ini berbentuk batang berukuran 2-6 µm, bersifat anaerob fakultatif dan tergolong bakteri Gram negatif. Bakteri ini tumbuh optimum pada suhu 37ºC, dan pH 7.0-7.5 (Burcharan dan Ghibbons 2000). Beberapa strain E.coli bersifat patogen penyebab infeksi, antara lain infeksi saluran pencernaan, infeksi saluran kemih, dan meningitis (Todar 2004). Penelitian oleh Palic et al. (2002) dan Stojanovic et al. (2000) menunjukkan adanya perbandingan aktivitas antibakteri ekstrak dan minyak atsiri dari tembakau Prilep dan Oltja seperti terlihat pada Tabel 3 dan Tabel 4. Pada tabel tersebut terlihat bahwa minyak atsiri memiliki kemampuan antibakteri yang lebih baik. Tabel 3. Perbandingan diameter zona hambat (mm) aktivitas antibakteri oleh ekstrak dan minyak atsiri daun tembakau jenis Prilep Minyak Atsiri Ekstrak Standar Daun Daun Daun bagian Bakteri Daun bagian atas Thymol bagian bagian tengah (100 mg/ml) (10 mg/ml) tengah atas (100 mg/ml) E. coli 15.0 14.0 14.4 23.8 S. aureus 15.2 14.8 13.8 14.6 24.6 P. aeruginosa 15.2 14.8 14.4 24.2 Sumber: Palic et al. (2002) Tabel 4. Perbandingan diameter zona hambat (mm) aktivitas antibakteri oleh ekstrak dan minyak atsiri daun tembakau jenis Oltja Minyak Atsiri Ekstrak Standar Daun Daun Daun bagian Bakteri Daun bagian atas Thymol bagian bagian tengah (100 mg/ml) (10 mg/ml) tengah atas (100 mg/ml) E. coli 15.0 20.0 14.4 23.8 S. aureus 15.4 24.4 16.2 24.6 P. aeruginosa 15.4 20.2 24.2 Sumber: Stojanovic et al. (2000) 12 III. METODOLOGI A. BAHAN DAN ALAT Bahan baku utama yang digunakan pada penelitian ini adalah daun tembakau Temanggung varietas Genjah Kemloko yang dipetik dari batangnya pada bagian atas dan tengah (sampel A) serta bagian bawah (sampel B) (Gambar 1). Sampel A merupakan daun tembakau yang sering digunakan dalam pembuatan rokok skala industri. Umumnya daun tersebut memiliki penampakan yang baik, ujung daunnya tidak menggulung, berwarna hijau, dan tebal. Sementara itu, sampel B merupakan daun sortiran yang oleh masyarakat Temanggung dikenal dengan istilah dendeng tembakau. Warna daunnya hijau kekuningan dan sedikit coklat yang mencirikan bahwa tanaman tersebut sulit mendapat sinar matahari karena terletak pada bagian bawah batang tanaman. Penggunaan kedua jenis kualitas tersebut adalah untuk membandingkan potensinya dalam hal aktivitas antibakteri. Hal itu diharapkan dapat memberikan informasi mengenai perbandingan aktivitas antibakteri daun tembakau yang bernilai ekonomi (sampel A) dan daun tembakau sortiran/dendeng tembakau (sampel B) yang bernilai jual rendah. Kedua jenis sampel tersebut telah dikeringkan di bawah sinar matahari selama 2 hari. Selang waktu itu merupakan periode rata-rata penjemuran daun tembakau di Temanggung sebelum dijual kepada tengkulak tembakau. Setelah kering, daun tembakau dipisahkan dari batang daunnya dan dihaluskan hingga berukuran 60 mesh yang telah disesuaikan dengan metode yang digunakan oleh Yaqin et al. (2006). Hal itu bertujuan memperluas permukaan sampel untuk mengefisiensikan penggunaan pelarut dalam proses ekstraksi (Harborne 1993). Sampel A Sampel B Gambar 1. Sampel daun tembakau yang digunakan sebagai bahan pengujian aktivitas antibakteri Pada proses ekstraksi daun tembakau digunakan pelarut etanol teknis 96% dan bahan pendukung berupa air dan es batu. Sementara itu, bahan penunjang lainnya dalam pengujian aktivitas antibakteri menggunakan aquades, nutrient agar, NaCl, alkohol 70%, tripton, yeast extract, bakteri uji (Staphlylococcus aureus dan Escherichia coli), tetrasiklin (kontrol positif uji antibakteri), dan dimetil sulfoksida (DMSO). Pada persiapan awal bahan baku digunakan blender untuk menghasilkan tembakau serbuk. Selanjutnya, pada pengujian kadar air bahan baku digunakan oven dan cawan-cawan alumunium. Sementara itu, pada proses ekstraksi daun tembakau digunakan rangkaian alat soxlet, shaker, kertas saring, peralatan gelas, sudip, dan vacuum rotary evaporator. 13 Alat-alat lainnya yang digunakan pada pengujian aktivitas antibakteri meliputi cawan gelas, gel puchner dengan diameter 3 cm, ose, peralatan gelas, pipet mikro volume 20-200 µL, gelas ukur, sudip, batang pengaduk (stirrer), oven, shaker incubator, oven inkubator, pembakar Bunsen, alumunium foil, plastik wrap, karet gelang, korek api, kain kasa, dan kapas. B. WAKTU DAN TEMPAT PENELITIAN Waktu penelitian dimulai sejak September hingga Oktober tahun 2010. Penelitian dilakukan di laboratorium kimia analitik, Departemen Kimia, dan laboratorium Biokimia, Departemen Biokimia, FMIPA IPB. C. PROSEDUR PENELITIAN Penelitian ini terdiri atas analisis kadar air, ekstraksi daun tembakau dengan metode soxletasi, analisis fitokimia hasil ekstrak, dan uji aktivitas antibakteri dari ekstrak yang didapat. Diagram alir penelitian secara ringkas dapat dilihat pada Gambar 2. Tembakau serbuk (sampel A dan B) Analisis kadar air Ekstraksi (soxletasi dengan pelarut etanol) Ekstrak Analisis fitokimia (alkaloid, flavonoid, terpenoid dan steroid) Uji daya hambat ekstrak terhadap pertumbuhan bakteri (S.aureus, E. coli) (20%, 40%, 60%, 80%, 100%) Gambar 2. Diagram alir penelitian 1. Analisis Kadar Air Penelitian pendahuluan meliputi penentuan analisis kadar air sampel daun tembakau. Sebanyak 3 gram sampel A dan B yang telah ditimbang sebelumnya dimasukkan ke dalam oven dengan suhu 105oC. Selanjutnya kedua sampel tersebut ditimbang lagi hingga diperoleh bobot akhir yang stabil. Perhitungan kadar air dapat dirumuskan dengan persamaan (1). 14 Kadar air = bobot sampel awal (b) – (bobot akhir (c)-bobot wadah (a)) bobot sampel awal (b) (1) 2. Proses Ekstraksi Daun Tembakau Metode ekstraksi tembakau yang digunakan pada penelitian ini adalah metode soxletasi dengan pelarut etanol (alkohol teknis 96%). Proses ekstraksi tersebut menggunakan tembakau serbuk (TS) sampel A dan B sebanyak 10 g dilarutkan masingmasing dalam 100 ml pelarut dan dimasukkan dalam alat soxhlet. Soxletasi dilakukan selama 90 menit dengan suhu 85˚C dan dilanjutkan evaporasi pada suhu 50oC. 3. Perhitungan Rendemen Hasil Ekstrak Hasil ekstraksi yang diperoleh dihitung rendemennya dengan persamaan (2). Rendemen = (W/Wo) x 100% (w/w) (2) Keterangan: W = berat ekstrak (g) Wo = berat bahan yang diekstrak (g) Ukuran sampel tembakau kering = 40 mesh 4. Analisis Fitokimia (Harborne 1987) Alkaloid Sebanyak 1 gram ekstrak sampel A dan B masing-masing dilarutkan dengan 5 ml kloroform dan beberapa tetes NH4OH dan disaring. Selanjutnya ditambahkan 10 tetes H2SO4 2M yang akan membentuk lapisan asam pada bagian atasnya. Pada lapisan tersebut diteteskan pereaksi Meyer hingga membentuk endapan putih, pereaksi Wagner hingga berwarna coklat, dan pereaksi Dragendrof hingga berwarna merah jingga. Flavonoid Sebanyak 0.1 gram ekstrak sampel sampel A dan B masing-masing ditambahkan 1 mL metanol dan dididihkan selama 1 menit. Terbentuknya, warna merah pada filtrat setelah penambahan 3 tetes H2SO4 menunjukkan adanya flavonoid Steroid dan terpenoid Sebanyak 0.1 gram ekstrak sampel sampel A dan B masing-masing ditambahkan 5 mL etanol lalu dipanaskan pada suhu 50°C dan disaring. Filtratnya diuapkan lalu ditambah 5 tetes eter. Lapisan eter ditambah pereaksi Liebermen Buchard (3 tetes asam pekat lalu 1 tetes H2SO4 pekat). Larutan dikocok perlahan lalu dibiarkan beberapa menit. Warna merah atau ungu menunjukkan kandungan terpenoid pada sampel, sedangkan warna hijau menunjukkan kandungan steroid. 15 5. Uji Aktivitas Antibakteri (modifikasi metode Bloomfield 1991) Pembuatan Media Media NA Nutrient agar (NA) sebanyak 23 g dilarutkan dalam 1 L akuades dan dipanaskan. Larutan disterilisasi pada suhu 121oC selama 15 menit. Media LB Sebanyak 1,25 g yeast extract, 0,5 g NaCl, dan 0,5 g tripton dilarutkan dalam 1 L akuades dan dipanaskan. Larutan disterilisasi pada suhu 121oC selama 15 menit. Persiapan Ekstrak Sediaan ekstrak yang digunakan sebagai sampel uji dalam penelitian ini terdiri atas ekstrak dengan konsentrasi 20% (b/v), 40% (b/v), 60% (b/v), 80% (b/v), dan 100% (b/v). Sebanyak 20 g, 40 g, 60 g, 80 g, dan 100 g ekstrak dilarutkan masingmasing dalam 100 ml pelarut DMSO sehingga diperoleh konsentrasi ekstrak sebesar 20% (b/v), 40% (b/v), 60% (b/v), 80% (b/v), dan 100% (b/v). Uji Aktivitas Antibakteri Peremajaan bakteri dilakukan terlebih dahulu untuk mempersiapkan bakteri yang akan digunakan dalam pengujian aktivitas antibakteri. Bakteri S. aureus dan E. coli diregenerasi dalam larutan LB masing-masing 10 ml dan diinkubasi bergoyang (shaker incubator) selama 18 jam pada suhu 37oC, 200 rpm. Remajaan kultur bakteri ditumbuhkan dalam media NA dengan mengambil sebanyak 50 µL bila nilai kerapatan optikalnya (OD)>1 dan 100 µL bila ODnya<1. Media didiamkan hingga memadat, lalu dilubangi menggunakan gel puchner sebanyak 5 lubang. Remajaan bakteri ditumbuhkan dalam media NA sebanyak 50 µL bila ODnya>1 dan 100 µL bila ODnya<1. Media itu didiamkan hingga beku. Media lalu dilubangi menggunakan gel puchner sebanyak 7 lubang. Masing-masing lubang diisi oleh pengenceran ekstrak etanol daun tembakau sampel A masing-masing sebanyak 50 µL dengan berbagai konsentrasi (20%, 40%, 60%, 80%, 100%), kontrol negatif (DMSO) dan kontrol positif (tetrasiklin 10%). Media tersebut kemudian diinkubasi pada suhu 37oC selama 24 jam. Zona bening yang terbentuk diukur diameternya menggunakan alat pengukur jangka sorong dengan rataan 3 kali ulangan dan digunakan sebagai indikator aktivitas antibakteri. 16 IV. HASIL DAN PEMBAHASAN A. EKSTRAK ETANOL DAUN TEMBAKAU Peng et al. (2004) menyatakan bahwa karakteristik sampel termasuk kadar air yang terkandung di dalamnya dapat mempengaruhi kualitas hasil ekstrak dan rendemen yang diperoleh. Oleh karena itu, pada penelitian ini dilakukan pengujian kadar air terhadap sampel terlebih dahulu sebelum proses soxletasi untuk mengetahui keterkaitan karakteristik awal sampel dengan hasil rendemen yang akan di peroleh. Pengukuran kadar air daun tembakau sampel A dan B menunjukkan nilai 12.37% dan 10.69%. Tingginya nilai kadar air tersebut akan berpengaruh terhadap jumlah rendemen yang dihasilkan pada proses ekstraksi sampel. Berdasarkan data diketahui bahwa kadar air daun tembakau sampel B lebih rendah dibandingkan pada sampel A. Hal itu disebabkan oleh adanya perbedaan karakteristik bahan bakunya sendiri. Daun tembakau sampel B merupakan bagian daun pada batang tembakau yang rusak dan sudah mengalami kekeringan pada sebagian daunnya sejak masih menyatu pada batang tanaman. Pada penelitian, nilai kadar air yang lebih baik terdapat pada sampel B (10.69%) dibandingkan sampel A (12.37%). Hal itu dikarenakan rendahnya kadar air di dalam sampel B dapat meminimalkan peluang kontaminasi oleh mikroorganisme. Mikroorganisme seperti bakteri dan kapang dapat tumbuh pada kondisi yang berkadar air secara berturut-turut adalah 7.5% dan 8% (Winarno 2002). Adanya nilai kadar air yang tinggi berisiko menjadi peluang kontaminasi oleh kapang dan bakteri apabila sampel disimpan dalam jangka waktu yang lama sebagai stok bahan baku. Namun demikian, kadar air sampel yang tinggi pada penelitian ini tidak berpeluang menimbulkan kontaminan karena kedua sampel hanya mengalami penyimpanan selama dua hari. Setelah penentuan kadar air, dilakukan proses ekstrak daun tembakau untuk mendapatkan ekstrak etanol yang akan digunakan sebagai bahan uji penelitian. Proses ekstraksi sampel pada penelitian ini menggunakan metode soxletasi dengan pelarut etanol (alkohol teknis 96%) yang mengacu pada penelitian sebelumnya. Puspita et al. (2010) telah menggunakan 3 metode ekstraksi tembakau yang meliputi soxletasi, maserasi, dan ultrasonik dengan masing-masing menggunakan pelarut heksan pro analisis, kloroform pro analisis, dan alkohol teknis 96%. Data hasil ekstraksi sebelumnya menunjukkan rendemen terbaik ekstraksi dendeng tembakau menggunakan metode soxletasi dengan pelarut alkohol teknis 96% yaitu 14.56%. Hal itu didukung pula oleh penelitian (Stanisavljevic et al. 2009) yang mengemukakan bahwa proses ekstraksi benih tembakau dengan metode soxletasi menghasilkan rendemen tertinggi (31.1 g/100 g) dibandingkan dengan metode maserasi (19.9 g/100 g) dan ultrasonifikasi langsung (21.0 g/100 g). Dengan demikian, metode soxletasi merupakan rekomendasi pilihan terbaik untuk mengekstrak daun tembakau pada penelitian ini agar diperoleh rendemen yang optimum. Prinsip kerja motode ekstraksi dengan soxletasi adalah adanya pemanasan dan perendaman sampel. Hal itu menyebabkan terjadinya pemecahan dinding dan membran sel akibat perbedaan tekanan antara di dalam dan di luar sel. Dengan demikian, metabolit sekunder yang ada di dalam sitoplasma akan terlarut dalam pelarut organik. Larutan itu kemudian menguap ke atas dan melewati pendingin udara yang akan mengembunkan uap tersebut menjadi tetesan yang akan terkumpul kembali. Bila larutan melewati batas lubang pipa samping soxlet akan terjadi sirkulasi. Sirkulasi yang berulang itulah yang menghasilkan ekstrak yang baik (Harborne 1987). Harborne (1987) menambahkan keuntungan metode soxletasi sebagai berikut: 1) cairan pelarut yang 17 diperlukan lebih sedikit dan secara langsung diperoleh hasil yang lebih pekat; 2) simplisisa disari oleh pelarut yang selalu baru sehingga dapat menarik zat aktif yang lebih banyak; 3) dan penyarian dapat diteruskan sesuai keperluan tanpa menambah volume pelarut. Sementara itu, kelemahannya adalah: 1) tidak baik untuk zat aktif yang tidak tahan panas, tetapi kondisi itu dapat diperbaiki dengan menambahkan peralatan untuk mengurangi tekanan udara; 2) adanya pendidihan pelarut terus-menerus sehingga mempengaruhi kualitas pelarut. Rendemen ekstrak etanol daun tembakau sampel A dan B yang diperoleh pada penelitian ini adalah 22.20% (b/b) dan 14.42% (b/b) dalam satuan basis basah. Besar rendemen ekstrak etanol pada penelitian ini jauh lebih tinggi dibandingkan dengan hasil penelitian Podlejski dan Olejniczak (1983) yang menyatakan bahwa ekstrak benzena dan petroleum eter daun tembakau secara berturut-turut adalah 7.42 % (b/b) dan 6.20 % (b/b) yang dinyatakan dalam satuan basis kering. Diduga bahwa rendemen sebenarnya yang seharusnya dihasilkan lebih kecil daripada nilai rendemen yang diketahui dari hasil penelitian. Tingginya hasil rendemen yang diperoleh pada ekstrak etanol daun tembakau Temanggung itu kemungkinan dipengaruhi oleh adanya kadar air dalam rendemen ekstrak yang belum dipisahkan. Kadar air pada sampel A (12.37%) yang lebih tinggi dibandingkan dengan sampel B (10.69%) memberikan pengaruh terhadap tingginya rendemen sampel A (22.20%) yang juga lebih tinggi dibandingkan dengan sampel B (14.42%). Dugaan terdapatnya kadar air pada ekstrak etanol daun tembakau juga dapat dilihat dari karakteristik fisik hasil ekstrak yang berbentuk pasta. Pasta merupakan sistem koloid dengan fase pendispersi berupa bahan cair dan fase terdispersi berupa bahan padatan. Fase cair dalam sistem koloid tersebut diduga mencakup di dalamnya kandungan air yang belum terpisahkan. Berdasarkan data rendemen ekstrak etanol daun tembakau diketahui bahwa daun tembakau sampel A (22.20%) menghasilkan ekstrak yang lebih tinggi dibandingkan dengan sampel B (14.42%). Rendemen ekstrak tersebut diasumsikan hanya mengandung sisa pelarut yang tertinggal dalam jumlah kecil karena telah dilakukan pengeringan ekstrak. Pengeringan ekstrak etanol daun tembakau berlangsung selama 3 jam dengan suhu 40ºC hingga diperoleh tembakau serbuk yang kering. Perlakuan pengeringan bertujuan menguapkan sisa pelarut etanol. Berdasarkan kadar rendemen, terlihat bahwa daun tembakau sampel A lebih baik digunakan untuk kepentingan produksi karena besarnya rendemen yang dihasilkan. Penggunaan etanol juga didasarkan oleh keunggulannya sebagai pelarut zat bioaktif. Pelarut etanol tidak bersifat toksik, tidak menyebabkan pembengkakan membran sel, dan mampu mengendapkan albumin serta menghambat kerja enzim. Etanol juga efektif menghasilkan bahan aktif yang optimal karena hanya terdapat sedikit kehilangan (loss) produk yang larut dalam pelarut (Voight 1995). B. KOMPONEN FITOKIMIA EKSTRAK ETANOL DAUN TEMBAKAU Analisis fitokimia merupakan pengujian ekstrak etanol daun tembakau secara kualitatif yang bertujuan mengetahui jenis senyawa yang terkandung dalam ekstrak. Hasil uji fitokimia menunjukkan bahwa ekstrak etanol daun tembakau sampel A mengandung alkaloid, flavonoid, terpenoid, dan steroid. Sementara itu, ekstrak etanol daun tembakau sampel B mengandung alkaloid, flavonoid, dan terpenoid (Tabel 5). Ekstrak etanol daun tembakau sampel A dan B menunjukkan hasil positif terhadap kandungan alkaloid yang dilihat berdasarkan hasil pengujian menggunakan pereaksi Meyer, Wagner, dan Dragendrof dengan adanya endapan putih, warna coklat, dan warna merah jingga (Gambar 3). Kadar alkaloid dalam ekstrak etanol daun tembakau tersebut secara kualitatif terlihat tinggi dan sangat tinggi untuk sampel A dan B. Dengan demikian, dapat diduga bahwa 18 alkaloid merupakan salah satu senyawa kimia tumbuhan yang mendominasi daun tembakau. Sementara itu, secara kualitatif pula dapat dilihat bahwa sampel B mengandung alkaloid yang lebih tinggi dibandingkan sampel A dengan adanya perubahan warna pada pengujian kimia yang tampak lebih jelas (Gambar 3). Tabel 5. Hasil uji fitokimia ekstrak etanol daun tembakau sampel A dan B Hasil Pengujian Sampel A Sampel B Alkaloid - Meyer ++++ +++++ - Wagner ++++ +++++ - Dragendrof ++++ +++++ Flavonoid +++ +++ Terpenoid +++ +++ Steroid ++++ Keterangan: + ++ +++ : sangat rendah : rendah : sedang ++++ +++++ : tinggi : sangat tinggi Sampel B Sampel A Meyer Wegner Dragendof Gambar 3. Hasil uji alkaloid Senyawa alkaloid adalah senyawa alami amina yang bersifat basa yang mengandung satu atau lebih atom nitrogen sebagai bagian dari sistem siklik (Harborne 1993). Menurut Andersen et al. (1991), senyawa alkaloid pada tembakau adalah penentu aroma yang terkait dengan kualitas tanaman tembakau. Senyawa tersebut didominasi oleh nikotin hingga 95% (Shen et al. 2006) yang bersifat karsinogenik. Senyawa alkaloid lainnya yang juga terkandung dalam tembakau adalah nornikotin dan anabasin yang dapat menimbulkan kecanduan apabila dikonsumsi (Nugroho et al. 2002). Pada tembakau, nikotin yang terkandung di dalamnya digunakan sebagai zat pertahanan diri dari serangan lingkungan (Wink 1998). Oleh karena itu, produksi nikotin semakin meningkat saat tanaman mulai mengalami kerusakan. Produksi nikotin mencapai kondisi maksimum ketika selang waktu 9 hari setelah terjadi kerusakan awal (Baldwin 1989). Hal tersebut dibuktikan juga oleh penelitian Misuzaki et al. (1973) yang menyatakan bahwa pemangkasan daun tembakau menyebabkan peningkatan produksi nikotin oleh tembakau. Dengan demikian, kondisi tersebut sesuai dengan hasil penelitian yang menunjukkan bahwa ekstrak sampel B memiliki kadar alkaloid yang lebih tinggi dibandingkan ekstrak sampel A. Telah diketahui bahwa sampel B merupakan daun tembakau dengan karakteristik fisik yang banyak mengalami luka akibat letaknya pada bagian bawah batang tanaman sehingga lebih rentan mengalami gangguan dari 19 lingkungannya. Dengan demikian, diduga daun tersebut (sampel B) memproduksi nikotin yang tergolong alkaloid lebih banyak sebagai bentuk pertahanan diri terhadap lingkungannya. Senyawa nikotin yang tergolong alkaloid tersebut telah diujikan kemampuan aktivitas antibakterinya terhadap beberapa strain bakteri oleh Pavia et al. (2000). Adanya nikotin dalam media cair yang di dalamnya ditumbuhkan bakteri S. aureus, E. coli, Mycobcterium phlei, dan Viridians streptococci dapat menghambat pertumbuhan bakteri secara berurutan pada konsentrasi minimum >10%, >10%, >0%, dan >0%. Kemampuan aktivitas antibakteri oleh ekstrak nikotin daun tembakau ditunjukkan dengan adanya penurunan total bakteri uji dalam media cair (cgu/ml). Senyawa kimia lainnya yang terdapat pada tumbuhan adalah flavonoid. Flavonoid merupakan golongan terbesar dari fenol. Flavonoid umumnya terdapat dalam tumbuhan berbentuk aglikol maupun terikat pada gula sebagai glikosida (Middleton dan Chitan 1994). Pada pengujian fitokimia senyawa flavonoid pada ekstrak etanol daun tembakau sampel A dan B, ditunjukkan terjadinya perubahan warna reaksi menjadi merah (Gambar 4). Hal itu menjadi dasar pendugaan adanya senyawa flavonoid pada daun tembakau yang kadarnya tergolong sedang untuk kedua jenis sampel. Dugaan tersebut sesuai dengan penelitian oleh Fathiazad et al. (2006) yang berhasil membuktikan adanya flavonid pada daun tembakau. Jenis flavonoid yang berhasil diisolasi tersebut adalah rutin. Rutin dapat berfungsi mengobati diabetes (Grinberg et al. 1994), meregenerasi sel, serta bersifat anti tumor (Sambantham 1985). Rutin juga dapat dipakai untuk pewarna makanan dan minuman (Evans 1996). Sampel A Sampel B Gambar 4. Hasil uji flavonoid Kelompok fenol yang mencakup senyawa flavonoid diketahui memiliki aktivitas antibakteri terhadap bakteri S. aureus, E. coli, dan B. subtilis. Zona hambat yang terbentuk pada media tumbuh ketiga bakteri tersebut di media agar oleh polifenol dengan konsentrasi 1 mg /ml secara berurutan adalah 17.7 mm, 20.2 mm, dan 12.9 mm. Steroid dan terpenoid juga ditemukan sebagai senyawa fitokimia dalam ekstrak etanol daun tembakau sampel A yang ditunjukkan dengan terbentuknya warna keunguan dan hijau pada pengujian fitokimia (Gambar 5). Sementara itu, pada ekstrak etanol daun tembakau sampel B tidak ditemukan adanya steroid. Adanya dugaan senyawa steroid dan terpenoid pada ekstrak etanol daun tembakau sampel A sesuai dengan karakteristik warna dan aromanya. Ekstrak etanol daun tembakau sampel A berwarna hijau, selaras dengan sifat steroid yang berwarna hijau (Cowan 1999). Selain itu, aromanya juga khas, sesuai dengan sifat steroid yang tergolong terpenoid, yaitu komponen minyak atsiri yang memiliki kekhasan aroma (Gunta et al. 1985). Hal itu berbeda dengan ekstrak etanol daun tembakau sampel B yang berwarna coklat dan tidak beraroma khas sehingga diduga tidak mengandung steroid dan telah dibuktikan melalui pengujian fitokimia secara kualitatif. 20 Sampel A Sampel B Gambar 5. Hasil uji steroid dan terpenoid Kandungan terpenoid pada ekstrak etanol daun tembakau sampel A dan B tergolong sedang berdasarkan penilaian kualitatif, sedangkan steroid pada ekstrak etanol daun tembakau sampel A tergolong kuat. Hal itu menunjukkan bahwa steroid merupakan senyawa yang menyusun sebagian besar komponen terpenoid pada ekstrak etanol daun tembakau sampel A. Sementara itu, tidak adanya kandungan steroid pada ekstrak etanol daun tembakau sampel B pada pengujian fitokimia menunjukkan pula bahwa senyawa terpenoid dalam kandungan ekstrak tersebut diduga tersusun atas senyawa selain steroid. Senyawa steroid dan terpenoid yang tergolong komponen minyak atsiri telah dibuktikan kemampuan antibakterinya terhadap S. aureus, E. coli, dan P. aeruginosa pada konsentrasi 1 mg/ml (Palic et al. 2002). Diameter zona hambat yang terbentuk pada konsentrasi tersebut terhadap bakteri uji secara berurutan adalah 15.2 mm, 15.0 mm, dan 15.2 mm. C. AKTIVITAS ANTIBAKTERI EKSTRAK TERHADAP BAKTERI S. aureus DAN E. coli DAUN TEMBAKAU Pengujian aktivitas antibakteri oleh ekstrak daun tembakau dapat dilakukan dengan mengukur daya hambat pertumbuhan bakteri S. aureus dan E. coli. Hal itu dapat diketahui melalui pengukuran diameter zona bening yang terbentuk di sekitar sumur pada agar yang diisikan ekstrak sampel. Pengukuran itu bertujuan mengetahui potensi senyawa bioaktif pada ekstrak daun tembakau dalam menghambat pertumbuhan bakteri uji. Hasil penelitian tentang parameter aktivitas antibakteri pada ekstrak etanol daun tembakau yang dapat disajikan hanya untuk sampel A (yaitu daun tembakau yang dipetik dari batang tembakau bagian atas dan tengah). Sementara itu, pengujian parameter daya aktivitas antibakteri terhadap ekstrak etanol daun tembakau sampel B pada tahap penelitian ini tidak diuji lanjut karena data yang diperoleh kurang layak sedangkan kendala waktu tidak memungkinkan untuk melakukan pengujian ulang. Pengujian aktivitas antibakteri ekstrak etanol daun tembakau sampel A dilakukan dengan mengukur diameter zona hambat pada berbagai konsentrasi ekstrak etanol (20% b/v, 40% b/v, 60% b/v, 80% b/v, dan 100% b/v) sehingga diperoleh nilai daya hambat tumbuh bakteri. Zona hambat tersebut berupa zona bening yang merupakan zona yang tidak ditumbuhi oleh bakteri. Selain itu digunakan pula kontrol positif (tetrasiklin) dan kontrol negatif (DMSO). Tetrasiklin yang digunakan dalam penelitian ini tergolong senyawa antibiotik yang menghambat bakteri dengan cara merusak mekanisme sintesis protein pada sel bakteri. Penggunaan tetrasiklin sebagai kontrol positif tersebut dikarenakan daya spektrum menghambatnya yang luas yaitu terhadap bakteri Gram negatif dan positif (Fardiaz et al. 1987). Sementara itu, pengunaan DMSO sebagai pelarut dan kontrol negatif didasarkan atas sifatnya yang dapat melarutkan senyawa hidrokarbon 21 (Merck 1986) seperti senyawa bioaktif dalam daun tembakau tanpa berpengaruh terhadap pengujian aktivitas antibakteri ekstrak sampel. Perlakuan diberikan terhadap bakteri uji S. aureus (Gram positif) dan E. coli (Gram negatif). Kekuatan daya hambat terhadap bakteri tersebut dapat dinilai dari ukuran zona bening yang terbentuk yaitu daerah yang tidak ditumbuhi oleh bakteri (Kusumaningjati 2009). Penentuan sifat daya hambat bakteri pada penelitian ini didasarkan pada ketentuan Davis-Stout bahwa daya hambat bakteri tergolong sangat kuat bila bernilai >20 mm, kuat bila bernilai 10-20 mm, sedang bila bernilai 5-10 mm, dan tergolong lemah bila bernilai <5 mm. Tabel 6 menunjukkan kekuatan aktivitas antibakteri oleh ekstrak etanol daun tembakau sampel A berdasarkan pengukuran diameter zona hambat yang terbentuk pada pengujian daya hambat tumbuh bakteri. Tabel 6. Diameter zona hambat (mm) ekstrak etanol daun tembakau sampel A terhadap bakteri S. aureus dan E. coli Perlakuan S. aureus E. coli Kontrol (+) / Tetrasiklin 10% Kontrol (-) / DMSO Konsentrasi ekstrak 20% (b/v) Konsentrasi ekstrak 40% (b/v) Konsentrasi ekstrak 60% (b/v) Konsentrasi ekstrak 80% (b/v) Konsentrasi ekstrak 100% (b/v) 29.5 0 4 6 6 7 7 37 0 4 6 6 8 8 Berdasarkan data tersebut diketahui bahwa ekstrak etanol daun tembakau sampel A memiliki kemampuan antibakteri terhadap S. aureus dan E. coli dengan adanya zona hambat terbentuk (Gambar 6). Pada konsentrasi 20%, daya hambat ekstrak etanol daun tembakau sampel A terhadap S. aureus dan E. coli tergolong lemah (4 mm). Sementara itu, daya hambat ekstrak etanol daun tembakau sampel A terhadap S. aureus dan E. coli tergolong sedang pada konsentrasi 40%-100% b/v. Dengan demikian, ekstrak etanol daun tembakau pada rentang konsentrasi 20-100% b/v tidak memiliki aktivitas yang kuat dalam menghambat bakteri S. aureus maupun E. coli (5-10 mm). Hal itu dimungkinkan karena rentang konsentrasi 20% b/v hingga 100% b/v tersebut terlalu rendah bagi senyawa antibakteri pada daun tembakau untuk bekerja optimal. Pada konsentrasi tersebut kemungkinan telah terbentuk kompleks protein dengan senyawa antibakteri melalui ikatan yang lemah dan segera mengalami peruraian. Akibatnya senyawa antibakteri belum mampu mengkoagulasi protein serta melisis sel bakteri. Dengan demikian, daun tembakau lokal asal Temanggung memiliki aktivitas antibakteri yang rendah, tidak sekuat daun tembakau jenis Prilep (Palic et al. 2002) dan Oltja (Stojanovic et al. 2000) dalam menghambat bakteri S. aureus (15.2 mm & 15.0 mm) maupun E. coli (15.4 mm & 15.0 mm). Kemungkinan lainnya yang menjadi penyebab lemahnya daya hambat tumbuh bakteri S. aureus dan E. coli oleh ekstrak etanol tembakau adalah faktor kemurnian konsentrasi ekstrak yang digunakan. Nilai konsentrasi ekstrak yang digunakan sebagai sampel uji diduga masih mengandung air sehingga konsentrasi sebenarnya yang digunakan lebih rendah daripada nilai yang digunakan dalam pengujian. Dengan demikian, adanya kandungan air dalam ekstrak berpengaruh negatif pada kemampuan hambat tumbuh bakteri S. aureus dan E. coli. 22 Nilai daya hambat tumbuh bakteri S. aureus dan E. coli oleh ekstrak etanol daun tembakau menunjukkan nilai yang secara umum lebih rendah (<10 mm) bila dibandingkan dengan senyawa atsiri dan polifenol daun tembakau. Nilai daya hambat tumbuh bakteri oleh senyawa atsiri daun tembakau jenis Prilep dapat mencapai 15.2 mm dan 15.0 mm terhadap bakteri S. aureus dan E. coli (Palic et al. 2002). Sementara itu, nilai daya hambat tumbuh bakteri oleh senyawa polifenol daun tembakau dapat mencapai 17.6 mm dan 20.2 mm terhadap bakteri S. aureus dan E. coli (Wang 2008). Dengan demikian, penggunaan ekstrak kasar etanol daun tembakau tidak mampu memberikan pengaruh aktivitas antibakteri yang lebih tinggi dibandingkan penggunaan ekstrak yang telah dimurnikan menjadi flavonoid dan polifenol. Hal itu berbeda dengan kontrol positif (tetrasiklin 10%) yang memberikan nilai diameter zona bening pada S. aureus dan E. coli sebesar 29 mm dan 37 mm yang keduanya memiliki aktivitas antibakteri yang tergolong sangat kuat. Adanya ukuran diameter zona hambat bakteri oleh tetrasiklin sebagai kontrol positif dikarenakan keunggulannya sebagai antibiotik berspektrum luas. Sementara itu, kontrol negatif (DMSO) tidak menunjukkan adanya zona bening yang berarti bahwa peranannya sebagai pelarut tidak berdampak pada pengaruh aktivitas antibakteri ekstrak etanol daun tembakau. Data pada tabel 6 juga menunjukkan bahwa konsentrasi ekstrak 20%-60% b/v memiliki aktivitas antibakteri yang sama terhadap kedua bakteri uji (S. aureus dan E. coli). Pada konsentrasi yang tinggi (60%-80% b/v) terlihat perbedaan daya hambat ekstrak terhadap kedua jenis bakteri uji. Pada konsentrasi itulah, senyawa bioaktif ekstrak dapat berpenetrasi optimal ke dalam sel bakteri dan membuatnya lisis. 60% 40% 40% 20% 20% 60% 80% 100% 80% 100% 60% S. aureus 60% E. coli Gambar 6. Zona hambat ekstrak etanol daun tembakau sampel A terhadap bakteri S. aureus dan E. coli Ekstrak etanol daun tembakau sampel A pada konsentrasi 80% b/v dan 100% b/v memiliki aktivitas antibakteri yang lebih baik terhadap E. coli (8 mm) dibandingkan S. aureus (7 mm) berdasarkan diameter zona bening yang terbentuk (Gambar 6). Hal itu dipengaruhi oleh adanya sifat dinding sel bakteri Gram negatif (E.coli) yang lebih tipis (5-80 nm) dibandingkan dengan Gram positif (10-15 nm). Perbedaan ketebalan tersebut menyebabkan bakteri Gram negatif lebih mudah untuk dihambat aktivitasnya dengan cara merusak dinding sel bakteri (Pelczar & Chan 1998). Adanya aktivitas antibakeri pada pengujian ekstrak etanol daun tembakau sampel A terhadap S. aureus dan E. coli diduga dipengaruhi oleh kandungan senyawa antibakteri berupa komponen 23 bioaktif pada sampel. Hasil pengujian fitokimia sebelumnya membuktikan bahwa ekstrak etanol daun tembakau sampel A mengandung alkaloid, flavonoid, terpenoid, dan steroid. Senyawasenyawa tersebut bersifat antibakteri dengan mekanisme penghambatan pertumbuhan bakteri yang khas sesuai dengan karateristiknya masing-masing. Pada prinsipnya, mekanisme kerja senyawa alkaloid sebagai antibakteri adalah kemampuannya mengganggu sintesis DNA dan dinding sel (Cowan 1999). Namun demikian, penggunaan kadar alkaloid yang berlebihan dapat menimbulkan resistensi mikroorganisme sasaran. Resistensi merupakan masalah individual epidemilogi yang menggambarkan ketahanan mikroba terhadap antibiotik tertentu yang dapat berupa resistensi alamiah hidup (Setiabudy dan Gan 1995), resistensi karena adanya faktor R pada sitoplasma (resistensi ekstrak kromosomal) atau resistensi karena pemindahan gen yang resistensi atau faktor R atau plasmid (Wattimena et al 1991). Senyawa lainnya pada ekstrak daun tembakau pada penelitian ini yang juga diduga berperan sebagai antibakteri adalah flavonoid. Flavonoid merupakan golongan terbesar senyawa fenol (Middleton dan Chitan 1994). Harborne (1993) menyatakan bahwa flavonoid pada tumbuhan berfungsi untuk mengatur pertumbuhan, mengatur fotosintesis, mengatur kerja antibakteri, dan antivirus, serta mengatur kerja antiserangga. Hal itu dikarenakan flavonoid memiliki spektrum aktivitas antibakteri yang luas dengan mengurangi kekebalan pada organisme sasaran (Naidu 2000). Mekanisme antibakteri flavonoid ialah dengan cara membentuk senyawa kompleks terhadap protein ekstraseluler yang mengganggu integritas membran sel bakteri (Cowan 1999). Diketahui bahwa membran sitoplasma berperan mempertahankan bahan-bahan tertentu di dalam sel serta mengatur keluar masuknya bahan-bahan bagi sel. Membran berfungsi memelihara integritas komponen-komponen seluler. Zat antibakteri akan menyebabkan terjadinya kerusakan pada membran sel. Kerusakan pada membran ini mengakibatkan terganggunya pertumbuhan sel bahkan menyebabkan sel mati (Akiyama et al 2001). Selain itu Dwidjoseputro (1994) mengemukakan bahwa flavonoid merupakan senyawa fenol sementara senyawa fenol dapat bersifat koagulator protein. Senyawa steroid dan terpenoid yang merupakan golongan minyak atsiri turut pula diduga sebagai senyawa yang berperan sebagai antibakteri. Nychas dan Tassou (2000) menyatakan bahwa minyak atsiri dapat menghambat enzim yang terlibat pada produksi energi dan pembentukan komponen struktural sehingga pembentukan dinding sel bakteri terganggu. Mekanisme kerusakan dinding sel disebabkan oleh adanya akumulasi komponen lipofilik yang terdapat pada dinding sel atau membran sel sehingga menyebabkan perubahan komposisi penyusun dinding sel. Minyak atsiri yang aktif sebagai antibakteri pada umumnya juga mengandung fenol yang merupakan gugus fungsi hidroksil (-OH) dan karbonil (Beuchat 1994). Turunan fenol berinteraksi dengan sel bakteri melalui proses adsorpsi yang melibatkan ikatan hidrogen. Pada kadar rendah terbentuk kompleks protein fenol dengan ikatan yang lemah dan segera mengalami peruraian diikuti penetrasi fenol ke dalam sel dan menyebabkan presipitasi serta denaturasi protein. Pada kadar tinggi fenol menyebabkan koagulasi protein dan sel membran mengalami lisis (Parwata dan Dewi 2008). 24 V. SIMPULAN DAN SARAN A. SIMPULAN Rendemen ekstrak etanol daun tembakau Temanggung varietas Genjah Kemloko campuran bagian atas dan tengah yang diperoleh pada penelitian ini lebih tinggi (22.20% b/b) dibandingkan dengan bagian bawah (14.42% b/b) dalam satuan basis basah. Nilai tersebut kemungkinan di atas nilai sebenarnya karena adanya kadar air pada daun tembakau campuran bagian atas dan tengah (12.37%) dan bagian bawah (10.69%). Ekstrak etanol daun tembakau bagian atas dan tengah mengandung komponen fitokimia yang berupa alkaloid, flavonoid, terpenoid, dan steroid yang merupakan senyawa bioaktif yang berperan sebagai antibakteri. Ekstrak etanol daun tembakau bagian bawah mengandung komponen alkaloid, flavonoid, dan terpenoid. Berdasarkan hasil uji fitokimia, senyawa alkaloid diduga terdapat dalam kadar yang paling tinggi pada kedua jenis ekstrak daun tembakau. Kadar alkaloid terdapat dalam jumlah yang lebih tinggi pada ekstrak daun tembakau bagian atas dan tengah. Adapun, flavonoid dan terpenoid terdapat dalam jumlah yang relatif sama secara kualitatif pada kedua jenis ekstrak daun tembakau. Pada konsentrasi 20% b/v ekstrak etanol daun tembakau bagian atas dan tengah memiliki aktivitas antibakteri yang tergolong lemah (diameter zona hambatnya adalah 4 mm) terhadap S. aureus dan E. coli sedangkan pada konsentrasi sebesar 40% b/v dan 60% b/v tergolong sedang (diameter zona hambatnya adalah 6 mm & 7 mm) terhadap S. aureus dan E. coli. Ekstrak etanol daun tembakau pada konsentrasi 20%-60% b/v menunjukkan aktivitas yang sama terhadap S. aureus dan E. coli. Hal itu berbeda dengan ekstrak etanol daun tembakau konsentrasi 80%-100% b/v yang memiliki daya hambat lebih besar terhadap E. coli (8 mm) dibandingkan dengan S. aureus (7 mm) dengan aktivitas antibakteri tergolong sedang. B. SARAN Perlu dilakukan penelitian lebih lanjut mengenai penentuan senyawa bioaktif ekstrak daun tembakau asal Temanggung yang memiliki aktivitas antibakteri paling optimum. 25 DAFTAR PUSTAKA Abdullah A dan Soedarmanto. 1982. Budidaya Tembakau. Jakarta: CV Yasaguna. Andersen RA, Fleming PD, Burton HR, Hamilton-Kemp TR, Sutton TG. 1991. J Agric Food Chem 39:1280. Baldwin IT. 1989. Mechanism of damage induces alkaloid production in wild tobacco. J Chem. Ecol 20: 2139-2157. Berdy J. 2005. Bioactive Microbial Metabolites. J Antibiotics Research Association 58(1): 1-26. Beuchat LR. 1994. Antimicrobial Properties of Species and Theirs Essential Oils. Di dalam Naidu AS (ed). 2000. Natural Foods Antimicrobial Systems. CRC Press. USA. Blanch GP, Tabera J, Herraiz M, Reglero G. 1993. J Chromatograph 628:261. Brooks GF, Janet SB, Stephen AM. 2001. Mikrobiologi Kedokteran. Jakarta: Salemba Medika. Brunnemann KD, Hofmann D. 1991. Rec Adv Tob Sci 17:71. Cahyono B. 1998. Tembakau, Budidaya dan Analisis Tani. Yogyakarta: Kanisius. Cai JB, Liu BZ, Ling P, Su QD. 2002. J Chromatogr. A 947: 267-275. Chomnawang MT, Surassno S, Nukoolkarn VS, and Gristanapan W. 2005. Antimicrobial effects of Thai medicinal plants against acneinducing bacteria. Jethnopharmacol 101: 330-333. Cowan MM. 1999. Plant products as antimicrobial agents. Clinical Microbiology Reviews 12: 564– 82. DerMarderosian A. 2001. The review of natural products 2nd ed. facts and comparison. Missouri. Halaman 554-555. [Deptan]. 2011. http://www.litbang.deptan.go.id/varietas. [1 Februari 2011] Evans WC. 1996. Trease and evans pharmacognosy 14th ed. wb saunders company Ltd. London. Halaman 251. Fardiaz F. 1987. Mikrobiologi pangan jilid 1. Bogor: PAU. Fathiazad F, Delazar A, Amiri R, Sarker SD. 2006. Extraction of flavonoids and quantification of rutin from waste tobacco leaves. Iranian Journal of Pharmaceutical Research 3:222-227. Goodspread TH. 1954. The genus nicotiana, origins, relationships and evolution of its species in the light of their distribution, morphology and cytogenetics. USA: Waltham Mass. Grinberg LN, Rachmilewitz EA, Newmark H. 1994. Protective effects of rutin against hemoglobin oxidation. Biochem Pharmacol 48:643-649. Gunta YZ, Baynove CL, Baumes RL, Cordonnier RE. 1985. J. Chromatogr, 331: 83-90. Harborne JB. 1987. Metode Fitokimia: Penuntun cara modern menganalisis tumbuhan. Edisi kedua. Penerjemah; Padmawinata K dan Soediro J, Niksolihin editor. Bandung: ITB. Terjemahan dari: Phytochemical methods. Harborne JB. 1993. Phytochemistry. London: Academic Press. Hastari DW. 2009. Struktur pendapatan usahatani tembakau Temanggung sistem rotasi dengan jagung dan kacang tanah: kasus di Desa Wonotirto kecamatan Bulu, Kabupaten Temanggung, Jawa Tengah [skripsi]. Bogor: Program Sarjana, IPB. Hogiono, Dangi. 1994. Peningkatan Nilai Tambah Tanaman Holtikultura yang Berpotensi sebagai Bahan Dasar Sintesis Obat-obatan Steroid [skripsi]. Surabaya: Program Sarjana, Unair. Khidyrova NK, Shakhidoyatov KM. 2002. Plant polyprenols and their biological activity. Chem Nat. Comp 38: 107-121. 26 Kim KR, Zlatkis A, Park JW, Lee VC. 1982. Chromatographia 15:5590 Kusumaningjati F. 2009. Potensi antibakteri kitosan sebagai pengawet tahu [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor. Li Y, Pang T, Guo Z, Li Y, Wang X, Deng J, Zhong K, Li X, Xu G. 2010. Accelerated solvent extraction for GC-based tobacco fingerprint and its comparison with simultaneous distillation and extraction. Journal Talanta 81: 650-656. Machado PA, Fu H, Kratochivl RJ, Yuan Y, Hahm TS, Sabliov CM, Wei CI, lo YM. 2010. Recovery of solanesol from tobacco as a value added byproduct for alternative applications. J Bioresources Technology 101: 1091-1096. Man J. 1987. Secondary Metabolism (2nd ed). England: Oxford Clerendon Press. Merck. 8th edition. 1986. Paul G. Stecher (ed). USA: Merck & Co., Inc. Rahway. N. J. Middleton E, Chitan K. 1994. The impact of plant flavonoids on mammalian biology: Implication for immunity, inflammation dan cancer. Di dalam: Harborne JB (ed) The Flavonoids. Chapman and Hall. London. Miller LP. 1973. Phytochemistry organic metabolites van nostrand and reinbold company. New York 2: 382-384. Misuzaki S, Tanabe Y, Roguchi M, Tamaki E. 1973. Changes in the activities of ornithin decarboxylase, putrescine n-methyltransferase and n-methylputrescine oxidase in tobacco roots in relation to nicotine biosynthesis. J Plant Cell Physiol 14:103-110. Naidu AS. 2000. Natural Food Antimicrobial Systems. USA: CRC Press. Nugroho LH, Peltenburg-Looman AMG, de Vos H, Verberne MC, Verpoorte R. 2002. Nicotine and related alkaloids accumulation in constitutive salycyclic acid producing tobacco plants. J Plant Science 162: 575-581. Nychas GJE. 1995. Natural antimicrobial from plants. Di dalam: Gould GW (eds) Newmethods of food preservation. London: Blackie Academic and professional. Palic R, Stojanovic G, Alagic S, Nikolic M, Lepojevic Z. 2002. Chemical Composition and Antimicrobial Activity of The Essential Oil and CO2 Extracts of Semi-orientl Tobacco, Prilep. Flavour Fragr J. 17:323-326. Parwata IMOA, Dewi PFS. 2008. Isolasi dan uji aktivitas antibakteri minyak atsiri dari rimpang lengkuas (Alpinia galanga L.). Jurnal Kimia 2(2): 100-104. Pelczar MJ dan Chan ECS. 1998. Dasar-dasar Mikrobiologi. Jakarta: UI Pr. Pang F, Sheng L, Liu B, Tong H, Liu S. 2004. Comparison of Different Extraction Methods: Steam Distillation, Simlutaneous Distillation and Extraction and Headspace Co-distillation, Used for the Analysis of the Volatile Components in Aged Flue Cured Tobacco Leaves. J Chromatogr. A 1040: 1-17. Podlejski J, Olejniczak W. 1983. methods and techniques in research of tobacco flavour. Nahrung 27. 5:429-436. Puspita PE, Purnamasari RA, Manurung AJ. 2010. Aplikasi antiseptik tembakau. Program Kreativitas Mahasiswa Bidang Penelitian. DIKTI. Roselius W, Vitzhum O, Hubert P. 1979. US Patent, 4, 153, 063. Sambantham P. 1985. Analgesic activity of certain bioflavonoids. Indian J Pharm Sci 47: 230-231. Shen J, Shao X. 2006. Determination of tobacco alkaloids by Gas Chromatographhy-Mass Spectrometry using cloud point extraction as a preconcentration step. J Analytica Chimica Acta 561: 83-87. Schultz TH, Flath RA, Mon TR, Eggling SB, Teranishi R. 1977. J Agric Food Chem 25:446 27 Stanisavljevic I, Velickovic DT, Todorovic ZB, Lazic ML, Velkjovic VB. 2009. Comparison of techniques for the extraction of tobacco seed oil. Eur. J. Lipid Sci. Technol 111:513-518. Stojanovic G, Palic R, Alagic S, Zekovic Z. 2000. Chemical composition and antimicrobial activity of the essential oil and co2 extracts of Semi-oriental Tobacco, Oltja. Flavour Fragr J. 15:335-338. Susilowati EY. 2006. Identifikasi nikotin dari daun tembakau kering dan uji efektivitas ekstrak daun tembakau (Nicotiana tabacum) sebagai insektisida penggerek batang padi (Scirpophaga innonata). Skripsi. Universitas Negeri Semarang. Teissser PJ. 1994. Chemistry of Fragment Substance. VHC Publ Inc. New York. Todar K. 2004. Structure and Fuction of Prokarytic Cells. Todar’s Online Textbook of Bacteriology. Wisconsin-Madison. Voight R. 1995. Buku Pelajaran Teknologi Farmasi, Edisi V. Diterjemahkan oleh Soendani Noerono. Gadjah Mada University Press. Yogyakarta. Wax GR, Lewis K, Salyer AA, Taber H. 2008. Bacterial Resistance to Antimicrobials Second Edition. London. CRC Press. New York. Wilson RA, Mookherjee BD, Vinals JF. 1982. A Comparative Analysis of The Volatile Constituents of Virginia, Burley, Turkeys, and Black Tobaccos. Plenary Lecture. Kansas. Winarno FG. 2002. Kimia Pangan dan Gizi. Gramedia Pustaka Utama. Jakarta. Wink M. 1998. A short history of alkaloids. Di dalam: Alkaloids: Biochemistry, ecology and medicinal applications. M.F. Roberts, & M. Wink, eds. Plenum. New York. Wu ZM, Weeks WW, Long RC. 1992. J Agric Food Chem 40:1917. Xin Z, Jinren N, Wen H. 2006. Extraction of Solanesol from Tobacco with Supercritical Carbon Dioxide. Fine Chem 23:480-501. Yaqin HU, Jibao CAI, Xiaolan ZHU, Yun GAO, Qingde SU. 2006. Two-Step Simultaneous Distillation and Solvent Extraction for Isolation Both Free and Bound Aroma in Tobacco. J. Animali di Chimica, 96:1-8. 28 LAMPIRAN 29 Lampiran 1. Prosedur pengukuran kadar air Wadah sampel Diukur bobotnya (a) Sampel tembakau serbuk(b) Dikeringkan dalam oven 105˚C, 24 jam Diukur bobot akhirnya (c) tidak Bobot stabil ya Diukur kadar airnya Lampiran 2. Kadar air daun tembakau sampel A dan B Ulangan 1 2 3 Rerata Kadar Air (%) Sampel A Sampel B 12.34 10.33 12.27 10.55 12.50 11.18 12.37 10.69 30 Lampiran 3. Prosedur ekstraksi daun tembakau dengan metode soxletasi Sampel tembakau serbuk (10 g) Ditambahkan etanol (100 ml) Soxletasi 90 min, 4 refluks Pengukuran rendemen Lampiran 4. Rendemen hasil soxletasi daun tembakau sampel A dan B Sampel A B Bobot awal (g) 50.00 50.00 Bobot akhir (g) 46.25 44.25 Rendemen (%) 22.2 14.42 31 Lampiran 5. Prosedur pengujian alkaloid Sampel tembakau serbuk (1 g) Ditambahkan 5 ml kloroform, NH4OH, H2SO4 Ditambahkan pereaksi Meyer Ditambahkan pereaksi Wagner Ditambahkan pereaksi Dragendrof Terbentuk endapan putih Terbentuk warna coklat Terbentuk warna jingga Lampiran 6. Prosedur pengujian flavonoid Sampel tembakau serbuk (0.1 g) Ditambahkan 1 ml metanol dididihkan Ditambahkan H2SO4 Terbentuk warna merah 32 Lampiran 7. Prosedur pengujian steroid dan terpenoid Sampel tembakau serbuk (0.1g) Ditambahkan 5 ml metanol dididihkan Ditambahkan eter dan pereaksi Liebermen Dikocok Terbentuk warna hijau menunjukkan adanya steroid Terbentuk warna merah menunjukkan adanya terpenoid 33 Lampiran 8. Prosedur pembuatan media NA Media NA (2 gram) dan 100 mL air Dipanaskan pada suhu 70°C, 30 menit dan diaduk dengan magnetik stirer Dituang ke dalam labu Erlenmeyer dan disumbat dengan kapas Sterilisasi dengan autoklaf 121°C, 15 menit Lampiran 9. Prosedur pembuatan media LB NaCl (0.5 g), yeast extract (1.25), tripton (0.5 g), 1 liter aquadest Dipanaskan pada suhu 70°C, 30 menit dan diaduk dengan magnetik stirer Dituang ke dalam labu Erlenmeyer dan disumbat dengan kapas Sterilisasi dengan autoklaf 121°C, 15 menit 34 Lampiran 10. Prosedur peremajaan bakteri E. coli S. aureus Diinokulasi ke dalam labu Erlemeyer berisi larutan LB 10 ml Diinokulasi ke dalam labu Erlemeyer berisi larutan LB 10 ml Dituang ke dalam labu Erlenmeyer dan disumbat dengan kapas Dituang ke dalam labu Erlenmeyer dan disumbat dengan kapas Inkubasi dalam shaker bergoyang 18 jam, 37°C, 200 rpm 35 Lampiran 11. Prosedur uji aktivitas antibakteri Media NA berisi bakteri dituangkan ke cawan Petri Peremajaan bakteri ke media LB 24 jam, 37°C, 200 rpm Stok bakteri Inokulasi remajaan bakteri ke media NA Pembentukan sumur berdiameter 0.5 cm Sampel berupa: 1) Ekstrak (20%, 40%, 60%, 80%, dan 100%) 2) DMSO 3) Tetrasiklin (10%) Inkubasi selama 24 jam, suhu 37°C Pengukuran diameter zona bening 36 Lampiran 12. Diameter zona hambat (mm) ekstrak etanol daun tembakau sampel A terhadap bakteri S. aureus Ulangan 1 2 Rerata Kontrol Tetrasiklin DMSO (10%) 29 0 30 0 29.5 0 Konsentrasi 20% 40% 60% 80% 100% 4 4 4 6 6 6 6 6 6 7 7 7 7 7 7 Lampiran 13. Diameter zona hambat (mm) ekstrak etnol daun tembakau sampel A terhadap bakteri E. coli Ulangan 1 2 Rerata Kontrol Tetrasiklin DMSO (10%) 37 0 37 0 37 0 Konsentrasi 20% 40% 60% 80% 100% 4 4 4 6 6 6 6 6 6 8 8 8 8 8 8 37