1 I. PENDAHULUAN A. Latar Belakang Bakteri dan jamur
advertisement

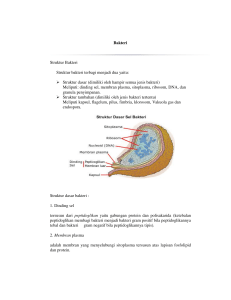
I. PENDAHULUAN A. Latar Belakang Bakteri dan jamur lignoselulolitik memiliki peran penting dalam proses penyediaan energi bagi ruminansia. Ruminansia mampu mengubah pakan berkualitas rendah menjadi tinggi di dalam rumen karena peran mikrobia lignoselulolitik tersebut. Kerbau tropis dapat tumbuh baik dengan pakan berupa hijauan berkualitas rendah, limbah pertanian dan industri yang struktur dasarnya mengandung lignoselulosa tinggi sebagai sumber energi utama (Wanapat, 2001). Namun sesungguhnya konversi serat kasar pakan menjadi produk pada ruminansia yang dipelihara intensif belumlah optimal, karena hanya 10-35% energi dari serat kasar yang dapat dimanfaatkan. Kondisi ini terjadi karena 20% sampai 70% selulosa tidak tercerna dan keluar bersama feses (Varga dan Kovler, 1997). Fakta pencernaan serat kasar dalam rumen belum optimal juga dibuktikan berdasarkan kenyataan bahwa kadar serat kasar pada feses tinggi dan proses fermentasi tetap berlangsung (Krause et al., 2003). Ketersediaan mikrobia lignoselulolitik di dalam rumen dipengaruhi oleh jenis pakan, obat-obatan dan cekaman faktor lingkungan. Penggunaan pakan konsentrat berlebih dan obat-obatan pada peternakan sistem intensif akan menekan populasi mikrobia lignoselulolitik rumen. Sebaliknya populasi mikrobia lignoselulolitik berkembang dengan baik pada ruminansia yang diberi pakan utama berupa hijauan, oleh karena itu ruminansia yang pakan utamanya mengandung serat kasar tinggi sangatlah baik digunakan sebagai sumber mikrobia lignoselulolitik. Mikrobia lignoselulolitik kemungkinan juga dapat diperoleh dari saluran pencernaan ruminansia bagian belakang (sekum dan kolon) karena mikrobia lignoselulolitik di dalam sekum dan kolon akan berkoloni dengan fraksi serat kasar tak tercerna di rumen. . Berdasarkan pertimbangan rendahnya tingkat kecernaan serat kasar di dalam rumen ternak dan sistem fermentasi anaerob serta potensi mikrobia lignoselulolitik sekum dan kolon herbivora, maka penting dilakukan isolasi sebagai upaya untuk memperoleh isolat bakteri dan jamur lignoselulolitik berkemampuan tinggi. 1 2. Roadmap Alur Penelitian INPUT METODE OUTPUT Isolasi Sampel segar saluran pencernaan kerbau, kuda dan feses gajah 1. Isolasi Bakteri metode Hungate (Ogimoto dan Imai, 1981; Bachruddin, 1985) 2. Isolasi Jamur metode Hungate (Lowe, 1986). Isolat pendegradasi selulosa, silan dan lignin dalam tabung Hungate Selulosa, silan, asam tanat sebagai media selektif Pemurnian Isolat dan Identifikasi Morfologis 1. Koloni bakteri dan jamur dipindah ke cawan petri (Lowe, 1986) 2. Pencatatan warna, diameter koloni, zona difusi, zona jernih (Subba Rao, 1993; Ogimoto dan Imai, 1981) Uji Aktivitas Enzim 1. Isolat murni dikultur dalam medium pertumbuhan cair metode Hungate (Bachruddin, 1985) 2. diukur aktivitas enzim selulase, silnase, dan lignase ( Efiok, 1996 dan Miller, 1959). PATEN Isolat murni pendegradari selulosa, silan dan lignin potensi tinggi dalam cawan petri Isolat bakteri/Jamur yang memiliki aktivitas enzim lignoselulolitik tinggi STARTER FERMENTASI PEROMBAK SERAT KASAR C. Tujuan Khusus Tujuan khusus dari penelitian ini adalah : (1) mengisolasi dan mengidentifikasi secara morfologis bakteri dan jamur yang mampu merombak lignin, selulosa, hemiselulosa 2 (silan) dari saluran pencernaan herbivora secara anaerob. (2) menguji kemampuan enzimatis masing-masing isolat lignoselulolitik dalam medium semi sintetik, dan (3) memperoleh isolat bakteri dan jamur lignoselulolitik berkemampuan tinggi sehingga berpotensi untuk dipatenkan. D. Urgensi (Keutamaan) Penelitian Isolasi bakteri selulolitik rumen telah sering dilakukan sebagai upaya mendapatkan bakteri perombak selulosa dan hemiselulosa secara anaerob. Penelitian mengenai kemampuan enzimatis dan formulasi media fermentasi bakteri selulolitik rumen juga telah sering dilakukan ( Kurniawati, 1999; Wahyudi dan Bachruddin, 2004; 2005). Uji aktivitas enzim selulase bakteri dan penggunan beberapa substrat alami seperti ampas tebu, daun tebu kering dan jerami padi sebagai media selektif bakteri telah dilakukan sebelumnya oleh peneliti. Penelitian lain mengenai isolasi bakteri perombak lignin (Martani, 2003) dan jamur lignoselulolitik seresah akasia (Samingan, 1998) telah pula dilakukan, namun keduanya menggunakan metode isolasi aerob. Meskipun isolasi bakteri selulolitik rumen telah sering dilakukan, namun isolasi bakteri dan jamur perombak lignin dari saluran pencernaan herbivora secara anaerob sejauh ini belum pernah dilakukan. Bakteri dan jamur perombak lignin selama ini diduga ada di dalam rumen dan kolon namun belum dibuktikan secara empirik. Eksplorasi lebih jauh potensi bakteri dan jamur lignoselulolitik dari sekum dan kolon selama ini juga belum banyak diteliti. Bakteri dan jamur lignoselulolitik dari sekum dan kolon mungkin memiliki potensi sebagai perombak serat kasar lebih baik karena substrat yang tersedia di dalamnya mengandung fraksi serat kasar tidak tercerna dalam rumen. Fenomena kelinci memakan fesesnya sendiri dan gajah menyuapi feses kepada anaknya merupakan bentuk penyempurnakan pencernaan pakan secara fermentatif dan pemanfaatan nutrisi pakan berserat di saluran pencernaan bagian belakang oleh mikrobia lignoselulolitik pada herbivora nonruminansia. Isolasi bakteri dan jamur lignoselulolitik dari sekum dan kolon kerbau disamping sebagai pembeda penelitian ini dengan penelitian sebelumnya, eksplorasi potensi bakteri dan jamur lignoselulolitik sekum dan kolon kuda serta feses gajah merupakan suatu hal baru yang ditambahkan dalam penelitian. Dengan berbagai sumber mikrobia 3 lignoselulolitik saluran pencernaan herbivora diharapkan diperoleh isolat bakteri dan jamur lignoselulolitik potensial sebagai inokulum fermentasi bahan pakan berserat secara anaerob. 4 II. STUDI PUSTAKA A. Bakteri perombak lignoselulosa Beberapa kelompok bakteri dengan peran berbeda bekerja dalam keseluruhan proses perombakan lignoselulosa secara anaerob. Perombakan itu secara alami terjadi di dalam ekosistem anaerob seperti dalam sedimen tanah, lahan terendam air, tumpukan kotoran ternak, atau di dalam saluran pencernaan ruminansia (Stams et al., 2003). Tiga kelompok bakteri yang berperan dalam perombakan anaerob adalah: (1) Bakteri perombak polimer dan monomer yang terdapat pada materi limbah dan menghasilkan terutama asetat dan hidrogen, dan juga sejumlah asam lemak volatil seperti propionat dan butirat serta alkohol, (2) Bakteri obligat asetogenik penghasil hidrogen yang mengkonversi propionat dan butirat menjadi asetat dan hidrogen dan (3) Kelompok bakteri metanogenik penghasil metan dari asetat atau hidrogen (Ahring, 2003). 1. Perombak lignin. Penelitian mengenai perombakan lignin selama ini banyak dilakukan pada jamur wood rot fungi, hanya beberapa penelitian yang melaporkan penggunaan bakteri sebagai perombak lignin (Odier et al., 1981). Hasil penelitian Ruttimann et al., (1991) menunjukkan bahwa bakteri memiliki kemampuan enzimatik dalam penggunaan senyawa aromatik bercincin (aromatic ring) dan rantai samping yang ada pada lignin. Bakteri juga berperan dalam perombakan lebih lanjut pada senyawa intermediate hasil perombakan jamur (Ruttimann et al., 1991). Dua kelompok bakteri perombak lignin adalah Pseudomonas dan Flavobacterium (Subba Rao, 2001). Genus bakteri perombak lignin lainnya adalah Micrococcus dan Bacillus yang diisolasi dari sampah domestik (Martani et al., 2003), kedua isolat ini dilaporkan mampu mendegradasi lignin masing-masing 75% dan 78%. Enzim perombak lignin dihasilkan oleh aktinobakteria dari genus Streptomyces. Walaupun biodegradasi lignin umumnya terjadi secara aerob, namun beberapa peneliti telah melaporkan bahwa mikrobia anaerob dalam rumen dipercaya dapat merombak lignin (Peres et al., 2002), dan protein enzim serupa lakase dari bakteri telah diisolasi dan digunakan dalam proses pembuatan kompos. 5 Beberapa penelitian mengenai perombakan anaerob untuk mengubah biomasa lignoselulosa menjadi metan telah dilakukan, namun dibutuhkan pengembangan lebih lanjut dalam teknologi ini, misalnya dengan pemilihan bakteri yang toleran terhadap cekaman lingkungan agar diperoleh potensi ekonominya. Akin dan Benner (1988) mengatakan bahwa bakteri rumen memiliki efektivitas lebih tinggi dibandingkan jamur rumen dalam merombak lignin menjadi gas. Derivat lignin dalam lingkungan anaerob merupakan prekursor pembentuk gas metan (Colberg, 2001). 2. Perombak selulosa. Bakteri merombak selulosa secara ekstraseluler karena selulosa tidak larut air. Mikrobia memiliki dua tipe sistem kerja enzim ekstraseluler: (1) Sistem hidrolitik, yaitu dengan cara menghasilkan enzim hidrolase yang bekerja merombak selulosa dan hemiselulosa, dan (2) Sistem oksidatif dan sekresi lignase ekstraseluler dengan cara depolimerisasi lignin (Peres et al., 2002). Bakteri lignoselulolitik diyakini terdapat di dalam saluran pencernaan ternak ruminansia (Peres et al., 2002), baik di dalam rumen, sekum maupun kolon (Anonymous, 1991). Sekum dan kolon gajah serta kuda juga mengandung mikrobia dengan komposisi mirip mikrobia rumen (Ullrey et al., 1997). Komposisi mikrobia sekum dan kolon bagian depan mirip penyusun mikrobia rumen (DeGregorio et al., 1984; Ullrey et al., 1997), bahkan feses kambing pada konsentrasi 160-170 gram per liter aquades dapat pula digunakan sebagai sumber mikrobia pengganti cairan rumen (Utomo et al., 2006). Mikrobia di dalam rumen terdiri atas bakteri (1010 – 1011 sel/gram isi rumen), protozoa (105 – 106 sel /ml cairan rumen), dan jamur dalam jumlah sedikit (Church, 1988; Soejono, 1990). Berdasarkan jumlah dan kemampuan mencerna selulosa di dalam rumen, bakteri selulolitik adalah kelompok mikrobia paling berperan. Kelompok bakteri selulolitik tersebut adalah Fibrobacter succinogenes, Butirivibrio fibrisolven dan Ruminococcus albus (Madigan et al., 1997; Weimer et al.,1999) (Tabel 2.1). Pada kondisi tertentu beberapa spesies lain seperti Eubacterium cellulosolvens dapat menggantikan fungsi bakteri selulolitik di dalam rumen. Bakteri selulolitik jenis lain adalah Clostridium lochheadii dan beberapa spesies lainnya dianggap kecil perannya karena terdapat dalam jumlah sedikit atau tidak konsisten keberadaannya di dalam rumen (Weimer et al.,1999). 6 Tabel 2.1. Bakteri selulolitik rumen ( Madigan et al., 1997; Weimer et al., 1999) Organisme Pencerna Selulosa F. succinogenes B. fibrisolvens Bentuk Motilitas Batang Batang + R. albus Clostridium lochheadii Coccus Batang + Produk Fermentasi Suksinat, asetat, format Acetat, format, laktat, butirat, H2 dan CO2 Asetat, format, H2, CO2 Asetat, format, butirat H2, CO2 Pada umumnya kelompok bakteri selulolitik dominan pada rumen bila ternak mengkonsumsi hijauan tetapi bakteri selulolitik juga terdapat pada ternak yang mengkonsumsi biji-bijian. Tiga spesies bakteri selulolitik bekerja berkompetisi mendegradasi selulosa di dalam rumen. Dalam kondisi jumlah substrat cukup tersedia, ketiga spesies tersebut terdapat dalam jumlah hampir seimbang tetapi bila jumlah substrat terbatas populasi Ruminococcus flavifaciens akan lebih tinggi dibandingkan Fibrobacter succinogenes dan Ruminococcus albus (Chen dan Weimer, 2001). Namun hasil penelitian Berra-Maillet et al. (2004) menunjukkan bahwa populasi Fibrobacter succinogenes adalah paling besar di dalam rumen sapi dan domba. Produk akhir hasil perombakan selulosa oleh bakteri selulolitik adalah suksinat, asetat, format atau butirat. Ketiga spesies bakteri selulolitik rumen memiliki karakteristik antara lain membutuhkan kondisi anaerob, dan hanya dapat hidup pada kisaran pH yang sempit yaitu 6 – 7 (Weimer et al., 1999). 3. Perombak hemiselulosa (Silan). Beberapa jenis bakteri rumen diketahui menghasilkan enzim silanase. Menurut Peres et al. (2002) silanase bakteri pada umumnya lebih stabil pada pengaruh temperatur dibandingkan silanase jamur. Enzim silanase termofilik dapat dihasilkan oleh kelompok bakteri actinomycetes dan thermonospora. Enzim silanase actinobacteria bekerja aktif pada kisaran pH 6,0 – 7,0 sedangkan silanase jamur bekerja optimal pada pH 4,5 – 5,5 (Peres et al., 2002). Bakteri rumen perombak selulosa umumnya juga menghasilkan enzim penghidrolisis hemiselulosa atau silan (Tabel 2.2). 7 Tabel 2.2. Bakteri rumen perombak silan ( Madigan et al., 1997) Organisme Pencerna Hemiselulosa F. succinogenes B. fibrisolvens Bentuk Motilitas Batang Batang + R. albus Coccus - Produk Fermentasi Suksinat, asetat, format Acetat, format, laktat, butirat, H2 dan CO2 Asetat, format, H2, CO2 B. Jamur perombak lignoselulosa Berbagai hasil penelitian menunjukkan bahwa jamur terbukti dapat ditemukan di dalam saluran pencernaan herbivora. Rumen sapi, domba, rusa, kambing dan ruminansia lainnya serta sekum kuda dan gajah semua mengandung jamur meskipun jumlahnya sedikit (Jouany, 1991). Namun jamur dari saluran pencernaan herbivora memiliki tipe berbeda dengan jamur dari tanah maupun lingkungan perairan (Joblin dan Naylor, 1989). Jamur anaerob dapat mengkoloni lignoselulosa di dalam rumen sehingga hubungan yang erat ini diduga menjadi dasar bahwa jamur rumen mampu merombak komponen dinding sel tanaman (Jouany, 1991). Dinding sel yang tidak dapat dihidrolisis oleh bakteri akan dirombak oleh jamur rumen. Rizobium atau hifa jamur rumen mampu masuk ke dalam jaringan xylem, sclerenchym dan cuticula tanaman dan secara parsial merombaknya (Akin dan Borneman, 1990). Jamur rumen tumbuh dalam kisaran temperatur antara 33 – 41oC tanpa oksigen, tidak memiliki sitokrom, menakuinon dan mitokondria, yang berarti hidupnya bergantung sepenuhnya pada proses fermentasi untuk mendapatkan energi. Menurut Akin dan Borneman (1990), jamur rumen dapat ditumbuhkan pada media semisintetik yang biasa digunakan untuk bakteri rumen dengan mengatur pH antara 6,5 sampai 6,7 dan temperatur 39oC. Cairan rumen dapat diganti dengan campuran media mengandung ekstrak yeast, tripton, hemin, dan asam-asam lemak volatil, sedangkan sulfur dapat ditambahkan untuk memicu pertumbuhannya. Kondisi alamiah yang spesifik dari zoospora dan obligat anaerob di dalam rumen, menyebabkan klasifikasi jamur rumen agak berbeda dalam taksonomi jamur pada umumnya. Jamur rumen dibagi menjadi dua kelompok spesies yaitu monosentris dan 8 polisentris (Akin dan Borneman, 1990; Jouany, 1991). Spesies monosentris hanya memiliki satu spora dalam rizobiumnya, sedangkan spesies polisentris mengandung beberapa spora dengan inti di dalamnya. Jamur monosentris rumen dikelompokkan menjadi tiga tipe morfologis yaitu : (1) Neocallimastic sp. dengan spora poliflagella dan rizobium bercabang banyak, (2) Piromonas sp. dengan spora monoflagella dan rizobium bercabang, dan (3) Sphaeromonas sp. dengan zoospora monoflagella dan rizobium membengkak. Contoh spesies monosentrik adalah Neocallimastix frontalis, Neocallimastix patriciarum, Piromonas commuunis, Sphaeromonas commuunis, dan Sphaeromonas equi. Contoh jamur polisentris rumen adalah Neocallimastix joyonii. Jamur anaerob ditemukan di dalam rumen hewan ruminansia, sekum kuda dan feses gajah (Akin dan Borneman, 1990). Namun hasil temuan lainnya menunjukkan bahwa terdapat perbedaan jenis jamur polisentris pada kerbau, sapi dan domba (Jouany, 1991). 1. Perombak lignin. Jamur di alam merupakan perombak lignin paling efisien dan berperan penting dalam siklus karbon. Jamur rumen juga berperan penting dalam proses perombakan lignin (Madigan et al., 1997). Ciri khas jamur rumen terkait dengan fungsi nutrisi adalah kemampuannya mengkoloni dinding sel tanaman pakan mengandung lignin dan merombaknya. (Akin dan Borneman, 1990). Spesies jamur perombak lignin dikelompokkan atas dasar warna saat fermentasi substrat menjadi soft rot, brown rot dan white rot (Paul, 2007). Lebih lanjut Paul (2007) mendiskripsikan ketiga kelompok jamur tersebut sebagai berikut : (1) Soft rot memiliki kemampuan melepas rantai samping metil (R-O-CH3) dan membuka cincin aromatik, namun tidak mampu merombak struktur lignin secara sempurna. Contoh : Chaetomium dan Preussia. (2) Brown rot adalah jamur mayoritas perombak kayu. Brown rot tidak memiliki enzim pembuka cincin tetapi mampu langsung merombak semua selulosa dan hemiselulosa. Brown rot merombak lignin dengan cara demetilasi dan melepaskan rantai samping metil menghasilkan fenol hidroksilat. Oksidasi struktur aromatik lignin menghasilkan karakter warna coklat. Pemisahan polisakarida dari lignin terjadi secara oksidasi non enzimatik melalui pembentukan radikal hidroksil (OH). Reaksi ini menjadikan Brown rot mampu merombak struktur kayu tanpa merusak struktur lignin. Contoh: Poria 9 dan Gloeophyllum. (3) White rot adalah jamur paling aktif merombak lignin. Ada ribuan spesies jamur white rot telah diketahui utamanya berasal dari kelompok basidiomisetes dan askomisetes. Contoh basidiomisetes adalah Phanerochataete chrysosprium dan Coriolus versicolor sedangkan contoh ascomisetes adalah Xylaria, Libertella dan Hypoxylon. Jamur white rot memproduksi enzim lignolitik yang mampu bekerja mengoksidasi pelepasan unit fenilpropanoid, demetilasi, mengubah gugus aldehid (RCHO) menjadi gugus karboksil (R-COOH), dan membuka cincin aromatik sehingga secara sempurna merombak lignin menjadi CO2 dan H2O. Jamur white rot menghasilkan tiga kelas enzim ektraseluler perombak lignin yaitu lakase pengoksidasi fenol, peroksidase lignin, dan oksidase mangan. 2. Perombak selulosa. Jamur anaerob perombak selulosa terbukti ada di dalam rumen dan diketahui berperan aktif pada proses pencernaan serat kasar pakan. Semua jamur rumen perombak lignoselulosa adalah perombak selulosa. Hasil fermentasi jamur rumen bermanfaat bagi hewan inang maupun mikrobia lainnya di dalam rumen (Akin dan Borneman, 1990). Spesies jamur rumen perombak selulosa umumnya bergantian antara bentuk thallus dan flagella, dan dalam bentuk kultur murni terbukti dapat merombak selulosa menjadi VFA (Madigan et al., 1997). Jamur rumen perombak selulosa diduga tidak esensial karena jumlahnya sangat sedikit, namun diyakini memiliki peran sangat penting dalam perombakan serat kasar pakan kualitas rendah, oleh karena itu diperlukan penelitian perannya di dalam rumen (Jouany, 1991). Beberapa kelebihan jamur selulolitik rumen menurut Akin dan Borneman, (1990) adalah : (1) mampu menghasilkan enzim selulase dan silanase kadar tinggi, (2) mampu mengkoloni jaringan dinding sel tanaman lebih baik dibandingkan bakteri, (3) hasil inkubasi pakan berserat oleh jamur rumen lebih lunak dibandingkan oleh bakteri dan (4) mampu bersintrofi dengan bakteri. 3. Perombak hemiselulosa. Jamur rumen berperan penting dalam proses perombakan hemiselulosa (Madigan et al., 1997). Semua jamur perombak selulosa umumnya adalah juga perombak 10 hemiselulosa (silan). Jamur rumen mampu menghasilkan enzim silanase lebih tinggi dibandingkan jamur anaerob lainnya (Akin dan Borneman, 1990). Namun produksi silanase tersebut dipengaruhi oleh adanya gula, jika terdapat gula maka produksi silanase terhambat. Beberapa jenis jamur seperti Trichoderma reesei dan Penicillium chrysoporium menghasilkan β-xylosidase yang memiliki ukuran lebih besar ( antara 90 - 122 kDa), namun umumnya kurang populer dibandingkan endosilanase lainnya (Peres et al., 2002). Endosilanase dan endoglukanase dari jamur rumen Neocallimastix frontalis mempunyai aktivitas beberapa kali lebih tinggi dibandingkan endosilanase dan endoglukanase dari jamur anaerobik lainnya. 11 III. METODE PENELITIAN Untuk mencapai tujuan utama penelitian maka pelaksanaan penelitian dilakukan dalam 2 tahap yaitu : (1) Isolasi bakteri dan jamur lignoselulolitik dari saluran pencernaan herbivora (2) Uji kemampuan merombak senyawa lignoselulosa dalam medium semisintetik oleh isolat bakteri dan jamur lignoselulolitik. A. Tahap I. Isolasi bakteri dan jamur lignoselulolitik saluran pencernaan kerbau, kuda dan feses gajah. Penelitian tahap I dilakukan untuk menjawab tujuan penelitian pertama yaitu mengisolasi dan mengidentifikasi secara morfologis bakteri dan jamur yang mampu merombak lignin, selulosa, hemiselulosa (silan) dari saluran pencernaan herbivora sekaligus membuktikan hipotesis pertama bahwa bakteri dan jamur lignoselulolitik (selulolitik, silanolitik dan lignolitik) dapat diperoleh dari saluran pencernaan herbivora. 1. Bahan dan Alat. Bahan penelitian tahap I meliputi sampel segar cairan rumen, sekum, dan kolon kerbau; sekum dan kolon kuda serta feses gajah, digunakan sebagai sumber mikrobia. Kerbau dipilih sebagai sumber mikrobia karena memiliki kemampuan memanfaatkan pakan berserat lebih efisien (Kennedy et al., 1992) dan rumen kerbau mampu menghasilkan koloni bakteri selulolitik lebih banyak dalam medium selektif (Wahyudi dan Bachruddin, 2004) dibandingkan ternak ruminansia lain. Aktivitas selulase cairan rumen kerbau juga lebih tinggi dari cairan rumen ternak ruminansia lainnya (Cahyono, 1994), sedangkan kuda dan gajah dipilih untuk mewakili herbivora nonruminansia. Sekum dan kolon kuda serta gajah mengandung mikrobia dengan komposisi mirip mikrobia rumen (Ullrey et al., 1997). Larutan pengencer, medium selektif bakteri dan medium selektif jamur digunakan sebagai medium isolasi. Selulosa, silan dan asam tanat digunakan sebagai substrat dalam medium selektif. Medium selektif bakteri menggunakan metode Hungate (Ogimoto dan Imai, 1981; Bachrudin, 1985 yang dimodifikasi), dan medium selektif jamur menggunakan Hungate (Lowe, 1986 yang dimodifikasi). Asam tanat dalam hal ini digunakan karena memiliki struktur molekul mirip lignin sehingga dapat dipakai sebagai pengganti lignin 12 dalam proses perombakan lignin. Perombakan asam tanat ditandai dengan terbentuknya zona berwarna coklat di sekitar koloni sehingga indikator warna tersebut dapat digunakan untuk uji aktivitas lignoselulolitik secara semikuantitatif (Subba Rao, 1993; Martani, 2003). Bakteri dan jamur yang diperoleh diidentifikasi dengan beberapa tahapan uji yaitu : kepadatan koloni, morfologi koloni, dan mengukur diameter zona difusi koloni selulolitik, silanolitik dan lignolitik (Subba Rao, 1993; Samingan 1998; Martani et al, 2003) guna mengetahui potensi isolat bakteri dan jamur perombak selulosa, silan dan lignin. Alat-alat utama yang digunakan adalah pembangkit gas CO2, anaerobic jar, anaerobic generating kit, laminar air flow, water bath, pH meter, inkubator 39oC, mikropipet, pengaduk magnetik, otoklaf, sentrifuse, mikroskop, kamera, jangka sorong dan alat-alat gelas. 2. Metode Penelitian Pengambilan dan penyiapan sampel sumber mikrobia (Lowe, 1986). Isi rumen, sekum, kolon atau feses diambil segera setelah hewan dipotong atau feses diekskresikan. Sampel dimasukkan dalam termos kaca berisi penuh air hangat (temperatur sekitar 39oC) yang telah keluarkan isinya. Termos diisi penuh sampel, ditutup rapat agar terbebas dari udara dan segera digunakan untuk penelitian. Pengenceran sampel untuk penghitungan koloni. Sampel dari termos harus terlindung dari O2 dan segera digunakan di laboratorium. 45 ml larutan pengencer (medium No.14, Bryant and Burkey dalam Ogimoto and Imai, 1981) ditempatkan pada tabung steril dan dialiri gas CO2, dan ditambahkan 5 gram isi rumen atau sampel sumber mikrobia. Larutan 10-1 ini diaduk selama 5 menit. Selanjutnya sampel diencerkan menjadi 102,105,107,108 dan 109 sambil tetap dialiri CO2. Untuk mendapatkan hasil yang baik diinokulasikan 0,5 ml dari tabung pengenceran 105 ke dalam medium selektif bakteri, sedangkan ke dalam medium selektif jamur dinokulasikan 0,5 ml dari pengenceran 103. Pembuatan ekstrak cairan rumen sebagai nutrien (Bachruddin, 1985, Lampiran 9-13). Cairan rumen dipusingkan dengan sentrifu selama 10 menit pada 10.000 x g selama 30 menit dan disaring dengan kain kasa dobel. Pembuatan larutan pengencer sampel anaerobik. Komposisi larutan pengencer merupakan medium No.14 oleh Bryant and Burkey dalam Ogimoto dan Imai, (1981) 13 dengan komposisi 7,50 ml mineral I, 7,50 ml mineral II, 0,05g HCl-cistein; 0,30g Na2CO3; 0,10ml Rezasurin 0,1% larutan; 100 ml H2O. Seluruh bahan tersebut dicampur dalam tabung Erlenmeyer dan disterilisasi dengan otoklaf pada 15 lbs (121oC) selama 20 menit. Setelah dikeluarkan dari otoklaf pada temperatur 45 – 50oC tabung dialiri dengan gas CO2 sampai indikator resazurin berubah dari warna pink menjadi tidak berwarna, kemudian ditutup dengan penutup karet steril dan disimpan dalam refrigerator sebagai sediaan. Pembuatan larutan mineral. Mineral berupa formula larutan No. 32 sesuai petunjuk Bryant and Burkey (Ogimoto and Imai, 1981; Bachrudin, 1985) dibuat dengan cara menimbang 6 gram K2HPO4 dalam 1 liter aquades (mineral I). Sedangkan mineral II dibuat dengan cara menimbang 6,0g KH2PO4; 12,0g (NH4)2SO4; 12,0g NaCl; 2,50g MgSO4.7H2O; 1,20g CaCl2 dalam 1 liter aquades. Pembuatan medium selektif dan cara isolasi bakteri lignoselulolitik. Mikrobia dikultur pada medium selektif padat menggunakan metode Hungate (medium No. 6 dalam Ogimoto and Imai, 1981; Lampiran 12 dalam Bachruddin, 1985). Selulosa (bubuk kertas saring Whatman No. 1), silan, dan asam tanat digunakan sebagai substrat untuk masingmasing isolasi bakteri selulolitik, silanolitik dan lignolitik. Setiap satu liter medium mengandung 400 ml cairan rumen, 20 g agar, 1 ml rezasurin 0,1% larutan, 150 ml larutan mineral I, 150 ml larutan mineral II, 250 ml aquadest dan 2 g substrat. Semua bahan tersebut dimasukkan ke dalam tabung Erlenmeyer 1000 ml dan dipanaskan pada 100oC selama 5 menit untuk menghomogenkan campuran sambil dialiri gas CO2. Temperatur selanjutnya dijaga pada 45oC dalam water bath. Suasana anaerob tercapai ditandai dengan hilangnya warna pink. Selanjunya 32,3 ml sodium karbonat dan 16,7 ml HCl-cistein ditambahkan. Medium kemudian dibagi ke dalam tabung Hungate sebanyak 4 ml per tabung sambil terus diisi gas CO2 dan disterilisasi dengan otoklaf pada 121oC selama 20 menit. Dengan pipet steril selanjutnya 1 ml larutan mikrobia dalam pengenceran 105 diinokulasikan segera ke dalam tabung pada temperatur 45oC dan diisi gas CO2. Tabung selanjutnya ditutup rapat dan digojok sampai homogen, kemudian diputar di atas nampan berisi air es (rolling tube) sampai kondisi agar memadat. Kultur selanjutnya diinkubasi pada 39oC selama 7 hari. Koloni bakteri yang tumbuh di hitung dan diidentifikasi. 14 Seleksi koloni bakteri lignoselulolitik secara semikuantitatif. Koloni bakteri lignoselulolitik yang tumbuh dalam medium roll tube secara individual dipilih dan dipindahkan ke dalam medium padat cawan petri secara anaerob dengan metode overlay (Lowe, 1986). Komposisi medium padat sama dengan medium selektif dengan menambahkan 2 g ekstrak yeast sebagai pengkaya nutrien. Koloni diambil dari agar roll tube menggunakan kawat iridium-platinum berujung runcing. Seluruh prosedur dikerjakan secara anaerob menggunakan gas CO2 dengan indikator hilangnya warna pink dalam medium padat cawan petri. Cawan petri selanjutnya diinkubasi pada 39oC selama 7 hari dalam anaerobic jar yang telah diisi anaerobic generating kit. Koloni bakteri yang tumbuh diidentifikasi secara semikuantitatif dengan Pembuatan medium selektif dan cara isolasi jamur lignoselulolitik. Mikrobia dikultur pada medium selektif padat menggunakan metode Lowe, (1986) yang dimodifikasi. Selulosa (bubuk kertas saring Whatman No. 1), silan, dan asam tanat digunakan sebagai substrat untuk masing-masing isolasi bakteri selulolitik, silanolitik dan liggnolitik sebagaimana digunakan pada medium selektif bakteri. Setiap 100 ml medium mengandung 83 ml medium basal A, 0,2 g substrat dalam 10 ml aquadest, 5 ml Na2CO3 12% (w/v), 1 ml HCl-cistein 3% (w/v), 7,7 mg antibiotik (antibakteri spektrum luas) dan 1,8 g agar. Semua bahan kecuali Na2CO3 12% (w/v) dan HCl-cistein 3% (w/v) dimasukkan ke dalam tabung Erlenmeyer 100 ml, kemudian dipanaskan pada 100oC selama 5 menit untuk menghomogenkan campuran sambil dialiri gas CO2. Temperatur selanjutnya dijaga pada 45oC dalam water bath. Suasana anaerob tercapai ditandai dengan hilangnya warna pink. Selanjunya 5 ml Na2CO3 12% (w/v) dan 1 ml HCl-cistein ditambahkan. Medium kemudian dibagi ke dalam tabung Hungate sebanyak 4 ml per tabung sambil terus diisi gas CO2 dan disterilisasi dengan otoklaf pada 121oC selama 20 menit. Dengan pipet steril selanjutnya 1 ml larutan mikrobia dalam pengenceran 103 diinokulasikan segera ke dalam tabung pada temperatur 45oC dan diisi gas CO2. Tabung selanjutnya ditutup rapat dan digojok sampai homogen, kemudian diputar di atas nampan berisi air es (rolling tube) sampai kondisi agar memadat. Kultur selanjutnya diinkubasi pada 39oC selama 5 hari. Koloni jamur yang tumbuh di hitung dan diidentifikasi. 15 Pembuatan medium basal A. Setiap 1 liter medium basal A mengandung 2 g ekstrak yeast, 2 g pepton, 150 ml cairan rumen, 75 ml larutan mineral I, 75 larutan mineral II, 1 ml rezasurin 0,1%, dan aquadest sampai volume 1 liter. Semua bahan diisi gas CO2 dan disterilisasi, pH diatur 6,8 dan disimpan pada 4oC dalam ruang gelap sebagai sediaan. Seleksi koloni jamur lignoselulolitik secara semikuantitatif. Koloni jamur lignoselulolitik yang tumbuh dalam medium roll tube secara individual dipilih dan dipindahkan ke dalam medium padat cawan petri secara anaerob dengan metode overlay (Lowe, 1986) yang dimodifikasi. Komposisi medium padat dalam cawan petri sama dengan medium selektif dengan menambahkan 1 ml vitamin B kompleks (larutan) sebagai pengkaya nutrien. Koloni diambil dari agar roll tube menggunakan kawat iridium- platinum berujung runcing. Seluruh prosedur dikerjakan secara anaerob menggunakan gas CO2 dengan indikator hilangnya warna pink dalam medium padat cawan petri. Cawan petri selanjutnya diinkubasi pada 39oC selama 5 hari dalam anaerobic jar yang telah diisi anaerobic generating kit. Koloni jamur yang tumbuh diidentifikasi secara semikuantitatif dengan mencatat warna, diameter dan zona difusi koloni (Subba Rao, 1993; Martani, 2003) serta zona bening (clear zome) disekitar koloni (Ogimoto and Imai, 1981). Pengukuran diameter zona difusi dan zona bening koloni. Diameter zona difusi dan zona bening di sekeliling koloni diukur dengan jangka sorong untuk menentukan aktivitas semikuantitatif bakteri dan jamur selulolitik dan silanolitik, sedangkan kemampuan lignolitik bakteri dan jamur ditentukan berdasarkan klasifikasi Subba Rao (1993) dan Martani (2003) dari luas zona difusi berwarna coklat di sekeliling koloni pada setiap isolat yang diinkubasi selama 6 hari. Klasifikasi tersebut adalah : Kelas 0 ; negatif, tidak ada warna dibawah atau di sekeliling koloni, Kelas 1 ; terjadi pertumbuhan warna di bawah atau di sekeliling koloni, Kelas 2 ; terjadi difusi warna coklat muda sampai coklat tua di bagian bawah koloni, Kelas 3: terjadi difusi warna coklat muda sampai coklat tua di bagian bawah koloni dengan jarak perluasan difusi warna 1 – 5mm, Kelas 4 : terjadi difusi warna coklat muda sampai coklat tua di bagian bawah koloni dengan jarak perluasan 6 – 10mm, Kelas 5 : terjadi difusi warna coklat tua dengan jarak perluasan difusi lebih dari 10 mm. 3. Hasil yang diharapkan. 16 Penelitian ini diharapkan menghasilkan isolat bakteri dan jamur lignoselulolitik terbaik berdasarkan karakter morfologis sesuai substratnya. 4. Alur Penelitian - Kerbau (cairan rumen, sekum dan kolon) - Kuda (cairan sekum dan kolon) - Gajah (feses) Medium selektif bakteri metode Hungate (Ogimoto and Imai, 1981; Bachrudin, 1985) dan selektif jamur metode Hungate (Lowe, 1986) yang dimodifikasi dengan substrat selulosa/silan/asam tanat − Anaerob − Inkubasi 390C, 7 hr Koloni bakteri dan jamur lignoselulolitik dimurnikan dalam medium padat cawan petri (sebagian disimpan dalam gliserol pd -18oC sebagai sediaan untuk penelitian tahap II) − Anaerob − Inkubasi 390C, 7 hr Identifikasi morfologis koloni bakteri dan jamur lignoselulolitik Pengukuran aktivitas lignoselulolitik semikuantitatif dengan mencatat warna, diameter dan zona difusi koloni (Subba Rao, 1993; Martani, 2003) serta clear zone (Ogimoto dan Imai, 1981) Isolat bakteri dan jamur lignoselulolitik terbaik berdasarkan karakter morfologis dan aktivitas semikuantitatif sesuai jenis substratnya 17 B. Tahap II. Kemampuan merombak senyawa lignoselulosa oleh masing-masing isolat dalam medium semisintetik. Penelitian tahap II dilakukan untuk menjawab tujuan penelitian kedua yaitu menguji kemampuan masing-masing isolat lignoselulolitik yang telah diperoleh dari tahap I dalam medium semi sintetik sekaligus membuktikan hipotesis kedua bahwa kemampuan merombak senyawa lignoselulosa oleh masing-masing isolat berbeda. Kemampuan merombak lignoselulosa diukur berdasarkan aktivitas enzim selulase, silanase dan lignase. 1. Bahan dan Alat Bahan penelitian tahap II adalah isolat bakteri dan jamur lignoselulolitik yang telah diperoleh pada penelitian tahap I, medium pertumbuhan cair bakteri menggunakan metode Hungate (Ogimoto and Imai, 1981; Bachrudin, 1985) yang telah dimodifikasi dan medium pertumbuhan jamur menggunakan metode Lowe (1986) yang telah dimodifikasi serta reagen uji aktivitas enzim selulase, silanase dan lignase menggunakan metode Efiok (1996) dan Miller (1959). Alat-alat utama yang digunakan adalah pembangkit gas CO2, laminar air flow, pH meter, incubator 39oC, mikropipet, pengaduk magnetik, otoklaf, water bath, sentrifuse, spektrofotometer, alat-alat gelas dan haemocitometer. 2. Metode Penelitian Pembuatan medium pertumbuhan cair untuk bakteri. Isolat bakteri ditumbuhkan pada medium cair menggunakan metode Hungate (Bachruddin, 1985 yang telah dimodifikasi) dengan mencampur 150 ml larutan mineral I, 150 ml larutan mineral II, 1 ml rezasurin 0,1% (w/v) larutan, 2,00g substrat, 400 ml ekstrak cairan rumen, 2 g ekstrak yeast sebagai pengkaya nutrien dan 250 ml aquadest dalam tabung Erlenmeyer 1000 ml. Substrat yang digunakan adalah selulosa, silan, dan lignin disesuaikan dengan jenis uji aktivitas enzim masing-masing bakteri. Semua bahan dimasukkan dalam tabung Erlenmeyer dan dipanaskan 100oC selama 5 menit untuk menghomogenkan campuran sambil dialiri gas CO2. Temperatur selanjutnya dijaga pada 45oC dalam water bath. Suasana anaerob tercapai ditandai dengan hilangnya warna pink. Selanjunya 32,3 ml 18 sodium karbonat dan 16,7 ml HCl-cistein ditambahkan. Tabung Erlenmeyer kemudian ditutup dengan karet penutup dan diklem dengan kawat lalu disterilkan beserta isinya pada 121oC selama 15 menit. Masing-masing medium sesuai jenis substratnya dibagi lagi berdasarkan banyaknya isolat yang akan di ditumbuhkan dalam medium cair. Isolat dari medium padat dilarutkan dalam larutan pengencer pada absorban 0,5 λ 600 diinokulasikan ke dalam tabung Erlenmeyer sebanyak 10%, lalu inkubasikan pada suhu 39oC selama 7 hari dan setiap hari digojok. Kultur medium cair selanjutnya digunakan sebagai sumber enzim. Pembuatan medium pertumbuhan cair untuk jamur. Komposisi medium cair dalam tabung Erlenmeyer sama dengan medium selektif jamur pada Tahap I dengan menambahkan 1 ml vitamin B kompleks (larutan) sebagai pengkaya nutrien (Lowe, 1986) yang dimodifikasi. Spora jamur dari medium agar dengan kepadatan tertentu ditera dengan haemocitometer dalam larutan Tween 80 0,5% digunakan sebagai inokulum dalam medium cair. Seluruh prosedur dikerjakan secara anaerob menggunakan gas CO2 dengan indikator hilangnya warna pink. Kultur dalam Erlenmeyer selanjutnya diinkubasi pada 39oC selama 5 hari dan setiap hari digojok. Kultur medium cair selanjutnya digunakan sebagai sumber enzim. Pengujian aktivitas enzim. Ekstrak enzim diperoleh dengan cara mensentrifugasi kultur medium cair pada 5000 rpm selama 15 menit pada suhu 4oC. Ekstrak enzim sesuai jenis mediumnya diuji pada tiga macam substrat, masing-masing mengandung 1% kertas saring Whatman No. 1/silan/lignin dalam buffer asetat 50 mM, pH 5,5. Masing-masing larutan substrat dalam buffer diambil 8 ml, ditambah 1 ml sumber enzim dan 1 ml aquades. Campuran larutan tersebut digojok dengan fortex, kemudian setiap 5 menit diukur aktivitasnya dan diulangi 4 kali (20 menit). Pengukuran aktivitas spesifik dilakukan dengan cara menghitung banyaknya produk yang dihasilkan dari reaksi enzim tersebut (Efiok, 1996). Produk yang diukur adalah gula reduksi (glukosa dari kertas saring Whatman, silosa dari silan) dan vanilin dari lignin. Pengukuran produk yang dihasilkan, untuk gula reduksi yaitu dengan cara mengambil 1 ml sampel ditambahkan pada 3 ml reagen dinitrosalisilat (DNS) dan 1 ml aquades (Miller, 1959), sedangkan untuk vanilin, 1 ml sampel ditambahkan pada 4 ml metanol, kemudian masing-masing diukur absorbansinya 19 menggunakan spektrofotometer pada λ 560 nm untuk glukosa, 550 nm untuk silosa dan 335 nm untuk vanilin. 3. Hasil yang diharapkan. Penelitian ini diharapkan menghasilkan isolat bakteri dan jamur lignoselulolitik terbaik berdasarkan karakter aktivitas enzim (biokemis), sehingga dapat dipilih sebagai inokulum potensial. 4. Alur Penelitian Isolat bakteri dan jamur lignoselulolitik dari penelitian I Medium semisintetik cair diperkaya metode Hungate ( Bachrudin, 1985) dan pertumbuhan jamur (Lowe, 1986) dengan substrat selulosa/silan/lignin Anaerob , 390C, 5-7 hr Uji aktivitas selulase (FPase) Uji Aktivitas silanase (silan) Uji aktivitas lignase (lignin) Metode Efiok (1996) dan Miller (1959) Isolat bakteri dan jamur lignoselulolitik terbaik berdasarkan karakter biokemis (aktivitas enzim) sesuai jenis substratnya 20 IV. RANCANGAN PENELITIAN Metode penelitian yang digunakan adalah eksperimen. Namun Analisis statistik (variansi) tidak dilakukan dalam penelitian tahap I. Analisis data dilakukan secara diskriptif dengan parameter kualitatif dan semikuantitatif. Warna, ukuran koloni, diameter zona difusi dan zona jernih merupakan parameter kualitatif dan semikuantitatif. Analisis statistik dilakukan pada tahap II untuk parameter aktivitas enzim FPase, silanase dan lignase menggunakan analisis variansi menggunakan rancangan acak lengkap (RAL) pola faktorial dengan faktor perlakuan pertama berupa sumber isolat dan faktor kedua adalah jenis substrat yang diulang tiga kali untuk mendapatkan tingkat kepercayaan cukup (Steel and Torrie, 1993). 21 V. HASIL YANG DIHARAPKAN Penelitian ini diharapkan menghasilkan luaran sebagai berikut : Luaran Jangka Panjang: 1. secara teknis akan menjamin keberhasilan proses perombakan limbah mengandung lignoselulosa di lingkungan usaha pertanian-peternakan. 2. secara ekonomis akan meningkatkan penghasilan petani-peternak karena terjadi peningkatan efisiensi produksi bahan baku pakan dan pupuk organik. 3. aspek sosialnya akan membiasakan petani-peternak hidup dengan cara lebih bersih dan sehat karena tidak ada lagi limbah di lingkungannya. Luaran Jangka Pendek 1. diperoleh isolat bakteri dan jamur lignoselulolitik dari saluran pencernaan herbivora. 2. didapatkan isolat bakteri dan jamur yang memiliki kemampuan sebagai agen biologis dalam sistem fermentasi lignoselulosa secara anaerob. 3. didapatkan isolat bakteri dan jamur lignoselulolitik yang memiliki kemampuan tinggi sebagai starter pengolah limbah organik berserat (berpotensi paten). Luaran Publikasi dan Paten Rencana seminar nasional, publikasi jurnal, buku teks dan paten adalah sebagai berikut : No. Jenis Luaran Judul Keterangan 1. Jurnal Nasional/ Isolation and Characterization of Colon’s Indonesian Internasional Lignocellulolytic Bacteria as an Inoculum Journal for Terakreditasi for Crude Fibre Degradation in Anaerobic Microbiology, PERMI/ African Fermentation Journal of Biotechnology 2. Seminar Nasional Potensi Jamur Lignoselulolitik saluran Indonesian Biotecnology pencernaan herbivora sebagai inokulum Conference 2009 fermentasi limbah organik berserat 3. Buku Teks 4. Paten Sistem Usaha Peternakan Tanpa Limbah Berbasis Reaktor Biogas Starter Perombak Serat Kasar Mengandung Bakteri dan Jamur Lignoselulolitik Edisi 2 (Revisi) UMM Press Pendaftaran melalui Sentra HKI UMM 22 VI. JADWAL DAN INDIKATOR KERJA Kegiatan dan Indikator Kerja No Kegiatan 1. Preparasi alat dan bahan penelitian 2. Isolasi Bakteri dan Jamur Lignoselulolitik dengan medium selektif padat dengan asam tanat, selulosa, dan silan sebagai media selektif Pembuatan kultur murni padat dalam cawan petri untuk masing-masing isolat Mengamati karakter morfologis (warna, ukuran koloni, diameter zona difusi, zona jernih) isolat bakteri dan jamur lignoselulolitik kultur murni Pembuatan kultur pertumbuhan cair untuk masing-masing isolat dan uji aktivitas enzim lignase, selulase, dan silanase Analisis data, penyusunan laporan penelitian 3. 4. 5. 6. Pelaksanaan (Minggu ke) 1-4 5-10 11-16 17-20 21-26 27-28 Indikator Kerja Tersedianya seluruh alat dan bahan penelitian yang dibutuhkan Diperoleh isolat dari 6 sumber mikrobia yang digunakan Diperoleh isolat murni (individual) Diperoleh data dengan parameter karakter morfologis sebagai dasar seleksi pertama Diperoleh data potensi aktivitas enzim dari masing-masing isolat. Diperoleh laporan hasil penelitian 23 VII. PERSONALIA Nama Lengkap dan Gelar Ir.Ahmad Wahyudi, Mkes. Mu’li Syafi’i Adi Nugraha Bidang Jabatan Struktural/ Keahlian Alokasi Waktu (jam/mg) Biokimia/Te 25 knologi Posisi Dalam Kegiatan Peneliti Utama Gol/ Pangkat/ NIP Mahasiswa S1 (Skripsi) Mahasiswa S1 (Skripsi) Analis Lab. - - - 20 - - - 20 - - Mikrobiologi 10 - - Biokimia 10 Fungsional Lektor kepala IVb /Pembina 131929547 Fermentasi Retno Setyawati, SPt Rina Ispitasari, Analis Lab AmAk 24 VIII. PEMBIAYAAN No. 1. 2. 3. 4. 5. Uraian Gaji dan Upah Bahan Habis Pakai Peralatan Perjalanan Lain-lain Biaya Total Penelitian Jumlah (Rp) 10.500.000 22.600.000 6.500.000 3.700.000 4.200.000 47.500.000 25 DAFTAR PUSTAKA Ahring, B. K. 2003. Perspectives for anaerobic digestion. In : T. Scheper (Ed.), Advances in Biochemical Engineering/Biotechnology. 81 : 1-30. Springer-Verlag Berlin Heidelberg. Akin, D.E. and W. S. Borneman. 1990. Role of rumen fungi in fiber degradation. J. Dairy Sci. 73 : 3023-3032. Anonymous. 1991. Biological Feed Additive. Kursus Singkat Penanganan Limbah Industri. PAU-Bioteknologi UGM, Yogyakarta. Bachruddin, Z. 1985. Development of Ruminal Microflora in Goat ( Capra hircus), Thesis Program Pasca Sarjana, University of Philipines, Los Banos. Berra-Maillet, C., Y. Ribot, and E. Forano. 2004. Fiber-degrading system of different strains of the genus fibrobacter, Appl Enviro.l Microbiol. Apr. : p. 2172-2179 Cahyono, E.W. 1994. Pengaruh Pakan Serat Kasar Dari Rumen Jerami Padi Terhadap Karakteristik Biokimiawi Cairan Rumen Ternak Ruminansia. Tesis S2. Program Studi Ilmu Peternakan, Universitas Gadjah Mada. Chen, J. and P. J. Weimer. 2001. Competition among three predominant ruminal cellulolytic bacteria in the absence or presence of non-cellulolytic bacteria. J. Environ. Microbiol. 147: 21-30. Church, D.C. 1988. Livestock Feeds and Feeding. Third Edition. Prentice Hall. International Ed. New Jersey. Colberg P.J. 2001. Microbial Degradation of Lignin-derivat Compound Under Anaerobic Conditions, Stanford University Publ. USA. DeGregorio, R.M., R.E. Tucker, G.E. Mitchell, and W.W. Gill. 1984. Acetate and propionate production in the cecum and proximal colon of lamb, J Anim Sci. : 58(1): 203-7 http://www.ncbi.nlm.nih.gov/sites/entrez? Efiok, B. J. S. 1996. Basic Calculation for Chemical and Biological Analysis. AOAC International, Maryland, USA. Flagel, T. W. and V. Meetivision. 1998. Livestock and Feeding. Fourth Editions, Durham and Doney, Oregon, USA Hungate, R. 1966. The Rumen and Its Microbes. Academic Press, New York. Joblin, K. N. and G. E. Naylor. 1989. Fermentation of wood by rumen anaerobic fungi. FEMS Microbiol. Lett., 65: 111-122. 26 Jouany, J. P. 1991. Rumen Microbial Metabolism and Ruminant Digestion. Institute National De La Recherche Agronomique, 147, Rue De I’Universite-75338 Paris Cedex 07. Kennedy, P.M., C. S. McSweeney, Foulkes, A. John, A.C. Schlinka, R.P. Lefeuvre, and J.D. Kerr. 1992. Intake and digestion in swamp buffaloes and cattle : The digestion of rice straw (Oriza sativa), J. Agri. Sci., 119 (2) : 227-242 Krause D. O., S. E. Denman, R. I. Mackie, M. Morrison, A. L. Rae, G. T. Attwood, and C. S. McSweeney. 2003. Opportunities to improve fiber degradation in rumen: microbiology, ecology and genomics, FEMS Microbiol. Rev. 27: 663-669. Kurniawati, A. 1999. Purifikasi dan karakterisasi selulase yang diproduksi oleh isolate mikrobia selulolitik rumen kerbau. Tesis S2. Program Pascasarjana Universitas Gadjah Mada. Lowe, S. E. 1986. The Physiology and Cytology of Anaerobic Rumen Fungus, A Thesis Submitted to the University of Manchester for the Degree of PhD. Department of Botany, Faculty of Science. Madigan, M. T., J. M. Martinko, and J. Parker. 1997. Biology of Microorganisms, 8th ed., Prentice Hall International, Inc. Martani, E., N. Haedar dan S. Margino. 2003. Isolasi dan karakterisasi bakteri pendegradasi lignin dari beberapa substrat alami. Gama Sains V (2) : 32 – 35. Miller, G. L. 1959. Use of dinitrosalisylic Acid reagent. Method for determination of reducing sugar. Anal. Chem. 31 : 426-428 Odier, E., G. Janin and B. Monties. 1981. Poplar lignin decomposition by Gram-negative aerobic bacteria, Appl. Environ. Microbiol. p. 337-341. Ogimoto, K. and S. Imai. 1981. Atlas of Rumen Microbiology. Japan Scientific Societies Press, Tokyo. Paul, E. A. 2007. Soil Microbiology, Ecology and Biochemistry. Elsevier Inc. Canada. Peres, J., J. Munoz-Dorado, T. de la Rubia, and J. Martinez. 2002. Biodegradation and biological treatment of cellulose, hemicellulose and lignin: an overview. Int. Microbiol. 5 : 53-56. Ruttimann, C., R. Vicuna, M.D. Mozuch, and T.K. Kirk. 1991. Limited bacteria mineralization of fungal degradation intermediate from synthhetic lignin. Appl. Environ. Microbiol. p. 3652 – 3655. Samingan. 1998. Biodegradasi seresah Acacia mangium Wild oleh Jamur lignoselulolitik. Tesis S2. Program Studi Biologi-MIPA, Universitas Gadjah Mada. 27 Soejono, M. 1990. Simbiosis Ruminansia, Kursus Singkat Ekologi Mikrobia. PAU Bioteknologi-UGM. Yogyakarta. Stams, A. J. M., S. J. W. H. O. Elferink, and P. Wastermann. 2003. Metabolic interactions between methanogenic consortia and anaerobic respiring bacteria. In : T. Scheper (Ed.), Advances in Biochemical Engineering/Biotechnology, 81 : 3156. Springer-Verlag Berlin Heidelberg. Subba Rao, N.S. 1993. Biofertilizers in Agriculture and Forestry, 3th ed. International Science Publisher, New York. Subba Rao, N.S. 2001. Soil Microbiology, 4th ed. Science Publishers Inc. New Hampshire 03748. Ullrey, D. E., S. D. Crissey, and H. F. Hintz. 1997. Elephants : Nutrition and Dietary Husbandry, Michigan State University. www.nagoline.net/Technical %20Papers/NAGFS00497Elephants-JONIFEB24,2002MODIFIED2.pdf Utomo, R., Z. Bachruddin, B. P. Widyobroto, M. Soejono, dan R. Antari. 2006. Pemanfaatan feses kambing sebagai sumber mikrobia dan enzim mikrobia pengganti cairan rumen, Buletin Peternakan. 30 (3) : 106-114 Varga, G. A. and E. S. Kovler. 1997. Microbial and animal limitation to fiber digestion and utilization. J. Nutr. 127 (5) : 819-823 Wahyudi, A. dan Z. Bachruddin. 2004. Isolasi mikrobia selulolitik cairan rumen beberapa ternak ruminansia (kerbau, sapi, kambing dan domba) sebagai probiotik pakan sapi. Jurnal Ilmiah Terakreditasi Fakultas Peternakan-Perikanan UMM. 11 (2) : Hal. 181-185 Wahyudi, A. dan Z. Bachruddin. 2005. Aktivitas enzim selulase ekstraseluler bakteri rumen kerbau, sapi, kambing dan domba pada beberapa kultur fermentasi : Upaya mendapatkan starter probiotik bagi ternak ruminansia. Proseding Seminar Nasional ”Pengembangan Usaha Peternakan berdaya Saing di Lahan Kering” . Edisi Pertama, Fakultas Peternakan UGM. Hal. 342-347 Weimer, P. J., G.C. Waghorn, and DR. Merten S., 1999. Effect of diet on population of three species of ruminal cellulolytic bacteria in lactating dairy cows. J. Dairy Sci. 82 : 122-134 Wanapat, M., 2001, Swamp buffalo rumen ecology and its manipulation, Proceedings bufallo workshop, December. http://www.mekarn.org/procbuf/wanapat.htm 28 LAMPIRAN 1. BIODATA PENGUSUL HIBAH PENELITIAN PROGRAM DOKTOR I. IDENTITAS DIRI 1.1. 1.2. 1.3. 1.4. 1.5. 1.6. 1.7. 1.8. 1.9. 1.10. Nama Lengkap Jabatan Fungsional NIP. Tempat dan Tanggal Lahir Alamat Rumah Nomor Telepon/ Faks Nomor HP Alamat Kantor Nomor Telepon/ Faks Alamat Email Ir. Ahmad Wahyudi, Mkes. L/P Lektor Kepala 131 929 547 Magetan, 9 Nopember, 1965 Pondok Bestari Indah C2/263 Malang (0341) 466629 / 0811360927 Jl. Raya Tlogomas 246 Malang 65144 (0341) 464318 / (0341) 460782 [email protected] II. RIWAYAT PENDIDIKAN 2.1. Program 2.2. Nama PT S1 Fak. Peternakan UGM 2.3. Bidang Ilmu Biokimia Nutrisi 2.4. Tahun Masuk 1984 2.5. Tahun Lulus 1989 2.6. Judul Pengaruh Skripsi Penggantian Jagung /Tesis/Renca Kuning dengan na Disertasi Tepung Karak dan Wortel terhadap Pigmentasi Yolk S2 Program Pascasarjana UGM IKD-Biokimia 1993 1996 S3 Sekolah Pascasarjana UGM Bioteknologi 2006 - Peningkatan Toleransi S. Erytthrea CCRC 11513 terhadap Minyak Sawit Sebagai Praprekursor Eritromisin dengan Cara Induksi 2.7. Nama Prof. Dr. Dr. H. M. Ismadi dan Dra. Retno S. Sudibyo, Apt. MSc Penggunaan Bakteri dan Jamur Lignoselulolitik Saluran Pencernaan Herbivora untuk Meningkatkan Kecernaan Serat Kasar Prof.Dr.Ir. Zaenal Bachruddin, MSc., Prof.Dr.drh. M. Soejono, MSc. dan Dr. Ir. M. Nur Cahyanto, MSc. Pembimbing/Promotor Dr. Ir. Ali Wibowo, MSc. dan Ir. Lies Mira Yusiati, SU. III. RIWAYAT PENELITIAN (bukan Skripsi maupun Tesis) 5 Tahun Terakhir Pendanaan No. Tahun 1. 2008 2. 2007 Judul Penelitian Sumber Pengembangan Inokulum Uber HKI-Dirjen Fibrolitik Tahan Antibiotik DIKTI sebagai Probiotik Pakan Ternak Pengembangan Starter PHB I dan II, Jumlah (Rp) 20.000.000,77.000.000,29 3. 2006 4. 2005 5 2004 Fermentasi Produksi Biogas dengan Reformulasi Isolat Bakteri Fibrolitik Pengkajian Kualitas Probiotik terhadap Produktivitas Daging dan Susu di Jawa Timur Pengembangan Starter Bakteri Selulolitik Pengolah Limbah Organik dan Produksi Biogas Peningkatan Kemampuan Bakteri Selulolitik Cairan Rumen untuk Probiotik Ternak Ruminansia Dirjen DIKTI Dinas Peternakan Propinsi Jawa Timur Uber HKI-Dirjen DIKTI 152.152.500,- Uber HKI-Dirjen DIKTI 15.000.000,- 15.000.000,- IV. PENGALAMAN PENULISAN ARTIKEL ILMIAH DALAM JURNAL No. Tahun Judul Artikel Ilmiah Volume/N omor Nama Jurnal 1. 2008 ISBN 978979-796100-8 2. 2008 Proceeding the International Research Seminar, Muhammadiyah University of Malang, 7-8 November, 2008 Proceeding the 4th Indonesian Biotechnology Conference, Bogor, 5-7 August 2008 3. 2007 Enhanced Fermentation Starter for Biogas Production by Formulation of Rumen and Sheep’s Colon Fibrolytic Bacteria Formulation of Cellulolytic Bacteria and Colon’s Liquid as fermentation Inoculum for Fiber Degradation and Biogas Production Evaluasi Daya Hidup Bakteri Selulolitik dalam Urea Molases Mineral Probiotik Blok (UMMPB) 4. 2007 ISBN 979796-020-X 5. 2005 6. 2005 Evaluasi Penggunaan Urea Molases Mineral Probiotik Blok (UMMPB) pada Sapi Perah Laktasi Terhadap Produksi dan Kualitas Susu Aktivitas Enzim Selulase Ekstraseluler Bakteri Rumen Kerbau, Sapi, Kambing dan Domba pada Beberapa Kultur Fermentasi : Upaya mendapatkan Starter Probiotik bagi ternak ruminansia Evaluasi Titer Enzim dan Kecernaan Fibrolitik (in vitro) Cairan Rumen Dengan Introduksi Bakteri Selulolitik. Ketersediaan N, P, K pada Manure Sapi Perah dengan Introduksi 7. 2005 In press ISBN 978979-166170-6 Proseding Seminar Nasional Kearifan Lokal dalam Penyediaan serta Pengembangan Pakan dan Ternak di Era Globalisasi, AINI-Fak Peternakan UGM Proseding Seminar Nasional Rekonstruksi Bidang Peternakan dalam Swasembada Pangan, Fak. Peternakan UMM ISBN 97997243-4-1 Proseding Seminar Nasional ”Pengembangan Usaha Peternakan berdaya Saing di Lahan Kering” Fak.Peternakan UGM-Puslitbang Petrnakan DEPTAN. 11 (1) Jurnal Ilmiah Terakreditasi Fakultas Peternakan-Perikan an UMM. ISSN 1410.3281 In press Proseding ”Prospek Seminar Nasional Pengembangan 30 Bakteri Selulolitik. 8. 9. 2004 2004 Peternakan tanpa Limbah” Program Studi Peternakan UNS Isolasi mikrobia selulolitik cairan rumen beberapa ternak ruminansia (kerbau, sapi, kambing dan domba). 11 (2) Evaluasi konsumsi bahan kering dan kecernaan energi pada domba ekor gemuk dengan penambahan probiotik. 21 (1) ISSN 1410.3281 ISSN 1410.3281 Jurnal Ilmiah Terakreditasi Fakultas Peternakan-Perikan an UMM. Jurnal Ilmiah Terakreditasi Fakultas Peternakan-Perikan an UMM. V. PENGALAMAN PENULISAN BUKU No. Tahun Judul Buku Jumlah Halaman 1. 2007 155 2. 2007 PROBIOTIK, Konsep dan Penerapan pada Ternak Ruminansia Bugar dengan Susu Fermentasi 3. 2008 196 4. 2009 Manajemen Peternakan Tanpa Limbah Berbasis Reaktor Biogas Mengenal Virus Flu Burung dan Cara Pengendaliannya 211 147 Penerbit UMM Press ISBN: 979-796-032-3 UMM Press ISBN: 978-979-796-042-1 UMM Press ISBN: 978-979-796-016-2 UMM Press ISBN: 978-979-796-015-3 Semua data yang saya isikan dan tercantum dalam biodata ini adalah benar dan dapat dipertanggung jawabkan secara hukum dan apabila di kemudian hari ternyata dijumpai ketidak sesuaian dengan kenyataan, saya sanggup menerima resikonya. Demikian biodata ini saya buat dengan sebenarnya untuk memenuhi persyaratan sebagai salah satu syarat pengajuan hibah penelitian untuk mahasiswa Program Doktor. Yogyakarta, 20 Pebruari, 2009 Ir. Ahmad Wahyudi, M.Kes. NIP : 131 929 547 31 LAMPIRAN 2. JUSTIFIKASI ANGGARAN Rekapitulasi biaya yang diusulkan No. Uraian 1. Gaji dan Upah 2. Bahan Habis Pakai 3. Peralatan 4. Perjalanan 5. Lain-lain Jumlah (Rp) 10.500.000 22.600.000 6.500.000 3.700.000 4.200.000 47.500.000 Biaya Total Penelitian 1. Gaji dan Upah No. Pelaksana kegiatan 1. 2. 3. Peneliti Asisten Peneliti Analis Lab. Jumlah Jumlah Jam/minggu 25 20 10 1 1 2 Honor/Jam 7.000 5.000 4.000 Jumlah Biaya 2. Bahan Habis Pakai No. Bahan Kertas A4 80g Spidol permanen Flash disc Disket CD-RW Cartridge Cutter Gunting Transparant sheet Kertas foto Selotip Tinta refil Kertas label Selulosa (Sigma) Xylan (Sigma) Selubiosa (Sigma) Lignin (Aldrich) Asam Tanat (Aldrich) Resazurin (Sigma) Agar (Merck) Mineral 1 Mineral 2 Cystein HCl Volume 3 rem 2 bh 1 bh 10 bh 5 bh 1 bh 1 bh 2 bh 1 set 2 set 5 bh 2x 3 set 100g 50g 25g 100g 50g 5g 1000g 5lt 5lt 10g Biaya Satuan (Rp) 35.000 40.000 150.000 5.000 5.000 375.000 20.000 15.000 75.000 60.000 5.000 30.000 10.000 1 x 700.000 1 x 2.500.000 1 x 2.500.000 1 x 1.750.000 1 x 1.750.000 1 x 1.500.000 1 x 1.725.000 5 x 60.000 5 x 60.000 1 x 720.000 Biaya (Rp) 4.900.000 3.360.000 2.240.000 10.500.000 Biaya (Rp) 105.000 80.000 150.000 50.000 25.000 375.000 20.000 30.000 75.000 120.000 25.000 60.000 30.000 700.000 2.500.000 2.500.000 1.750.000 1.750.000 1.500.000 1.725.000 300.000 300.000 720.000 32 Larutan pengencer KH2PO4 K2HPO4 MgSO4 Na2CO3 Alumunium foil Kertas payung Karet gelang Masker Sarung tangan Spiritus Alkohol Gas CO2 Anaerobik gen. kit Kapas Kain kassa Aquadest 3lt 100g 100g 100g 100g 10 rol 200lbr 2kg 1 pak 1 pak 10lt 10lt 45kg 2 box 2 kg 1 roll 50 lt 3 x 35.000 1 x 600.000 1 x 500.000 1 x 450.000 1 x 375.000 10 x 55.000 200 x 1.400 2 x 20.000 1 x 525.000 1 x 575.000 10 x 36.000 10 x 31.000 1.740.000 2x 450.000 2x 50.000 1 x 50.000 50x 4.000 105.000 600.000 550.000 450.000 375.000 550.000 280.000 40.000 525.000 575.000 360.000 310.000 1.740.000 900.000 100.000 50.000 200.000 22.600.000 Jenis Volume Biaya Satuan (Rp) Erlenmeyer 250ml 12 bh 12 x 45.000 Erlenmeyer 500ml 12 bh 12 x 55.000 Erlenmeyer 1000ml 6 bh 6 x 85.000 Gelas ukur 10ml 6 bh 6 x 50.000 Gelas ukur 50ml 2 bh 2 x 150.000 Tabung Hungate 60 bh 60 x 15.000 Botol serum 1000ml 18 bh 18 x 15.000 Botol serum 250ml 60 bh 60 x 6.000 Petri disk diameter 6 cm 60 bh 60 x 14.500 Eppendorf 1 pak 1 x 800.000 Termos (Sampling) 130ml 18 bh 18 x 15.000 Anaerobic jar (Toples 12 bh 12 x 60.000 kedap) Jumlah Biaya Biaya (Rp) 540.000 660.000 510.000 300.000 300.000 900.000 270.000 360.000 870.000 800.000 270.000 720.000 Jumlah Biaya 3. Peralatan No. 6.500.000 4. Perjalanan No 1. 2. 3. Tujuan Lokal di Jogja Volume Biaya Satuan (Rp) 7 bln x 1 orang 100.000 Gol IVb Kudus (Pengambilan 3 x 1 orang Gol 600.000 sampel isi saluran IVb pencernaan kerbau) Bogor (Seminar 1 orang Gol 1.200.000 Nasional Mikrobiologi) IVb Jumlah Biaya Biaya (Rp) 700.000 1.800.000 1.200.000 3.700.000 33 5. Lain-lain No 1. 2. 3. 4. 5. Uraian Kegiatan Administrasi Lab. Lab. Biokimia dan Nutrisi Fak. Peternakan UGM Analisis data, pembuatan dan penggandaan laporan Browsing dan fotocopy pustaka Pendaftaran paten Publikasi Jurnal Total Biaya Penelitian Volume Biaya Satuan (Rp) Biaya (Rp) 2 smt 1.200.000 1.200.000 10 eks 500.000 500.000 - 500.000 500.000 1.000.000 1.000.000 1.000.000 1.000.000 4.200.000 1 kali 1 kali Jumlah Biaya 47.500.000 34 Nomor ID 06/09-I/1943/PS Klaster Antar Bidang Bidang Ilmu Bioteknologi PROPOSAL HIBAH PENELITIAN UNTUK PROGRAM DOKTOR TAHUN ANGGARAN 2009 ISOLASI DAN KARAKTERISASI BAKTERI SERTA JAMUR LIGNOSELULOLITIK SALURAN PENCERNAAN KERBAU, KUDA DAN FESES GAJAH Diajukan oleh : Ahmad Wahyudi 06/09-I/1943/PS FAKULTAS ANTAR BIDANG PROGRAM STUDI BIOTEKNOLOGI UNIVERSITAS GADJAH MADA 2009 HALAMAN PENGESAHAN 1. Judul Penelitian Isolasi dan karakterisasi bakteri serta jamur 35 2. lignoselulolitik saluran pencernaan kerbau, kuda dan feses gajah. Penggunaan bakteri dan jamur lignoselulolitik saluran pencernaan herbivora untuk meningkatkan perombakan serat kasar. Judul Disertasi 3. Peneliti 3.1. Data Pribadi a. Nama Lengkap b. NIP c. Jenis Kelamin d. Gol./Jab. Fungsional e. Fakultas/Jurusan f. Bidang Ilmu g. Alamat Kantor Ir. Ahmad Wahyudi, Mkes. 131 929 547 Laki-laki IVb/ Lektor kepala Peternakan/Produksi Ternak Biokimia dan Teknologi Fermentasi Kopertis Wilayah VII dpk pada Fakultas Peternakan Univ. Muhammadiyah Malang Telepon/Faks (0341) 464318 ext. 175 / (0341) 460782 Email [email protected] h. Alamat Rumah Pondok Bestari Indah Blok C2 No 263, Landungsari, Malang Telepon/HP (0341) 466629/ 0811360927 3.2. Pembimbing Utama Prof. Dr. Ir. Zaenal Bachruddin, MSc. 3.3. Anggota Pembimbing 1 Prof (Emer). Dr. drh. M. Soejono, MSc., MS. 3.4. Anggota Pembimbing 2 Dr. Ir. M. Nur. Cahyanto, MSc. 3.5. Anggota Pembimbing 3 4. Program Studi S3 Bioteknologi 5. Fakultas/Sekolah Pascasarjana Antar bidang/ Universitas Gadjah Mada 6. Jangka Waktu Penelitian 7 (tujuh) bulan 7. Lokasi Penelitian Lab. Biokimia Nutrisi Fakultas Peternakan dan Lab. Mikrobiologi Pusat Studi Bioteknologi Universitas Gadjah Mada 8. Pembiayaan Rp. 49.510.000 Menyetujui Menyetujui Yogyakarta, 20-02-2009 Direktur Pascasarjana Pembimbing Ketua Peneliti Prof. Dr. Irwan Abdullah NIP. 131 851 818 Prof. Dr. drh. M. Soejono Ir. Ahmad Wahyudi, MKes NIP. 131 212 040 NIP. 131 9929 547 Menyetujui Ketua Lembaga Penelitian dan Pengabdian kepada Masyarakat UGM Prof. Dr-Tech. Ir. Danang Parikesit, M.Sc. NIP. 131 887 481 36 ABSTRAK Tujuan penelitian ini adalah meningkatkan kecernaan lignoselulosa yang merupakan faktor pembatas dalam perombakan polisakarida sebagai sumber energi murah pada sistem fermentasi anaerob menggunakan bakteri dan jamur lignoselulolitik yang diisolasi dari saluran pencernaan herbivora. Kerbau, kuda dan gajah dipilih sebagai sumber bakteri dan jamur lignoselulolitik karena ketiganya merupakan representasi herbivora pemakan serat kasar berkualitas rendah sebagai sumber energi utama. Bakteri dan jamur lignoselulolitik diisolasi dengan medium selektif metode Hungate (Ogimoto dan Imai, 1981; Bachruddin, 1985 dan Lowe, 1986) menggunakan selulosa, silan dan asam tanat sebagai substrat selektif. Identifikasi morfologis koloni bakteri dan jamur lignoselulolitik dilakukan dengan pemurnian mikrobia melalui pemindahan isolat dari kultur tabung Hungate ke kultur cawan petri. Pencatatan warna, ukuran koloni, diameter zona difusi (Subba Rao, 1993), dan zona jernih (Ogimoto dan Imai, 1981) dilakukan sebagai parameter identifikasi. Rasio aktivitas lignoselulolitik dihitung dari perbandingan antara diameter zona difusi dengan diameter koloni. Isolat bakteri dan jamur lignoselulolitik terbaik berdasarkan karakter morfologis dan aktivitas semikuanttitatif perombakan substrat selanjutnya akan digunakan sebagai inokulum fermentasi perombakan selulosa, silan dan lignin secara enzimatis. 37 DAFTAR ISI Halaman HALAMAN JUDUL ....................................................................................... i HALAMAN PENGESAHAN ......................................................................... ii DAFTAR ISI.................................................................................................... iv I. PENDAHULUAN ....................................................................................... 1 A. Latar Belakang ...................................................................................... 1 B. Permasalahan......................................................................................... 3 C. Keaslian Penelitian ............................................................................... 3 D. Tujuan ............................................................................................. ..... 4 E. Manfaat ................................................................................................. 5 II. TINJAUAN PUSTAKA DAN LANDASAN TEORI ................................ 6 A. Tinjauan Pustaka ................................................................................... 6 1. Lignoselulosa ................................................................................... 6 2. Bakteri perombak lignoselulosa ...................................................... 17 3. Jamur perombak lignoselulosa......................................................... 21 4. Interaksi mikrobia perombak lignoselulosa ..................................... 26 B. Landasan Teori...................................................................................... 29 C. Hipotesis Penelitian............................................................................... 30 III. METODE PENELITIAN........................................................................... 31 A. Tahap I. Isolasi bakteri dan jamur lignoselulolitik ............................... 31 B. Tahap II. Kemampuan merombak senyawa lignoselulolitik................. 38 C. Tahap III. Perombakan jerami padi dalam cairan rumen oleh ............. 41 D. Alur Penelitian ...................................................................................... 46 E. Jadwal Penelitian ................................................................................... 49 DAFTAR PUSTAKA ...................................................................................... 50 LAMPIRAN..................................................................................................... 55 DAFTAR RIWAYAT HIDUP ........................................................................ 60 38