larutan elektrolit dan non elektrolit
advertisement

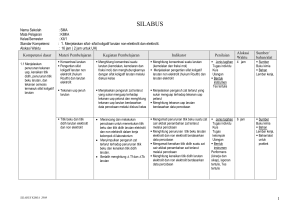
RENCANA PELAKSANAAN PEMBELAJARAN Mata Pelajaran : Kimia Materi Pelajaran : Larutan Elektrolit dan Non Elektrolit Kelas/Semester : X/2 Alokasi Waktu : 2 jam pelajaran Standar Kompetensi : 3 Memahami sifat-sifat laturan non elektrolit dan elektrolit serta reaksi oksidasi reduksi. Kompetensi Dasar : 3.1. Mengidentifikasi sifat larutan non elektrolit dan elektrolit berdasarkan data hasil percobaan. Indikator : 1. Menyimpulkan gejala-gejala hantaran listrik larutan dalam berbagai larutan berdasarkan hasil pengamatan. 2. Mengelompokkan larutan kedalam larutan elektrolit dan larutan non elektrolit berdasarkan sifat hantaran listriknya. 3. Menjelaskan penyebab kemampuan larutan elektrolit menghantarkan arus listrik. 4. Menjelaskan bahwa larutan elektrolit dapat berupa senyawa ion dan senyawa kovalen polar II. TUJUAN PEMBELAJARAN Setelah melakukan kegiatan eksperimen siswa dapat : 1. membedakan larutan elektrolit dan non elektrolit 2. memberi contoh senyawa-senyawa yang dalam larutan air dapat menghantarkan listrik dan tidak 3. memberi penjelasan sifat daya hantar listrik larutan III. Materi Pembelajaran Larutan elektrolit dan non elektrolit Larutan elektrolit adalah larutan yang dapat menghantarkan arus listrik sedangkan larutan non elektrolit adalah larutan yang tidak dapat menghantarkan arus listrik Jenis larutan berdasarkan daya hantar listrik Berdasarkan daya hantar listriknya, larutan elektrolit di golongakan menjadi dua jenis, yaitu larutan elektrolit kuat dan larutan elektrolit lemah. Contoh larutan elektrolit : larutan NaCl, CaCl2, NaOH, KCl,, HCl, H2SO4, NH4OH, CH3COOH. Larutan elektrolit dapat menghantarkan arus listrik, karena zat terlarutnya dalam larutan dapat terionisasi menghasilkan ion positif ( kation ) dan ion negatif (anion). Ionion inilah yang bergerak bebas menuju elektroda –elektroda yang muatannya berbeda. Imam Ahamdi,SMAN4 Mataram Page 1 Contoh reaksi ionisasi elektrolit : a. NaCl b. (aq) → Na+(aq) + Cl- (aq) HCl (aq) → H+ (aq) + Cl- (aq) c. H2SO4 (aq) → 2H+ (aq) + SO4 (aq) d. CH3COOH (aq) ↔ CH3COO- (aq) + H+ (aq) e. NaOH (aq) → Na+ (aq) + OH- (aq) f. Ca(OH)2 (aq) → Ca+2 (aq) + 2OH-(aq) g. NH4OH (aq) ↔ NH4+ (aq) + OH- (aq) Jenis larutan elektrolit berdasarkan ikatan. Larutan elektrolit dapat berasal dari senyawa ion dan senyawa kovalen polar. Contoh larutan elektrolit yang berasal darti senyawa ion adalah larutan NaCl, CaCl2, NaOH, KCl. Contoh larutan elektrolit yang berasal dari senyawa kovalen polar adalah larutan HCl, H2SO4, NH4OH. Larutan non elektrolit Larutan non elektrolit adalah larutan yang tidak dapat menghantarkan arus listrik. Hal itu disebabkan karena zat terlarutnya tidak dapat terionisasi dalam larutannya. Beberapa contoh larutan non elektrolit : larutan urea ( CO(NH2)2 ), glukosa ( C6H12O6 ), ethanol ( C2H5OH ) III. Model/ Pendekatan/Metode Pembelajaran: Model Pendekatan Metode : Perkembangan Kognitif : Ketrampilan Proses : Eksperimen, Diskusi ,Penugasan, Tanya jawab, Kegiatan Mandiri PROSES BELAJAR MENGAJAR Fase pembelajaran/sintak Kegiatan Guru-Siswa pembelajaran PENDAHULUAN o Guru memperlihatkan beberapa larutan yang dapat Fase 1 menghantarkan listrik dan tidak , misalnya larutan gula, Menghadapkan siswa pada garam dapur, alkohol, asam klorida. Masing-masing masalah wadah diberi label A,B,C,dan D. o Siswa mengamati demonstrasi guru. o Guru mengajukan pertanyaan, misalnya: Apa yang dapat kamu amati? Mengapa ada beberapa larutan yang dapat menghantarkan listrik dan tidak? o Siswa mengajukan beberapa jawaban sementara (hipotesis) dan guru mencatatnya di papan tulis Imam Ahamdi,SMAN4 Mataram Page 2 o Guru meminta siswa untuk mencari jawaban dan melakukan percobaan dengan beberapa larutan lainnya KEGIATAN INTI Siswa melakukan percobaan (LKS terlampir) Fase Inkuari (Keterampilan berpikir yang dilatihkan: mengamati, menggolongkan, menyimpulkan) Siswa mendiskusikan pertanyaan dalam LKS, mengkaji literatur. Guru memberikan arahan untuk mengaitkan dengan konsep ikatan kimia Guru membahas hasil diskusi siswa dan memberikan Fase Transfer penguatan Guru memberikan masalah baru, misalnya: Manakah dari senyawa-senyawa berikut yang bila dilarutkan dalam air dapat menghantarkan listrik dan tidak ? KBr, CCl4 , KI, CO2, Siswa menjawab pertanyaan guru dengan menerapkan pemahamannya tentang sifat-sifat senyawa berdasarkan jenis ikatannya. Guru meminta siswa memberi contoh kegunaan larutan elektrolit dalam kehidupan sehari-hari. Guru meminta siswa mereviu materi pelajaran PENUTUP Guru memberikan tugas terstruktur V. Alat/Bahan/Sumber Belajar. Alat : 1 set alat uji elektrolit/nonelektrolit Bahan : Beberapa jenis larutan sesuai dengan Lembar Kerja Siswa Sumber : LKS, buku kimia yang relevan, LKS Soal-soal, Internet VI. Prosedur Penilaian Penilaian Kognitif Teknik : Pertanyaan lisan dan tulisan Bentuk : Pilihan Ganda dan Uraian, Performan (Unjuk kerja ) Penilaian Afektif Bentuk : Lembar pengamatan Lembar Pengamatan Nama Disiplin Aktifitas Imam Ahamdi,SMAN4 Mataram Kerjasama Kejujuran Etika Rata-rata Page 3 Skala penilaian dibuat dengan rentangan dari 1 s/d 5 Penafsiran angka : 1. sangat kurang, 2. kurang, 3. cukup, 4. baik, 5. amat baik Penilaian Psikomotor Bentuk : Lembar penilaian kinerja Lembar Penilaian Psikomotor Aspek Penilaian No Nama A B C D 1 2 3 Jumlah Skor E Nilai Aspek yang dinilai : A. Keterampilan merangkai alat B. Kerapihan mengatur alat dan bahan B. Keterampilan mencelupkan elektroda C. Keterampilan mengamati nyala lampu D. Keterampilan mengamati gelembung gas E. Keterampilan membereskan dan membersihkan alat dan bahan Skala penilaian dibuat dengan rentangan dari 1 s,d 5. Penafsiran angka: 1 = 60, 2 = 70, 3 = 80, 4 = 90, 5 = 100 Penugasan Terstruktur Mengidentifikasi larutan elektrolit dan non elektrolit yang ada dirumah Menuliskan reaksi ionisasi beberapa contoh zat elektrolit Mengklasifikasikan beberapa zat elektrolit berdasarkan jenis ikatan penyusunnya. Kegiatan Mandiri Membuat alat uji elektrolit sederhana dengan disain menarik Instrumen Penilaian A. Soal Uraian Indikator dan Soal skor 4 1. Indikator soal : membedakan larutan elektrolit dan non elektrolit melalui percobaan Soal : Jelaskan cara membedakan larutan elektrolit dan non elektrolit melalui percobaan, gambarlah rangkaian alatnya? 3 2. Indikator :..Menjelaskan kekuatan daya hantar listrik berdasarkan kekuatan zat elektrolitnya Soal : Jelaskan mengapa pada larutan HCl lampu nyala terang, sedangkan pada larutan CH3COOH lampu menyala redup? 3..Indikator : Menjelaskan penyebab larutan dapat 3 menghantar listrik dan ada yang tidak menghantar listrik Soal : Perhatikan data hasil percobaanmu. Pada larutan HCl dan larutan garam dapat menghantarkan Imam Ahamdi,SMAN4 Mataram Page 4 arus listrik, sedangkan pada larutan gula tidak dapat menghantarkan arus listrik. Apa yang menyebabkan hal itu terjadi ? 4. Indikator: Menjelaskan penyebab larutan elektrolit 2 dapat menghantarkan arus listrik. Soal : Jelaskan mengapa larutan elektrolit dapat menghantar listrik sedangkan larutan non elektrolit tidak? 5. Indikator: Menjelaskan penyebab suatu zat dalam 2 bentuk lelehan ada yang menghantar arus listrik dan ada yang tidak menghantar arus listrik. Soal: Mengapa lelehan KCl dapat menghantarkan arus listrik sedangkan lelehan HCl tdak dapat menghantarkan arus listrik? Kunci Jawaban Uraian : 1. Cara membedakan larutan elektrolit dan non elektrolit melalui percobaan adalah dengan menguji daya hantar listriknya. Jika pada saat pengujian daya hantar listrik, timbul gejala terbentuk gelembung gas dan atau bola lampu menyala maka larutan tersebut tergolong elektrolit. Tetapi jika pada elektrode maupun pada bola lampu tidak terjadi perubahan, maka larutan tersebut tergolong non elektrolit. 2. Karena jumlah ion yang dihasilkan dalam larutan HCl lebih banyak dibandingkan dengan jumlah ion yang dihasilkan dalam larutan CH3COOH. 3. Larutan HCl dan larutan garam dapat menghantarkan arus listrik, sedangkan larutan gula tidak dapat menghantarkan arus listrik karena HCl dan garam dalam larutannya dapat terionisasi menghasilkan ion positip dan ion negatip sedangkan larutan gula tidak dapat terionisasi dalam larutannya. 4. Larutan elektrolit dapat menghantarkan arus listrik karena zat terlarutnya dapat terionisasi menghasilkan ion-ion positip dan negatip sedangkan zat non elektrolit tidak dapat terionisasi dalam larutannya. 5. Karena dalam lelehan KCl terdapat ion positip dan negatip yang bebas bergerak sedangkan dalam lelehan HCl tidak terdapat ion-ion. Imam Ahamdi,SMAN4 Mataram Page 5 B. Soal Pilihan ganda. Indikator dan Soal 1. . 2. . Indikator : Berdasarkan data hasil percobaan siswa dapat membedakan larutan elektrolit dan non elektrolit Soal: Skor 1 Data berikut data pengamatan percobaan daya hantar listrik beberapa larutan. Pengamatan Larutan Nyala lampu Gelembung gas P Menyala Ada Q Tidak menyala ada R Tidak Menyala Tidak Ada S Tidak menyala ada T Menyala Ada Pasangan larutan yang termasuk larutan elektrolit adalah.... A. .P dan Q B. . Q dan R C. R dan S D. .R dan T E. S dan T Indikator : Disajikan data hasil percobaan siswa dapat menyimpulkan sifat larutan berdasarkan data hasil percobaan. Soal : 1 Percobaan uji elektrolit dari berbagai macam air diperoleh data sebagai berikut : No Jenis air Nyala lampu Pengamatan lain 1. air laut redup ada gelembung gas 2. air ledeng ada gelembung gas 3. air danau ada gelembung gas 4. air sumur redup ada gelembung gas 5. air suling ada gelembung gas Kesimpulan yang dapat ditarik dari data di atas adalah …. A. Air laut dan air sumur merupakan larutan elektrolit lemah B. Air laut dan air sumur merupakan larutan elektrolit kuat C. Semua jenis air merupakan larutan elektrolit D. Air merupakan cairan penghasil gas E. Air tidak mampu menyalakan elektrolit tester 3. 4.. Indikator : Diberikan beberapa contoh larutan elektrolit yang konsentrasinya sama siswa dapat menentukan larutan elektrolit yang daya hantar listriknya paling baik. Soal : Larutan berikut yang dapat menghantarkan listrik paling baik adalah …. A. Larutan urea 1 M D. Larutan asam klorida 1 M B. Larutan asam cuka 1 M E. Larutan asam sulfat 1 M C. Larutan natrium hidroksida 1 M Indikator : Siswa dapat menjelaskan penyebab larutan elektrolit dapat menghantarkan arus listrik. Soal : Hidrogen klorida (HCl) dalam benzene tidak dapat Imam Ahamdi,SMAN4 Mataram 1 1 Page 6 menghantarkan arus listrik karena…. A. HCl terurai menjadi ion H+ dan Cl− B. HCl bukan senyawa ion C. HCl dalam benzena menimbulkan endapan D. benzene tidak dapat menghantarkan arus listrik E. dalam benzene HCl tidak terionisasi 5 Indikator : Diberikan beberapa contoh zat elektrolit siswa dapat menentukan jenis ikatan dalam senyawa elektrolit. Soal : Senyawa elektrolit di bawah ini yang merupakan senyawa kovalen adalah…. A. CaCl2 B. KBr C. MgI2 D. H2SO4 E. Ba(OH)2 1 Kunci Jawaban : 1. 2. 3. 4. 5. A C E E D PENILAIAN = Skor Uraian + Pilihan Ganda x 100 17 Tabel konversi Skor SKOR 17 16 15 14 13 12 11 10 9 NILAI 100.00 94.12 88.24 82.35 76.47 70.59 64.71 58.82 52.94 Imam Ahamdi,SMAN4 Mataram SKOR 8 7 6 5 4 3 2 1 NILAI 47.06 41.18 35.29 29.41 23.53 17.65 11.76 5.88 Page 7 Lampiran LKS LARUTAN ELEKTROLIT DAN NON ELEKTROLIT Latar Belakang Teori Larutan adalah suatu campuran dua zat atau lebih yang sifatnya homogen. Dalam larutan terdapat komponen yang jumlahnya banyak yang disebut jumlahnya lebih sedikit pelarut dan komponen yang yang disebut zat terlarut. Larutan suatu zat yang pelarutnya air memiliki sifat menghantarkan arus listrik. Daya hantar listrik dari larutan sangat bergantung pada banyaknya ion dalam larutan dan konsentrasi dari larutan itu sendiri. Larutan yang dapat menghantarkan arus listrik disebut larutan elektrolit dan larutan yang tidak dapat menghantarkan arus listrik disebut larutan non elekrolit. Pada percobaan ini kamu akan menyelidiki daya hantar dari beberpa larutan Tujuan Menguji daya hantar listrik berbagai larutan dengan alat uji elektrolit Alat dan Bahan: Nama alat dan bahan spesifikasi Alat uji elektrolit jumlah 1 set Gelas kimia Kaca, 100 cm3 11 buah Baterai 1,5 volt 4 buah 250 cm3 Aquades Larutan NaOH 1M 50 cm3 Larutan HCl 1M 50 cm3 Larutan H2SO4 1M 50 cm3 Larutan CuSO4 1M 50 cm3 Larutan gula pasir 1% 50 cm3 Larutan garam dapur 1M 50 cm3 Larutan asam cuka 1M 50 cm3 Larutan soda kue 1M 50 cm3 Larutan alkohol 10 % 50 cm3 Larutan amonia 1M 50 cm3 (NaHCO3) Imam Ahamdi,SMAN4 Mataram Page 8 Prosedur dan Observasi 1. Siapkan 10 gelas kimia 100 cm3 dan berilah label 1 sampai 10, kemudian isilah gelas kimia tersebut secara berutan masing-masing dengan aquades kemudian larutan NaOH, HCl, H2SO4, CuSO4, gula pasir, garam dapur, asam cuka, soda kue (NaHCO3), alcohol , amonia (NH3) masing-masing dengan konsentrasi 1 M 2. Rangkailah alat uji elektrolit seperti gambar berikut. atau secara diagram sebagai berikut: kabel + Elektroda karbon Elektroda karbon lampu baterai 3. Ambil gelas kimia yang berisi aquades, uji daya hantar aquades tersebut dengan alat penguji elektrolit dengan cara mencelupkan kedua elektrode ke dalam aquades tersebut. Amati apa yang terjadi pada lampu dan elektroda, catat hasil pengamatan anda dan masukkan kedalam tabel pengamatan sesuai dengan larutan di atas . 4. Ulangi percobaan seperti langkah no 3 untuk larutan lainnya. Perhatian : Kedua elektroda harus dicuci bersih dan dikeringkan dengan tisu sebelum dicelupkan ke dalam larutan yang akan diuji. Tabel Pengamatan No Larutan 1 Aquades 2 Larutan NaOH 3 Larutan HCl 4 Larutan H2SO4 Imam Ahamdi,SMAN4 Mataram Pengamatan Pada lampu Pengamatan Pada elektrode Page 9 5 Larutan CuSO4 6 Larutan gula pasir 7 Larutan garam dapur 8 Larutan asam cuka 9. Larutan soda kue (NaHCO3) 10. Larutan alkohol 11 Larutan amonia Pertanyaan: Berdasarkan hasil pengamatan di atas jawablah pertanyaan berikut : a. Apa tanda-tanda larutan menghantarkan arus listrik ? b. Apa tanda-tanda larutan yang tidak menghantar arus listrik ? c. Berdasarkan hasil percobaan, kelompokkan larutan mana apa saja yang dapat menghantarkan arus listrik dan tidak? Kesimpulan percobaan : ......................................................................................................... ................................................................................................................................................ ......................................................................................................................................................... Tugas: Diskusikan dalam kelompok, berdasarkan ikatan kimianya, senyawa apa sajakah yang bila dilarutkan dalam air dapat menghantarkan arus listrik? CATATAN : Jika alat uji elektrolit belum tesedia dalam bentuk alat jadi, Anda dapat membuatnya seperti pada gambar bagan rangkaian di atas. Baterai dapat disusun secara seri dengan menggunakan wadah karton, batang karbon dapat diperoleh dari baterai bekas, cara memdapatkannya buka bateriai bekas dengan menggunakan tang, ambil batang karbon lalu cuci sampai bersih. Imam Ahamdi,SMAN4 Mataram Page 10