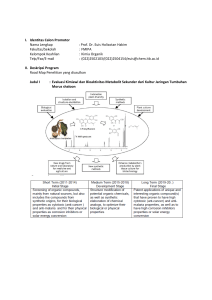
ISOLASI SENYAWA AKTIF ANTIOKSIDAN DARI FRAKSI ETIL
advertisement

UIN SYARIF HIDAYATULLAH JAKARTA ISOLASI SENYAWA AKTIF ANTIOKSIDAN DARI FRAKSI ETIL ASETAT TUMBUHAN PAKU Nephrolepis falcata (Cav.) C. Chr SKRIPSI Diajukan sebagai salah satu syarat memperoleh gelar Sarjana Farmasi AGUNG PRIYANTO NIM. 109102000011 FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN PROGRAM STUDI FARMASI UNIVERSITAS ISLAM NEGERI SYARIF HIDAYATULLAH JAKARTA JULI 2013/1434 H ii HALAMAN PERNYATAAN ORISINALITAS Skripsi ini adalah hasil karya sendiri, dan semua sumber yang dikutip maupun dirujuk telah saya nyatakan dengan benar. ` Nama : Agung Priyanto NIM : 109102000011 Tanda Tangan : Tanggal : Juli 2013 iii HALAMAN PERSETUJUAN PEMBIMBING Nama : AgungPriyanto NIM : 109102000011 Program Studi : Farmasi Judul : Isolasi Senyawa Aktif Antioksidan Dari Fraksi Etil Asetat Tumbuhan Paku Nephrolepis falcata (Cav.) C. Chr Menyetujui, Pembimbing I Pembimbing II Ismiarni Komala, M.Sc., Ph.D., Apt NIP : 197806302006042001 Puteri Amelia, M.Farm., Apt NIP : 198012042011012004 Mengetahui, Kepala Program Studi Farmasi Fakultas Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri Syarif Hidayatullah Drs. Umar Mansur, M.Sc iv HALAMAN PENGESAHAN SKRIPSI Skripsi ini diajukan oleh Nama NIM Program Studi Judul : : Agung Priyanto : 109102000011 : Farmasi : Isolasi Senyawa Aktif Antioksidan Dari Fraksi Etil Asetat Tumbuhan Paku Nephrolepis falcata (Cav.) C. Chr. Telah berhasil dipertahankan di hadapan Dewan Penguji dan diterima sebagai bagian persyaratan yang diperlukan untuk memperoleh gelar Sarjana Farmasi pada Program Studi Farmasi Fakultas Kedokteran dan Ilmu Kesehatan, Universitas Islam Negeri Syarif Hidayatullah Jakarta DEWAN PENGUJI Pembimbing I : Ismiarni komala, M.Sc., Ph.D., Apt ( ) Pembimbing II : Putei Amelia, M.Farm., Apt ( ) Penguji I : Prof. Atiek Soemiati, M.Si., Apt ( ) Penguji II : Eka Putri, M.Si., Apt ( ) Ditetapkan di Tanggal : Ciputat : Juli 2013 v ABSTRAK Nama : Agung Priyanto Program studi : Farmasi Judul :Isolasi Senyawa Aktif Antioksidan dari Fraksi Etil Asetat Tumbuhan Paku Nephrolepis falcata (Cav.) C. Chr. Tumbuhan paku digunakan secara luas dalam pengobatan tradisional seperti pengobatan inflamasi, infeksi, impotensi dan permasalahan dalam kehamilan. Ekstrak etanol Nephrolepis falcata dilaporkan memiliki aktivitas antioksidan dengan nilai IC5072 µg/mL (Komala, 2012). Studi pendahuluan terhadap aktivitas antioksidan, menunjukkan bahwa ekstrak n-heksan dan etil asetat dari Nephrolepis falcata aktif dalam menangkap radikal 2,2-diphenyl-1-picrylhydrazyl (DPPH). Studi lebih lanjut dalam mengisolasi komponen kimia dari ekstrak etil asetat, memperoleh senyawa aktif antioksidan, yang diduga sebagai senyawa β-sitosterol. Struktur kimia di elusidasi dengan menggunakan metode spektroskopi antara lain (FTIR, UV-Visible dan 1H-RMI) dan data yang diperoleh di hubungkan dengan literatur data dari β-sitosterol. β-sitosterol telah diketahui memiliki aktivitas antioksidan dengan nilai IC50 389,5 µM (Baskar, et al., 2010) Kata Kunci : Nephrolepis falcata (Cav.) C. Chr, tumbuhan paku, β-sitosterol, triterpenoid. vi ABSTRACT Name : Agung Priyanto Program study : Pharmacy Title : Isolation of Active Antioxidant Compound from Ethyl Acetate Fraction of Ferns Nephrolepis falcata (Cav) C. Chr.. Ferns widely used in traditional medicine against inflammation, infection, impotence and problems in pregnancy. Ethanol extract of Nephrolepis falcata was reported to have antioxidant activity with IC50 value 31,72 µg/mL (Komala, 2012). Preliminary study on the antioxidant activity, showed that n-hexane and ethyl acetate extracts of Nephrolepis falcata were active scavenging free radical 2,2-diphenyl-1-picrylhydrazyl (DPPH). Further study on the isolation of the chemical components of the Ethyl acetate extract gave the active antioxidant compound, which was suggested as β-sitosterol. The structure were elucidated by using spectroscopic data such as (FTIR, UV-Visible and 1H-NMR) and the data were compared to the reference data of β-sitosterol. β-sitosterol was known to have antioxidant activity with IC50 value 389,5 µM (Baskar, et al., 2010). Keyword : Nephrolepis falcata (Cav.) C. Chr, ferns, β-sitosterol, triterpenoid. vii KATA PENGANTAR Bismillahirahmaanirrahiim Alhamdulillah, puji syukur kehadirat Allah SWT, karena atas segala rahmat dan karunia-Nya penulis dapat menyelesaikan penelitian dan penyusunan skripsi dengan judul “Isolasi Senyawa Aktif Antioksidan Dari Fraksi Etil Asetat Tumbuhan Paku Nephrolepis falcata (Cav.) C. Chr”. Skripsi ini disusun sebagai salah satu syarat untuk menyelesaikan program pendidikan tingkat Strata 1 (S1) pada Program Studi Farmasi, Fakultas Kedokteran dan Ilmu Kesehatan, Universitas Islam Negeri (UIN) Syarif Hidayatulah Jakarta. Pada kesempatan ini perkenankanlah penulis menyampaikan ucapan terima kasih yang sebesar-besarnya kepada: 1. Ibu Ismiarni Komala, M.Sc., Ph.D., Apt dan Ibu Puteri Amelia, M.Farm., Apt. Selaku pembimbing yang telah memberikan bimbingan, waktu, serta motivasi kepada penulis selama penelitian. 2. Prof.DR (hc). Dr. M. K Tadjudin, Sp. And. Selaku dekan Fakultas Kedokteran dan Ilmu Kesehatan, Universitas Islam Negeri (UIN) Syarif Hidayatulah Jakarta. 3. Drs. Umar Mansur, M.Sc. Selaku ketua Program Studi Farmasi Fakultas Kedokteran dan Ilmu Kesehatan, Universitas Islam Negeri (UIN) Syarif Hidayatulah Jakarta. 4. Dosen-dosen, staff, karyawan Program Studi Farmasi Fakultas Kedokteran dan Ilmu Kesehatan, Universitas Islam Negeri (UIN) Syarif Hidayatulah Jakarta serta karyawan Perpustakaan Fakultas Kedokteran dan Ilmu Kesehatan, Universitas Islam Negeri (UIN) Syarif Hidayatulah Jakarta. 5. Kepada Ka Eris, Ka Tiwi, Ka Lisna, Ka Liken Ka Rani, Ka Yopi, Ka Rahmadi yang telah memberi banyak bantuan kepada penulis selama penelitian di kampus. 6. Kepada kedua orang tua penulis bapak Jasmo, dan Ibu Sudjinem, kakak Rahayu Apriyanti dan adik Aisyah Khumairah yang senantiasa memberi viii support, semangat dan doanya kepada penulis. dalam menyelesaikan skripsi ini. 7. Kepada Dyah Mundir Sari yang telah memberikan motivasi, dukungan dan semangat kepada penulis, sehingga dapat menyelesaikan skripsi ini. 8. Sahabat-sahabat Farmasi angkatan 2009. Muhammad Arif, Gian Pertela Muchammad Irsyad, Wardah Nabiella, Fauziah Utami, Widya Larasaty Risda Yulianti, Indah fadlul Maula dan seluruh teman-teman farmasi angkatan 2009, Terima kasih untuk semangat dan motivasinya. 9. Sahabat-sahabat seperjuangan di laboratorium PHA, Ferry Indar Ardiansyah, M. Muaffaq Zaki, Siti Zamilatul Azkiyah, Putri Assifa, Maulida Putri Ahdaini. 10. Serta semua pihak yang tidak dapat disebutkan satu-persatu yang turut membantu menyelesaikan skripsi. Penulis menyadari bahwa skripsi ini masih memiliki banyak kekurangan, oleh karena itu penulis dengan senang hati menerima segala saran dan kritik. Semoga kebaikan yang telah diberikan kepada penulis dicatat sebagai amal ibadah dan dibalas oleh Allah SWT dan penulis berharap semoga penelitian ini dapat bermanfaat bagi masyarakat dan dalam pengembangan ilmu pengetahuan. Aamiin. Ciputat, Juli 2013 Penulis ix HALAMAN PERNYATAAN PERSETUJUAN PUBLIKASI TUGAS AKHIRUNTUK KEPENTINGAN AKADEMIK Sebagai sivitas akademik Universitas Islam Negeri (UIN) Syarif Hidayatullah Jakarta, Saya yang bertanda tangan di bawah ini : Nama : Agung Priyanto NIM : 109102000011 Program studi : Farmasi Fakultas : Fakultas Kedokteran dan Ilmu Kesehatan (FKIK) Jenis Karya : Skripsi Demi pengembangan ilmu pengetahuan, saya menyetujui skripsi/karya ilmiah saya dengan judul ISOLASI SENYAWA AKTIF ANTIOKSIDAN DARI FRAKSI ETIL ASETAT TUMBUHAN PAKU Nephrolepis falcata (Cav.) C. Chr untuk dipublikasikan atau ditampilkan di internet atau media lain yaitu Digital Library Perpustakaan Universitas Islam Negeri (UIN) Syarif Hidayatullah Jakarta untuk kepentingan akademik sebatas sesuai dengan Undang-Undang Hak Cipta. Dengan demikian persetujuan publikasi karya ilmiah ini saya buat dengan sebenarnya. Dibuat di : Ciputat Pada Tanggal : Juli 2013 Yang menyatakan, (Agung Priyanto) x DAFTAR ISI Halaman HALAMAN JUDUL .......................................................................................... HALAMAN PERNYATAAN ORISINALITAS ............................................... HALAMAN PERSETUJUAN PEMBIMBING ............................................... HALAMAN PENGESAHAN ............................................................................. ABSTRAK............................................................................................................ ABSTRACT ........................................................................................................ KATA PENGANTAR ......................................................................................... HALAMAN PERSETUJUAN PUBLIKASI KARYA ILMIAH ................... DAFTAR ISI ....................................................................................................... DAFTAR GAMBAR .......................................................................................... DAFTAR TABEL ............................................................................................... DAFTAR LAMPIRAN ...................................................................................... ii iii iv v vi vii viii x xi xiv xv xvi BAB 1 PENDAHULUAN .................................................................................. 1.1 Latar Belakang ................................................................................... 1.2 Rumusan Masalah ............................................................................. 1.3 Tujuan Penelitian ............................................................................... 1.4 Manfaat Penelitian.............................................................................. 1 1 3 3 4 BAB 2 TINJAUAN PUSTAKA ......................................................................... 2.1 Tumbuhan Paku ................................................................................. 2.1.1 Habitat Tumbuhan Paku ......................................................... 2.1.2 Penggunaan Tradisional Tumbuhan Paku .............................. 2.2 Nephrolepis falcata (Cav.) C. Chr ..................................................... 2.2.1 Klasifikasi............................................................................... 2.2.2 Kandungan Kimia dan Aktivitas Biologis ............................. 2.3 Radikal Bebas ..................................................................................... 2.3.1 Reaksi Perusakan Radikal Bebas Terhadap Sel ..................... 2.4 Antioksidan ........................................................................................ 2.5 Uji Aktivitas Antioksidan Dengan Metode DPPH ............................. 2.6 Ekstrak dan Ekstraksi ......................................................................... 2.6.1 Ekstraksi Cara Dingin ............................................................ 2.6.2 Ekstraksi Cara Panas .............................................................. 2.6.3 Macam-macam Teknik Ekstraksi Lain................................... 2.7 Pelarut................................................................................................. 2.8 Vaccum Rotary Evaporator ................................................................ 2.9 Metode Isolasi .................................................................................... 2.9.1 Kromatografi .......................................................................... 2.9.2 Kromatografi Lapis Tipis ....................................................... 2.9.3 Identifikasi Kromatogram ...................................................... 5 5 5 5 7 7 7 8 9 9 10 12 13 14 15 16 18 19 19 20 23 xi 2.9.4 Sistem Fase Gerak Pada KLT ................................................ 2.9.5 Kromatografi Gas ................................................................... 2.9.6 Kromatografi Kolom .............................................................. 2.10 Elusidasi Struktur ............................................................................. 2.10.1 UV-Visible .............................................................................. 2.10.2 Spektrofotometri Infra Merah ................................................ 2.10.3 Spektrofotometri Massa ......................................................... 2.10.4 Kromatografi Gas-Spektrofotometri Massa (KG-SM)........... 2.10.5 Resonansi Magnetik Inti (RMI) ............................................. 2.11 Kerangka Konsep ............................................................................. 24 24 25 26 26 27 28 28 29 30 BAB 3 METODOLOGI PENELITIAN ........................................................... 31 3.1 Lokasi dan Waktu Penelitian ............................................................. 31 3.2 ALAT DAN BAHAN ........................................................................ 31 3.2.1 Alat ......................................................................................... .31 3.2.2 Sampel Tumbuhan .................................................................. 31 3.2.3 Bahan Kimia ........................................................................... 31 3.2.4 Instrumen ................................................................................ 32 3.3 PROSEDUR KERJA ......................................................................... 32 3.3.1 Pemeriksaan Sampel Tumbuhan ............................................ 32 3.3.2 Penyiapan Simplisia ............................................................... 32 3.3.3 Pembuatan Ekstrak ................................................................. 32 3.3.4 Kromatografi Lapis Tipis ....................................................... 33 3.3.5 Skrining Fitokimia .................................................................. 34 3.3.6 Uji Kualitatif Aktivitas Antioksidan Dengan DPPH .............. 35 3.3.7 Isolasi Senyawa Aktif Antioksidan Dengan Kromatografi Kolom .............................................................. 36 3.3.8 Pemurnian Kristal ................................................................... 37 3.3.9 Uji Kualitatif Aktivitas Antioksidan Senyawa Murni ...................................................................................... 37 3.3.10 Uji Kemurnian Senyawa Aktif Antioksidan .......................... 37 3.3.10.1 Kromatografi Lapis Tipis 2 Dimensi ..................... 38 3.3.10.2 Uji Titik Leleh ....................................................... 38 3.3.10.3 Kromatografi Cair Kinerja Tinggi (KCKT) .................................................................. 39 3.3.11 Penentuan Struktur Molekul ................................................... 39 3.3.11.1 UV-Visible .............................................................. 39 3.3.11.2 FTIR ....................................................................... 39 3.3.11.3 1H-RMI .................................................................. 39 BAB 4 HASIL DAN PEMBAHASAN .............................................................. 4.1 Penyiapan Bahan ............................................................................... 4.2 Ekstraksi ............................................................................................ 4.3 Hasil Penapisan Fitokimia .................................................................. 4.4 Hasil Kromatografi Lapis Tipis (KLT) .............................................. 4.5 Hasil Uji Kualitatif Aktivitas Antioksidan Dengan DPPH ................ 4.6 Hasil Pemisahan Dengan Kromatografi Kolom ................................. 4.7 Hasil Uji Kemurnian Senyawa ........................................................... xii 40 40 41 41 42 43 44 46 4.7.1 Hasil Uji Titik Leleh (Melting Point) ....................................... 4.7.2 Hasil KCKT .............................................................................. 4.7.3 Hasil KLT 2 Dimensi................................................................ 4.8 Penentuan Struktur Molekul Senyawa Fraksi F2.D ........................... 4.8.1 Hasil UV-Visible ....................................................................... 4.8.2 Hasil Spektrofotometri Infra Merah ......................................... 4.8.3 Hasil Resonansi Magnetik Inti Proton (1H-RMI) ..................... BAB 5 KESIMPULAN DAN SARAN .............................................................. 5.1 Kesimpulan ........................................................................................ 5.2 Saran .................................................................................................. 46 46 46 47 47 48 48 53 53 53 DAFTAR PUSTAKA ......................................................................................... 54 xiii DAFTAR GAMBAR Halaman Gambar 2.1.Nephrolepis falcata (Cav.) C. Chr .................................................... Gambar 2.2 Struktur molekul senyawa seskuiterpenoid tipe drimane .................. Gambar 2.3 Reaksi penghambatan antioksidan primer terhadap radikal lipid ..... Gambar 2.4 Reaksi penghambatan antioksidan terhadap radikal DPPH ............. Gambar 3.1 KLT 2 dimensi .................................................................................. Gambar 4.1 Hasil uji kualitatif antioksidan ekstrak .............................................. Gambar 4.2 Hasil uji kualitatif antioksidan isolat ................................................. Gambar 4.3 Hasil KLT 2 dimensi dari senyawa fraksi F2.D ................................ Gambar 4.4 Struktur molekul β-sitosterol............................................................. xiv 7 8 10 12 36 42 44 46 51 DAFTAR TABEL Halaman Tabel 2.1 Penggunaan Tumbuhan Paku Sebagai Bahan Obat Tradisional ........... 6 Tabel 4.1 Hasil Rendemen Ekstrak n-Heksana dan Etil Asetat ............................ 41 Tabel 4.2 Hasil Penapisan Fitokimia Ekstrak Etil Asetat ..................................... 42 Tabel 4.3 Hasil Isolat Dari Ekstrak Etil Asetat ..................................................... 45 Tabel 4.4 Data Geseran Kimia Proton Senyawa Fraksi F2.D yang diukur pada frekuensi 500 MHz dengan pelarut CDCl3 ....................... 49 Tabel 4.5 Perbandingan Serapan Gugus Fungsi Senyawa Fraksi F2.D Dengan Senyawa β-sitosterol ........................................... 50 Tabel 4.6 Perbandingan Geseran Kimia Proton Senyawa Fraksi F2.D Dengan β-sitosterol........................................................... 51 xv DAFTAR LAMPIRAN Halaman Lampiran 1. Hasil determinasi tumbuhan paku Nephrolepis falcata ................. Lampiran 2. Bagan alur ekstraksi tumbuhan paku Nephrolepis falcata ............. Lampiran 3. Uji kromatografi lapis tipis ekstrak etil asetat dan n-heksana Nephrolepis falcata ...................................................... Lampiran 4. Bagan isolasi senyawa aktif antioksidan tumbuhan paku Nephrolepis falcata ....................................................................... Lampiran 5. Hasil analisis senyawa fraksi F2.D dengan KCKT ....................... Lampiran 6. Hasil analisis senyawa fraksi F2.D dengan UV-Visible ................. Lampiran 7. Hasil Spektrum IR Senyawa Fraksi F2.D ...................................... Lampiran 8. Hasil spektrum 1H-RMI senyawa Fraksi F2.D ............................... Lampiran 9. Hasil Spektrum 1H-RMI Senyawa F2.D (Diperbesar) .................. Lampiran 10. Hasil Spektrum 1H-RMI Senyawa F2.D (Diperbesar) .................. Lampiran 11. Hasil Spektrum 1H-RMI Senyawa F2.D (Diperbesar) ................... Lampiran 12. Hasil Spektrum 1H-RMI Senyawa F2.D (Diperbesar) ................... Lampiran 13. Hasil Spektrum 1H-RMI Senyawa F2.D (Diperbesar) ................... Lampiran 14. Hasil Spektrum 1H-RMI Senyawa F2.D (Diperbesar) ................... Lampiran 15. Spektrum 1H-RMI senyawa β-Sitosterol ........................................ xvi 61 62 63 64 67 68 69 70 71 72 73 74 75 76 77 BAB 1 PENDAHULUAN 1.1 Latar Belakang Tumbuhan telah banyak digunakan sebagai bahan obat tradisional sejak zaman dahulu. Berbagai jenis tumbuhan obat telah digunakan oleh sekitar 80% dari populasi masyarakat dunia, meskipun dalam kebanyakan kasus, tidak ada penelitian ilmiah yang telah dilakukan untuk membuktikan khasiat tumbuhan obat tersebut (Verpoorte, et al., 2006). Setidaknya 80% dari populasi masyarakat dunia diperkirakan masih akan menggunakan obat tradisional seperti dalam perawatan kesehatan. Dari 40.000 sampai 70.000 jenis tumbuhan obat, sekitar 20% dari semua spesies adalah tumbuhan tingkat tinggi (Verpoorte, et al., 2006). Aktivitas farmakologi dari tumbuhan obat, sering tergantung dari keberadaan senyawa bioaktif yang disebut metabolit sekunder (Bruneton, 1999; Heinrich, et al., 2004). Dalam tumbuhan, metabolit sekunder memiliki fungsi penting sebagai perlindungan terhadap predator, mikroba patogen atas dasar sifatnya yang beracun, dan perlindungan terhadap herbivora, mikroba, serta beberapa di antaranya juga terlibat dalam pertahanan terhadap stres abiotik (misalnya paparan UV-B) (Schafer, et al., 2009), metabolit sekunder juga penting untuk komunikasi dari tumbuhan dengan organisme lain (Rosenthal, et al., 1991). Metabolit sekunder dari tumbuhan yang memiliki aktivitas sebagai obat, dilaporkan terdiri dari lilin, asam lemak, alkaloid, terpenoid, fenolat, antara lain fenolat sederhana, flavonoid, glikosida, dan turunannya (Sarker, et al., 2006). Indonesia adalah negara megabiodiversity yang kaya akan tumbuhan obat, dan sangat potensial untuk dikembangkan, namun belum dikelola secara maksimal. Kekayaan alam tumbuhan di Indonesia meliputi 30.000 jenis tumbuhan dari total 40.000 jenis tumbuhan di dunia, 940 jenis diantaranya merupakan tumbuhan berkhasiat obat. Jumlah ini merupakan 90% dari jumlah tumbuhan obat di Asia (Pers, 2010). Berdasarkan hasil 1 UIN SYARIF HIDAYATULLAH JAKARTA 2 penelitian, dari sekian banyak jenis tumbuhan obat, baru 20-22% yang dibudidayakan (Pers, 2010). Potensi tumbuhan obat di Indonesia, termasuk tumbuhan obat kehutanan, apabila dikelola dengan baik akan sangat bermanfaat dari segi ekonomi, sosial, budaya maupun lingkungan. Tumbuhan paku merupakan tumbuhan yang distribusinya tersebar luas di Indonesia dan menjadi salah satu sumber kekayaan alam Indonesia. Tumbuhan paku sangat mudah tumbuh di Indonesia karena iklim Indonesia sangat cocok untuk pertumbuhan tumbuhan tersebut. Tumbuhan paku merupakan tumbuhan yang dikenal pertama kali memiliki sistem pembuluh sejati. Tumbuhan ini tidak menghasilkan biji dan mereka merupakan tumbuhan yang paling sederhana diantara tumbuhan yang memiliki sistem pembuluh sejati (Tracheophytes). Tumbuhan paku distribusinya tersebar luas di seluruh dunia dan jumlahnya melimpah dalam studi geologi. Tumbuhan paku tumbuh dengan baik di tempat lembab, dingin dan teduh serta tersedianya air (Fathima, et al., 2007). Berdasarkan studi fitokimia, tumbuhan paku telah dilaporkan mengandung senyawa golongan flavonoid, terpenoid, senyawa fenol dan xanton (Soeders, 1985). Beberapa tumbuhan paku juga telah dilaporkan memiliki aktivitas biologis seperti antibakteri, antihelmintik, ekspektoran dan antioksidan (Lai, 2011). Antioksidan merupakan senyawa yang dapat mencegah oksidasi dari molekul lain dengan cara menghalangi inisiasi atau propagasi dari reaksi oksidasi berantai. Di dalam industri makanan, antioksidan digunakan sejak lama sebagai bahan aditif untuk melindungi produk makanan dari reaksi oksidasi yang berhubungan dengan penurunan kualitas makanan seperti berbau tengik (Lee, et al., 2004). Telah dilaporkan bahwa antioksidan alami terdapat dalam banyak tumbuhan yang berfungsi dalam mengurangi kerusakan sel dan membantu mencegah mutagenesis, karsinogenesis dan penuaan akibat aktivitas radikal bebas (Lee, et al., 2004). Antioksidan alami telah diisolasi dari berbagai macam buah-buahan, sayur-sayuran dan tumbuhan obat (Boveris et al., 2001). UIN SYARIF HIDAYATULLAH JAKARTA 3 Nephrolepis falcata merupakan salah satu tumbuhan paku yang sangat mudah ditemukan di Indonesia yang banyak digunakan sebagai tanaman hias. Berdasarkan penelusuran kepustakaan, penelitian mengenai tumbuhan ini masih sangat sedikit, baik usaha dalam menentukan metabolit sekunder maupun dalam penggunaannya sebagai bahan obat. Tetapi spesies lain dari genus Nephrolepis, yaitu Nephrolepis radicans dilaporkan memiliki aktivitas antioksidan (Dayanti & Suyatno, 2012), dan Nephrolepis bisserata dilaporkan memiliki aktivitas sebagai antioksidan dengan nilai lC50 0,53 mg/mL (Lai, 2011). Dalam penelitian sebelumnya yang dilakukan oleh (Komala, 2012), telah dilaporkan bahwa ekstrak etanol 70% dari tumbuhan Nephrolepis falcata yang diambil dari wilayah kampus UIN Syarif Hidayatullah Jakarta memiliki aktivitas antioksidan dengan nilai lC50 31,72 µg/mL. Untuk mengetahui jenis metabolit sekunder dalam tumbuhan ini yang memberikan aktivitas antioksidan, maka dilakukan penelitian lebih lanjut dalam mengisolasi kandungan metabolit sekunder dari tumbuhan Nephrolepis falcata yang memiliki aktivitas antioksidan. 1.2 Rumusan Masalah Berdasarkan penelusuran pustaka, belum diketahuinya senyawa yang memberikan aktivitas antioksidan dalam tumbuhan paku Nephrolepis falcata (cav,) C.Chr. 1.3 Tujuan Penelitian a. Mengetahui senyawa aktif antioksidan dari fraksi etil asetat tumbuhan paku Nephrolepis falcata. b. Menentukan struktur kimia dari senyawa murni hasil isolasi yang diduga memiliki aktivitas antioksidan dari tumbuhan paku Nephrolepis falcata. c. Mengidentifikasi aktivitas antioksidan dari senyawa hasil isolasi. UIN SYARIF HIDAYATULLAH JAKARTA 4 1.4 Manfaat Penelitian Penelitian ini diharapkan dapat memberikan informasi kepada masyarakat mengenai khasiat dari tumbuhan Nephrolepis falcata, sehingga dapat digunakan sebagai bahan obat tradisional. Penelitian ini juga diharapkan memberikan kontribusi bagi perkembangan ilmu pengetahuan dengan memberikan informasi terhadap aktivitas antioksidan tumbuhan Nephrolepis falcata. Mengingat tumbuhan ini belum pernah diteliti sebelumnya, diharapkan ditemukan senyawa baru yang nantinya mungkin didapatkan yang akan memperkaya pengetahuan dalam bidang kimia bahan alam. UIN SYARIF HIDAYATULLAH JAKARTA BAB 2 TINJAUAN PUSTAKA 2.1 Tumbuhan Paku Secara taksonomi tumbuhan paku berada diantara tumbuhan tingkat tinggi (gymnosperma dan angiosperma) dan tumbuhan lumut (bryophyta). Berbeda dengan alga dan lumut, tumbuhan paku telah memiliki jaringan pengangkut seperti xilem dan floem tetapi tidak menghasilkan biji untuk reproduksi seksualnya (Pooja, 2004). 2.1.1 Habitat Tumbuhan Paku Habitat tumbuhan paku terdiri dari kondisi iklim yang rendah dengan lokasi khusus pada tempat-tempat lembab dan teduh. Gangguan kecil terhadap kondisi iklim tempat tumbuh mereka, dapat menyebabkan hilangnya sejumlah besar spesies. Tumbuhan paku terdapat dalam jumlah besar di hutan tropis, subtropis, temperatur dan kelembaban yang rendah dan siklus hidup mereka didasarkan pada keberadaan hutan (Dudani, et al., 2010). 2.1.2 Penggunaan Tradisional Tumbuhan Paku Tumbuhan paku telah banyak digunakan sebagai bahan obat tradisional di beberapa negara, seperti di kepulauan Hawaii yang menggunakan tumbuhan paku dari spesies Nephrolepis sebagai bahan obat dalam penyembuhan beberapa penyakit, diantaranya penyakit diabetes, infeksi yang disebabkan jamur ataupun bakteri. Selanjutnya tumbuhan paku spesies Nephrolepis tuberosa yang secara tradisional digunakan untuk menurunkan demam. Bagian daun dari tanaman ini digunakan untuk mengobati perdarahan pada luka dan akar dari tanaman ini digunakan dalam mengobati infeksi serta sebagai obat batuk (Ja & Sharma, 2012) Beberapa tumbuhan paku yang digunakan sebagai bahan obat tradisional antara lain (Lai, et al., 2011): 5 UIN SYARIF HIDAYATULLAH JAKARTA 6 Tabel 2.1. Penggunaan Tumbuhan Paku Sebagai Bahan Obat Tradisional. Nama Tumbuhan Acrostichum aureum (Pteridaceae) Blechnum orientale (Blechnaceae) Cibotium barometz (Dicksoniaceae) Penggunaan Sebagai Obat Tradisional Sinus, sakit tenggorokan, kesehatan pada kehamilan, sembelit, obat penurun panas dan nyeri dada. Untuk pengobatan luka lecet, abses dan impotensi. Untuk pengobatan tifus, dispepsia, batuk dan untuk pengobatan penyakit ginjal dan hati. Sebagai antihelmintik, antibakteri, Dicranopteris linearis pengobatan penyakit asma, gangguan (Gleicheniaceae) pencernaan, wasir, tukak lambung, epilepsi dan nyeri usus buntu. Untuk pengobatan tifus, TBC, dispepsia, Drynaria quercifolia penyakit paru-paru, sebagai ekspektoran, (Polypodiaceae) antihelmintik, meredakan sakit kepala dan radang usus. Lygodium circinnatum Untuk menetralkan racun ular dan luka (Schizaeaceae) akibat sengatan serangga. Nephrolepis biserrata (Nephrolepidaceae) Pityrogramma calomelanos (Hemionitidaceae) Pyrossia nummularifolia Untuk pengobatan luka lecet dan abses Untuk pengobatan sakit ginjal Sebagai obat batuk (Polypodiaceae) UIN SYARIF HIDAYATULLAH JAKARTA 7 2.2 Nephrolepis falcata (Cav.) C.Chr Gambar 2.1. Nephrolepis falcata (Cav.) C.Chr (Sumber: Koleksi Pribadi, Februari 2013) 2.2.1 Klasifikasi Kingdom : Plantae Divisio : Pteridophyta Class : Polypodiopsida = Filicopsida Order : Polypodiales Family : Davalliaceae Genus : Nephrolepis Species : Nephrolepis falcata (Cav.) C.Chr. (http://plants.usda.gov, USA Departement Of Agriculture, Maret 2013) 2.2.2 Kandugan Kimia dan Aktivitas Biologis Belum ada penelitian sebelumnya yang mempublikasikan mengenai kandungan kimia dari Nephrolepis falcata. Tetapi spesies lain dari genus Nephrolepis yaitu Nephrolepis biserrata diketahui bahwa tumbuhan ini mengandung senyawa seskuiterpenoid tipe drimane (Seims, et al., 1996), dan dilaporkan bahwa tumbuhan ini memiliki aktivitas sebagai antioksidan (Lai, et al., 2011). Aktivitas biologis Nephrolepis falcata dilaporkan, bahwa ekstrak etanol 70% dari tumbuhan tersebut memiliki aktivitas sebagai antioksidan dengan nilai IC50 31,72 µg/mL (Komala, 2012). UIN SYARIF HIDAYATULLAH JAKARTA 8 Gambar 2.2. Struktur Molekul Senyawa Seskuiterpenoid Tipe Drimane (Seims, et al., 1996). 2.3 Radikal Bebas Radikal bebas merupakan atom, molekul atau senyawa-senyawa yang mengandung satu atau lebih elektron yang tidak berpasangan yang bersifat sangat reaktif dan tidak stabil (Surai, 2003). Agar menjadi stabil, radikal bebas memerlukan elektron yang berasal dari pasangan elektron di sekitarnya, sehingga terjadi perpindahan elektron dari molekul donor ke molekul radikal untuk menjadikan radikal tersebut stabil (Simanjuntak, et al., 2012). Senyawa radikal yang terdapat dalam tubuh (prooksidan) dapat berasal dari luar tubuh (eksogen) atau terbentuk di dalam tubuh (endogen) dari hasil metabolisme zat gizi secara normal (Muchtadi, 2000). Secara eksogen, senyawa radikal antara lain berasal dari polutan, makanan atau minuman, radiasi, ozon dan pestisida (Supari, 1996). Sedangkan secara endogen, senyawa radikal dapat timbul melalui beberapa macam mekanisme seperti autooksidasi, aktivitas oksidasi dan sistem transpor elektron. Radikal bebas dapat menyebabkan kerusakan pada sel dengan cara mengoksidasi DNA, sehingga DNA mengalami mutasi dan dapat menyebabkan penyakit degeneratif (Wang, et al., 2002), senyawa radikal bebas juga dapat menyebabkan kerusakan pada jaringan tubuh sehingga terjadi proses penuaan dan menimbulkan penyakit autoimun (Muchtadi, 2000) UIN SYARIF HIDAYATULLAH JAKARTA 9 2.3.1 Reaksi Perusakan Radikal Bebas Terhadap Sel a. Peroksidasi Lemak Membran sel kaya akan sumber poly unsaturated fatty acid (PUFA), yang mudah dirusak oleh bahan-bahan pengoksidasi; proses tersebut dinamakan peroksidasi lemak. Hal ini sangat merusak, karena merupakan suatu proses berkelanjutan. Pemecahan hidroperoksida lemak sering melibatkan katalisis ion logam transisi (Droge, 2002). b. Kerusakan Protein Protein dan asam nukleat lebih tahan terhadap radikal bebas daripada PUFA, sehingga kecil kemungkinan terjadinya reaksi berantai yang cepat. Serangan radikal bebas terhadap protein sangat jarang kecuali bila sangat ekstensif. Hal ini terjadi hanya jika radikal tersebut mampu berakumulasi (jarang pada sel normal), atau bila kerusakannya terfokus pada daerah tertentu dalam protein. Salah satu penyebab kerusakan terfokus adalah jika protein berikatan dengan ion logam transisi (Droge, 2002). c. Kerusakan DNA Seperti pada protein, kecil kemungkinan terjadinya kerusakan pada DNA menjadi suatu reaksi berantai, biasanya kerusakan terjadi bila ada lesi pada susunan molekul, apabila tidak dapat diatasi, dan terjadi sebelum replikasi, maka akan terjadi mutasi. Radikal oksigen dapat menyerang DNA jika terbentuk disekitar DNA seperti pada radiasi biologis (Allen, et al., 2000). 2.4 Antioksidan Antioksidan adalah zat yang dapat melawan pengaruh bahaya dari radikal bebas atau Reactive Oxygen Species (ROS) yang terbentuk sebagai hasil dari metabolisme oksidatif, yaitu hasil dari reaksi-reaksi kimia dan proses metabolik yang terjadi dalam tubuh (Goldberd, 2003). Senyawa antioksidan dapat berfungsi UIN SYARIF HIDAYATULLAH JAKARTA 10 sebagai penangkap radikal bebas, membentuk kompleks dengan logam-logam peroksida dan berfungsi sebagai senyawa pereduksi (Andlauer, et al., 1989) . Antioksidan dapat menangkap radikal bebas sehingga dapat menghambat mekanisme oksidatif yang merupakan penyebab penyakit-penyakit degeneratif seperti penyakit jantung, kanker, katarak, disfungsi otak dan artritis (Miller, et al., 2000). Mekanisme kerja antioksidan memiliki dua fungsi, fungsi pertama yaitu merupakan fungsi utama dari antioksidan yaitu sebagai pemberi atom hidrogen. Antioksidan yang mempunyai fungsi utama tersebut sering disebut sebagai antioksidan primer. Antioksidan tersebut dapat memberikan atom hidrogen secara cepat ke radikal lipida (R*,ROO*) atau mengubahnya ke bentuk lebih stabil, sementara turunan radikal antioksidan (A*) tersebut memiliki keadaan lebih stabil dibandingkan radikal lipida. Fungsi kedua merupakan mekanisme fungsi sekunder antioksidan, yaitu memperlambat laju autooksidasi dengan berbagai mekanisme diluar mekanisme pemutusan rantai autooksidasi dengan pengubahan radikal lipida ke bentuk lebih stabil (Gordon, 1990). Inisiasi : R* + AH RH + A* + AH RH + A* Radikal lipid Propagasi : ROO* Gambar 2.3. Reaksi Penghambatan Antioksidan Primer Terhadap Radikal Lipid (Gordon, 1990). 2.5 Uji Aktivitas Antioksidan Dengan Metode DPPH Metode DPPH merupakan salah satu metode untuk menentukan aktivitas antioksidan yang sederhana dengan menggunakan 2,2-diphenyl-1-picrylhydrazyl (DPPH) sebagai senyawa pendeteksi (Surai, 2003). DPPH (2,2-diphenyl-1picrylhydrazyl) adalah senyawa radikal bebas yang stabil yang dapat bereaksi UIN SYARIF HIDAYATULLAH JAKARTA 11 dengan atom hidrogen yang berasal dari suatu antioksidan membentuk DPPH tereduksi (Surai, 2003). Metode DPPH (2,2-diphenyl-1-picrylhydrazyl) digunakan secara luas untuk menguji kemampuan senyawa yang berperan sebagai pendonor elektron atau atom hidrogen. Metode DPPH merupakan metode yang dapat mengukur aktivitas total antioksidan baik dalam pelarut polar maupun nonpolar. Beberapa metode lain terbatas mengukur komponen yang larut dalam pelarut yang digunakan dalam analisa. Metode DPPH mengukur semua komponen antioksidan, baik yang larut dalam lemak maupun dalam air (Prakash, 2001). Metode DPPH merupakan metode yang sederhana, mudah, cepat dan peka, serta hanya memerlukan sedikit sampel. DPPH adalah senyawa radikal bebas stabil kelompok nitrit oksida. Senyawa ini mempunyai ciri-ciri padatan berwarna ungu kehitaman, larut dalam pelarut DMF atau etanol/metanol, dengan rumus molekul C18H12N5O6 (Prakash, 2001). Radikal bebas DPPH yang memiliki elektron tidak berpasangan memberikan warna ungu dan menghasilkan absorbansi maksimum pada panjang gelombang 517 nm. Warna akan berubah menjadi kuning saat elektronnya berpasangan. Pengurangan intensitas warna yang terjadi berhubungan dengan jumlah elektron DPPH yang menangkap atom hidrogen. Sehingga pengurangan intensitas warna mengindikasikan peningkatan kemampuan antioksidan untuk menangkap radikal bebas (Prakash, 2001). Aktivitas antioksidan dapat dinyatakan dengan satuan persen aktivitas. Nilai ini diperoleh dengan rumus sebagai berikut (Molyneux, 2003). absorbansi kontrol – absorbansi sampel % Inhibisi = X 100% absorbansi Kontrol Absorbansi kontrol yang digunakan dalam prosedur DPPH ini adalah absorbansi DPPH, sedangkan blanko yang digunakan adalah etanol 95%. Berdasarkan rumus tersebut, semakin tinggi tingkat diskolorisasi (absorbansi semakin kecil) maka semakin tinggi nilai aktivitas penangkapan radikal bebas (Molyneux, 2003). UIN SYARIF HIDAYATULLAH JAKARTA 12 (2,2-diphenyl-1-picrylhydrazyl) (2,2-diphenyl-1-picrylhydrazyn) Gambar 2.4. Reaksi Penghambatan Antioksidan Terhadap Radikal DPPH (Prakash, 2001). Aktivitas antioksidan pada metode DPPH dinyatakan dengan IC 50 (Inhibition Concentration). IC50 adalah bilangan yang menunjukkan konsentrasi ekstrak yang mampu menghambat aktivitas DPPH sebesar 50%. Semakin kecil nilai IC50 berarti semakin tinggi aktivitas antioksidan. Secara spesifik, suatu senyawa dikatakan sebagai antioksidan sangat kuat jika nilai IC50 kurang dari 0,05 mg/mL,aktivitas kuat untuk IC50 antara 0,05-0,1 mg/mL, aktivitas sedang jika IC50 bernilai 0.101–0.150 mg/mL dan aktivitas lemah jika IC50 bernilai 0,151 – 0,200 mg/mL (Blois, 1958). 2.6 Ekstrak dan Ekstraksi Ekstrak adalah sediaan kental yang diperoleh dengan mengekstraksi zat aktif dari simplisia nabati atau simplisia hewani menggunakan pelarut yang sesuai, kemudian semua atau hampir semua pelarut dan massa atau serbuk yang tersisa, diperlakukan sehingga memenuhi baku yang telah ditetapakan (Soesilo, 1995). Ekstrak adalah sediaan kering, kental atau cair, dibuat dengan menyari simplisia nabati atau hewani menurut cara yang sesuai diluar pengaruh cahaya matahari langsung (Tiwari, et al., 2011). UIN SYARIF HIDAYATULLAH JAKARTA 13 Parameter yang mempengaruhi kualitas dari ekstrak adalah (Tiwari, et al., 2011): a) Bagian dari tumbuhan yang digunakan. b) Pelarut yang digunakan untuk ekstraksi. c) Prosedur ekstraksi Selama proses ekstraksi, pelarut akan berdifusi sampai ke material padat dari tumbuhan dan akan melarutkan senyawa dengan polaritas yang sesuai dengan pelarutnya. Efektivitas ekstraksi senyawa kimia dari tumbuhan bergantung pada. a) Bahan-bahan tumbuhan yang diperoleh b) Keaslian dari tumbuhan yang digunakan c) Proses ekstraksi d) Ukuran partikel Macam-macam perbedaan metode ekstraksi yang akan mempengaruhi kuantitas dan kandungan metabolit sekunder dari ekstrak, antara lain : a) Tipe ekstraksi b) Waktu ekstraksi c) Suhu ekstraksi d) Konsentrasi pelarut e) Polaritas pelarut Beberapa metode ekstraksi dengan menggunakan pelarut dibagi menjadi dua cara, yaitu cara panas dan cara dingin (Ditjen POM, 2000). 2.6.1 Ekstraksi Cara Dingin a) Maserasi Maserasi adalah proses pengekstrakan simplisia dengan menggunakan pelarut dengan beberapa kali pengocokan atau pengadukan pada temperatur kamar (Ditjen POM, 2000). Keuntungan ekstraksi dengan cara maserasi adalah pengerjaan dan peralatan yang digunakan sederhana, sedangkan kerugiannya yakni cara pengerjaannya lama, membutuhkan pelarut yang banyak dan penyarian kurang sempurna. Dalam maserasi, serbuk halus atau kasar dari tumbuhan obat yang kontak dengan pelarut disimpan dalam wadah tertutup untuk periode tertentu dengan pengadukan UIN SYARIF HIDAYATULLAH JAKARTA 14 yang sering, sampai zat tertentu dapat terlarut. Metode ini paling cocok digunakan untuk senyawa yang termolabil (Tiwari, et al., 2011). b) Perkolasi Perkolasi adalah ekstraksi dengan pelarut yang selalu baru sampai penyarian sempurna (exhaustive extraction) yang umumnya dilakukan pada temperatur ruang. Proses terdiri dari tahapan pengembangan bahan, tahap maserasi antara, (penetesan/penampungan tahap ekstrak), perkolasi terus sampai sebenarnya diperoleh ekstrak (perkolat) yang jumlahnya 1-5 kali dari bahan (Ditjen POM, 2000). Perkolasi adalah ekstraksi dengan pelarut yang selalu baru sampai terjadi penyarian sempurna yang umumnya dilakukan pada temperatur kamar. Proses perkolasi terdiri dari tahap pengembangan bahan, tahap perendaman, tahap perkolasi antara, tahap perkolasi sebenarnya (penampungan ekstrak) secara terus menerus sampai diperoleh ekstrak (perkolat). Untuk menentukan akhir dari pada perkolasi dapat dilakukan pemeriksaan zat secara kualitatif pada perkolat akhir. Ini adalah prosedur yang paling sering digunakan untuk mengekstrak bahan aktif dalam penyusunan tincture dan ekstrak cairan (Tiwari, et al., 2011). 2.6.2 Ekstraksi Cara Panas a) Sokletasi Sokletasi adalah ekstraksi menggunakan pelarut yang selalu baru, dengan menggunakan alat soklet sehingga terjadi ekstraksi kontinyu dengan jumlah pelarut relatif konstan dengan adanya pendingin balik (Ditjen POM, 2000). b) Refluks Refluks adalah ekstraksi dengan menggunakan pelarut pada temperatur titik didihnya, selama waktu tertentu dan jumlah pelarut terbatas yang relatif konstan dengan adanya pendingin balik (Ditjen POM, 2000). UIN SYARIF HIDAYATULLAH JAKARTA 15 c) Infusa Infusa adalah ekstraksi menggunakan pelarut air pada temperatur penangas air dimana bejana infus tercelup dalam penangas air mendidih, temperatur yang digunakan (96-980C) selama waktu tertentu (15-20 menit) (Ditjen POM, 2000). Cara ini menghasilkan larutan encer dari komponen yang mudah larut dari simplisia (Tiwari, et al., 2011). d) Dekok Dekok adalah infus pada waktu yang lebih lama (≥300C) dan temperatur sampai titik didih air (Ditjen POM, 2000). Dekok adalah ekstraksi dengan pelarut air pada temperatur 90oC selama 30 menit. Metode ini digunakan untuk ekstraksi konstituen yang larut dalam air dan konstituen yang stabil terhadap panas (Tiwari, et al., 2011). e) Digesti Digesti adalah maserasi kinetik pada temperatur lebih tinggi dari temperatur suhu kamar, yaitu secara umum dilakukan pada temperatur 40-50oC (Ditjen POM, 2000). Digesti adalah maserasi dengan pengadukan kontinyu pada temperatur lebih tinggi dari temperatur ruang (umumnya 25-30oC). Ini adalah jenis ekstraksi maserasi di mana suhu sedang digunakan selama proses ekstraksi (Tiwari, et al., 2011). 2.6.3 Macam-macam Teknik Ekstraksi Lain 1) Sonikasi Prosedur ekstraksi ini melibatkan penggunaan gelombang ultrasonik dengan frekuensi mulai dari 20 kHz sampai 2000 kHz. Teknik ini meningkatkan permeabilitas dinding sel dan menghasilkan kavitasi. Meskipun proses ini berguna dalam beberapa kasus, tetapi pada skala besar aplikasinya terbatas karena biayanya yang tinggi. Satu kelemahan dalam teknik ini adalah efek yang merusak dari energi ultrasonik (lebih UIN SYARIF HIDAYATULLAH JAKARTA 16 dari 20 KHz) yang menyebabkan konstituen tanaman membentuk radikal bebas yang tidak diharapkan (Tiwari, et al., 2011). 2) Supercritical Fluid Teknik ekstraksi supercritical fluid memberikan fakta bahwa gas dapat berperilaku sebagai cairan ketika berada dibawah tekanan. Salah satu contohnya adalah karbon dioksida yang dapat digunakan untuk mengekstrak biomassa dan memiliki keuntungan bahwa setelah tekanan dihilangkan, molekul gas akan meninggalkan ekstrak. Karbon dioksida bertindak sebagai pelarut non polar, tetapi polaritas ekstraksi dengan supercritical fluid dapat ditingkatkan dengan menambahkan agen tertentu, yang biasanya berupa pelarut lain seperti metanol atau diklormetan (Heinrich, 2004). 2.7 Pelarut Pelarut adalah zat yang digunakan sebagai media untuk melarutkan zat lain. kesuksesan penentuan senyawa biologis aktif dari bahan tumbuhan sangat tergantung pada jenis pelarut yang digunakan dalam prosedur ekstraksi (Ncube, et al., 2008). Sifat pelarut yang baik untuk ekstraksi yaitu toksisitas dari pelarut yang rendah, mudah menguap pada suhu yang rendah, dapat mengekstraksi komponen senyawa dengan cepat, dapat mengawetkan dan tidak menyebabkan ekstrak terdisosiasi (Tiwari, et al., 2011). Pemilihan pelarut juga akan tergantung pada senyawa yang ditargetkan. Faktor-faktor yang mempengaruhi pemilihan pelarut adalah jumlah senyawa yang akan diekstraksi, laju ekstraksi, keragaman senyawa yang akan diekstraksi, kemudahan dalam penanganan ekstrak untuk perlakuan berikutnya, toksisitas pelarut dan potensial bahaya kesehatan dari pelarut (Tiwari, et al., 2011). UIN SYARIF HIDAYATULLAH JAKARTA 17 Berbagai pelarut yang digunakan dalam prosedur ekstraksi antara lain: 1) Air Air adalah pelarut universal, biasanya digunakan untuk mengekstraksi produk tumbuhan dengan aktivitas antimikroba. Meskipun pengobatan secara tradisional menggunakan air sebagai pelarut, tetapi ekstrak tumbuhan dari pelarut organik telah ditemukan untuk memberikan aktivitas antimikroba lebih konsisten dibandingkan dengan ekstrak air (Tiwari, et al., 2011). Air juga melarutkan flavonoid (kebanyakan antosianin) yang tidak memiliki aktivitas signifikan terhadap antimikroba dan senyawa fenolat yang larut dalam air yang mempunyai aktivitas sebagai antioksidan. 2) Aseton Aseton melarutkan beberapa komponen senyawa hidrofilik dan lipofilik dari tumbuhan. Keuntungan pelarut aseton yaitu dapat bercampur dengan air, mudah menguap dan memiliki toksisitas rendah. Aseton digunakan terutama untuk studi antimikroba (Tiwari, et al., 2011). 3) Alkohol Aktivitas antioksidan yang lebih tinggi dari ekstrak etanol dibandingkan dengan ekstrak air dapat dikaitkan dengan adanya jumlah polifenol yang lebih tinggi pada ekstrak etanol dibandingkan dengan ekstrak air. Konsentrasi yang lebih tinggi dari senyawa flavonoid terdeteksi dengan etanol 70% karena polaritas yang lebih tinggi daripada etanol murni (Tiwari, et al., 2011). Etanol lebih mudah untuk menembus membran sel untuk mengekstrak bahan intraseluler dari bahan tumbuhan. Metanol lebih polar dibanding etanol namun karena sifatnya yang toksik, sehingga tidak cocok digunakan untuk ekstraksi. UIN SYARIF HIDAYATULLAH JAKARTA 18 4) Kloroform Terpenoid lakton telah diperoleh dengan ekstraksi berturut-turut menggunakan n-heksana, kloroform dan metanol dengan konsentrasi aktivitas tertinggi terdapat dalam fraksi kloroform. Kadang-kadang tanin dan terpenoid ditemukan dalam fase air, tetapi lebih sering diperoleh dengan pelarut semipolar (Tiwari, et al., 2011). 5) Eter Eter umumnya digunakan secara selektif untuk ekstraksi kumarin dan asam lemak (Tiwari, et al., 2011). 6) n-Heksana n-Heksana mempunyai karakteristik sangat tidak polar, volatil, mempunyai bau khas yang dapat menyebabkan pingsan. Berat molekul n-heksana adalah 86,2 gram/mol dengan titik leleh 94,3°C sampai 95,3°C. Titik didih n-heksana pada tekanan 760 mmHg adalah 66°C sampai 71°C (Daintith, 1994). n-Heksana biasanya digunakan sebagai pelarut untuk ekstraksi minyak nabati. 7) Etil Asetat Etil asetat merupakan pelarut dengan karakteristik semipolar. Etil asetat secara selektif akan menarik senyawa yang bersifat semipolar seperti fenol dan terpenoid. 2.8 Vacuum Rotary Evaporator Vacuum rotary evaporator adalah alat yang berfungsi untuk memisahkan suatu larutan dari pelarutnya sehingga dihasilkan ekstrak dengan kandungan kimia tertentu sesuai yang diinginkan. Cairan yang ingin diuapkan biasanya ditempatkan dalam suatu labu yang kemudian dipanaskan dengan bantuan penangas dan diputar. Uap cairan yang dihasilkan didinginkan oleh suatu pendingin (kondensor) dan ditampung pada suatu tempat (receiver flask). Setelah Pelarutnya diuapkan, UIN SYARIF HIDAYATULLAH JAKARTA 19 akan dihasilkan ekstrak yang dapat berbentuk padatan atau cairan (Nugroho, et al., 1999). Kelebihan dari alat ini adalah diperolehnya kembali pelarut yang diuapkan. Penggunaan vacuum rotary evaporator meningkatkan presentase plarut yang terevaporasi dibandingkan dengan menggunakan waterbath (Mutairi & Jasser, 2012). Prinsip kerja alat ini didasarkan pada titik didih pelarut dan adanya tekanan yang menyebabkan uap dari pelarut terkumpul, serta adanya kondensor yang menyebabkan uap ini mengembun dan akhirnya jatuh ke tabung penerima (receiver flask). 2.9 Metode Isolasi Suatu ekstrak yang telah dihasilkan dari suatu protokol ekstraksi yang sesuai dan pengujian aktivitas biologis telah dilakukan (contohnya aktivitas antibakteri), langkah selanjutnya adalah fraksinasi ekstrak menggunakan metode pemisahan sehingga komponen biologis aktif dapat diisolasi (Heinrich, et al., 2004). Pemisahan dan pemurnian kandungan tumbuhan terutama dilakukan dengan menggunakan salah satu dari keempat teknik kromatografi atau gabungan teknik tersebut. Keempat teknik kromatografi itu adalah: kromatografi kertas (KKt), kromatografi lapis tipis (KLT). Kromatografi gas cair (KGC), dan kromatografi cair kinerja tinggi (KCKT) (Harborne, 1987). 2.9.1 Kromatografi Kromatografi merupakan metode pemisahan fisikokimia untuk memisahkan campuran senyawa berdasarkan perbedaan waktu huni komponen campuran dalam sistem fase diam dan fase gerak (Hostettman, et al., 1995). Prinsip pemisahan dari kromatografi adanya distribusi komponen-komponen dalam fase diam dan fase gerak berdasarkan sifat fisik komponen yang akan dipisahkan. Pada dasarnya semua cara kromatografi menggunakan dua fase, yaitu fase diam (stationer) dan fase gerak (mobile). Menurut (Adrianingsih, 2009), persyaratan utama kromatografi antara lain: 1. Ada fase diam dan fase gerak. Fase diam tidak boleh bereaksi dengan fase gerak. UIN SYARIF HIDAYATULLAH JAKARTA 20 2. Komponen sampel harus larut dalam fase gerak dan berinteraksi dengan fase diam. 3. Fase gerak harus bisa mengalir melewati fase diam, sedangkan fase diam harus terikat kuat di posisinya. 2.9.2 Kromatografi Lapis Tipis Kromatografi lapis tipis (KLT) merupakan salah satu metode pilihan kromatografi secara fisikokimia (Gandjar & Rohman, 2007). KLT merupakan bentuk kromatografi planar, selain kromatografi kertas dan elektroforesis. Pada KLT fase diamnya berupa lapisan yang seragam (uniform) pada permukaan bidang datar yang didukung oleh lempeng kaca, pelat alumunium atau plat plastik. Meskipun demikian, kromatografi planar ini merupakan bentuk terbuka dari kromatografi kolom (Gritter, et al., 1991). KLT dapat dipakai dengan dua tujuan. Pertama, dipakai untuk mencapai hasil kualitatif, kuantitatif atau preparatif. Kedua dipakai untuk menjajaki sistem pelarut dan sistem penyangga yang akan dipakai dalam kromatografi kolom (Gritter, et al., 1991). Kromatografi lapis tipis (KLT) dapat digunakan untuk tujuan analitik dan preparatif. KLT analitik digunakan untuk menganalisa senyawa-senyawa organik dalam jumlah kecil, misalnya menentukan jumlah komponen dalam campuran dan menentukan pelarut yang tepat untuk pemisahan dengan KLT preparatif. Sedangkan KLT preparatif digunakan untuk memisahkan campuran senyawa dari sampel dalam jumlah besar berdasarkan fraksinya, yang selanjutnya fraksi-fraksi tersebut dikumpulkan dan digunakan untuk analisa berikutnya (Townshend, 1995). Plat KLT yang umum digunakan adalah plat KLT analitik dengan ketebalan 0,1-0,2 mm dengan ukuran 20x20 cm yang dilapisi dengan adsorben silika gel 60 F254 dengan ketebalan 0,2 mm. Plat kemudian ditempatkan ke dalam bejana dengan fase gerak yang sesuai, dimana ketinggian fase gerak cukup untuk membasahi bagian bawah plat dan tidak sampai membasahi dimana sampel diaplikasikan. Fase gerak kemudian bermigrasi melewati adsorben dengan gaya kaliper, dan proses ini dikenal sebagai pengembangan (Sarker, et al., 2006). UIN SYARIF HIDAYATULLAH JAKARTA 21 KLT merupakan teknik yang benar-benar menguntungkan karena tingkat sensitivitasnya sangat besar dengan jumlah sampel lebih sedikit (Brain & Turner, 1975). Fase gerak yang dikenal sebagai pelarut pengembang atau cairan pengelusi, akan bergerak sepanjang fase diam karena pengaruh kapiler pada pengembangan secara menaik (ascending), atau karena pengaruh gravitasi pada pengembangan secara menurun (descending) (Gritter, et al., 1991). Jumlah volume fase gerak harus mampu mengelusi lempeng sampai ketinggian lempeng yang telah ditentukan. Setelah lempeng terelusi, dilakukan deteksi bercak (Gandjar & Rohman, 2007). Laju pergerakan fase gerak terhadap fase diam dihitung sebagai retardation farctor (Rf). Nilai Rf diperoleh dengan membandingkan jarak yang ditempuh oleh zat terlarut dengan jarak yang ditempuh oleh fase gerak (Gandjar & Rohman, 2007). Fase gerak harus memiliki kemurnian yang tinggi. Hal ini dikarenakan KLT merupakan teknik yang sensitif. Fase gerak yang digunakan adalah pelarut organik yang memiliki tingkat polaritas tersendiri, melarutkan senyawa contoh, dan tidak bereaksi dengan penjerap (Gritter, et al., 1991). Adsorben umumnya digunakan dalam KLT meliputi partikel silika gel ukuran 12 µm, alumina, mineral oksida, selulosa, poliamida, polimer penukar ion (Gocan, 2002). a) Silika Gel Silika gel adalah yang paling banyak digunakan sebagai adsorben dan fase stasioner yang dominan untuk KLT. Sebagian besar analisa dengan KLT dilakukan dengan menggunakan fase normal lapisan silika gel. Fase diam ini dapat digunakan sebagai fase polar maupun non polar. Untuk fase polar, merupakan silika yang dibebaskan dari air dan bersifat sedikit asam. Silika gel perlu ditambah gips (kalsium sulfat) untuk memperkuat pelapisannya pada pendukung. Sebagai pendukung biasanya lapisan tipis digunakan kaca dengan ukuran 20x20 cm, 10x20 cm, atau 5x10 cm. Pendukung yang lain berupa lembaran alumunium atau plastik seperti ukuran di atas yang umumnya dibuat oleh pabrik. Silika gel kadang-kadang ditambah senyawa fluoresensi, agar bila disinari dengan sinar UV dapat berfluoresensi atau berpendar, sehingga UIN SYARIF HIDAYATULLAH JAKARTA 22 dikenal dengan silika gel 60 F254 yang berarti silika gel dengan fluoresen yang berpendar pada panjang gelombang 254 nm. Silika gel untuk fase non polar terbuat dari silika yang dilapisi dengan senyawa non polar misalnya, lemak, parafin, minyak silikon, raber gom, atau lilin, dengan fase gerak air yang bersifat polar dapat digunakan sebagai eluen. Fase diam ini dapat memisahkan banyak senyawa namun elusinya sangat lambat dan keterulangannya kurang bagus (Sumarno,2001). b) Alumina Alumina merupakan adsorben yang paling banyak digunakan dalam KLT (Gocan, 2002). Fase diam ini bersifat sedikit basa, lebih jarang digunakan. Saat akan digunakan harus diaktifkan kembali dengan pemanasan. Alumina yang digunakan sebagai fase diam untuk KLT umumnya yang bebas air, sehingga mempunyai aktivitas penjerapan lebih tinggi (Sumarno, 2001). c) Perlit Mineral Perlit mineral adalah adsorben baru untuk KLT, yang dibuat dengan mengkonversi SiO2 (70-75%) menjadi silikat yang larut dengan Na2CO3 (Gocan, 2002). d) Kiselgur Fase diam ini sebenarnya merupakan asam silika yang berbentuk amorf, berasal dari kerangka diatomae, maka lebih dikenal dengan nama tanah diatomae, kurang bersifat adsorptif dibanding silika (Sumarno, 2001). e) Magnesium Silikat Fase diam ini hanya digunakan bila adsorben atau penjerap lain tidak dapat digunakan. Nama lain dalam perdagangan dikenal dengan floresil (Sumarno, 2001). Floresil (magnesium silikat) adalah endapan silika dan magnesium. Sifat dan aplikasi dari floresil pada KLT dan KCKT ditinjau dan dibandingkan dengan adsorben lainnya (Gocan, 2002). UIN SYARIF HIDAYATULLAH JAKARTA 23 f) Selulosa Polaritasnya tinggi sehingga dapat digunakan sebagai pemisahan secara partisi, baik dengan bentuk kertas maupun bentuk lempeng. Kedua bentuk tersebut masih sering digunakan untuk pemisahan flavonoid. Ukuran partikel yang digunakan kira-kira 50 m. Fase diam ini sekarang sudah diganti dengan bubuk selulosa yang dapat dilapiskan pada kaca seperti halnya fase diam yang lain sehingga lebih efisien dan lebih banyak digunakan untuk memisahkan senyawa-senyawa polar atau isomernya (Sumarno, 2001). g) Resin Fase diam resin digunakan pada KLT penukar ion. Resin merupakan polimer dari stirendivenil yang mengalami kopolimerisasi dan bersifat non polar. Fase diam ini sangat berguna untuk memisahkan senyawa berbobot molekul tinggi dan bersifat amfoter seperti asam amino, protein, enzim, nukleotida. Sebagai fase gerak digunakan larutan asam kuat atau basa kuat (Sumarno, 2001). 2.9.3 Identifikasi Kromatogram Ada beberapa cara untuk mendeteksi senyawa yang tidak berwarna pada kromatogram. Deteksi paling sederhana adalah jika senyawa menunjukkan penyerapan di daerah UV gelombang pendek (radiasi utama kira-kira 254 nm) atau jika senyawa itu dapat dieksitasi pada radiasi UV gelombang pendek dan gelombang panjang (365 nm). Pada senyawa yang mempuyai dua ikatan rangkap atau lebih dan senyawa aromatik seperti turunan benzena, mempunyai serapan kuat di daerah 230-300 nm (Stahl, 1985). Identifikasi dari senyawa-senyawa yang terpisah dari lapisan tipis yaitu dengan menggunakan nilai Rf. Nilai Rf didefinisikan sebagai berikut (Sastrohamidjojo, 2005). Rf = Jarak yang digerakkan oleh senyawa dari titik asal Jarak yang digerakkan oleh pelarut dari titik asal UIN SYARIF HIDAYATULLAH JAKARTA 24 Nilai Rf untuk senyawa-senyawa murni dapat dibandingkan dengan harga standar. Nilai Rf yang diperoleh hanya berlaku untuk campuran tertentu dari pelarut dan penjerap yang digunakan, meskipun demikian daftar dari harga-harga Rf untuk berbagai campuran dari pelarut dan penjerap dapat diperoleh (Sastrohamidjojo, 2005). 2.9.4 Sistem Fase Gerak Pada KLT Polaritas fase gerak perlu diperhatikan pada analisa dengan KLT, sebaiknya digunakan campuran pelarut organik yang mempunyai polaritas serendah mungkin. Campuran yang baik memberikan fase gerak yang mempunyai kekuatan bergerak sedang. Secara umum dikatakan bahwa fase diam yang polar akan mengikat senyawa polar dengan kuat sehingga bahan yang kurang sifat kepolarannya akan bergerak lebih cepat dibandingkan bahan-bahan polar (Gritter, et al., 1991). Fase gerak harus memiliki kemurnian yang tinggi. Hal ini dikarenakan KLT merupakan teknik yang sensitif. Fase gerak yang digunakan adalah pelarut organik yang memiliki tingkat polaritas tersendiri, melarutkan senyawa contoh, dan tidak bereaksi dengan penjerap (Gritter, et al., 1991). Pelarut yang ideal harus melarutkan linarut dan harus cukup baik sebagai pelarut yang bersaing dengan daya serap penjerap. Keadaan yang ideal tersebut mungkin terjadi jika pelarut tidak berproton seperti hidrokarbon, eter dan senyawa karbonil dipakai sebagai pelarut pengembang (Gritter, et al., 1991). 2.9.5 Kromatografi Gas Kromatografi gas merupakan metode yang dinamis untuk pemisahan senyawa-senyawa organik yang mudah menguap dan senyawa-senyawa gas anorganik dalam suatu campuran. Sampel yang mudah menguap dan stabil terhadap panas akan bermigrasi melalui kolom yang mengandung fase diam dengan suatu kecepatan yang terantung pada rasio distribusinya. Pada umumnya solut dari ujung kolom menghantarkan ke detektor (McNair, et al., 1998). Kromatografi gas penggunaan utamanya ialah pada pemisahan senyawa atsiri, yaitu asam lemak, mono dan seskuiterpen, hidrokarbon dan senyawa belerang tinggi. Tetapi, keatsirian kandungan tumbuhan yang bertitik didih tinggi UIN SYARIF HIDAYATULLAH JAKARTA 25 dapat diperbesar dengan mengubahanya menjadi ester dan/atau eter trimetil-silil sehingga hanya sedikit saja golongan yang sama sekali tidak cocok untuk dipisahkan dengan cara KGC (Harborne, 1987). Kromatografi gas dapat digunakan untuk analisia kualitatif dan kuantitatif. Untuk analisia kualitatif dilakukan dengan cara membandingkan waktu retensi dari komponen yang akan dianalisa dengan waktu retensi zat baku pembandig (standar) pada kondisi analisa yang sama. Untuk analisa kuantitatif dilakukan dengan cara perhitungan relatif dari tinggi atau luas puncak kromatogram komponen yang dianalisa terhadap zat baku pembanding (standar) yang dianalisa (McNair, et al., 1998). Untuk pemisahan bahan-bahan yang mudah menguap, kromatografi gas merupakan metode yang tepat karena kecepatannya, resolusinya yang tinggi dan mudah digunakan (McNair, et al., 1998). 2.9.6 Kromatografi Kolom Kromatografi kolom merupakan metode kromatografi klasik yang digunakan untuk memisahkan senyawa-senyawa dalam jumlah banyak berdasarkan adsorpsi dan partisi (Gritter, et al., 1991). Kromatografi kolom membutuhkan zat terlarut yang terdistribusi diantara dua fase, satu diantaranya fase diam dan yang lainnya fase gerak. Fase gerak membawa zat terlarut melalui media, hingga terpisah dari zat terlarut lain yang terelusi lebih awal atau akhir. Umumnya zat terlarut dibawa melewati media pemisah oleh aliran suatu pelarut berbentuk cairan atau gas (Harborne, 1987). Pada kromatografi kolom, tabung pemisah diisi penjerap. Penjerap yang biasa digunakan ialah silika gel. Pengisian ini harus dilakukan secara berhati-hati dan merata. Penjerap dapat dikemas dalam tabung dengan cara basah maupun kering (Harborne, 1987). Cara basah, silika gel terlebih dahulu dijenuhkan dengan cairan pengelusi yang akan digunakan. Kemudian dimasukkan ke dalam kolom melalui dinding kolom secara kontinyu sedikit demi sedikit, sambil kran kolom dibuka. Kemudian pelarut dialirkan hingga silika gel mampat. Setelah silika gel mampat, pelarut dibiarkan mengalir hingga batas adsorben. Kemudian kran UIN SYARIF HIDAYATULLAH JAKARTA 26 ditutup dan sampel dimasukkan, sampel yang dimasukkan terlebih dahulu dilarutkan dalam pelarut hingga diperoleh kelarutan yang spesifik. Kemudian sampel dipipet dan dimasukkan ke dalam kolom melalui dinding kolom sedikit demi sedikit hingga semua sampel masuk. Selanjutnya kran dibuka dan diatur tetesannya, serta ditambahkan dengan cairan pengelusi. Tetesan yang keluar ditampung sebagai fraksi-fraksi (Gritter, et al., 1991). Sedangkan cara kering, yaitu dengan memasukkan silika gel ke dalam kolom yang telah diberi kapas sedikit demi sedikit dan diratakan dengan alat pemampat kemudian ditambahkan dengan cairan pengelusi (Gritter, et al., 1991). 2.10 Elusidasi Struktur Elusidasi struktur umumnya menggunakan teknik spektroskopi klasik seperti spektrofotometri masa (SM) dan resonansi magnetik inti (RMI). Langkah pertama, bagaimanapun harus memperoleh rekaman spektrum sinar inframerah dan ultraviolet untuk menentukan adanya kelompok gugus fungsi tertentu dalam suatu molekul (Heinrich, 2004). 2.10.1 UV-Visible Spektrum serapan kandungan tumbuhan dapat diukur dalam larutan yang sangat encer dengan pembanding blanko pelarut serta menggunakan spektrofotometer yang merekam otomatis. Senyawa tanwarna diukur pada jangka 200-400 nm, senyawa berwarna pada jangka 200-700 nm. Prinsip kerja spektrofotometer UV-Vis ialah interaksi sinar ultraviolet atau tampak dengan molekul sampel. Energi cahaya akan mengeksitasi elektron terluar molekul ke orbital lebih tinggi (Harborne, 1987). Pada kondisi ini, elektron tidak stabil dan dapat melepas energi untuk kembali ke tingkat dasar, dengan disertai emisi cahaya. Besarnya penyerapan cahaya sebanding dengan molekul, sesuai dengan hukum lambert-Beer: UIN SYARIF HIDAYATULLAH JAKARTA 27 (Day & Underwood, 1980). A= ɛ B C Keterangan: A= Serapan/absorbansi ɛ= Absortivitas molar B= Tebal kuvet C= Konsentrasi komponen Sumber radiasi pada spektrofotometer UV-Vis berdasarkan panjang gelombang terbagi menjadi 2, yaitu lampu deuterium dan tungstent. Lampu deuterium menghasilkan sinar 160-500 nm. Lampu tungstent digunakan di daerah sinar tampak 350-3500 nm. Sumber radiasi dikatakan ideal jika memancarkan spektrum radiasi yang kontinyu, intensitasnya tinggi dan stabil pada semua panjang gelombang. 2.10.2 Spektrofotometri Infra Merah Spektrofotometri infra merah merupakan suatu metode yang mengamati interaksi molekul dengan radiasi elektromagnetik yang berada pada daerah panjang gelombang 0,75–1.000 m atau pada bilangan gelombang 13.000–10 cm-1. Spektrofotometer infra merah merupakan alat untuk mendeteksi gugus fungsi, mengidentifikasi senyawa dan menganalisis campuran. Banyak pita absorbsi yang terdapat dalam daerah yang di sebut daerah ”sidik jari” spektrum (Harborne, 1987). Spektrum infra merah suatu sampel dapat di ketahui letak pita serapan yang dikaitkan dengan adanya suatu gugus fungsi tertentu (Day & Underwood, 1999). Spektrofotometer infra merah digunakan sebagai analisa kualitatif untuk menentukan gugus fungsi. Gugus fungsi dapat diintepretasi dengan memeriksa puncak absorbsi dari spektrum infra merah. Daerah pada spektrum inframerah diatas 1200 cm-1 menunjukkan pita spektrum atau puncak yang disebabkan oleh getaran ikatan kimia atau gugus fungsi dalam molekul yang telah ditelaah. Daerah dibawah 1200 cm-1 menunjukkan pita yang disebabkan oleh getaran seluruh molekul, dan karena kerumitannya dikenal sebagai daerah sidik jari. Intensitas berbagai pita direkam UIN SYARIF HIDAYATULLAH JAKARTA 28 secara subjektif pada skala sederhana yaitu kuat, menengah atau lemah (Harborne, 1987). 2.10.3 Spektrofotometri Massa Teknik ini memungkinkan untuk mengukur berat molekul dari senyawa dan ion molekular yang diidentifikasi, teknik ini memungkinkan untuk mengukur ion secara akurat, untuk memastikan jumlah dari atom hidrogen, karbon, oksigen dan atom lain yang terdapat dalam suatu molekul. Teknik ini akan memberikan hasil data berupa rumus molekul (Heinrich, 2004). Sejumlah teknik ionisasi terdapat dalam Spektrofotometri massa, yang mana electron impact digunakan secara luas. Teknik ini memberikan fragmentasi yang baik dari molekul dan berguna untuk menentukan struktur dengan menetapkan fragmentasi untuk kelompok gugus fungsi yang terdapat dalam senyawa (Heinrich, 2004). 2.10.4 KG-SM (Kromatografi Gas-Spektrofotometri Massa) Kromatografi gas dan spektrofotometri massa dapat digunakan untuk memisahkan komponen dengan memberikan waktu retensi dan puncak elusi yang dapat dimasukkan ke dalam spektrofotometer massa untuk memperoleh berat molekul, karakteristik dan informasi fragmentasi (Heinrich, 2004). Teknik ini juga dapat digunakan untuk komponen yang polar (senyawa yang larut dalam air) seperti calistegines dan polihidroksil alkaloid jika dibuat turunannya dengan komponen yang sesuai (trimetilsilil klorida) untuk meningkatkan volatilitasnya (Heinrich, 2004). Kromatografi gas saat ini merupakan metode analisa yang penting dalam kimia organik untuk menentukan senyawa tunggal dalam campuran. Spektrofotometri massa sebagai metode deteksi yang memberikan data bermakna, yang diperoleh dari penentuan langsung molekul zat atau fragmen (Heinrich, 2004). UIN SYARIF HIDAYATULLAH JAKARTA 29 2.10.5 Resonansi Magnetik Inti (RMI) Radiasi pada daerah frekuensi radio digunakan untuk mengeksitasi atom-atom, biasanya proton-proton (1H-RMI) atau atom-atom karbon-13 (13C-RMI), sehingga spinnya berubah dari sejajar menjadi sejajar melawan medan magnet yang digunakan. Rentang frekuensi yang dibutuhkan untuk eksitasi dan pola-pola pembagian kompleks yang dihasilkan sangat khas pada struktur kimia molekul tersebut (Watson, 2009). Spektra RMI biasanya ditentukan dari larutan substansi yang akan dianalisa. Untuk itu pelarut yang digunakan tidak boleh mengandung atom hidrogen karena akan mengganggu puncak spektrum. Ada dua cara untuk mencegah gangguan oleh pelarut. Pertama dapat digunakan pelarut seperti tetraklormetana, CCl4 yang tidak mengandung hidrogen atau pelarut yang atom hidrogennya telah diganti dengan isotopnya yaitu deuterium, sebagai contoh CDCl3 (Sudjadi, 1985). UIN SYARIF HIDAYATULLAH JAKARTA 30 2.11 Kerangka Konsep Tumbuhan Paku Nephrolepis falcata Determinasi Ekstraksi Bertingkat Dengan Pelarut n-Heksana dan Etil Asetat Ekstrak n-Heksana Ekstrak Etil Asetat Uji Aktivitas Antioksidan Dengan DPPH Ekstrak Aktif Antioksidan Fraksinasi Dengan Kromatografi kolom Senyawa Hasil Isolasi Uji Kemurnian Senyawa Penentuan Struktur Molekul Dengan UV, IR, 1H-NMR UIN SYARIF HIDAYATULLAH JAKARTA BAB 3 METODOLOGI PENELITIAN 3.1 Lokasi dan Waktu Penelitian Penelitian dilaksanakan di (Laboratorium Analisis Obat dan Pangan) dan (Laboratorium Farmakognosi dan Fitokimia) Program Studi Farmasi, Fakultas Kedokteran dan Ilmu Kesehatan, Universitas Islam Negeri Syarif Hidayatullah Jakarta. Waktu penelitian ini berlangsung selama 6 bulan, yaitu pada bulan Januari 2013 sampai dengan bulan Juni 2013. 3.2 ALAT DAN BAHAN 3.2.1 Alat Alat yang digunakan dalam penelitian ini antara lain: Ayakan No.40, blender, timbangan analitik, kertas label, alumunium foil, kertas saring, kapas, labu erlenmeyer (Duran), beker gelas (Duran), gelas ukur (Duran), corong (Eyela), tabung reaksi, kolom kromatografi, spatula, batang pengaduk, pipet tetes, seperangkat alat vaccum rotary evaporator, kaca arloji, cawan penguap, alat melting point, pipa kapiler, vial, plat KLT dan bejana KLT. 3.2.2 Sampel Tumbuhan Sampel tumbuhan yang digunakan adalah tumbuhan paku Nephrolepis falcata (Cav.) C. Chr yang diperoleh di wilayah kampus FKIK UIN Syarif Hidayatullah Jakarta, yang selanjutnya dideterminasi di Herbarium Bogoriense ( LIPI), Cibinong, Bogor. 3.2.3 Bahan Kimia Bahan kimia yang digunakan dalam penelitian ini antara lain: n-heksana (Brataco), etil asetat (Brataco), aquades, metanol grade HPLC, aquabides, silika gel 60 F254 (0,063-0,200 mm for column chromatography) (Merck), lempeng UIN SYARIF HIDAYATULLAH JAKARTA 31 32 KLT (whatman, 250 µm 20 x 20 cm AL SIL G/UV, Felxible Plates for TLC, Cat No. 4420222, coating silica gel) (Merck). Reagen kimia antara lain: Dragendorff, Mayer, Wagner, ferri klorida, asam sulfat, natrium hidroksida, asam asetat, kloroform, Liberman Buchardat, asam kloroda, natrium klorida, gelatin, Vanilin , dan asam perklorat. 3.2.4 Instrumen Instrumen yang digunakan antara lain: spektrofotometer infra merah, kromatografi cair kinerja tinggi (KCKT), resonansi magnetik inti proton (1H-RMI), lampu UV 254 nm dan 366 nm ( bioinstrument atta), UV-Visible. 3.3 PROSEDUR KERJA 3.3.1 Pemeriksaan Sampel Tumbuhan Sampel tumbuhan Nephrolepis falcata sebanyak 10,1 kg yang diperoleh dari halaman kampus Universitas Islam Negeri Syarif Hidayatullah Jakarta, dilakukan determinasi di Pusat Penelitian Herbarium Bogoriense (LIPI), Cibinong, Bogor. 3.3.2 Penyiapan Simplisia Sampel daun tumbuhan Nephrolepis falcata sebanyak 10,1 kg disortasi basah dan dilakukan pencucian dengan menggunakan air mengalir hingga bersih. Selanjutnya sampel dikeringkan dengan cara diangin-anginkan dan terhindar dari cahaya matahari, pengeringan dilakukan selama satu minggu hingga sampel benar-benar kering. Sampel yang telah kering, disortasi kering kemudian dihaluskan dengan menggunakan blender dan diayak dengan ayakan no.40. Serbuk simplisia yang diperoleh kemudian ditimbang, Selanjutnya simplisia disimpan dalam wadah tertutup rapat dan terhindar dari cahaya matahari. 3.3.3 Pembuatan Ekstrak Prosedur ekstraksi menggunakan metode ekstraksi cara dingin dengan teknik maserasi bertingkat. Pelarut yang digunakan antara lain, n-heksana dan etil asetat. Serbuk simplisia sebanyak 1,256 kg dimasukkan ke dalam wadah gelap UIN SYARIF HIDAYATULLAH JAKARTA 33 sehingga terhindar dari cahaya matahari. Selanjutnya dimasukkan pelarut n-heksana ke dalam wadah yang berisi serbuk simplisia hingga serbuk terendam ±3 cm di atas permukaan simplisia. Pelarut n-heksana yang digunakan untuk maserasi sebanyak 4,5 liter. Maserasi dilakukan selama 1-2 hari dengan beberapa kali pengadukan. Hasil maserasi disaring untuk memisahkan filtrat dengan ampas. Filtrat yang diperoleh diuapkan dengan vaccum rotary evaporator hingga diperoleh ekstrak kental. Ampas yang tersisa, kembali ditambahkan n-heksana dan proses maserasi dilakukan kembali. Maserasi dengan menggunakan pelarut n-heksana dilakukan sebanyak 15 kali hingga pelarut yang digunakan terlihat bening yang menandakan senyawa telah terekstraksi seluruhnya. Selanjutnya maserasi diganti dengan perlarut etil asetat, volume etil asetat yang digunakan sebanyak 4,5 liter. Prosedur ekstraksi sesuai dengan kegiatan ekstraksi sebelumnya. Maserasi dengan menggunakan pelarut etil asetat dilakukan sebanyak 10 kali hingga pelarut yang digunakan terlihat bening. Total pelarut n-heksana yang digunakan untuk maserasi sebanyak 18 liter dan pelarut etil asetat yang digunakan sebanyak 10 liter. 3.3.4 Kromatografi Lapis Tipis (KLT) Ekstrak yang diperoleh, dianalisa dengan menggunakan kromatografi lapis tipis untuk mengamati pola pemisahannya. Lempeng KLT dengan ukuran 5x10 cm, pada bagian atas dan bawah plat, dibuat garis tepi sepanjang 1 cm. Selanjutnya dibuat sistem fase gerak yang terdiri dari n-heksana dan etil asetat dengan berbagai perbandingan, setiap perbandingan kepolarannya ditingkatkan 10%. Fase gerak yang telah dibuat, dimasukkan ke dalam bejana KLT dan dijenuhkan dengan memasukkan kertas saring ke dalamnya, hingga kertas saring terbasahi semua. Selanjutnya, 10 mg ekstrak dilarutkan dengan 1 mL pelarut etil asetat dan ditotolkan pada garis tepi bagian bawah plat dengan menggunakan pipa kapiler. Plat KLT dielusi di dalam masing-masing bejana KLT yang berisi fase gerak, hingga fase gerak mencapai garis tepi bagian atas, kemudian diangkat. Plat KLT dibiarkan kering dan dilihat pola pemisahannya secara langsung dan di UIN SYARIF HIDAYATULLAH JAKARTA 34 bawah lampu UV dengan panjang gelombang 254 nm dan 366 nm. Dari hasil KLT, dilihat kombinasi sistem fase gerak yang memberikan pola pemisahan yang baik. 3.3.5 Skrining Fitokimia (Tiwari, et al., 2011; Fransworth, 1969) 1) Uji Alkaloid Sejumlah ekstrak dilarutkan dalam larutan HCl encer kemudian disaring dan filtrat dibagi menjadi dua tabung reaksi. Tes Mayer: filtrat A ditambahkan reagen Meyer (larutan kalium merkuri iodida). Terjadinya endapan berwarna putih mengindikasikan adanya senyawa alkaloid. Tes Dragendorff: filtrat B ditambahkan reagen Dragendorff (larutan kalium bismut iodida) Terjadinya endapan berwarna merah bata mengindikasikan adanya senyawa alkaloid. 2) Uji Flavonoid Sejumlah Ekstrak dilarutkan dalam 5 mL air panas, didihkan selama 5 menit lalu disaring. Filtrat ditambahkan serbuk Mg secukupnya, 1 mL asam klorida pekat dan 2 mL etanol. Dikocok kuat dan dibiarkan terpisah. Terbentuk warna merah, kuning atau jingga pada lapisan etanol menunjukkan adanya senyawa flavonoid. 3) Uji Saponin Sejumlah ekstrak dilarutkan dalam 20 mL aquades, kemudian larutan dikocok dalam labu ukur selama 15 menit. Terbentuknya lapisan busa setinggi 1 cm mengindikasikan adanya senyawa saponin. 4) Uji Steroid dan Terpenoid Tes Salkowski: Sejumlah ekstrak dilarutkan dalam kloroform dan disaring. Kemudian filtrat ditambahkan beberapa tetes asam sulfat dan dikocok. Terbentuknya warna kuning emas mengindikasikan adanya senyawa tepenoid. Tes Liberman Buchardat: Sejumlah ekstrak dilarutkan dalam kloroform dan disaring, filtrat ditambahkan beberapa tetes asam asetat anhidrat, UIN SYARIF HIDAYATULLAH JAKARTA 35 kemudian dipanaskan dan didinginkan. Selanjutnya larutan ditambahkan beberapa tetes asam sulfat. Terbentuknya cincin coklat mengindikasikan adanya senyawa steroid. 5) Uji Fenol Sejumlah ekstrak ditambahkan beberapa tetes larutan FeCl3. Terbentuknya warna biru kehitaman mengindikasikan adanya senyawa fenol. 6) Uji Tanin Tes gelatin: Sejumlah ekstrak ditambahkan larutan gelatin yang mengandung natrium hidroksida. Terbentuknya endapan putih mengindikasikan adanya senyawa tanin. 7) Uji Asam Lemak Sejumlah ekstrak dicampur dengan 5 ml eter, kemudian diuapkan. Ekstrak yang telah diuapkan ditotolkan di atas kertas saring dan dibiarkan kering. Bercak transparan pada kertas saring setelah ditotolkan ekstrak mengindikasikan adanya senyawa asam lemak. 8) Uji Kumarin Sejumlah ekstrak ditambahkan 1 mL NaOH 5 N dalam tabung reaksi, kemudian dipanaskan selama beberapa menit di atas penangas air. Selanjutnya larutan disaring dengan menggunakan kertas saring. Filtrat yang diperoleh dilihat di bawah lampu UV dengan panjang gelombang 254 nm dan 366 nm. Terjadinya fluoresensi dengan warna kuning kehijauan mengindikasikan adanya senyawa kumarin. 3.3.6 Uji Kualitatif Aktivitas Antioksidan Dengan DPPH Uji kualitatif aktivitas antioksidan dilakukan dengan menggunakan kromatografi lapis tipis. Larutan DPPH dengan konsentrasi 0,04% dalam 20 mL metanol dibuat dengan cara menimbang 8 mg serbuk DPPH, kemudian dilarutkan dalam 20 mL metanol pro analisis. Ekstrak yang sebelumnya telah dilakuakan pemisahan dengan KLT, disemprot dengan reagen tersebut hingga seluruh plat terbasahi. Plat yang telah disemprot dibiarkan selama 30 menit dalam ruangan UIN SYARIF HIDAYATULLAH JAKARTA 36 tertutup. Selanjutnya dilihat pola bercak yang memberikan aktivitas antioksidan pada plat KLT (Basma, et al., 2011). 3.3.7 Isolasi Senyawa Aktif Antioksidan Dengan Kromatografi Kolom Ekstrak etil asetat yang memiliki aktivitas antioksidan setelah diuji secara kualitatif dengan DPPH, selanjutnya difraksinasi dengan metode kromatografi kolom. Kolom kromatografi yang digunakan memiliki ukuran tinggi 100 cm dan diameter 5 cm. Kolom disiapkan dengan menyumbat pada bagian dasarnya dengan menggunakan kapas. Selanjutnya kolom dialiri dengan pelarut n-heksana dan kapas ditekan-tekan dengan batang pengaduk hingga tidak ada udara yang terjerap. Dibuat bubur silika dengan menimbang serbuk silika gel sebanyak 250 gram kemudian didispersikan dengan pelarut n-heksana hingga menjadi bubur suspensi. Bubur silika gel dimasukkan ke dalam kolom kromatografi dan Kolom dialiri dengan menggunakan pelarut n-heksana. Pelarut yang menetes ditampung, kemudian dimasukkan kembali ke dalam kolom sambil diketuk-ketuk. Proses ini dilakukan hingga silika gel mampat. Tahap selanjutnya, ekstrak etil asetat sebanyak 32 gram dipreadsorbsi dengan silika gel sebanyak 15 gram. Ekstrak dimasukkan ke dalam kolom dan disumbat dengan kapas. Selanjutnya dibuat sistem fase gerak dengan komposisi n-heksana dan etil asetat dengan berbagai perbandingan. Sistem fase gerak yang digunakan adalah sistem gradien, setiap gradien kepolarannya ditingkatkan 10%. Fraksinasi pertama dilakukan dengan mengaliri kolom menggunakan fase gerak n-heksana 100% sebanyak 250 mL. Pelarut yang menetes, ditampung dalam vial yang sebelumnya telah diberi nomor. Penggantian gradien fase gerak dilakukan ketika gradien sebelumnya telah habis digunakan untuk mengaliri kolom. Fraksinasi dilakukan hingga fase gerak yang digunakan telah mencapai gradien akhir yaitu etil asetat 100%. Pada tahap akhir kromatografi kolom, kolom dicuci dengan mengaliri pelarut metanol 100% sebanyak 300 mL untuk membersihkan silika gel dari sisa ekstrak yang masih menempel. Setiap fraksi yang diperoleh, dilakukan kromatografi lapis tipis dan dilihat pola bercak yang dihasilkan dibawah lampu UV dengan panjang gelombang 254 nm dan 366 nm. UIN SYARIF HIDAYATULLAH JAKARTA 37 Hasil KLT, dilakukan uji aktivitas antioksidan dengan menyemprot reagen DPPH dengan konsentrasi 0,04%. Fraksi yang memberikan pola bercak dengan nilai Rf yang sama, digabungkan dalam satu vial yang selanjutnya akan difraksinasi kembali untuk melakukan pemisahan lebih lanjut. Fraksinasi dengan kroatografi kolom dilakukan hingga diperoleh senyawa murni. 3.3.8 Pemurnian Kristal Pemurnian dilakukan terhadap kristal yang diperoleh dari hasil pemisahan dengan kromatografi kolom yaitu (fraksi F2.A, F2.D dan F3.C). Prosedur pemurnian dilakukan dengan mengalirkan pelarut n-heksana pada fraksi F2.A, kemudian dikocok secara perlahan hingga n-heksana dapat melarutkan komponen lain tanpa melarutkan kristal. Kemudian komponen yang terlarut dalam n-heksana ditarik dengan pipet tetes yang sebelumnya telah disumbat kapas pada bagian ujungnya dan komponen tersebut dipisahkan dari kristal. Pemurnian dilakukan hingga kristal bersih. Prosedur yang sama juga dilakukan terhadap kristal dari fraksi F2.D dan fraksi F3.C. Tetapi pada kristal fraksi F3.C menggunakan etil asetat dalam proses pemurniannya karena etil asetat merupakan pelarut yang cocok untuk pemurnian kristal fraksi F3.C. 3.3.9 Uji Kualitatif Aktivitas Antioksidan Senyawa Murni Kristal yang diperoleh, diuji aktivitas antioksidannya dengan menggunakan DPPH. Setiap fraksi terlebih dahulu dilakukan kromatografi lapis tipis dengan fase gerak n-heksana-etil asetat (8:2). Hasil KLT disemprot dengan DPPH 0,04% dan didiamkan selama 30 menit dalam ruang gelap. Dari ketiga kristal yang diperoleh, hanya kristal dari fraksi F2.D yang memiliki aktivitas antioksidan, sehingga kristal tersebut yang akan diuji lebih lanjut. 3.3.10 Uji Kemurnian Senyawa Aktif Antioksidan Uji kemurnian senyawa dengan menggunakan 3 metode, antara lain kromatografi lapis tipis 2 dimensi (KLT 2 dimensi), uji titik leleh dan kromatografi cair kinerja tinggi (KCKT). UIN SYARIF HIDAYATULLAH JAKARTA 38 3.3.10.1 Kromatografi Lapi Tipis 2 Dimensi (KLT 2 Dimensi) Uji kemurnian senyawa dengan menggunakan KLT 2 dimensi. Dibuat plat KLT dengan bentuk bujur sangkar yang setiap sisinya memiliki ukuran 5 cm. Kemudian sejumlah kristal dilarutkan dengan etil asetat dan ditotolkan pada salah satu sisi plat dengan pipa kapiler. Plat KLT dielusi dengan fase gerak n-heksana-etil asetat (8:2) dan dibiarkan kering sesaat. Kemudian plat KLT dielusi kembali pada sisi lainnya dengan menggunakan fase gerak yang sama. Bercak dilihat di bawah lampu UV ( 254 nm dan 366 nm) dan disemprot dengan pereaksi godyns sebagai penampak bercak. Elusi Kedua Sampel Elusi Pertama Gambar 3.1. KLT 2 Dimensi 3.3.10.2 Uji Titik Leleh Pengujian titik leleh dengan menggunakan alat melting point. Serbuk kristal dimasukkan dalam pipa kapiler yang telah ditutup pada salah satu ujungnya kemudian diketuk-ketuk hingga kristal mampat. Selanjutnya Pipa kapiler dimasukkan ke dalam alat melting point dan temperatur dinaikkan secara perlahan-lahan. Lazimnya setiap menit temperatur dinaikkan sebanyak 10C. Titik leleh ditandai pada saat kristal mulai meleleh hingga meleleh sempurna. Senyawa dikatakan murni apabila memiliki titik leleh dengan rentang ± 20C. UIN SYARIF HIDAYATULLAH JAKARTA 39 3.3.10.3 Kromatografi Cair Kinerja Tinggi (KCKT) Prosedur Pada KCKT, pertama dengan menentukan beberapa metode instrumen yang digunakan, antara lain Fase gerak berupa metanol grade HPLC-aquabides (60%:40%), panjang gelombang UV 239 nm, temperatur kolom 250C, laju alir fase gerak 0,4 mL/menit, volume injeksi sampel 20 µL dan waktu alir adalah 15 menit. Dilakukan pencucian kolom selama 30 menit dengan aquabides. Selanjutnya dilakukan baseline pada alat dan dicek konsistensi kolom dengan melihat adanya puncak atau tidak pada kromatogram. Kristal yang telah dilarutkan dengan metanol, dianalisa dan dilihat puncak yang dihasilkan. Senyawa dikatakan murni apabila menghasilkan puncak tunggal pada kromatogram. 3.3.11 Penentuan Struktur Molekul Penentuan struktur molekul dilakukan dengan menggunakan 3 alat instrumen antara lain, UV-Visible, FTIR dan 1H-RMI. 3.3.11.1 UV-Visible Kristal fraksi F2.D dilarutkan dengan menggunakan pelarut metanol. Pada alat UV-Vis, terlebih dahulu ditentukan panjang gelombang yang digunakan yaitu 200-400 nm. Kemudian dilakukan baseline pada alat dengan blanko berupa metanol. Sampel dianalisa dan dilihat panjang gelombang yang dihasilkan. 3.3.11.2 FTIR Kristal fraksi F2.D sebanyak 0,5 mg, dicampur dengan KBr sebanyak 50 mg dan digerus homogen. Pada alat terlebih dahulu dilakukan baseline dengan blanko berupa udara. sampel diletakkan ke dalam sel KBr dan dimasukkan ke dalam alat dengan lubang mengarah ke sumber radiasi kemudian dilakukan analisa. 3.3.11.3 1H-RMI Kristal fraksi F2.D dilarutkan dalam kloroform dan dilakukan analisa dengan 1H-RMI pada frekuensi 500 MHz. UIN SYARIF HIDAYATULLAH JAKARTA BAB 4 HASIL DAN PEMBAHASAN 4.1 Penyiapan Bahan Tumbuhan paku yang diperoleh dari wilayah Universitas Islam Negeri Syarif Hidayatullah Jakarta, dilakukan determinasi di Pusat Penelitian Bogoriense (LIPI), Cibinong, Bogor, yang bertujuan untuk mengetahui keaslian tumbuhan yang akan digunakan dan untuk menghindari terjadinya kesalahan dalam pemilihan tumbuhan. Hasilnya adalah tumbuhan yang diperoleh merupakan tumbuhan paku Nephrolepis falcata (Cav.) C.Chr (Lampiran 1). Tumbuhan paku yang diperoleh sebanyak 10,1 kg, disortasi untuk memisahkan antara tumbuhan dengan kotoran dan kontaminan lainnya. Proses pengeringan dilakukan dengan cara diangin-anginkan yang bertujuan untuk meminimalisir adanya pemanasan yang dapat merusak senyawa yang terkandung, mengingat senyawa yang akan diisolasi merupakan senyawa antioksidan, karena senyawa tersebut sebagian besar dapat mengalami kerusakan dengan adanya pemanasan. Pengeringan dengan cara ini, juga dapat meminimalisir terjadinya kehilangan senyawa yang mudah menguap (atsiri) apabila dalam tanaman tersebut mengandung senyawa minyak atsiri. Penghalusan dilakukan untuk memperkecil ukuran partikel tumbuhan, yang bertujuan untuk memaksimalkan dalam proses ekstraksi, karena semakin kecil ukuran partikel, maka semakin besar luas permukaannya, sehingga kontak antara pelarut dengan partikel tumbuhan semakin besar dan proses ekstraksipun dapat berjalan maksimal. Dari 10,1 kg sampel daun segar Nephrolepis falcata, diperoleh 1,256 kg simplisia kering yang selanjutnya Simplisia disimpan dalam wadah tertutup rapat untuk menghindari cemaran oleh mikroba dan mikroorganisme lainnya. 40 UIN SYARIF HIDAYATULLAH JAKARTA 41 4.2 Ekstraksi Ekstraksi dilakukan dengan menggunakan ekstraksi cara dingin, yaitu dengan metode maserasi. Prosedur ekstrasi dengan cara dingin dipilih, alasannya untuk meminimalisir terjadinya pemanasan yang dapat menyebabkan kerusakan terhadap senyawa yang tidak tahan panas. Proses ekstraksi ini menggunakan teknik maserasi bertingakat dengan pelarut yang memiliki tingkat kepolaran yang berbeda-beda yaitu n-heksana yang merupakan pelarut non polar dan etil asetat yang merupakan pelarut semi polar. Alasan penggunaan teknik ekstraksi bertingkat, yaitu untuk memaksimalkan proses ekstraksi, di mana senyawa akan terekstraksi berdasarkan sifat kepolarannya. Selain itu, teknik ini juga digunakan untuk memperoleh hasil rendemen yang lebih banyak. Dari proses maserasi, diperoleh 2 ekstrak kental, yaitu ekstrak dari pelarut n-heksana yang memiliki bobot 20 gram dan ekstrak dari pelarut etil asetat yang memiliki bobot 40 gram. Tabel 4.1. Hasil Rendemen Ekstrak n-Heksana dan Etil Asetat Total Simplisia Ekstrak Bobot Rendemen n-Heksana 20 gram 1,59% Etil Asetat 40 gram 3,18% 1,256 Kg 4.3 Hasil Penapisan Fitokimia Uji penapisan fitokimia dilakukan untuk mengidentifikasi komponen apa saja yang terkandung dalam tanaman, sehingga memungkinkan untuk mengetahui senyawa yang berpotensi sebagai antioksidan. Dari hasil uji penapisan fitokimia, ekstrak etil asetat positif mengandung beberapa komponen golongan senyawa antara lain, steroid, terpenoid, flavonoid, dan asam lemak. UIN SYARIF HIDAYATULLAH JAKARTA 42 Tabel 4.2. Hasil Penapisan Fitokimia Ekstrak Etil Asetat 4.4 No Golongan Kimia Hasil Pengamatan 1 Alkaloid _ 2 Flavonoid + 3 Steroid + 4 Terpenoid + 5 Kumarin _ 6 Tanin _ 7 Asam Lemak + 8 Fenol _ 9 Saponin _ Hasil Kromatografi Lapis Tipis (KLT) Kromatografi lapis tipis dilakukan untuk mengetahui pola pemisahan senyawa dari bercak yang dihasilkan. Keuntungan dari metode KLT ini, yaitu analisisnya cepat dan sampel yang digunakan sedikit. Pola pemisahan yang baik tergantung dari fase gerak yang digunakan. Penentuan fase gerak pada KLT berguna dalam menentukan fase gerak yang akan digunakan dalam kromatografi kolom. Dari hasil uji kromatografi lapis tipis, ekstrak n-heksana dielusi dengan menggunakan fase gerak dengan komposisi n-heksana dan etil asetat dengan perbandingan 8:2, sedangkan ekstrak etil asetat dielusi dengan menggunakan fase gerak n-heksana dan etil asetat dengan perbandingan 6:4. Pemilihan fase gerak untuk kedua ekstrak cukup baik dengan terlihatnya banyak senyawa yang terpisah (Lampiran 3). UIN SYARIF HIDAYATULLAH JAKARTA 43 4.5 Hasil Uji Kualitatif Aktivitas Antioksidan Dengan DPPH Untuk mengetahui adanya senyawa antioksidan dalam tumbuhan paku Nephrolepis falcata, dilakukan uji pendahuluan aktivitas antioksidan. Metode yang digunakan yaitu dengan metode DPPH, alasannya karena metode ini memiliki kelebihan, diantaranya, analisisnya mudah, cepat dan efisien, serta memungkinkan mengetahui adanya senyawa yang bersifat sebagai antioksidan yang dapat dilihat secara visual. Eluen Eluen n-heksana:E.A (8:2) n-heksana:E.A (6:4) A B Gambar 4.1. Hasil Uji Kualitatif Antioksidan Ekstrak. (a). Ekstrak Etil Asetat (b) Ekstrak n-Heksana. Dari hasil uji aktivitas antioksidan, ekstrak etil asetat dan n-heksana menunjukkan adanya aktivitas senyawa antioksidan. Ini diketahui dengan melihat pola bercak setelah disemprot dengan pereaksi DPPH. Pola bercak yang menimbulkan warna kuning dengan latar belakang ungu setelah disemprot dengan DPPH, mengindikasikan adanya senyawa antioksidan (Aderogba, et al., 2012) UIN SYARIF HIDAYATULLAH JAKARTA 44 4.6 Hasil Pemisahan Dengan Kromatografi Kolom Hasil pemisahan pada kromatografi kolom pertama, diperoleh fraksi sebanyak 206 vial. Dari 206 fraksi, diperoleh 12 sub fraksi yang memiliki pola bercak dengan nilai Rf yang sama antara lain F1.A merupakan fraksi no.(14), F1.B gabungan fraksi no.(15-25), F1.C gabungan fraksi no.(26-34), F1.D gabungan fraksi no.(35-52), F1.E gabungan fraksi no.(53-67), F1.F gabungan fraksi No.(68-75), F1.G gabungan fraksi no.(76-97), F1.H gabungan fraksi No.(98-113), F1.I gabungan fraksi No.(114-132), F1.J gabungan fraksi no.(133-184), F1.K gabungan fraksi no.(185-188) dan F1.L gabungan fraksi no.(189-206). Dari 12 sub fraksi, fraksi yang memberikan pola bercak dengan aktivitas antioksidan yang banyak adalah fraksi F1.A dengan bobot 2,5 gram, sehingga fraksi tersebut dilakukan pemisahan lebih lanjut dengan kromatografi kolom. Hasil pemisahan pada kromatografi kolom kedua, diperoleh fraksi sebanyak 128 vial. Dari 128 fraksi, diperoleh 6 sub fraksi dari hasil gabungan fraksi yang memiliki pola bercak yang sama antara lain, F2.A gabungan fraksi no.(46-50), F2.B gabungan fraksi no.(51-52), F2.C gabungan fraksi no.(56-70), F2.D gabungan fraksi no.(71-90), F2.E gabungan fraksi no.(91-98) dan F2.F gabungan fraksi no.(99-128). Dari 6 sub fraksi, fraksi yang memberikan pola bercak dengan aktivitas antioksidan yang banyak adalah fraksi F2.A dengan bobot 658,7 mg, sehingga fraksi tersebut dilakukan pemisahan kembali dengan kromatografi kolom untuk memperoleh senyawa yang lebih murni. Dari kromatografi kolom II, juga diperoleh kristal berwarna putih yang terdapat pada fraksi F2.A dan fraksi F2.D. Hasil pemisahan pada kromatografi kolom ketiga, diperoleh 196 fraksi. Dari 196 fraksi diperoleh 5 sub fraksi dari hasil gabungan fraksi yang memiliki pola bercak yang sama antara lain, F3.A gabungan fraksi no.(30-47), F3.B gabungan fraksi no.(48-61), F3.C gabungan fraksi no.(62-77), F3.D gabungan fraksi no.(78-93) dan F3.E gabungan fraksi no.(93-110). Pada kromatografi kolom III juga diperoleh kristal berwarna putih yang terdapat pada fraksi F3.C (No.62-77). Dari hasil pemisahan dengan kromatografi kolom, diperoleh tiga isolat yang tertera pada tabel di bawah. UIN SYARIF HIDAYATULLAH JAKARTA 45 Tabel 4.3. Hasil Isolat Dari Ekstrak Etil Asetat Fraksi Organoleptik Rf Bentuk: Kristal jarum pendek F2.A 0,675 Warna: Putih bening Bentuk: Kristal jarum panjang F2.D 0,325 Warna: Putih Bentuk: Kristal jarum pendek F3.C 0,67 Warna: Putih bening Eluen n-heksana:E.A (8:2) n-heksana:E.A (8:2) n-heksana:E.A (8:2) Bobot 5 mg 20 mg 80 mg Dari ketiga kristal yang diperoleh, setelah dilakukan uji aktivitas antioksidan dengan DPPH, hanya kristal fraksi F2.D yang aktif sebagai antioksidan, sehingga kristal tersebut yang dianalisa lebih lanjut. Eluen n-heksana : E.A (8:2) Rf = 0,325 A B C Gambar 4.2. Hasil Uji Kualitatif Aktivitas Antioksidan Isolat. (A). Kristal F2.A (B) Kristal F2.D, (C) Kristal F3.C. UIN SYARIF HIDAYATULLAH JAKARTA 46 4.7 Hasil Uji Kemurnian Senyawa Hasil uji kemurnian senyawa meliputi: Hasil uji titik leleh, hasil KCKT dan hasil KLT 2 dimensi. 4.7.1 Hasil Uji Titik Leleh (Melting Point) Pengujian titik leleh bertujuan untuk mengetahui kemurnian senyawa berdasarkan titik leleh senyawa uji. Senyawa dikatakan murni apabila memiliki titik leleh dengan rentang ±20C. Hasil pengujian titik leleh dari senyawa fraksi F2.D menunjukkan jarak leleh antara 132-1340C. Dari hasil tersebut diketahui bahwa jarak antara titik awal senyawa tersebut meleleh hingga meleleh sempurna adalah 20C, sehingga dapat diindikasikan bahwa senyawa dari fraksi F2.D telah murni. 4.7.2 Hasil KCKT Pengujian kemurnian senyawa selanjutnya menggunakan KCKT. KCKT dipilih karena memiliki beberapa kelebihan, diantaranya memiliki sensitivitas yang tinggi, kemampuan pemisahan yang cepat, teknik dengan resolusi tinggi dan efisien. KCKT akan memberikan puncak tunggal apabila senyawa yang di analisa telah murni. Dari hasil pengujian kemurnian senyawa fraksi F2.D dengan KCKT, menunjukkan puncak tunggal pada waktu retensi 5,672 menit. Hasil ini mengindikasikan bahwa senyawa dari fraksi F2.D telah murni (lampiran 5). 4.7.3 Hasil KLT 2 Dimensi KLT dua dimensi digunakan untuk menguji kemurnian suatu senyawa dilihat dari bercak yang dihasilkan dengan kromatografi secara dua arah. Senyawa dikatakan murni apabila memiliki bercak tunggal setelah dilakukan pengujian dengan KLT dua dimensi. Hasil KLT dua dimensi dari senyawa fraksi F2.D menunjukkan bercak tunggal dengan nilai Rf 0,325, sehingga dapat diindikasikan bahwa senyawa dari fraksi F2.D telah murni. UIN SYARIF HIDAYATULLAH JAKARTA 47 Eluen n-heksana:etil asetat (8:2) Rf = 0,325 Eluen: n-heksana:etil asetat (8:2) Gambar 4.3. Hasil KLT 2 Dimensi Dari Senyawa Fraksi F2D, Dengan Penampak Bercak: Pereaksi Godyns 4.8 Penentuan Struktur Molekul Senyawa fraksi F2.D. Penentuan struktur molekul senyawa fraksi F2.D meliputi: Hasil UV-Visible, spketrofotometri infra merah dan hasil 1H-RMI. 4.8.1 Hasil UV-Visible UV-Visible digunakan untuk mengetahui karakteristik senyawa berdasarkan panjang gelombang maksimum yang dihasilkan. Panjang gelombang dari suatu senyawa tergantung dari senyawa yang dianalisa, alasannya karena syarat senyawa yang dapat dianalisa dengan UV-Visible adalah senyawa yang memiliki gugus kromofor atau senyawa tersebut memiliki warna. Senyawa yang memiliki gugus kromofor akan menghasilkan serapan dengan panjang gelombang pada daerah UV (200-400 nm), sementara senyawa yang memiliki warna akan menghasilkan serapan dengan panjang gelombang pada daerah tampak (visible) (400-800 nm). Dari hasil analisa senyawa dengan UV-Visible, senyawa dari fraksi F2.D menghasilkan serapan pada panjang gelombang 239 nm. Senyawa yang dianalisa UIN SYARIF HIDAYATULLAH JAKARTA 48 tersebut memiliki panjang gelombang pada daerah UV (200-400 nm), sehingga dapat diketahui bahwa senyawa tersebut memiliki gugus kromofor (Lampiran 6). 4.8.2 Hasil Spektrofotometri Infra Merah Infra merah digunakan dalam menetukan struktur molekul senyawa berdasarkan gugus fungsi dari senyawa yang dianalisa. Gugus fungsi suatu senyawa dapat diketahui dari spektrum yang dihasilkan oleh infra merah, karena setiap gugus fungsi memiliki karakteristik spektrum yang khas yang dihasilkan oleh infra merah. Hasil analisa infra merah dari senyawa fraksi F2.D, menunjukkan adanya serapan melebar dan kuat pada bilangan gelombang 3450-3426 cm-1, yang mengindikasikan adanya gugus OH. Selanjutnya terdapat serapan dengan intensitas kuat pada bilangan gelombang 2936-2867 cm-1 yang mengindikasikan adanya gugus CH alifatik, serapan dengan intensitas medium terlihat pada bilangan gelombang 1646 cm-1 yang mengindikasikan adanya gugus karbon dengan ikatan rangkap dua (alkena) C=C dalam struktur cincin heterosiklik (Lampiran 7). Gugus alkena dalam struktur cincin heterosiklik ini diketahui karena umumnya gugus fungsi alkena memiliki frekuensi serapan pada daerah 1640-1670 cm-1, sedangkan frekuensi serapan akan menurun apabila gugus alkena berada di dalam struktur cincin heterosiklik (Pavia, et al., 2001). Dari data spektrum infra merah dapat disimpulkan bahwa senyawa dari fraksi F2.D memiliki gugus fungsi OH, CH alifatik, dan adanya gugus alkena (C=C). 4.8.3 Hasil Resonansi Magnetik Inti Proton (1H-RMI) Analisa struktur dengan 1 H-RMI memungkinkan untuk mengetahui Kedudukan proton dalam suatu struktur molekul. Data yang dihasilkan dari 1 H-RMI berupa pergeseran kimia yang dapat dianggap sebagai ciri bagian tertentu dari suatu struktur molekul dan dapat membantu mengidentifikasi tiap gugus suatu senyawa. Dari data spektrum 1H-RMI, senyawa fraksi F2.D memiliki gugus fungsi yang khas antara lain, terdapat 6 gugus metil (CH3), pada nilai geseran kimia (0,6755 ppm, 0,8156 ppm, 0,8376 ppm, 0,8415 ppm, 0,9233 ppm, dan 1,0049 UIN SYARIF HIDAYATULLAH JAKARTA 49 ppm), pada geseran kimia 2,761 ppm (m) mengindikasikan adanya gugus metilen (CH2) yang berikatan dengan gugus alkena (C=C-CH2), pada geseran kimia 3,5148 ppm (m) mengindikasikan adanya gugus metin (CH) yang berikatan dengan gugus OH (CH-OH) dan pada geseran kimia 5,3525 ppm (m) mengindikasikan adanya satu sinyal proton yang berikatan dengan gugus alkena (C=CH) (Lampiran 8-13). Tabel 4.4. Data Geseran Kimia Proton Senyawa Fraksi F2.D Yang Diukur Pada Frekuensi 500 MHz Dengan Pelarut CDCl3 δH Gugus Fungsi 0,6755 ppm, (s) 3H (CH3) 0,8156 ppm, (m) 3H (CH3) 0,8376 ppm (m) 3H (CH3) 0,8415 ppm, (m) 3H (CH3) 0,9232 ppm, (d) 3H (CH3) 1,0049 ppm, (s) 3H (CH3) 2,761 ppm, (m) 2H (C=C-CH2) 3,5148 ppm, (m) (CH-OH) 5,3525 ppm, (m) 1H (C=CH) Dari hasil analisa instrumen di atas, senyawa F2.D memiliki kesamaan struktur dengan senyawa golongan triterpenoid yaitu β-sitosterol. Dari data infra merah, senyawa F2.D menunjukkan adanya karakteristik spektrum yang sesuai dengan spektrum β-sitosterol. β-sitosterol sendiri memiliki spektrum yang khas UIN SYARIF HIDAYATULLAH JAKARTA 50 pada infra merah dengan adanya gugus OH pada bilangan gelombang 3373,6 cm-1, kemudian adanya gugus CH alifatik pada bilangan gelombang 2936 cm-1 sampai 2867 cm-1, adanya gugus alkena (C=C) pada bilangan gelombang 1641 cm-1 dan adanya gugus CH2 pada bilangan gelombang 1457 cm-1 (Kamboj, et al., 2011; Sen, et al., 2012). Tabel 4.5. Perbandingan Data Serapan Gugus Fungsi Senyawa Fraksi F2.D Dengan Senyawa β-sitosterol. β-sitosterol Senyawa Fraksi F2.D Gugus Fungsi 3425 cm-1 3446 cm-1 2936-2876 cm-I 2936-2876 cm-1 1641 cm-1 1646 cm-1 C=C 1457 cm-1 1457 cm-1 CH2 Selanjutnya dari data yang OH diperoleh CH Alifatik 1 H-RMI, senyawa F2.D menunjukkan adanya gugus fungsi yang mirip dengan gugus fungsi yang dimiliki β-sitosterol. Dari data 1H-RMI diketahui bahwa senyawa F2.D memiliki 6 gugus metil yang mana merupakan ciri dari senyawa β-sitosterol. β-sitosterol memiliki ciri spektrum yang khas, yaitu 6 gugus metil yang terdapat pada nilai geseran kimia (0,68 ppm (s); 0,81 ppm (m); 0,83 ppm (m), 0,84 ppm (m); 0,92 ppm (d); 1,01 ppm (s). Selanjutnya pada geresan kimia 3,50 ppm (m) terdapat gugus metin (CH) yang berikatan dengan gugus OH (CH-OH) pada karbon ke 3, dan pada geseran kimia 5,35 ppm (m) terdapat satu proton yang berikatan dengan gugus alkena (C=CH) pada atom karbon ke 6 (Hisham, et al., 2012). UIN SYARIF HIDAYATULLAH JAKARTA 51 Tabel 4.6. Perbandingan Data Geseran Kimia Proton Senyawa Fraksi F2.D Dengan β-sitoterol (Sosińka, et al., 2013) δH β-sitosterol Senyawa F2.D Gugus Fungsi 0,68 ppm (s) 0,6775 ppm (s) 3H (CH3) 0,81 ppm (d) 0,815 ppm (d) 3H (CH3) 0,83 ppm (d) 0,841 ppm (d) 3H (CH3) 0,85 ppm (t) 0,855 ppm (t) 3H (CH3) 0,92 ppm (d) 0,923 ppm (d) 3H (CH3) 1,01 ppm (s) 1,004 ppm (s) 3H (CH3) 0,93 ppm (m) 0,934 ppm (m) 1H (CH) 0,93 ppm (m) 0,941 ppm (m) 1H (CH) 1,02 ppm (m) 1,024 ppm (m) 1H (CH) 1,09 ppm (m) 1,098 ppm (m) 2H (CH2) 1,11 ppm (m) 1,108 ppm (m) 1H (CH) 1,16 ppm (m) 1,163 ppm (m) 2H (CH2) 1,20 ppm (m) 1,202 ppm (m) 2H (CH2) 1,25 ppm (m) 1,248 ppm (m) 2H (CH2) 1,26 ppm (m) 1,274 ppm (m) 2H (CH2) 1,34 ppm (m) 1,346 ppm (m) 2H (CH2) 1,35 ppm (m) 1,361 ppm (m) 1H (CH) 1,44 ppm (m) 1,375 ppm (m) 2H (CH2) 1,45 ppm (m) 1,456 ppm (m) 1H (CH) 1,48 ppm (m) 1,486 ppm (m) 2H (CH2) 1,51 ppm (m) 1,51 ppm (m) 2H (CH2) 1,57 ppm (m) 1,579 ppm (m) 2H (CH2) 1,66 ppm (m) 1,561 ppm (m) 1H (CH) 2,23 ppm (m) 2,34 ppm (m) 2H (CH2) 3,51 ppm (d) 3,514 ppm (d) (CH-OH) 5,35 ppm (d) 5,352 ppm (d) 1H (CH) UIN SYARIF HIDAYATULLAH JAKARTA 52 Kesamaan struktur ini juga diperkuat dengan data lainnya, yaitu data uji titik leleh. Senyawa F2.D memiliki titik leleh dengan rentang 132-1340C. Berdasarkan pustaka, sebelumya telah dilaporkan bahwa titik leleh β-sitosterol adalah 1330C (Woldeyes, et al., 2012) Dari data di atas dapat diperkirakan bahwa senyawa F2.D adalah senyawa β-sitosterol. β-sitosterol merupakan senyawa golongan triterpenoid yang memiliki struktur utama yaitu siklopentana perhidrofenantren dengan rumus molekul C29H50O. Senyawa ini secara alamiah terdapat dalam tumbuhan. Berdasarkan struktur molekul, senyawa β-sitosterol memiliki 6 gugus metil (CH3), 11 gugus metilen (CH2), 9 gugus metin (CH), dan adanya satu gugus hidroksil (OH) yang berperan dalam memberikan aktivitas antioksidan. Berdasarkan pustaka, β-sitosterol memiliki beberapa aktivitas biologis diantaranya sebagai analgesik, antiinflamasi, antidiabetes dan antikanker. β-sitosterol juga memiliki aktivitas antioksidan dengan nilai IC50 389,5 µM (Baskar, et al., 2010). Gambar 4.4. Struktur Molekul β-sitosterol UIN SYARIF HIDAYATULLAH JAKARTA BAB 5 KESIMPULAN 5.1 Kesimpulan Senyawa fraksi F2.D yang diperoleh dari ekstrak etil asetat tumbuhan paku Nephrolepis falcata (Cav.) C. Chr diperkirakan adalah senyawa β-sitosterol. Ini diketahui berdasarkan data infra merah yang menunjukkan adanya gugus fungsi utama yaitu gugus OH, CH alifatik dan gugus alkena (C=C) yang merupakan ciri khas dari struktur senyawa β-sitosterol. Ini diperkuat dengan adanya data 1H-RMI, yang menunjukkan adanya gugus yang khas antara lain, adanya 6 gugus metil (CH3), gugus metilen yang berikatan dengan ikatan rangkap karbon (C=C˗CH2), gugus metin yang berikatan dengan gugus hidroksil (CH-OH) dan adanya satu proton yang berikatan dengan ikatan rangkap karbon (C=CH). Berdasarkan pustaka, senyawa fraksi F2.D memiliki gugus fungsi yang identik dengan senyawa β-sitosterol, sehingga dapat diduga bahwa senyawa fraksi F2.D adalah senyawa β-sitosterol. 5.2 Saran 1. Perlu adanya data lebih lanjut mengenai penentuan struktur dari senyawa fraksi F2D, yang meliputi data 13 C-RMI dan RMI dua dimensi (HMBC, HMQC dan NOESY) sebagai data pendukung dari struktur senyawa F2D. 2. Perlu dilakukan uji aktivitas antioksidan secara kuantitatif dari senyawa F2D untuk mengetahui seberapa kuat aktivitas antioksidan dari senyawa tersebut. 3. Perlu adanya penelitian lebih lanjut mengenai isolasi antioksidan dari tanaman ini. Karena diketahui masih banyak senyawa antioksidan yang belum dapat diidentifikasi pada penelitian ini. 4. Perlu juga dilakukan penelitian mengenai aktivitas farmakologi terhadap tanaman ini, karena telah diketahui bahwa tanaman ini mengandung senyawa yang berkhasiat sebagai obat. 53 UIN SYARIF HIDAYATULLAH JAKARTA 45 DAFTAR PUSTAKA Aderogba, A, M. Kgatle, T, D. McGaw, J, L. Eloff, N, J. 2011. Isolation of Antioxidant Constituents from Combretum apiculatum subsp. Apiculatum. South African Journal of Botany 79. Adrianingsih, R. 2009. Penggunaan High Performance Liquid Chromatography (HPLC) Dalam Proses Analisa Ion. Berita Dirgantara Vol.10 No.4. Allen RG, Tressini M. 2000.Oxidative Stress and Gene Regulation. Free Radical Biol Med 463-99. Al-Mutairi, K, S. Al-jasser, S, M. 2012. Effect of Using Rotary Evaporator on Date Dibs Quality.Journal of American Science 2012. Andlauer, W. and P. Furst. 1998. Antioxidative Power of Phytochemicals With Special Reference to Cereals. General Mills, Inc., Minneapolis, Minnesota. Badami, S., Gupta, M.K., Suresh, B., 2003. Antioxidant Activity of the Ethanolic Extract of Striga Orobanchioides. Journal of Ethnopharmacology 2852, Baskar, A, A. Ignacimuthu, S. Paulraj, M, G. Numair, A, S, K. 2010. Chemopreventive Potential of β-sitosterol In Experimental Colon Cancer Model–An in Vitro and in Vitro Study. BMC Complementary and Alternative Medicine, 10:24 Basma, A. A., Zakaria, Z., Latha, Y, L., Sasidharan, S. 2011. Antioxidant Activity and Phytochemical Screening of the Methanol Extract of Euphorbia hirta L. Aisan Pasific Journal of Tropical Medicine. Benjamin A. Manickan V.S. 2007. Medicinal Pterodophyta from Western Ghat. Indian Journal of Traditional Knowledge. Blois, M. S,. 1958. Antioxidant Determination By The Use of a Stable Free Radical, Nature. 181: 1199-1200. Boveris, A.D., Galatro, A., Sambrotta, L., Ricco, R., Gurni, A.A., Puntarulo, S., 2001. Antioxidant Capacity of a 3-deoxyanthocyanidin from Soybean. Phytochemistry 58, 1097–1105. 54 UIN SYARIF HIDAYATULLAH JAKARTA 55 Brain, K, R. Turner, T, B. 1975. The Practical Evaluation of Phytopharmaceutical. Wrights Sciencetechnia. Bristol. Bruneton, J., (1999). Pharmacognosy, Phytochemistry and Medicinal Plants. Intercept. Ltd. England, U.K. Daintith, J. 1994. Kamus Lengkap Kimia. Jakarta: Penerbit Erlangga. Day,R. A., dan Underwood, A. L., 1999, Analisis Kimia Kuantitatif (Penerjemah Aloysius Hadyana Pudjaatmaka, Ph.D.), Penerbit Erlangga, Jakarta, hal: 491. Dayanti, R. Suyatno. 2012. Aktivitas Antioksidan Ekstrak Metanol Bagian BatangTumbuhan Paku Nephrolepis radicans (burm.) kuhn.UNESA Journal of Chemistry Vol.1, No. 1. Ditjen POM. 2000. Parameter Standar Umum Ekstrak Tumbuhan Obat. Jakarta: Departemen Kesehatan RI. Droge W. 2002.Free Radicals in the Physiological Control of Cell Function. Physiol Rev:47-95. Dudani, S. Chandran, S, M, D. Ramachandra, T, V. 2012. Pteridophytes of Western Ghats. Energy & Wetland Research group, Center of Ecological Sciences, Indian Institute of Science, Bangalore – 50 012 Fathima, M. Shantha, N. Rajagovindan, P, N. 2005. Botany, Higher SecondaryFirst Year, Volume 1. Tamilnadu Texbook Coorporation. Gandjar, I, G. Rohman, A. 2007. Kimia Farmasi Analisis. Yogyakarta: Pustaka Pelajar, Hal: 353-367. Gocan, s. 2002. Stationary Phases for Thin-Layer Chromatography. Journal of Chromatographic Science, Vol. 40. Goldberg, G. 2003. Plants: Diet and Health. I Owa State Press, Blackwell Publishing Company, 2121 State Avenue, Ames, USA. Gordon, M. H. 1990. The Mechanism of Antioxidant Action in vitro. Di dalam : Hudson, B. J. F. (ed). Food Antioxidants. Elsevier Applied Science, London. UIN SYARIF HIDAYATULLAH JAKARTA 56 Gritter, R, J; Bobbit, M, J; Schwarting, E, A. Introduction to Chromatography (Pengantar Kromatografi), Edisi Kedua. Penerjemah kosasih Padmawinata. Bandung: Penerbit ITB. Hanja. Sharma R. 2012.Assessment of Antibacterial Properties of the fern Nephrolepis tuberosa. International jornal pf Biology, Pharmacy and Allied Sciences. Harborne, J.B. 1987. Metode Fitokimia: Penuntun Cara Modern Menganalisis Tumbuhan. Penerjemah: Kosasih P., Soediro Iwang. Bandung: Penerbit ITB. Heinrich, M. Barnes, J. Gibbons, S. Williansom, M, E. Fundamental of Pharmacognosy and Phytotherapy. Philadelpia: Penerbit Elsevier. Hisham, N, M, D. Lip, M, J. Suri, R. Shafit M, H. Kharis, Z. Shazlin, K. Normah, A. Nabilah, N, F, M. 2012. Argowaste: Phytosterol from Durian Seed. World Academy of Science, Engineering and Technology. Hostettman, K; Hostettman, M; Maerston. 1995. Preparative Chromatography Technique:Application in Natural Product Isolation. Cara Kromatografi preparatif: Penggunaan Pada Isolasi Senyawa Alam (diterjemahkan Oleh Kosasih P) Bandung: Penerbit ITB. Isnindar. Wahyuono, S. Setyowati, P, E. 2011. Isolasi dan Identifikasi Senyawa Antioksidan Daun Kesemek (diospyros kaki thunb.) Dengan Metode dpph (2,2-Difenil-1- Pikrilhidrazil). Majalah Obat Tradisional, 16(3). Ja, K., Sharma R. , 2012. Assesment of Antibacterial Properties of the Ferns Nephrolepis tuberosa. IJBPAS, November, 2012, 1(10): 1524-1529 Kamboj, A. Saluja, K, A. 2010. Isolation of Stigmasterol and β-sitosterol from Petroleum Ether Extract of Aerial Parts of Ageratum Conyzoides (Asteraceae). International Journal of Pharmaceutical Sciences. Vol 3, issue 2011. Khopkar, S, M. 2003. Konsep Dasar Kimia Analitik. Jakarta: UI Press. Komala, I. 2012.Laporan Penelitian Individu. uji aktivitas antioksidan tumbuhan paku Indonesia.Program Studi Farmasi, Universitas Islam Negeri Syarif Hidayatullah. Jakarta. UIN SYARIF HIDAYATULLAH JAKARTA 57 Kumari, K. P. S., Sridevil. V., Lakshmi. C. V. V. M. 2012. Studies on Phytochemical Screening of Aqueousextract Collected from Fertilizers Affected Two Medicinal Plants. Journal of Chemical, Biological and Physical Sciences. Vol.2.No.3, 1326-1332. Lai, Y, H. Lim Y, Y. 2011. Evaluation of Antioxidant Activities of the Methanolic Extracts of Selected Ferns in Malaysia. International Journal of Environmental Science and Development, Vol. 2, No. 6. Lee, Y, J. Yon, W, J. Kim, T, C. Lim, T, S. 2004. Antioxidant Activity of Phenylpropanoid Esters Isolated and Identified from Platycodon grandiflorum A. DC. Journal Phytochemistry. Elsevier. Lu, Y., Foo, Y., 2001. Antioxidant activities polyphenols from sage (Salvia officinalis). Food Chemistry 75,Badami, S., Gupta, M.K., Suresh, B., 2003. Antioxidant activity of theethanolic extract of Striga orobanchioides. Journal of Ethnopharmacology2852, di dalam, Lee, Y, J. Yon, W, J. Kim, T, C. Lim, T, S. 2004. Antioxidant activity of Phenylpropanoid Esters Isolated and Identified from Platycodon grandiflorum A. DC. Journal Phytochemistry. Elsevier. McNair, M, H; Miller, M, J. 1998. Basic Gas Chromatography. New York: John Wiley & Son. Miller, H. E., F. Rigelholf, L. Marquart, A. Prakash, M. Kanter. 2000. Antioxidant Content of Whole Grain Breakfast Cereals, Fruits and Vegetables. Journal of The American College of Nutrition. Vol. 19. No. 3. Molyneux, P., 2004, The Use of DPPH to Estimate Antioxidant Activity, J.Sci. Tecnol, 26 (2) Muchtadi, D. 2000. Sayur-sayuran Sumber Serat dan Antioksidan: MencegahPenyakit Degeneratif. Jurusan Teknologi Pangan dan Gizi, Fakultas Teknologi Pertanian, Institut Pertanian Bogor, Bogor. Ncube NS, Afolayan AJ, Okoh AI. Assessment Techniques of Antimicrobial Properties of Natural Compounds of Plant Origin: Current Methods and Future Trends. African Journal of Biotechnology 2008; 7 (12): Nugroho, B. W., Dadang, & Prijono, D. ńλλλ. “Pengembangan dan Pemanfaatan Insektisida Alami”. Pusat Kajian Pengendalian Hama Terpadu, IPB. Bogor.. UIN SYARIF HIDAYATULLAH JAKARTA 58 Pavia, l, D. Lampman, M, G. Kriz, S, G. 2001. Introduction To Spectroscopy, Third Edition. Departement of Chemistry Western Washington University Bellingham, Washington. Pers., 2010. Lokakarya Nasional Tanaman Obat Indonesia. Pusat Informasi Kehutanan Republik Indonesia. Pooja. 2004. Pterrdophyta Discovery Publishing House. India: di dalam, Komala, I. 2012. Uji Aktivitas Tumbuhan Paku Indonesia. Program Studi Farmasi. Universitas Islam Negeri Syarif Hidayatullah Jakarta. Prakash, A. Rigelhof, F. Miller, E. 2001. Activity Antioxidant. Medallion Laboratories. Proctor PH, Reynolds ES. 1984. Free Radicals and Diseas In Man. Physiol Chem Phys Med:175-95. Rashid, A. Qureshi, Z, M. Raza, A, S. William, J. Arsyad, M. Quantitative Determination of Antioxidant Potential of Artemisia Persica. Analele Universită ii din Bucuresti–Chimie (serie nouă), vol ńλ no. ń. Rates, K, M, S. 2001.Plants As Source Of Drugs. Toxicon 39. Rosenthal GA, 1991. The Biochemical Basis For the Deleterious Effects of L Canavanine. Phytochemistry: di dalam, M, Mazid., TA, Khan., F, Muhammad. 2011. Role of Secondary Metabolites in Defense Mechanisms Of Plants. Biology and Medicine, 3 (2) Special Issue: Sarker, D, S. Latif, Z. Gray, I, A. 2006. Natural Product Isolation. Second Edition. Humana Press. Totowa, New Jersey. Sastrohamidjojo, H., 2005, Kromatografi. Penerbit Liberty Yogyakarta, Yogyakarta. Schafer H, Wink M, 2009. Medicinally Important Secondary Metabolites in Recombinant Microorganisms or Plants: Progress in Alkaloid Biosynthesis. Biotechnology Journal. Sen, A. Dhavan, P. Shulka, K, K. Singh, S. Tejovathi, G. 2012. Analysis of IR, NMR and Antimicrobial Activity of β-sitosterol Isolated from Momordica charantia. Science Secure Journal of Biotechnology, Volume 1, Issue 1. Siems, K., Weigt F. Wollenweber. E. 1996. Dimarines from the Epicuticular Wax of the Fern Nephrolepis biserrata. Phytochemistry 41. UIN SYARIF HIDAYATULLAH JAKARTA 59 Simanjuntak, P., T. Parwati, L. E. Lenny, S. Tamat, R. Murwani. 2004. Isolasi dan Identifikasi Senyawa Antioksidan dari Ekstrak Benalu Teh, Scurrula oortiana (Korth) Danser (Loranthaceae). Jurnal Ilmu Kefarmasian Indonesia ISSN 1693-1831, Vol. 2 No. 1. Soeder, R, W. 1985. Fern Constituens: Including Occurrence, Chemotaxonomy and Physiological Activity. The Botanical Riview 51 (4), 442-536. Soesilo, Slamet, Drs. 1995. Farmakope Indonesia, Edisi IV. Jakarta: Departemen kesehatan Republik Indonesia. Sosińska, E. Przybylski, R. Hazendonk, P. Zhao, Y, Y. Curtis, M, J. 20ń3. Characterisation of Non Polar Dimers Formed During Thermo Oxidative Degradation of β-sitosterol. Food Chemistry. 464-474 Stahl, E. 1985. Analisis Obat Secara Kromatografi dan Mikroskopi. Penerjemah : Kosasih Padmawinata. Bandung: Penerbit ITB. Sudjadi, M,S., 1985. Penentuan Struktur Senyawa Organik. Penerbit Ghalia, Indonesia, Jakarta. Sumarno, 2001, Kromatografi Teori Dasar, Bagian Kimia Farmasi Fakultas Farmasi Universitas Gadjah Mada, Yogyakarta. Supari, F. 1996. Radikal Bebas dan Patofisiologi Beberapa Penyakit. ProsidingSeminar Senyawa Radikal dan Sistem Pangan: Reaksi Biomolekuler, Dampak Terhadap Kesehatan dan Penangkalan. Kerjasama Pusat StudiPangan dan Gizi-IPB dengan Kedutaan Besar Prancis, Bogor. Surai, P. F. 2003. Natural Antioxidant in Avian Nutrition and Reproduction. Bookcraft, Bath, England. Tiwari, P. Kumar, B. Kaur, M. Kaur, G. Kaur, H. 2011. Phytochemical Screening and Extraction: A Review. Internationale Pharmaceutica Sciencia. Vol. 1. Issue. 1. Townshend, A. 1995. Encyclopedia of Analytical Science, Vol. 2. London: Academic Press Inc. Verpoorte, R. Kim, K, H. Choi, Y, H. 2006. Plants As Source of Medicines. Amsterdam. UIN SYARIF HIDAYATULLAH JAKARTA 60 Waller, R, G. Mangiafico, S. Richey, R, C. 1978. A Chemical Investigation of Aloe barbadensis Miller.Department of Biochemistry, Oklahoma Agricultural Experimental Station, Oklahoma State University, Stillwater, Oklahoma Wang, S. Y., Y. H. Kuo, H. N. Chang, P. L. Kang, H. S. Tsay, K. F. Lin, N. S.Yang, L. F. Shyur. 2002. Profiling and Characterization Antioxidant Activities in Anoectochilus formosanus Hayata. Journal of. Agricultural and. Food Chemistry. 50.1859-1865. Watson, D, G. 2009. Analisis Farmasi : buku ajar untuk mahasiswa farmasi dan praktisi kimi farmasi. Penerjemah: Winny R. Syarief, Edisi kedua. Jakarta: EGC. Woldeyes, S. Adane, L. Triku, Y. Muleta, D. Begashaw, T. 2012. Evaluation of Antibacterial Activities of Compounds Isolated from Sida rhombifolia Linn. (Malvaceae). Natural Products Chemistry & Research.Department of Chemistry, Jimma University, Jimma, Ethiopia UIN SYARIF HIDAYATULLAH JAKARTA 61 Lampiran 1. Hasil Determinasi Tumbuhan Paku Nephrolepis falcata (Cav.) C. Chr. UIN SYARIF HIDAYATULLAH JAKARTA 62 Lampiran 2. Bagan Alur Ekstraksi Tumbuhan Paku Nephrolepis falcata Sampel daun segar Nephrolepis falcata (10,1 kg) Disortasi Dicuci Dikeringkan Dihaluskan Serbuk kering daun Nephrolepis falcata (1,256 kg) Maserasi dengan 4,5 liter n-heksana Disaring Dievaporasi Ekstrak n-heksana (20 gram) Uji pola KLT dan uji kualitatif aktivitas antioksidan dengan DPPH Ekstrak etil asetat (40 gram) Ampas Remaserasi dengan 4,5 liter etil asetat Disaring Dievaporasi Ampas Uji pola KLT dan uji kualitatif aktivitas antioksidan dengan DPPH UIN SYARIF HIDAYATULLAH JAKARTA 63 LAMPIRAN 3 Uji Kromatografi Lapis Tipis Ekstrak Etil Asetat dan n-Heksana Nephrolepis falcata. A B A A B B Keterangan: Gambar A: Kromatografi lapis tipis (A) ekstrak etil asetat, (B) ekstrak n-heksana, fase gerak n-heksana:etil asetat dengan perbandingan 6:4. Gambar B: Kromatografi lapis tipis (A) ekstrak etil asetat, (B) ekstrak n-heksana, fase gerak n-heksana:etil asetat dengan perbandingan 8:2 UIN SYARIF HIDAYATULLAH JAKARTA 64 Lampiran 4. Bagan Isolasi Senyawa Aktif Antioksidan Tumbuhan Paku Nephrolepis falcata Ekstrak etil asetat 32 gram, dipreadsorbsi dengan 15 gram silika gel Kromatografi kolom I Silika gel 250 gram Fase gerak n-heksana:etil asetat Total 206 fraksi F1.A (14) F1.E (53-67) F1.C (26-34) . F1.B (15-25) F1.D (35-52) F1.G (76-97) F1.F (68-75) F1.K (185-188) F1.I (114-132) F1.H (98-113) F1.J (133-184) F1.L (189-206) Uji aktivitas antioksidan dengan DPPH F1.A (14) Kromatografi kolom II Silika gel 40 gram Fase gerak n-heksana:etil asetat Total 128 fraksi F2.A (46-50) (Kristal, 5 mg) F2.B (51-52) F2.C (56-70) F2.D (71-90) (Kristal, 20 mg F2.E (91-98) F1.F (99-128) UIN SYARIF HIDAYATULLAH JAKARTA 65 LANJUTAN ISOLASI SENYAWA ANTIOKSIDAN F2.A (46-50) (kristal, 5mg) F2.C (56-70) F2.B (51-52) F2.D (71-90) (kristal, 20 mg) F2.E (91-98) F1.F (99-128) Uji aktivitas antioksidan dengan DPPH F2.A (46-50) Kromatografi kolom III Silika gel 10 gram Fase gerak n-heksana:etil asetat Total 196 fraksi F3.A (30-47) F3.B (48-61) F3.C (62-77) F3.D (78-93) F3.E (93-110) Uji aktivitas antioksidan dengan DPPH F3.C (kristal, 80 mg) UIN SYARIF HIDAYATULLAH JAKARTA 66 LANJUTAN ISOLASI SENYAWA ANTIOKSIDAN F2.D (kristal, 20 mg) F2.A (kristal, 5 mg) F3 (kristal, 80 mg) Pemurnian senyawa Uji aktivitas antioksidan dengan DPPH F2.D (kristal, 20 mg) Uji kemurnian KLT 2D KCKT Titik leleh Penentuan struktur molekul IR UV-Vis 1 H-RMI UIN SYARIF HIDAYATULLAH JAKARTA 67 Lampiran.5. Hasil analisis senyawa fraksi F2.D dengan KCKT UIN SYARIF HIDAYATULLAH JAKARTA 68 Lampiran 6. Hasil analisis senyawa fraksi F2.D dengan UV-Visible max = 23λ.0 nm UIN SYARIF HIDAYATULLAH JAKARTA 69 Lampiran7. Hasil spektrum IR senyawa fraksi F2.D UIN SYARIF HIDAYATULLAH JAKARTA 70 Lampiran 8. Hasil spektrum 1H-RMI senyawa Fraksi F2.D UIN SYARIF HIDAYATULLAH JAKARTA 71 Lampiran 9. Hasil Spektrum 1H-RMI Senyawa F2.D (Diperbesar) UIN SYARIF HIDAYATULLAH JAKARTA 72 Lampiran 10. Hasil spektrum 1H-RMI senyawa fraksi F2.D (Diperbesar) UIN SYARIF HIDAYATULLAH JAKARTA 73 Lampiran 11. Hasil spektrum 1H-RMI senyawa fraksi F2.D (Diperbesar) UIN SYARIF HIDAYATULLAH JAKARTA 74 Lampiran 12. Hasil Spektrum 1H-RMI Senyawa Fraksi F2.D (Diperbesar) UIN SYARIF HIDAYATULLAH JAKARTA 75 Lampiran 13. Hasil spektrum 1H-RMI senyawa fraksi F2.D (Diperbesar) UIN SYARIF HIDAYATULLAH JAKARTA 76 Lampiran 14. Hasil Spektrum 1H-RMI Senyawa Fraksi F2.D (Diperbesar) UIN SYARIF HIDAYATULLAH JAKARTA 77 Lampiran 15. Spektrum 1H-RMI Senyawa β-Sitosterol (Hisham, et al., 2012) UIN SYARIF HIDAYATULLAH JAKARTA