RINGKASAN Kimia Anorganik - Teknik Kimia UNDIP
advertisement

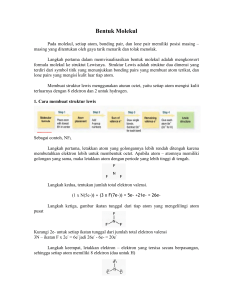
RINGKASAN Kimia Anorganik Materi: BAB 10 - BENTUK-BENTUK MOLEKUL Pengampu: Dr. Istadi, ST., MT. Disusun oleh: Nama NIM Jurusan Hari Kuliah : Bramantya Brian Suwignjo : 21030112140169 : S-1 Teknik Kimia (Kelas B) : Selasa UNIVERSITAS DIPONEGORO SEMARANG BENTUK-BENTUK MOLEKUL A. PENGGAMBARAN MOLEKUL DAN ION DENGAN STRUKTUR LEWIS Langkah awal penggambaran dengan cara mengubah rumus molekulnya menjadi struktur Lewis (atau rumus Lewis), dengan dilambangkan titik (dot) yang menggambarkan elektron-elektron yang mengelilingi suatu atom, baik itu elektron-elektron yang saling berikatan (PEI/Pasangan Elektron Ikatan) maupun elektron-elektron yang tidak berikatan (PEB/Pasangan Elektron Bebas). Dalam hal ini terdapat aturan-aturan yaitu kaidah oktet (dan duplet untuk hidrogen). PENGGUNAAN KAIDAH OKTET DALAM STRUKTUR LEWIS Struktur Lewis untuk molekul Ikatan Tunggal Langkah-langkah mengubah rumus molekul menjadi struktur Lewis: Penjelasan langkah-langkah tersebut secara jelas: 1. Letakkan atom yang satu berhubungan dengan yang lain. Untuk senyawa dengan rumus ABn, letakkan atom dengan golongan lebih kecil di tengah karena lebih banyak menerima elektron, dan juga atom dengan elektronegatif (EN) rendah. Contoh: NF3, N (gol. 5A, EN=3) menerima 3 e-, F (gol. 7A, EN=4) menerima 1 e-, maka N berada di tengah dikelilingi 3 atom F. Untuk pasangan atom bergolongan sama, letakkan atom dengan periode lebih besar di tengah. H tidak pernah sebagai atom pusat. 2. Tentukan total elektron valensi yang ada. Untuk molekul, jumlahkan elektron valensi semua atom (gol. A). Untuk NF3: (N=5 e val. F=7 e val.) Untuk ion poliatomik, tambahkan 1 e- untuk setiap muatan negatif ion, atau kurangi 1 e- untuk setiap muatan positif. 3. Gambarkan ikatan tunggal antara tiap atom ikatan (surrounding atom) dan atom pusat, dan kurangi 2 elektron valensi untuk tiap ikatan. (Paling sedikit 1 ikatan di antara dua atom yang berikatan) Kurangkan 2e- untuk tiap ikatan terhadap jumlah elektron valensi. 4. Sebarkan remaining electrons tersebut secara berpasangan agar tiap atom memiliki 8 elektron (atau 2 untuk H). Pertama tempatkan PEB pada atom ikatans (EN lebih besar). Jika ada sisa, baru tempatkan di atom pusat. Masing-masing atom harus mematuhi kaidah oktet. Struktur Lewis yang dapat dibentuk: Selalu dicek total elektron (PEI+PEB) = jumlah elektron valensi. Namun, bentuk struktur Lewis yang sebenarnya: 1 Hal-hal yang perlu diingat untuk jumlah ikatan: H : 1 ~ F, Cl, Br, I: 1 F selalu atom ikatan. C : 4 N : 3 O : 2 Contoh lain: CCl2F2 Langkah: 1. C punya golongan dan EN terkecil atom pusat 2. C (4A), Cl (7A), F (7A): 3. Buat ikatan tunggal dan kurangi 2 e- untuk tiap ikatan. 4 ikatan 8 e- maka 32 e- - 8 e- = 24 e- remaining 4. Distribusikan remaining elektron secara berpasangan Hydroxylamine (NH3O) (> 1 atom pusat) Langkah: 1. Menempatkan atom satu sama lain. H hanya 1 ikatan, maka N dan O dapat langsung berikatan. N ada 3 ikatan, O ada 2 ikatan, maka terbentuk susunan seperti: H H N O H 2. Jumlah elektron valensi: [1 x N(5e-)] + [1 x O(6e-)] + [3 x H(e-)] = 14 e3. Tambahkan ikatan tunggal masing-masing atom dan kurangkan 2e- untuk masing-masing ikatan. H | H- N-O-H 4 ikatan 8 e- 14 e- - 8 e- = 6 e- remaining 4. Tambahkan remaining elektron secara berpasangan. H | ** H- N-O-H ** ** Struktur Lewis dengan > 1 Ikatan Setelah empat langkah di atas tidak cukup elektron pada atom pusat untuk kaidah oktet karena adanya ikatan rangkap. Langkah berikut: 5. Mengubah satu PEB menjadi PEI pada atom pusat. Contoh 1: C2H4 Setelah keempat langkah tersebut struktur menjadi: C pada sebelah kanan memiliki oktet, tetapi C sebelah kiri hanya 6e-, maka dengan langkah 5: Contoh 2: N2 2 RESONANSI: PASANGAN ELEKTRON IKATAN YANG TERDELOKALISASI Ozone (O3) Kita sering menuliskan lebih dari satu struktur Lewis, masing-masing memiliki penempatan relatif atom yang sama, untuk molekul atau ion yang punya ikatan rangkap di samping ikatan tunggal. Contoh: ozone (O3) (hanya beda penulisan struktur Lewis) Struktur resonansi memiliki letak atom relatif sama tetapi lokasi berbeda dari PEI maupun PEB. Ditandai 2 struktur Lewis dengan panah resonansi (↔) di antaranya. Dapat mengubah satu bentuk resonansi ke bentuk lain dengan menggerakkan PEB pada posisi ikatan. Struktur resonansi bukanlah penggambaran nyata suatu ikatan: tidak secara langsung berubah dari I ke II atau sebaliknya. Molekul nyata adalah hibrida resonansi, rata-rata dari bentuk resonansi. Pada O3 terdapat 2 ikatan, PEI (pasangan elektron terlokalisasi) dan ikatan parsial (kontribusi salah satu pasangan elektron terdelokalisasi). Delokalisasi elektron mendifusikan densitas elektron yang melampai volume resonansi yang mengurangi tolakmenolak elektron untuk menstabilkan molekul. Sangat umum dan banyak molekul atau ion yang dapat digambarkan sebagai hibrida resonansi. Contoh lain: Benzena (C6H6) memiliki 2 bentuk resonansi penting yang pemilihan ikatan tunggal maupun rangkap memiliki posisi berbeda. (Sering dituliskan dalam bentuk titik-titik lingkaran kecil atau lingkaran kecil biasa.) Ikatan sebagian/parsial, seperti yang terjadi pada hybrida resonansi, yang menjurus kepada fractional bond orders. Untuk O3: Catatan: Struktur Lewis pada ion poliatomik dituliskan dengan tanda kurung kotak, dengan muatan di-superscript di bagian kanan atas luar dari tanda kurung kotak. NO33 Ingat untuk menambahkan 1e- pada jumlah elektron valensi karena bermuatan 1-. Setelah Langkah 1 – 4: Langkah 5: Karena N punya 6e- maka ubahlah satu PEB O untuk berikatan rangkap. Lalu resonansi dapat dibuat MUATAN FORMAL: MEMILIH STRUKTUR RESONANSI YANG LEBIH PENTING Cara memilih struktur resonansi yang lebih penting adalah menentukan muatan masingmasing atom, muatan yang dapat dimiliki jika PEI yang dimiliki tersebar merata. Contoh kasus O3. Muatan formal oksigen pada kedua resonansi: Muatan formal harus menjumlahkan muatan aktual dari tiap spesies: 0 untuk molekul dan muatan ionik untuk ion. Tiga kriteria untuk menentukan struktur resonansi yang lebih penting: Muatan formal lebih kecil (positif maupun negatif) didahulukan daripada muatan lebih besar. Muatan atom-atom berdekatan yang tidak 0 tidak diperhatikan Muatan negatif yang semakin besar menyebabkan semakin tinggal lama di atom yang lebih elektronegatif. Contoh: NCO-. Bentuk I kita eliminasi karena muatan O yang lebih EN daripada N, muatan bentuk II dan III hampir sama, namun bentuk III memiliki 1e- pada O (EN>>) sehingga bentuk III yang lebih penting. !! Muatan formal (pemeriksa struktur resonansi) tidak sama dengan bilangan oksidasi (pemeriksa bilangan redoks): Muatan formal: ikatan elektron dipakai bersama-sama (jika ikatan merupakan kovalen), sehingga setiap atom mendapat setengahnya. Bilangan oksidasi: ikatan elektron dipakai secara sempurna kepada atom elektronegatif lebih besar (jika ikatan ion). 4 Catatan: Bilangan oksidasi tidak berubah saat beresonansi ke bentuk lain, sedangkan muatan formal harus berubah. STRUKTUR LEWIS UNTUK PENGECUALIAN KAIDAH OKTET Molekul yang Kekurangan Elektron Molekul gas yang mengandung atom pusat Berilium maupun Boron seringkali kekurangan elektron, karena kurang dari 8 elektron di sekeliling atom pusat. (Contoh: BeCl2 dan BF3) Molekul Elektron Ganjil Atom pusat dengan elektron valensi ganjil sehingga tidak dapat berpasangan dinamakan radikal bebas, mengandung elektron bebas tunggal yang menyebabkan bersifat paramagnetik dan sangat reaktif. Contoh: NO2 Namun bentuk elektron bebas tunggal pada N (kiri) lebih penting disebabkan jalannya NO2 bereaksi. Ketika dua molekul NO2 bersamaan membentuk ikatan N-N dan tiap N mengandung oktet. Kulit Valensi Terekspansi Banyak molekul dan ion dengan lebih dari 8 elektron valensi di atom pusat. Satu atom mengekspansi kulit valensi untuk membentuk banyak ikatan, yang melepas energi. Hanya terjadi dengan atom pusat nonlogam dari Periode 3 atau lebih tinggi, yang terdapat orbital d. Contoh: SF6. (S dikelilingi 6 ikatan tunggal, dengan total 12 elektron) PCl5. [satu, ikatan Cl-Cl pecah (sebelah kiri) lalu dua, P-Cl terbentuk (sebelah kanan)] SF6 dan PCl5 atom pusatnya mengikat lebih dari 4 atom, sedangkan ada yang mengikat 4 atom atau lebih kecil, contoh: H2SO4. 5 B. TEORI VSEPR (VALENCE-SHELL ELECTRON-PAIR REPULSION) DAN BENTUK MOLEKUL Dalam pembuatan struktur Lewis, para ahli kimia mencoba mengembangkan teori VSEPR. Prinsip dasarnya adalah setiap pasangan elektron valensi di sekitar atom pusat berada sejauh mungkin untuk meminimalisasi gaya tolak-menolak. Maksud pasangan elektron ialah banyaknya elektron yang membentuk daerah sekitar atom, jadi bisa dalam bentuk ikatan tunggal, ikatan rangkap (dua maupun tiga), PEB, ataupun elektron bebas tunggal. Masing-masing pasangan elektron valensi saling tolak-menolak untuk membesarkan sudut antara mereka. Domain Elektron dan Bentuk Molekul Domain elektron ditentukan oleh pasangan elektron valensi di sekitar atom pusat, baik PEI maupun PEB. Sedangkan bentuk molekul ditentukan oleh proses relatif nukleus atom. Domain elektron yang sama dapat meningkatkan perbedaan bentuk molekul: beberapa molekul dengan semua PEI (sesuai gambar) dan molekul lain dengan adanya PEI dan PEB. Bentuk tolakan grup elektron dan 5 bentuk dasar molekul Notasi bentuk molekul: AXmEn. Di mana A adalah atom pusat, X adalah atom ikatan, E adalah grup elektron valensi tak terikat / PEB. m adalah jumlah PEI dan n adalah jumlah PEB. Sudut antara ikatan (bond angle) adalah sudut yang dibentuk nukleus atom ikatan dengan nukleus atom pusat, dengan sudut ideal seperti gambar di atas bagian B. Bentuk molekul dengan 2 pasangan elektron (Linier/Garis) Apabila terdapat dua pasang elektron saling berikatan (AX2) dengan atom pusat, PEI akan tolak-menolak sejauh mungkin dengan arah berlawanan dan membentuk garis (sudut ideal 1800). Contoh: BeCl2 dan CO2. Bentuk molekul dengan 3 pasangan elektron (Segitiga Planar) Apabila 3 pasang elektron berikatan dengan atom pusat (AX3) akan saling tolak menolak membentuk segitiga sama sisi / planar (sudut 1200). Contoh: BF3, NO3-. Efek Ikatan Rangkap Dua. Menyimpang dari sudut ikatan ideal. Gaya tolak-menolak antar ikatan rangkap 2, dengan kerapatan elektron lebih besar, lebih kuat daripada ikatan tunggal. Contoh: CH2O. 6 Efek Pasangan Elektron Bebas (PEB). Jika ada satu PEB dan dua yang lain terikat (PEI) notasi berubah menjadi AX2E. Bentuk berubah menjadi bentuk V (bengkok). Hal ini berefek pada besar sudut ikatan. Karena prinsipnya gaya tolak menolak antara PEB dengan PEI lebih kuat daripada antar PEI (pasangan elektron ikatan). Akibatnya gaya yang lebih kuat akan memperlebar sudut ikatannya. Contoh: SnCl2. Bentuk molekul dengan 4 pasangan elektron (Tetrahedral) Apabila 4 pasang elektron berikatan dengan atom pusat (AX4) akan saling tolak menolak membentuk tetrahedral (sudut ideal 109,50) Contoh: CH4. Ketika 1 pasang elektron menjadi bebas (PEB), maka bentuknya akan menjadi trigonal piramidal (AX3E). Contoh: NH3 (H – N – H : 107,30); jika menjadi NH4+ PEB akan menjadi PEI. Ketika menjadi 2 PEI dan 2 PEB (AX2E2), maka akan menjadi bentuk V (bengkok). Contoh: H2O (H – O – H : 104,50). Maka untuk molekul serupa dengan domain elektron, gaya tolak-menolak antara pasangan elektron menyebabkan deviasi sudut dengan urutan: PEB – PEB > PEB – PEI > PEI – PEI Bentuk molekul dengan 5 pasangan elektron (Segitiga Bipiramidal) Ketika 5 pasangan elektron memisah secara maksimal (AX5), akan terbentuk trigonal bipiramidal. Ada 2 macam tipe posisi pasangan elektron sekitar atom pusat beserta sudut ideal: Pasangan ekuatorial secara horisontal di sekitar atom pusat; dan Pasangan aksial secara vertikal tegak di atas dan di bawah atom pusat. Ikatan ekuatorialekuatorial (1200) lebih lemah daripada aksial-ekuatorial (900). Contoh: PCl5. 7 AX4E (1 PEB, 4 PEI) : Jungkat-jungkit (seesaw). (PEB dari posisi ekuatorial) Contoh: SF4. AX3E2 (2 PEB, 3 PEI) : Bentuk T. (dari posisi ekuatorial) Contoh: BrF3 (F-Br-F < 900) AX2E3 (3 PEB, 2 PEI) : Linier/Garis. (X-A-X : 1800, X=axial) Contoh: I3-. Bentuk molekul dengan 6 pasangan elektron (Oktahedral) Dan ketika 6 pasangan elektron memisah secara maksimal (AX6), akan terbentuk oktahedral. (Sudut ideal masing-masing 900) Contoh: SF6 yang merupakan hasil reaksi SF4 (seesaw) dengan tambahan F2. AX5E (1 PEB, 5 PEI) : Piramid Segiempat. Contoh: IF5. AX4E2 (2 PEB, 4 PEI) : Segiempat Planar. Contoh: XeF4. Langkah Menentukan Bentuk Molekul dengan Teori VSEPR 1. Tulis Struktur Lewis dari rumus molekul. (Gambar halaman 1) 8 2. Tentukan notasi domain elektronnya, dengan menghitung semua pasangan elektron sekitar atom pusat (PEI+PEB). 3. Perkirakan sudut antar ikatan yang ideal dan petunjuk adanya deviasi yang disebabkan adanya PEB ataupun ikatan rangkap. 4. Gambar dan namakan bentuk molekulnya dengan menghitung PEI dan PEB secara terpisah. Contoh soal: Gambarkan bentuk molekul senyawa BrF5. Bentuk Molekul Lebih dari 1 Atom Pusat Bentuk molekulnya merupakan kombinasi bentuk molekul untuk setiap atom pusat. Kita dapat menentukan jenis bentuk molekul pada salah satu atom pusat setiap saat. Contoh: Pada gambar A merupakan struktur etana (CH3CH3) dengan rumus molekul C2H6, berbentuk seperti 2 tetrahedral bolak-balik. Apabila struktur tersebut menjadi struktur etanol/alkohol pada gambar B (CH3CH2OH), maka rantai CH3– tetap membentuk 2 tetrahedral bolak-balik tersebut, sedangkan –CH2– memiliki 4 PEI sehingga juga terbentuk tetrahedral. Atom O memiliki 4 pasangan elektron dan 2 di antaranya termasuk PEB, maka berbentuk V (bengkok). 9 REFERENSI: Silberberg, Martin S. 2006. Chemistry: The Molecular Nature of Matter and Change, Forth Edition. New York : McGraw-Hill International Edition. LAMPIRAN: Tabel Rangkuman Bentuk-Bentuk Molekul (dari 2 sampai 6 pasangan elektron). 10