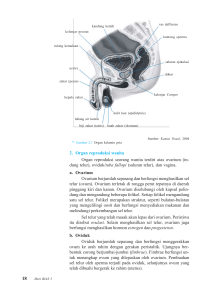
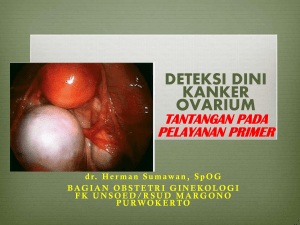
EKSPRESI PROTEIN 53 (p53) TIDAK BERHUBUNGAN
advertisement

TESIS EKSPRESI PROTEIN 53 (p53) TIDAK BERHUBUNGAN DENGAN STADIUM KANKER OVARIUM I GDE SASTRA WINATA PROGRAM PASCASARJANA UNIVERSITAS UDAYANA DENPASAR 2013 TESIS EKSPRESI PROTEIN 53 (p53) TIDAK BERHUBUNGAN DENGAN STADIUM KANKER OVARIUM I GDE SASTRA WINATA NIM 0914038210 PROGRAM MAGISTER PROGRAM STUDI ILMU BIOMEDIK PROGRAM PASCA SARJANA UNIVERSITAS UDAYANA DENPASAR 2013 EKSPRESI PROTEIN 53 (p53) TIDAK BERHUBUNGAN DENGAN STADIUM KANKER OVARIUM Tesis untuk Memperoleh Gelar Magister pada Program Magister, Program Studi Ilmu Biomedik Program Pasca Sarjana Universitas Udayana I GDE SASTRA WINATA NIM 0914038210 PROGRAM MAGISTER PROGRAM STUDI ILMU BIOMEDIK PROGRAM PASCA SARJANA UNIVERSITAS UDAYANA DENPASAR 2013 ii Lembar Pengesahan TESIS INI TELAH DISETUJUI TANGGAL 20 JANUARI 2014 Pembimbing I, Pembimbing II, Prof. Dr. dr. Ketut Suwiyoga, Sp.OG(K) NIP. 19530715 198003 1 009 dr. I Wayan Megadhana, Sp.OG(K) NIP 19600125 198710 1 002 Mengetahui Ketua Program Studi Ilmu Biomedik Program Pascasarjana Universitas Udayana, Direktur Program Pascasarjana Universitas Udayana, Prof. Dr. dr. Wimpie I Pangkahila, SpAnd, FAACS NIP. 194612131971071001 Prof. Dr. dr. A.A. Raka Sudewi, Sp.S(K) NIP. 195902151985102001 iii Tesis Ini Telah Diuji pada Tanggal 20 Januari 2014 Panitia Penguji Tesis Berdasarkan SK Rektor Universitas Udayana, No.:0051a/UN14.4/HK/2014, Tanggal 3 Januari 2014 Ketua: Prof. Dr. dr. Ketut Suwiyoga, Sp.OG(K) Anggota: 1. 2. 3. 4. dr. I Wayan Megadhana, Sp.OG(K) Prof. Dr. dr. Wimpie I Pangkahila, SpAnd, FAACS Dr.dr. Ida Sri Iswari, Sp.MK.,M.Kes Prof. dr. N. Tigeh Suryadhi, MPH,PH.D iv UCAPAN TERIMA KASIH Pertama-tama perkenankanlah penulis memanjatkan puji syukur kehadapan Tuhan Yang Maha Esa, karena hanya oleh berkatNya tesis ini dapat diselesaikan. Pada kesempatan ini perkenankanlah penulis mengucapkan terima kasih yang sebesar-besarnya kepada Prof. Dr. dr. Ketut Suwiyoga, SpOG(K) selaku pembimbing I dan Kepala Bagian Obstetri dan Ginekologi FK UNUD/RSUP Sanglah Denpasar, dr. I Wayan Megadhana, Sp.OG(K) selaku pembimbing II, dan kepada Bapak Drs. Ketut Tunas, Msi selaku pembimbing statistik, serta dr Dewi, Sp.PA sebagai pembimbing dalam pemeriksaan, analisis imunohistokimia p53, serta yang telah memberikan dorongan, semangat, bimbingan dan saran selama penulis mengikuti Program Pendidikan Spesialis I (PPDS I) dan Program Magister Program Studi Ilmu Biomedik Kekhususan Kedokteran Klinik (Combined Degree), khususnya dalam penyelesaian tesis ini. Ucapan yang sama juga ditujukan kepada Rektor Universitas Udayana, Prof. Dr. dr. I Ketut Suastika, Sp.PD (KEMD), Direktur Program Pascasarjana yang dijabat oleh Prof. Dr. dr. A.A. Raka Sudewi, Sp.S(K), Dekan Fakultas Kedokteran Universitas Udayana, Prof. Dr. dr. Putu Astawa, Sp.OT.,M.Kes, serta Direktur Rumah Sakit Umum Pusat Sanglah, dr. I Wayan Sutarga, MPHM, atas kesempatan dan fasilitas yang diberikan untuk mengikuti dan menyelesaikan PPDS I dan Program Magister Program Studi Ilmu Biomedik Kekhususan Kedokteran Klinik (Combined Degree) di Universitas Udayana. Terima kasih penulis ucapkan juga kepada Kepala Program Studi Ilmu Kebidanan dan Penyakit Kandungan PPDS I FK UNUD/RSUP Sanglah, dr. A.A.N. Anantasika, Sp.OG(K) dan seluruh dosen/Staf Bagian Obstetri dan Ginekologi Fakultas Kedokteran Universitas Udayana/RSUP Sanglah, serta Ketua Program Studi Ilmu Biomedik, Prof. Dr. dr. Wimpie I Pangkahila, SpAnd, FAACS atas segala bimbingan dan dorongan yang diberikan selama penulis mengikuti pendidikan spesialis. Ucapan terima kasih yang tulus dan penghargaan kepada para penguji tesis ini, yaitu Prof. Dr. dr. Wimpie I. Pangkahila, Sp.And., FAACS, Dr.dr. Ida Sri Iswari, Sp.MK.,M.Kes, dan Prof.dr.N. Tigeh Suryadhi, MPH,Ph.D yang memberikan berbagai masukan dan saran dalam penyempurnaan tesis ini. Pasien-pasien yang telah menjadi guru dan banyak memberikan pengetahuan dan pengalaman, rekanrekan residen Obstetri dan Ginekologi, serta rekan-rekan paramedis RSUP Sanglah. Tidak lupa penulis haturkan ucapan terima kasih yang dalam kepada Ibu dan Ayah penulis yang telah mengasuh dan membesarkan penulis, memberikan dasardasar berpikir logik, selalu memberi dukungan baik secara moril maupun materiil dan keadaan suasana demokratis sehingga tercipta lahan yang baik untuk berkembangnya kreativitas. Semoga Tuhan Yang Maha Esa selalu memberkati semua pihak yang telah membantu pelaksanaan dan penyelesaian tesis ini, serta kepada penulis sekeluarga. Penulis vi ABSTRAK EKSPRESI PROTEIN 53 (p53) TIDAK BERHUBUNGAN DENGAN STADIUM KANKER OVARIUM Kanker ovarium merupakan kanker kedua terbanyak pada wanita setelah kanker servik dan memiliki angka morbiditas dan mortalitas tertinggi setelah kanker servik dan korpus uteri. Selama ini, berbagai penelitian telah dikembangkan untuk membantu melakukan deteksi dini kanker ovarium, sehingga diharapkan dapat menurunkan angka morbiditas dan mortalitas serta meningkatkan harapan hidup bagi penderita. Namun belum ditemukan suatu alat deteksi dini yang ideal bagi penderita kanker ovarium. Melihat fenomena di atas, maka para ahli mulai memikirkan berbagai metode dalam melakukan deteksi dini terhadap kanker ovarium melalui pendekatan genetik, yaitu dengan mendeteksi kelainan genetik pada pasien kanker ovarium. Salah satu gen yang diperkirakan mengambil peranan penting dalam etiopatogenesis terjadinya kanker ovarium adalah P53, gen yang mengkode atau mengekspresikan protein 53 (p53). Sehubungan dengan hal tersebut di atas, maka melalui penelitian ini dilakukan penilaian korelasi atau hubungan antara p53 dengan derajat stadium kanker ovarium. Penelitian ini merupakan studi cross-sectional di Bagian Kebidanan dan Penyakit Kandungan, Patologi Anatomi dan Rekam Medis Rumah Sakit Umum Pusat (RSUP) Sanglah, Denpasar yang dilakukan mulai Juli 2011 sampai Juli 2013 dengan sampel penelitian sebanyak 44 buah blok parafin. Sampel blok parafin ini dikelompokkan berdasarkan atas stadium kanker ovarium, yaitu: kanker ovarium stadium I, II, III, dan IV. Kemudian masing-masing kelompok stadium dilakukan pemeriksaan ekspresi p53 dengan teknik imunohistokimia. Selanjutnya dilakukan penilaian hubungan antara p53 dengan derajat stadium kanker ovarium dengan menggunakan Uji Spearman. Penelitian ini memperoleh rerata umur, Indek Massa Tubuh (IMT), paritas, dan riwayat kontrasepsi hormonal pada keempat kelompok stadium kanker ovarium adalah homogen. Berdasarkan uji korelasi diperoleh nilai r sebesar -0,099 (p=0,522) yang ditunjukkan bahwa tidak terdapat hubungan antara stadium kanker ovarium dengan ekspresi p53 Disimpulkan bahwa ekspresi p53 tidak berhubungan dengan stadium kanker ovarium. Kata kunci: ekspresi p53 dan stadium kanker ovarium vii ABSTRACT PROTEIN 53 (p53) EXPRESSION DID NOT CORRELATE WITH OVARIAN CANCER STAGING Ovarian cancer is the second most common cancer in women after cervical cancer and having the highest morbidity and mortality rate after cervical cancer and uterine cancer. Many studies have been developed to explore the early detection method for ovarian cancer, in order to decrease the morbidity and mortality rate, and also to increase the patient’s life expectancy. However, the ideal early detection method for ovarian cancer patient has not been established until now. Based on that fact, many investigators initiate to investigate various methods for the early detection of ovarian cancer through genetic approach, which is by detecting any genetic disorder in ovarian cancer patient. One of the possible gene that play a role in etiopathology of ovarian cancer is P53, which is the gene that expresses or codes the protein 53 (p53). As the result, this study was aimed at assessing the correlation between p53 and the ovarian cancer stadium staging. This study was a cross-sectional study in Obstetric and Gynecologic, Anatomical Pathology, and Medical Record Department of Sanglah Hospital, Denpasar, in July 2011 until July 2013, with a total of 44 paraffin wax blocks. The parrafin wax block samples were categorized based on the ovarium cancer staging, namely: ovarian cancer stage I, II, III and IV respectively. Each group of staging was performed p53 expression experiment with immunohistochemistry technique. Analysis of correlation between p53 and ovarian cancer staging was conducted with Spearman Test. This study obtained mean age, Body Mass Index (BMI), parity, history of hormonal contraception from the four groups of ovarian cancer in homogeneity. Based on the correlation test, the r-value was -0,099 (p=0,522), which indicating that there was no correlation between ovarian cancer staging and p53 expression. In conclusion, p53 expression was not proved to correlate with the ovarian cancer staging. Keywords : p53 expression, ovarian cancer staging viii DAFTAR ISI Halaman SAMPUL DALAM ............................................................................................ i PRASYARAT GELAR ...................................................................................... ii LEMBAR PERSETUJUAN PEMBIMBING ..................................................... iii PENETAPAN PANITIA PENGUJI ................................................................... iv SURAT PERNYATAAN BEBAS PLAGIAT.................................................... v UCAPAN TERIMA KASIH ............................................................................... vi ABSTRAK ......................................................................................................... vii ABSTRACT ....................................................................................................... viii DAFTAR ISI ...................................................................................................... ix DAFTAR TABEL ............................................................................................... xii DAFTAR GAMBAR .......................................................................................... xiii DAFTAR SINGKATAN .................................................................................... xiv DAFTAR LAMPIRAN ...................................................................................... xvi BAB I PENDAHULUAN ........................................................................................1 1.1 Latar Belakang ...................................................................................................1 1.2 Rumusan Masalah ..............................................................................................7 1.3 Tujuan Penelitian ...............................................................................................8 1.4 Manfaat Penelitian .............................................................................................8 BAB II TINJAUAN PUSTAKA..............................................................................9 2.1 Protein 53 (p53).................................................................................................9 ix 2.1.1 Struktur p53....................................................................................................9 2.1.2 Peran p53......................................................................................................12 2.2 Kanker Ovarium ..............................................................................................19 2.2.1 Epidemiologi kanker ovarium ......................................................................19 2.2.2 Faktor risiko kanker ovarium .......................................................................21 2.2.3 Patogenesis kanker ovarium.........................................................................29 2.2.4 Stadium kanker ovarium ..............................................................................32 2.3 Imunohistokimia ...........................................................................................33 BAB III KERANGKA BERPIKIR, KONSEP DAN HIPOTESIS PENELITIAN .......................................................................................................36 3.1 Kerangka Berpikir ............................................................................................36 3.2 Konsep Penelitian.............................................................................................38 3.3 Hipotesis Penelitian..........................................................................................38 BAB IV METODE PENELITIAN ........................................................................39 4.1 Rancangan Penelitian .....................................................................................39 4.2 Tempat dan Waktu Penelitian ........................................................................40 4.3 Populasi Penelitian .........................................................................................40 4.4 Sampel Penelitian ...........................................................................................40 4.4.1 Kriteria inklusi .............................................................................................40 4.4.2 Kriteria eksklusi ...........................................................................................41 4.4.3 Perhitungan besar sampel.............................................................................41 4.4.4 Cara pengambilan sampel ............................................................................41 4.5 Variabel Penelitian .........................................................................................42 x 4.5.1 Identifikasi variabel......................................................................................42 4.5.2 Definisi operasional variabel........................................................................42 4.6 Alur Penelitian ...............................................................................................44 4.7 Instrumen Penelitian dan Metode Pemeriksaan .............................................46 4.7.1 Instrumen penelitian .....................................................................................46 4.7.2 Metode pemeriksaan ...................................................................................46 4.8 Pengumpulan dan Analisis Data ....................................................................49 4.8.1 Pengumpulan data ........................................................................................49 4.8.2 Analisis data .................................................................................................49 BAB V HASIL PENELITIAN...............................................................................50 5.1 Karakteristik Sampel Penelitian .....................................................................50 5.2 Hubungan antara Ekspresi p53 dengan Stadium Kanker Ovarium .................51 BAB VI PEMBAHASAN ......................................................................................52 6.1 Karakteristik Sampel Penelitian .....................................................................52 6.2 Hubungan antara Ekspresi p53 dengan Stadium Kanker Ovarium ................58 6.3 Kelemahan Penelitian .....................................................................................63 BAB VII SIMPULAN DAN SARAN ...................................................................65 7.1 Simpulan .......................................................................................................65 7.2 Saran ........................................................................................................65 DAFTAR PUSTAKA ............................................................................................66 LAMPIRAN ........................................................................................................71 xi DAFTAR TABEL Halaman 2.1 Mekanisme Inaktivasi Gen p53 ..................................................................12 2.2 Kelompok Gen dan Ekspresi Protein Abnormal pada Kanker Ovarium ...24 2.3 Hubungan Jumlah Paritas dengan Risiko Kanker Ovarium.......................26 2.4 Kriteria Stadium Kanker Ovarium Menurut FIGO ....................................32 4.1 Kategori Indek Massa Tubuh (IMT) untuk Indonesia ...............................43 4.2 Interpretasi Pulasan Imunohistokimia p53 .................................................49 5.1 Distribusi Umur, IMT, Paritas, dan Riwayat Kontrasepsi Hormonal pada Kelompok Stadium Kanker Ovarium.........................................................50 5.2 Hubungan antara Ekspresi p53 dengan Stadium Kanker Ovarium ............51 xii DAFTAR GAMBAR Halaman 2.1 Struktur p53 ...............................................................................................10 2.2 Peran p53 dalam Mempertahankan Integritas Genom ..............................14 2.3 Mekanisme Intrinsik dan Ekstrinsik pada Apoptosis ................................16 2.4 Peran p53 dalam Proses Apoptosis ............................................................17 2.5 Proses Karsinogenesis Akibat Kegagalan Peran p53 .................................18 2.6 Angka Kejadian Kanker Ovarium di RSUPN Cipto Mangunkusumo pada Tahun 2003 sampai 2007...................................................................21 2.7 Angka Kejadian Kanker Ovarium Berdasarkan Umur Spesifik dan Jumlah Wanita di United of Kingdom pada tahun 2006 ............................25 2.8 Hubungan Lama Pemakaian Kontrasepsi Oral dengan Risiko Kanker Ovarium......................................................................................................27 3.1 Kerangka Konsep Penelitian ......................................................................38 4.1 Rancangan Penelitian .................................................................................39 4.2 Alur Penelitian ...........................................................................................46 xiii DAFTAR SINGKATAN APAF-1 : Apoptosis Inducing Factor-1 ATP : Adenosine-Triphospat CCRC : Cancer Chemoprevention Research Center CDC : Center of Diseases Control CDK : Cycline D Kinase DAB : Diaminobenzinidine DMBA : Dimethylbenzanthrene DNA : Deoxyribonucleic Acid DR : Death Reseptor EGF receptor : Epidermal Growth Factor receptor FADD : Fas-Associative Death Domain FIGO : International Federation of Gynecology and Obstetrics FITC : Fluorescein isothiocyanate FSH : Follicle Stimulating Hormone G1 : Gap 1 G2 : Gap 2 GTP : Guinidine-Triphospat IMT : Indek Massa Tubuh kb : kilobasa kDa : kilo Dalton LH : Luteinizing Hormone xiv M : Mitosis MDM2 : Murine Double Minute 2 miRNAs : mikroRNAs PBS : Phospate Buffer Saline RSUP : Rumah Sakit Umum Pusat RSUPN : Rumah Sakit Umum Pusat Negeri S : Sintesis TGF-α : Transforming Growth Factor-α TNF : Tumor Necrotic Factor TVS : Transvaginal Sonografi WHO : World Health Organization xv DAFTAR LAMPIRAN Halaman Lampiran 1 Formulir Penelitian...................................................................... 71 Lampiran 2 Data Penelitian ............................................................................ 72 Lampiran 3 Perhitungan Statistik ................................................................... 74 Lampiran 4 Hasil Pemeriksaan Imunohistokimia p53.................................... 78 xvi 1 BAB I PENDAHULUAN 1.1 Latar Belakang Kanker ovarium merupakan tumor ganas pada ovarium dengan histogenisitas yang beraneka ragam oleh karena dapat berasal dari ketiga dermoblast baik ektoderm, mesoderm dan endoderm. Kanker ini berdasarkan atas sel-sel penyusun ovariumnya dapat dibagi menjadi tiga tipe utama, yaitu: kanker ovarium tipe epitelial, germinal, dan stromal. Sampai saat ini penyebab pasti dari kanker ovarium tersebut masih belum diketahui. Beberapa faktor risiko diduga mengakibatkan terjadinya kanker ovarium, antara lain: adanya riwayat keluarga menderita kanker ovarium, mamae dan kolon, mutasi genetik, umur di atas 50 tahun, wanita yang tidak memiliki anak, wanita yang memiliki anak pada umur lebih dari 35 tahun, riwayat pemakian terapi atau kontrasepsi hormonal, dan berat badan yang berlebih, terutama wanita dengan Indek Massa Tubuh (IMT) yang lebih dari 30 kg/m2 (Czyz, 2008). Kanker ovarium merupakan kanker kedua terbanyak pada wanita setelah kanker servik dan memiliki angka kematian tertinggi setelah kanker servik dan korpus uteri (Ari, 2008). Di Amerika Serikat, jumlah kasus baru dan angka kematian kanker ovarium meningkat setiap tahunnya, di mana pada tahun 2002 diperoleh sebanyak 23.300 kasus dengan angka kematian sebesar 56,29% dari kasus tersebut. Tahun 2003 meningkat menjadi 25.400 kasus dengan angka kematian sebesar 59,66% dari kasus dan tahun 2007 menjadi 22.430 kasus baru dengan angka kematian 1 2 meningkat mencapai 68,12%. Bahkan pada tahun 2010 diperkirakan sebanyak 21.880 kasus baru akan terdiagnosis dengan angka kematian yang masih tinggi yaitu sebesar 63,30% (American Cancer Society, 2010). Angka kejadian kanker ovarium di Rumah Sakit Umum Pusat (RSUP) Sanglah pada tahun 2005 diperoleh sebesar 35% dari seluruh kanker ginekologi dengan survival rate selama lima tahun yang hanya sebesar 15% (Karyana, 2005). Tingginya angka kematian dan rendahnya harapan hidup selama lima tahun pada kanker ovarium sangat ditentukan oleh seberapa dini ditemukannya stadium kanker ovarium tersebut. Semakin dini stadium kanker ovarium ditemukan, maka semakin tinggi angka harapan hidup dari penderita kanker ovarium (Ari, 2008). Namun kenyataannya sangat sulit untuk melakukan deteksi dini pada kanker ovarium, sehingga hampir sebagian besar kasus ditemukan pada stadium terminal dengan survival rate selama lima tahun yang sangat rendah, yaitu sebesar 20 sampai 30%. Apabila kasus kanker ovarium tersebut ditemukan pada stadium yang lebih dini maka survival rate selama lima tahun meningkat bahkan mencapai 90 sampai 95%. Sehingga, peranan deteksi dini merupakan hal yang sangat penting dalam upaya menurunkan morbiditas dan mortalitas pada kanker ovarium (Ari, 2008; American Cancer Society, 2010). Adanya keterlambatan dan kesulitan dalam melakukan diagnosis pada kanker ovarium sangat berhubungan dengan sifat totipoten dari ovarium, lokasi ovarium yang tersembunyi di dalam kavum pelvis, mudah terjadinya metastasis, gejala yang tidak spesifik, sosial budaya dan pendidikan masyarakat yang relatif rendah. Terlebih lagi, deteksi dini dari kanker ovarium sampai saat ini masih belum dapat 3 dilakukan (Berek dan Natarajan, 2007). Selain itu, penatalaksanaan kanker ovarium yang adapun ternyata masih kurang memuaskan, di mana penderita dengan kanker ovarium yang telah dinyatakan mengalami remisi komplit setelah dilakukan evaluasi selama enam bulan, lebih dari 50% penderita ternyata mengalami relaps atau kekambuhan (Parveen dkk., 2009). Angka kekambuhan kanker ovarium yang relatif tinggi menyebabkan semakin rendahnya angka harapan hidup pada wanita yang menderita kanker ovarium. Berdasarkan hal itu maka diperlukan suatu pendekatan yang berbeda dalam memahami etiologi dan patogenesis dari kanker ovarium yang nantinya dapat digunakan sebagai dasar untuk melakukan deteksi dini, penatalaksanaan, dan penentuan prognosis dari kanker ovarium. Selama ini, berbagai penelitian telah dikembangkan untuk membantu melakukan deteksi dini kanker ovarium, sehingga diharapkan dapat menurunkan angka morbiditas dan mortalitas serta meningkatkan harapan hidup bagi penderita. Namun sampai saat ini belum ditemukan suatu alat deteksi dini yang ideal bagi penderita kanker ovarium. Pemanfaatan alat Transvaginal Sonografi (TVS) dan biomarker serum Ca-125 merupakan dua di antara sekian banyak alat deteksi dini terbaru yang telah dilakukan penelitian secara mendalam (Karst dan Drakin, 2009). Penelitian deteksi dini kanker ovarium dengan menggunakan TVS telah melaporkan bahwa TVS memiliki sensitivitas yang rendah sebagai deteksi dini kanker ovarium. TVS mampu mendeteksi besar volume dari kanker ovarium saja, sehingga dikatakan bahwa TVS hanya mendeteksi kanker ovarium yang dapat 4 mengakibatkan peningkatkan volume secara signifikan (Karst dan Drakin, 2009). Hal ini sangat mengkhawatirkan, khususnya pada kasus kanker ovarium tipe serosa yang dapat bermetastasis dengan cepat dari ovarium ke organ pelvis lainnya sebelum ovarium mengalami peningkatan volume yang bermakna. Penelitian yang dilakukan oleh Van Nagell dkk. (2007) terhadap wanita yang tidak memiliki keluhan namun terdapat risiko menderita kanker ovarium. Setelah wanita tersebut menjalani deteksi dini menggunakan TVS dan dinyatakan negatif, dalam waktu 12 bulan observasi ternyata dinyatakan positif terdiagnosis kanker ovarium melalui pemeriksaan histopatologi. Selain itu, TVS juga memiliki kekurangan di mana tidak dapat membedakan kanker ovarium dengan massa jinak adneksa, seperti kista dan fibroma, terutama pada wanita postmenopause (Karst dan Drakin, 2009). Penelitian deteksi dini kanker ovarium menggunakan biomarker serum Ca125 telah menyimpulkan bahwa Ca-125 tidak dapat digunakan sebagai alat deteksi dini kanker ovarium pada wanita tanpa keluhan yang berisiko menderita kanker ovarium (Hogdall dkk., 2007). Hal ini disebabkan karena sensitivitas yang dimiliki oleh Ca-125 masih sangat rendah dan adanya positif palsu yang tinggi akibat berbagai kondisi lainnya, seperti: penyakit radang panggul, endometriosis, kista ovarium, dan fibroid (Karst dan Drakin, 2009). Melihat fenomena di atas, maka para ahli mulai memikirkan berbagai metode dalam melakukan deteksi dini terhadap kanker ovarium melalui pendekatan genetik, yaitu dengan mendeteksi kelainan genetik pada pasien kanker ovarium. Berbagai penelitian terhadap peran genetik telah dikembangkan dalam rangka 5 memahami etiologi dan patofisiologi kanker ovarium, baik melalui pemeriksaan secara langsung terhadap mutasi pada gen atau pun tidak langsung melalui abnormalitas ekspresi protein yang dihasilkan oleh gen termutasi. Beberapa gen dan ekspresi protein gen yang diduga mengalami kelainan dan terlibat dalam jalur karsinogenesis terjadinya kanker ovarium telah diketahui. Kelainan pada gen dan ekspresi protein gen tersebut dapat dibagi menjadi empat kelompok, yaitu onkogen seperti gen HER-2/neu, MYC, CDK1, inaktivasi gen supresor tumor seperti gen P53, perubahan pada gen apoptosis seperti gen BCL2, dan perubahan gen perbaikan DNA seperti gen BRCA1 dan BRCA2 (Kumar dkk., 2010). Salah satu gen yang diperkirakan mengambil peranan penting dalam etiopatogenesis terjadinya kanker ovarium adalah P53, gen yang mengkode atau mengekspresikan protein 53 (p53). Gen P53 melalui ekspresi proteinnya, yaitu p53 memiliki potensi yang besar untuk dikembangkan sebagai salah satu alat deteksi dini kanker ovarium dan berbagai penelitian pendahuluan telah dilakukan untuk mendukung ke arah itu. Penelitian tentang pemanfaatan gen P53 atau melalui ekspresi proteinnya, yaitu p53 sampai saat ini masih menunjukkan hasil yang berbeda, khususnya terhadap stadium kanker ovarium terdiri atas stadium I, II, II, dan IV yang nantinya dapat digunakan sebagai dasar pemikiran bahwa p53 dapat dimanfaatkan sebagai media atau alat deteksi dini kanker ovarium. Penelitian yang dilakukan oleh Adiyanti (2007) memperoleh hasil bahwa terdapat hubungan yang signifikan antara p53 dengan stadium kanker ovarium. Penelitian yang dilakukan oleh Rauf dan Masadah (2009) memperoleh hasil 6 sebesar 58,5% sampel mengalami ekspresi p53 positif, di mana hasil positif terbanyak ditemukan pada kanker ovarium stadium IV, kemudian diikuti dengan stadium III, II, dan I. Penelitian lainnya yang dilakukan oleh Lobna (2010) memperoleh hasil bahwa ekspresi p53 yang positif memiliki hubungan dengan stadium kanker ovarium, khususnya pada stadium lanjut. Penelitian yang dilakukan oleh Marks (2006) menyimpulkan bahwa ekspresi p53 positif tidak berhubungan dengan stadium kanker ovarium dan derajat histopatologis, namun sangat berhubungan dengan kejadian mutasi dari gen P53 itu sendiri. Penelitian yang dilakukan oleh Psyarii dkk. (2007) juga menyimpulkan bahwa ekspresi p53 tidak berhubungan dengan stadium dan derajat differensiasi kanker ovarium. Penelitian yang dilakukan oleh Marcus (2010) menyimpulkan bahwa mutasi dari gen P53 lebih banyak ditemukan pada kanker ovarium stadium dini dibandingkan dengan stadium lanjut dan ekspresi p53 tidak berhubungan dengan derajat stadium kanker ovarium. Pada sel yang mengalami mutasi atau kehilangan P53, maka sel akan mengekspresikan p53 secara berlebih atau overekspresi p53 namun tidak dapat bekerja sebagai pengaktivasi proses transkripsi pada beberapa gen target seperti gen inhibitor cyclin-dipendent kinase CDKN1A (P21) dan GADD45. Sehingga tidak akan terjadi aktivasi p21, yang mengakibatkan siklus sel tidak berhenti pada akhir fase G1 dan tidak terjadi aktivasi GADD45, yang mengakibatkan tidak terjadinya perbaikan DNA. Ditambah lagi, pada sel yang mengalami mutasi atau kehilangan P53, tidak adanya aktivasi pada gen apoptosis yaitu BAX mengakibatkan sel gagal mengalami apoptosis. Pada akhirnya, semua hal tersebut 7 berdampak pada terfiksasinya mutasi pada sel yang membelah, khususnya DNA sehingga sel akan masuk menuju proses menuju transformasi ganas dalam hal ini adalah kanker ovarium (Syaifudin, 2007; Kumar dkk., 2010). Sampai saat ini, deteksi dini kanker ovarium masih belum dapat dilakukan dan belum menunjukkan tanda-tanda adanya upaya ke arah pengembangan genetik sebagai alat deteksi dini kanker ovarium. Bahkan ide untuk memanfaatkan peran gen P53 dan protein p53 yang sedemikian besarnya pun masih belum terpikirkan. Padahal pemanfaatan peran genetik sebagai sarana deteksi dini memberikan harapan yang sangat cerah bagi kemajuan diagnostik kanker ovarium. Sehubungan dengan hal tersebut di atas, maka melalui tesis ini dilakukan upaya pemanfaatan peran genetik, khususnya protein p53, sebagai alat deteksi terkait dengan sejauh mana tingkat keparahan atau stadium dari kanker ovarium yang telah dialami oleh penderita. Pemanfaatan tersebut dilakukan dengan penilaian korelasi atau hubungan antara p53 dengan derajat stadium kanker ovarium. Penelitian ini diharapkan menjadi masukan atau tambahan pemikiran dalam rangka mendukung pengembangan ide pemanfaatan gen P53 dan ekspresi protein p53 sebagai deteksi dini dalam diagnostik kanker ovarium. 1.2 Rumusan Masalah Berdasarkan uraian tersebut di atas, maka rumusan masalah pada penelitian ini adalah: Apakah ada hubungan antara ekspresi protein 53 (p53) dengan stadium kanker ovarium? 8 1.3 Tujuan Penelitian Adapun tujuan yang ingin dicapai melalui penelitian ini adalah untuk mengetahui hubungan antara ekspresi protein 53 (p53) dengan stadium kanker ovarium. 1.4 Manfaat Penelitian 1.4.1 Manfaat bagi pengetahuan Penelitian ini diharapkan menjadi masukan atau tambahan pengetahuan dalam rangka mendukung pengembangan ide pemanfaatan gen P53 dan protein p53 sebagai deteksi dini dalam diagnostik kanker ovarium. 1.4.2 Manfaat bagi pelayanan Penelitian ini juga diharapkan dapat memperkaya khasanah medis dalam alat deteksi dini dalam diagnostik kanker ovarium. 9 BAB II TINJAUAN PUSTAKA 2.1 Protein 53 (p53) Protein 53 atau p53 merupakan suatu polipeptida yang diekspresikan atau dikode oleh gen P53 yang berperan dalam menjaga keutuhan sel atau integritas genom melalui proses transkripsi dan translasi. Gen P53 tersebut merupakan suatu gen penekan tumor atau supresor tumor (Syaifudin, 2007). Pada awalnya, P53 diperkirakan sebagai suatu onkogen oleh karena ditemukan dalam jumlah yang berlebihan atau overekspresi pada sel-sel yang mengalami keganasan. Penelitian terhadap P53 menunjukkan bahwa P53 dapat diisolasi dari sejumlah klon yang terbukti mampu mempertahankan sel kultur agar tetap hidup. Kemudian diketahui bahwa P53 yang terdapat dalam sel tersebut merupakan bentuk mutan dari P53 (Bai dan Zhu, 2006). Penelitian berikutnya terungkap bahwa P53 mampu menghambat pertumbuhan sel yang disebabkan oleh onkogen dan dapat menghambat potensi tumorigenik sel pada binatang. Hal tersebut membuktikan bahwa P53 merupakan suatu gen supresor tumor (Syaifudin, 2007). 2.1.1 Struktur p53 p53 merupakan suatu nuklear fosfoprotein yang memiliki berat molekul sebesar 53 kilo Dalton (kDa). Protein ini dikode oleh 20 kilobasa (kb) gen yang mengandung 11 ekson dan 10 intron, terletak pada bagian lengan pendek dari kromosom 17. p53 mengandung sebanyak 393 asam amino dan terdiri dari 9 10 beberapa struktur atau komponen penting yang dapat dilihat pada gambar 2.1 (Bai dan Zhu, 2006). Gambar 2.1 Struktur p53 (Bai dan Zhu, 2006) Bagian N-terminal mengandung daerah domain terminal amino, yaitu residu 1 sampai 42 dan daerah yang memiliki asam amino prolin yang tinggi atau prolinerich region, yaitu residu 61 sampai 94 dengan urutan sekuen PXXP yang berulang, di mana X adalah asam amino. Selain itu, terdapat sebuah daerah domain inti sentral atau central core, yaitu residu 102 sampai 292 dan daerah domain C-terminal, yaitu residu 324 sampai 393. Bagian C-terminal tersebut dapat dibagi menjadi dua bagian, yaitu daerah yang mengandung domain oligomerisasi atau tetramerisasi, pada residu 324 sampai 355 dan domain regulasi pada terminal karboksil, merupakan daerah dasar yang kuat pada residu 363 sampai 393 (Bai dan Zhu, 2006). Daerah domain terminal asam amino digunakan untuk aktivitas transaktivasi dan interaksi dengan berbagai macam faktor 11 transkripsi, meliputi asetil-transferase dan Murine Double Minute 2 (MDM2). Daerah yang kaya akan prolin memainkan peranan penting dalam stabilitas dari p53 yang diregulasi oleh MDM2 tersebut, di mana p53 menjadi lebih rentan terhadap degradasi oleh MDM2 jika daerah yang kaya akan prolin tersebut dihilangkan (Syaifudin, 2007). Sehingga, MDM2 merupakan suatu protein yang berperan khusus dalam menghancurkan protein p53. Bagian domain inti sentral dari protein p53, terutama dibentuk oleh ikatan Deoxyribonucleic Acid (DNA), di mana merupakan dominan yang dibutuhkan dalam sekuen ikatan DNA spesifik yang terdiri dari dua buah kopi rantai 5’-PuPuPuC(A/T)-(T/A)GPyPyPy-3’. Pada bagian C-terminal dari p53 juga berfungsi sebagai domain regulasi negatif yang memiliki fungsi untuk menginduksi proses kematian sel atau apoptosis dan mengatur kemampuan domain binding DNA inti sebagai bentuk yang laten. Apabila interaksi antar C-terminal dan domain binding DNA inti diputus atau dihilangkan oleh modifikasi pascatranslasi, seperti proses fosforilasi dan asetilasi, domain DNA binding akan menjadi teraktivasi, sehingga akan menginduksi terjadinya aktivitas transkripsi (Bai dan Zhu, 2006). Berbagai penelitian telah membuktikan bahwa mayoritas mutasi terhadap P53 yang ditemukan dalam berbagai keganasan berupa missense mutation dan sebagian besar terletak pada domain DNA binding inti. Penelitian lainnya terhadap P53 yang dimasukkan ke dalam sel kanker yang sebelumnya telah kehilangan fungsi P53 secara endogen, ternyata dapat memperkecil proses pembentukan tumor atau tumorigenesis. Namun, sebaliknya adanya pemberian mutan P53 dapat 12 memperbesar proses tumorigenesis (Syaifudin, 2007). Beberapa mekanisme inkativasi fungsi P53 dalam berbagai keganasan dapat dilihat pada tabel 2.1. Tabel 2.1 Mekanisme Inaktivasi Gen P53 Mekansime inaktivasi gen P53 Efek inaktivasi Mutasi perubahan asam amino pada domain DNA binding Menghalangi p53 dari binding pada deret DNA spesifik dan mengaktifkan gen didekatnya Delesi karboksil terminal domain Menghalangi p53 Penggandaan gen MDM2 MDM2 ekstra menstimuli degradasi p53 Delesi gen p14ARF Kegagalan menghambat MDM2 dan menahan degradasi p53 tetap terkendali Mis-lokasi P53 pada sitoplasma, di luar inti (Syaifudin, 2007) pembentukan tetramer Kegagalan fungsi p53, karena p53 berfungsi hanya dalam inti 2.1.2 Peran p53 p53 merupakan suatu polipeptida yang diekspresikan atau dikode oleh gen P53 yang berperan dalam menjaga keutuhan sel atau integritas genom melalui jalur transkripsi tetramerik. p53 ini ditemukan dalam jumlah yang sangat rendah pada sel yang tidak terpapar oleh stressor. Namun, apabila terjadi suatu stressor, baik berupa hipoksia, kerusakan pada integritas seluler dan onkogen yang tidak sesuai, maka p53 tersebut akan diekspresikan dalam jumlah yang lebih tinggi untuk mengaktifkan berbagai jalur menuju ke arah modifikasi pascatranslasi protein dan stabilisasi (Syaifudin, 2007). Adanya akumulasi p53 tersebut selanjutnya akan mengaktivasi transkripsi berbagai gen yang terlibat dalam 13 menimbulkan efek antiproliferasi atau penghentian siklus dan aktivasi apoptosis. Sehingga p53 dianggap sebagai suatu monitor sentral terhadap stressor yang dapat mengarahkan sel untuk memberikan respon yang sesuai, baik berupa penghentian siklus ataupun apoptosis (Kumar dkk., 2010). p53 secara normal di dalam sel yang tidak mengalami stress memiliki waktu paruh yang sangat pendek, kurang lebih dua puluh menit. Waktu paruh yang relatif pendek tersebut disebabkan oleh karena adanya ikatan p53 dengan Murine Double Minute 2 (MDM2) (Bai dan Zhu, 2006). MDM2 merupakan suatu protein yang berperan khusus dalam menghancurkan p53. p53 mengalami modifikasi pascatranskripsi yang membebaskan protein tersebut dari MDM2 sehingga dapat meningkatkan lama waktu paruhnya. Selama proses pembebasan dari MDM2, protein tersebut mengalami aktivasi menjadi suatu faktor transkripsi (Syaifudin, 2007). Peran p53 dalam mempertahankan integritas genom dapat dilihat pada gambar 2.2. Apabila terdapat suatu stressor, baik berupa hipoksia, kerusakan pada integritas seluler atau Deoxyribonucleic Acid (DNA) dan onkogen yang tidak sesuai maka akan terjadi aktivasi p53. Namun apabila perbaikan kerusakan DNA tersebut gagal, maka p53 yang normal akan mengarahkan sel pada kematian yang terprogram atau proses apoptosis (Kumar dkk., 2010). 2.1.2.1 Peran p53 dalam perbaikan kerusakan DNA Siklus replikasi sel dibagi menjadi empat fase, yaitu: fase gap 1 (G1), sintesis (S), gap 2 (G2), dan mitosis (M). Replikasi DNA berlangsung pada fase S dan mengalami pemisahan secara mitosis menjadi sister chromatid berlangsung pada 14 fase M. Fase S dan M adalah fase yang paling sensitif terhadap berbagai macam faktor risiko terjadinya kerusakan DNA. Oleh karena itu, apabila terdapat suatu faktor risiko tertentu, seperti pajanan radiasi, sel tetap berada pada tahap arrest, yaitu fase G1 atau G2. Namun, apabila perbaikan DNA tersebut telah selesai, maka pembelahan sel akan berlanjut dan memasuki fase berikutnya (Syaifudin, 2007). Gambar 2.2 Peran p53 dalam Mempertahankan Integritas Genom (Kumar dkk., 2010) P53 merupakan salah satu gen penekan kanker atau supresor tumor yang berperan penting dalam melindungi siklus sel. Apabila terjadi kerusakan pada sel, maka P53 di dalam inti akan teraktivasi sehingga dapat mensintesis p53. Aktivasi p53 tersebut akan meningkatan proses transkripsi pada beberapa gen target seperti gen inhibitor kinase dependent-cycklin, yaitu CDKN1A (P21) dan GADD45. 15 Selanjutnya aktivasi p21 menyebabkan siklus sel terhenti atau arrest pada akhir fase G1. Sementara siklus sel berhenti pada fase G1, aktivasi GADD45 selanjutnya berperan dalam melakukan perbaikan DNA. Apabila perbaikan DNA tersebut berhasil maka p53 akan meningkatkan transkripsi MDM2, yang kemudian menekan pembentukan p53, sehingga akan menghilangkan hambatan terhadap siklus sel. Selanjutnya, sel tersebut dapat melanjutkan siklus pembelahannya (Syaifudin, 2007). Namun apabila perbaikan kerusakan DNA tersebut gagal maka p53 yang normal akan mengarahkan sel pada kematian yang terprogram atau proses apoptosis (gambar 2.2a). Selain itu, p53 juga dapat mengaktivasi gen represi melalui proses aktivasi terhadap mir-34 yang merupakan keluarga mikroRNAs (miRNAs). Selanjutnya, mir-34 akan mengambat proses translasi dari gen-gen pemicu pertumbuhan atau growth promoting genes, seperti MYC dan CDK4 sehingga mengakibatkan terhentinya proses pertumbuhan sel. Protein aktivasi mir-34 juga menghambat proses translasi dari gen anti-apoptosis sehingga dapat memicu terjadinya proses apoptosis (gambar 2.2b) (Kumar dkk., 2010). 2.1.2.2 Peran p53 pada proses apoptosis Apoptosis merupakan program bunuh diri intra seluler yang dilakukan dengan cara mengaktifkan protein kaspase, yang merupakan suatu sistein protease (Kumar dkk., 2010). Secara umum, terdapat dua jalur utama dalam proses apoptosis, yaitu: jalur intrinsik dan ekstrinsik. Jalur intrinsik meliputi pemberian kode yang memicu proses mitokondria-dependent melalui pelepasan sitokrom c dan pengaktifan kaspase-9. Jalur ekstrinsik bekerja dengan cara mengaktifkan reseptor kematian atau Death Reseptor (DR), seperti Fas (reseptor 1 Tumor 16 Necrotic Factor (TNF)), DR4 dan DR5 (gambar 2.3) (Bai dan Zhu, 2006). Adanya interaksi dengan ligan yang sesuai akan mengarah kepada proses transduksi sinyal yang diawali dengan peliputan molekul yang berhubungan dengan DR seperti Fas-Associative Death Domain (FADD), yang selanjutnya akan mengaktifkan kaspase-8. Kaspase ini kemudian mengkatalis sederet proses proteolitik yang manghasilkan perubahan biokimia dan morfologi khas yang berhubungan dengan apoptosis. Selain itu, apoptosis juga merupakan suatu proses yang aktif, di mana menginduksi gen seperti BAX dan ekspresi antigen Fas maupun represi atau penekanan simultan gen seperti BCL2 (Kumar dkk., 2010). Gambar 2.3 Mekanisme Intrinsik dan Ekstrinsik pada Apoptosis (Bai dan Zhu, 2006) P53 memiliki peranan yang penting dalam pengaturan siklus sel dengan melakukan kontrol terhadap sejumlah gen, termasuk gen untuk apoptosis jika terdapat kerusakan seluler yang berat. Peran p53 dalam proses apoptosis ini, 17 terutama melibatkan mitokondria sebagai peran utama melalui pembebasan sitokrom c. Efek proapoptosis oleh p53 diperantarai melalui peningkatan sintesis Bax. Selanjutnya protein Bax tersebut akan mendorong pelepasan sitokrom c pada mitokondria, yang akhirnya akan membentuk suatu komplek dengan Apoptosis Inducing Factor-1 (APAF-1), prokaspase-9 dan Adenosine-Triphospat (ATP). Komplek tersebut mengakibatkan terjadinya aktivasi prokaspase-9 menjadi kaspase-9. Kemudian kaspase-9 akan memicu aktivasi dari kaspase-3. Kaspase-3 merupakan kaspase terakhir atau eksekutor yang memecah DNA dan substrat lainnya sehingga mengakibatkan terjadinya kematian sel (Gambar 2.4) (Kumar dkk., 2010). Gambar 2.4 Peran p53 dalam Proses Apoptosis (Kumar dkk., 2010) Pada sel yang mengalami mutasi atau kehilangan P53, maka sel tidak akan mampu mengekspresi p53 atau dapat terjadi ekspresi p53 secara berlebih (overekspresi p53) namun tidak dapat bekerja sebagai pengaktivasi proses 18 transkripsi pada beberapa gen target seperti gen inhibitor cyclin-dipendent kinase CDKN1A (P21) dan GADD45. Sehingga tidak terjadi aktivasi p21, yang mengakibatkan siklus sel tidak berhenti pada akhir fase G1 dan tidak terjadi aktivasi GADD45, yang mengakibatkan perbaikan DNA tidak terjadi. Ditambah lagi, pada sel yang mengalami mutasi atau kehilangan gen P53, tidak adanya aktivasi pada gen apoptosis yaitu BAX mengakibatkan sel gagal mengalami apoptosis. Pada akhirnya, semua hal tersebut berdampak pada terfiksasinya mutasi pada sel yang membelah, khususnya DNA sehingga sel akan masuk menuju proses menuju transformasi ganas (gambar 2.5) (Syaifudin, 2007; Kumar dkk., 2010). Gambar 2.5 Proses Karsinogenesis Akibat Kegagalan Peran p53 (Kumar dkk., 2010) 19 2.2 Kanker Ovarium Kanker ovarium merupakan tumor ganas pada ovarium yang memiliki histogenisitas yang beraneka ragam, di mana dapat berasal dari ketiga dermoblast baik ekoderm, mesoderm dan endoderm. Kanker ini berdasarkan atas sel-sel penyusun ovarium dapat dibagi menjadi tiga tipe utama, yaitu: kanker ovarium tipe epitelial, germinal dan stromal (Busman, 2008). Sampai saat ini penyebab pasti dari kanker ovarium masih diperdebatkan, namun beberapa faktor risiko yang dianggap dapat menjadi penyebab timbulnya kanker ovarium, antara lain: adanya riwayat keluarga penderita kanker ovarium, mamae, dan kolon, mutasi pada gen BRCA 1 dan BRCA 2, umur di atas 50 tahun, wanita yang tidak memiliki anak atau nullipara, dan wanita yang memiliki anak pada umur lebih dari 35 tahun (Ari, 2008). 2.2.1 Epidemiologi kanker ovarium Kanker ovarium merupakan keganasan ketiga terbanyak pada saluran genitalia wanita. Kanker ovarium sangat sulit ditemukan pada stadium awal, sehingga sebagian besar kasus baru ditemukan pada stadium yang telah lanjut (Ari, 2008). Adanya keterlambatan dan kesulitan dalam melakukan diagnosis pada kanker ovarium ini sangat berhubungan dengan sifat totipoten dari ovarium, lokasi ovarium yang tersembunyi di dalam kavum pelvis, mudah terjadinya metastasis, gejala yang tidak spesifik, sosial budaya, dan pendidikan masyarakat yang relatif rendah. Terlebih lagi, deteksi dini dari kanker ovarium, sampai saat ini masih belum dapat dilakukan (Berek dan Natarajan, 2007). 20 Kanker ovarium sebagian besar terjadi pada wanita umur 40 sampai 65 tahun dan sangat jarang terjadi pada umur di bawah 40 tahun. Angka kejadian kanker ovarium mengalami peningkatan seiring dengan pertambahan umur wanita, di mana kurang lebih sebesar 16 kasus per 100.000 wanita umur 40 sampai 44 tahun meningkat menjadi 57 kasus per 100.000 wanita umur 70 sampai 74 tahun. World Health Organization (WHO) pada tahun 2002 melaporkan bahwa kanker ovarium di Indonesia menempati urutan ke empat terbanyak dengan angka insiden mencapai 15 kasus per 100.000 wanita setelah kanker payudara, korpus uteri, dan kolorektal (Fauzan, 2009). Di Amerika serikat, jumlah kasus baru dan angka mortalitas kanker ovarium meningkat setiap tahunnya, di mana pada tahun 2002 diperoleh sebanyak 23.300 kasus, dengan angka kematian sebesar 56,29% dari kasus tersebut. Pada tahun 2003 meningkat menjadi 25.400 kasus dengan angka kematian sebesar 59,66% dari kasus dan tahun 2007 menjadi 22.430 kasus baru dengan angka kematian meningkat mencapai 68,12%. Bahkan pada tahun 2010 diperkirakan sebanyak 21.880 kasus baru akan terdiagnosis dengan angka kematian yang masih tinggi yaitu sebesar 63,30% (American Cancer Society, 2010). Penelitian yang dilakukan di Rumah Sakit Umum Pusat Nasional (RSUPN) Cipto Mangunkusumo pada tahun 2008 didapatkan adanya peningkatan angka kejadian kanker ovarium setiap tahunnya yang dirawat di RSUPN Cipto Mangunkusumo dari tahun 2003 sampai 2007 (gambar 2.6) (Fauzan, 2009). 21 Gambar 2.6 Angka Kejadian Kanker Ovarium di RSUPN Cipto Mangunkusumo pada Tahun 2003 sampai 2007 (Fauzan, 2009) Angka kejadian kanker ovarium di Indonesia berdasarkan data Badan Registrasi Kanker pada tahun 2006 mencapai 11,9% (Badan Registrasi Kanker, 2006). Angka kejadian kanker ovarium di Rumah Sakit Umum Pusat (RSUP) Sanglah pada tahun 2005 diperoleh sebesar 35% dari seluruh kanker ginekologi dengan survival rate selama lima tahunnya hanya sebesar 15% (Karyana, 2005). 2.2.2 Faktor risiko kanker ovarium Sampai saat ini penyebab pasti dari kanker ovarium masih diperdebatkan, namun beberapa faktor risiko yang dianggap dapat menjadi penyebab timbulnya kanker ovarium, antara lain adalah: genetik, umur, kehamilan dan paritas, penggunaan obat kontrasepsi oral, terapi hormon pengganti pada masa menopause, obat-obatan yang meningkatkan kesuburan, Indek Massa Tubuh (IMT) dan riwayat keluarga (Fauzan, 2009). 2.2.2.1 Genetik Berbagai kelainan genetik diduga berperan dalam menentukan terjadinya kanker ovarium. Beberapa gen dan ekspresi protein gen yang mengalami kelainan dan terlibat dalam karsinogenesis terjadinya kanker ovarium telah diketahui. 22 Secara umum berbagai gen berperan dalam karsinogenesis kanker ovarium. Adanya mutasi atau delesi pada gen P53 merupakan kelainan yang paling sering ditemukan, di mana pada lebih dari 50% kasus kanker ovarium, khususnya pada stadium yang telah lanjut (Granstrom, 2008). Pada saat sekarang ini, telah dikembangkan berbagai jenis penelitian untuk mengetahui hubungan antara gen P53 maupun ekspresi p53 terhadap stadium kanker ovarium. Hasil-hasil penelitian tersebut diharapkan dapat menjadi masukan atau tambahan pemikiran dalam rangka mendukung pengembangan ide pemanfaatan gen P53 dan ekspresi p53 sebagai deteksi dini dalam diagnostik kanker ovarium. Penelitian yang dilakukan oleh Lobna (2010) memperoleh hasil bahwa sebanyak 42 (73,7%) dari 57 sampel mengalami ekspresi p53 positif. Adanya ekspresi p53 yang positif tersebut memiliki hubungan dengan stadium kanker ovarium, khususnya pada stadium lanjut. Penelitian yang dilakukan oleh Rauf dan Masadah (2009) dari Universitas Hassanudin, Makasar terhadap 41 pasien kanker ovarium. Penelitian ini bertujuan untuk mengidentifikasi nilai prognostik ekspresi p53 terhadap kanker ovarium. Pada seluruh sampel dilakukan analisis imunohistokimia p53 dalam jaringan kanker ovarium dari pasien yang telah dioperasi. Hasilnya, derajat ekspresi p53 ditemukan lebih tinggi pada kanker ovarium stadium lanjut dan pemantauan selama enam bulan sampai dua tahun setelah operasi menunjukkan bahwa pasien yang mempunyai ekspresi p53 yang tinggi juga diperoleh angka kematian yang tinggi. Penelitian yang dilakukan oleh Pasyrii dkk. (2007) pada 141 jaringan pasien kanker ovarium stadium lanjut, bertujuan untuk menentukan peran dari p53 sebagai faktor prognostik pada kanker 23 ovarium. Pada seluruh sampel tersebut dilakukan analisis p53 dengan menggunakan teknik analisis protein secara kuantitatif. Hasilnya, diperoleh jumlah ekspresi p53 inti dan sitoplasma yang tinggi berhubungan dengan semakin besarnya harapan hidup lima tahunan dari pasien tersebut, masing-masing dengan nilai p= 0,0338 dan p= 0,0002 (p<0,005). Penelitian yang dilakukan oleh Adiyanti (2007) yang bertujuan untuk menilai hubungan antara ekspresi p53 dengan stadium kanker ovarium di Rumah Sakit Sardjito, Yogyakarta. Penelitian tersebut memperoleh hasil bahwa terdapat hubungan yang signifikan antara ekspresi p53 dengan stadium kanker ovarium. Penelitian yang dilakukan oleh Havrilesky dkk. (2002) pada 125 blok parafin pasien kanker ovarium stadium lanjut. Penelitian ini bertujuan untuk menentukan peran dari p53 sebagai faktor prognostik pada kanker ovarium, khusunya dalam hubungannya dengan derajat differensiasi dan lama harapan hidup pasien kanker ovarium serta hubungan overekspresi p53 dengan jenis kelainan gen P53 yang ditemukan pada sampel. Pada seluruh sampel dilakukan analisis p53 dengan menggunakan teknik imunohistokimia. Hasilnya, diperoleh jumlah ekspresi p53 berhubungan positif dengan derajat differensiasi namun tidak berhubungan dengan besarnya harapan hidup lima tahunan dari pasien tersebut. Dari 55 sampel yang mengalami overekspresi p53, sebesar 100% ditemukan kelainan berupa missense mutation. Kanker ovarium juga diduga berhubungan dengan terjadinya mutasi pada gen BRCA 1 dan BRCA 2. Kedua gen tersebut juga telah diketahui memiliki peranan yang penting dalam patogenesis molekuler terjadinya kanker payudara atau mamae (Chen dan Parmigiani, 2007; Busman, 2008). 24 Berbagai kelainan pada gen dan ekspresi protein gen tersebut dapat dibagi menjadi empat kelompok, yaitu onkogen yang memicu pertumbuhan, gen supresor kanker atau tumor yang tidak aktif, perubahan gen perbaikan DNA, dan perubahan gen apoptosis (Kumar dkk., 2010). Secara lengkap pembagian dan fungsi dari masing-masing gen dapat dilihat pada tabel 2.2. Tabel 2.2 Kelompok Gen dan Ekspresi Protein Abnormal pada Kanker Ovarium Kelompok Lokasi/Kategori Gen Keterangan Onkogen TGF-α TGFA Overekspresi EGF receptor HER-2/neu Overekspresi FMS- like tyrosine FLT3 Amplifikasi Kinase 3 GTP-binding KRAS/HRAS Point mutation RAS signal BRAF Point mutation transduction Transcriptional MYC Amplifikasi activator Cyclin dependent CDK1 Amplifikasi kinase Inaktivasi gen supresor tumor Inti sel Perubahan gen Inti sel perbaikan DNA Perubahan Inti sel gen apoptosis (Kumar dkk., 2010) P53 BRCA1 BRCA2 BCL2 Penghentian siklus sel, apoptosis(-) Perbaikan DNA(-) Inhibisi apoptosis meningkat 2.2.2.2 Umur Risiko kejadian kanker ovarium meningkat seiring dengan bertambahnya umur. Sebanyak 80% dari kejadian kanker ovarium ditemukan pada umur wanita lebih dari 45 tahun, namun pada beberapa kasus kanker ovarium juga dapat 25 ditemukan pada umur yang relatif lebih muda daripada kanker pada wanita lainnya, yaitu umur 20 sampai 30 tahun (Fauzan, 2009). Kanker ovarium dapat ditemukan pada semua golongan umur, bahkan pada kasus yang jarang, juga dapat ditemukan pada bayi bawah lima tahun (balita) dan anak-anak. Namun angka kejadian paling banyak ditemukan pada rentang umur 60 sampai 74 tahun dengan median umur saat terdiagnosis adalah 59 tahun. Bahkan, risiko tumor ovarium untuk mangalami degradasi keganasan pun meningkat seiring dengan bertambahnya umur, di mana risiko keganasan didapatkan sebesar 13% pada wanita premenopause dan 45% postmenopause (Colditz, 2004). Kasus Rerata wanita Gambar 2.7 Angka Kejadian Kanker Ovarium Berdasarkan Umur Spesifik dan Jumlah Wanita di United of Kingdom pada tahun 2006 (Granstrom, 2008) Penelitian yang dilakukan oleh Cancer Research United of Kingdom pada tahun 2006, diperoleh hasil bahwa, angka kejadian kanker ovarium meningkat seiring dengan bertambahnya umur, di mana kasus tertinggi kanker ovarium 26 ditemukan pada kelompok wanita umur 60 sampai 64 tahun (gambar 2.7) (Granstrom, 2008). 2.2.2.3 Kehamilan dan paritas Kehamilan dan paritas merupakan salah satu faktor risiko yang penting dalam menentukan terjadinya kanker ovarium. Wanita yang sudah pernah hamil memiliki risiko untuk mengalami kanker ovarium sekitar 50% lebih rendah daripada wanita yang belum pernah hamil atau nullipara. Bahkan, wanita yang telah beberapa kali hamil risiko terjadinya kanker ovarium menjadi semakin berkurang (Czyz, 2008). Penelitian yang dilakukan oleh Cancer Research United of Kingdom pada tahun 2006 menyimpulkan bahwa semakin tinggi jumlah paritas maka semakin rendah kemungkinan risiko terjadinya kanker ovarium. Pada wanita yang tidak memiliki anak atau nullipara memiliki risiko dua kali lipat lebih besar untuk terjadinya kanker ovarium daripada wanita dengan paritas tiga atau lebih (tabel 2.3) (Granstrom, 2008). Tabel 2.3 Hubungan Jumlah Paritas dengan Risiko Kanker Ovarium Jumlah paritas Risiko Relatif (95% CI) 3+ 1,0 2 1,21 (1,10-1,32) 1 1,60 (1,43-1,79) 0 2,12 (1,81-2,48) (Granstrom, 2008) 2.2.2.4 Penggunaan kontrasepsi oral Penelitian yang dilakukan oleh Center of Diseases Control (CDC) menyimpulkan bahwa penggunaan obat kontrasepsi oral dapat menurunkan risiko kejadian kanker ovarium kurang lebih sebesar 40% pada wanita yang berumur 20 27 sampai 54 tahun, dengan risiko relatif sebesar 0,6. Penelitian lainnya melaporkan bahwa penggunaan pil kontrasepsi selama kurang lebih satu tahun dapat menurunkan risiko kejadian kanker ovarium sebesar 11%, sedangkan apabila pemakaian mencapai lima tahun maka risiko terjadinya kanker ovarium dapat semakin menurun, bahkan mencapai 50% (Fauzan, 2009). Penelitian yang dilakukan oleh Beral (2008) juga memperoleh hasil bahwa penurunan risiko relatif terjadinya kanker ovarium sesuai dengan lamanya pemakaian kontrasepsi oral, di mana pada wanita yang memakai kontrasepsi oral selama kurang dari satu tahun memiliki risiko relatif 1 dan semakin menurun mencapai 0,42 pada pemakaian yang lebih dari lima belas tahun (gambar 2.8). Never use Gambar 2.8 Hubungan Lama Pemakaian Kontrasepsi Oral dengan Risiko Kanker Ovarium (Beral, 2008) Setelah dilakukan analisis lanjutan terhadap jenis hormon pada obat kontrasepsi, diperoleh bahwa hormon yang berperan dalam menurunkan risiko terjadinya kanker ovarium tersebut adalah progesteron. Penggunaan obat yang menggandung hormon estrogen saja khususnya pada wanita pascamenopause 28 justru meningkatkan risiko terjadinya kanker ovarium namun penggunaan kombinasi progesteron dan estrogen atau progesteron saja akan menurunkan risiko terjadinya kanker ovarium (Busman, 2008). 2.2.2.5 Terapi hormon pengganti pada masa menopause Pemakaian terapi hormon pengganti pada wanita menopause dengan menggunakan estrogen dalam jangka waktu sepuluh tahun dapat meningkatkan risiko relatif sebesar 2,2 untuk terjadinya kanker ovarium. Pada pemakaian yang lebih lama lagi, selama 20 tahun lebih meningkatkan risiko relatif menjadi 3,2 untuk terjadinya kanker ovarium (Busman, 2008). Pada pemakaian terapi hormonal yang dikombinasikan dengan pemberian progestin juga masih meningkatkan risiko relatif sebesar 1,5 untuk terjadinya kanker ovarium (Zhou, 2008; Beral, 2007). 2.2.2.6 Obat-obatan yang meningkatkan kesuburan Obat-obat yang meningkatkan kesuburan atau fertilitas, seperti klomifen sitrat dan obat-obatan gonadotropin, seperti Follicle Stimulating Hormone (FSH) dan Luteinizing Hormone (LH) dapat menginduksi terjadinya ovulasi baik tunggal maupun multipel. Hal tersebut ternyata meningkatkan risiko seorang wanita mengalami kanker ovarium. Pada pemakaian klomifen sitrat lebih dari dua belas siklus, dapat meningkatkan risiko relatif sebesar sebelas kali untuk menjadi kanker ovarium (Busman, 2008). 2.2.2.7 Indek Massa Tubuh (IMT) Berbagai penelitian membuktikan bahwa peningkatan IMT dapat meingkatkan risiko terjadinya kanker ovarium (Reeves, 2007). Penelitian yang 29 dilakukan oleh European Prospective Investigation into Cancer and Nutrition tahun 2006 memperoleh hasil bahwa pada wanita dengan IMT di atas 30 atau obesitas memiliki risiko relatif sebesar 1,59 untuk terjadinya kanker ovarium dibandingan dengan wanita dengan IMT normal (Lahmann, 2009). Penelitian yang berbeda memperoleh hasil bahwa peningkatan IMT pada wanita premenopause meningkatkan risiko terjadinya kanker ovarium dengan risiko relatif sebesar 1,72. Namun peningkatan IMT tersebut tidak bermakna meningkatkan risiko terjadinya kanker ovarium pada wanita pascamenopause (Schouten, 2008). 2.2.2.8 Riwayat keluarga Adanya riwayat keluarga yang menderita kanker ovarium dapat meningkatkan risiko terjadinya kanker ovarium pada anggota keluarga yang lainnya (Granstrom, 2008). Secara umum, risiko terjadinya kanker ovarium adalah 1,6% pada keseluruhan populasi. Risiko tersebut dapat lebih meningkat menjadi 4 sampai 5% apabila ada satu anggota keluarga, baik ibu atau saudara kandung, menderita kanker ovarium. Apabila terdapat dua anggota keluarga yang menderita kanker ovarium, maka risiko menderita kanker ovarium meningkat menjadi 7%. Adanya riwayat kanker payudara dan kolon juga dapat meningkatkan risiko terjadinya kanker ovarium pada anggota keluarga yang lainnya (Busman, 2008). 2.2.3 Patogenesis kanker ovarium Berbagai penelitian dalam rangka mengungkap patogenesis berbagai karsinogen sebagai penyebab terjadinya kanker ovarium masih belum menujukkan hasil. Walaupun penyebab pasti kanker ovarium masih belum 30 ditemukan, beberapa teori telah dikemukakan oleh para ahli dalam rangka mengungkap patogenesis terjadinya kanker ovarium, antara lain: teori incessant ovulation, inflamasi dan gonadotropin. 2.2.3.1 Teori incessant ovulation Teori Incessant ovulation ini beranggapan bahwa adanya trauma berulang pada ovarium selama proses ovulasi, mengakibatkan epitel ovarium mudah terpajan atau terpapar oleh berbagai faktor risiko sehingga dapat mengakibatkan terjadinya kelainan atau abnormalitas genetik. Semakin dini usia wanita mengalami menstruasi, semakin terlambat mencapai menopause, tidak pernah hamil atau memiliki keturunan merupakan berbagai kondisi yang dapat meningkatkan frekuensi ovulasi. Berbagai kondisi yang menekan frekuensi ovulasi, seperti kehamilan dan menyusui justru menurunkan risiko terjadinya kanker ovarium (Choi, 2007). Adanya ovulasi dan semakin bertambahnya umur seorang wanita meyebabkan terperangkapnya fragmen epitel permukaan ovarium pada cleft atau invaginasi pada permukaan dan badan inklusi pada kortek ovarium. Beberapa penelitian telah membuktikan bahwa terdapat hubungan antara frekuensi metaplasia dan neoplasma pada daerah-daerah ovarium yang mengalamai invaginasi dan terbentuknya badan inklusi (Choi, 2007). 2.2.3.2 Teori inflamasi Teori ini diangkat berdasarkan pada penelitian yang memperoleh hasil bahwa angka insiden kanker ovarium meningkat pada wanita yang mengalami infeksi atau radang pada panggul. Menurut teori ini, berbagai karsinogen dapat mencapai 31 ovarium melalui saluran genitalia. Walaupun adanya proteksi terhadap risiko kanker ovarium melalui ligasi tuba dan histerektomi mendukung teori ini, namun peranan signifikan faktor reproduksi lainnya tidak dapat dijelaskan dengan teori ini (Choi, 2007). 2.2.3.3 Teori gonadotropin Teori ini dapat dijadikan sebagai dasar timbulnya kanker ovarium. Adanya kadar gonadotropin yang tinggi, berkaitan dengan lonjakan yang terjadi selama proses ovulasi dan hilangnya gonadal negative feedbeck pada menopause dan kegagalan ovarium prematur memegang peranan penting dalam perkembangan dan progresivitas kanker ovarium (Choi, 2007). Perkembangan kanker ovarium dipengaruhi oleh hormon-hormon hipofisis pada berbagai macam tikus. Pada hewan tersebut, adanya penurunan estrogen dan peningkatan sekresi gonadotropin hipofisis dapat mengakibatkan perkembangan kanker ovarium. Ovarium yang terpapar bahan karsinogen, seperti Dimethylbenzanthrene (DMBA) akan berkembang menjadi kanker setelah ditransplantasikan pada tikus yang telah menjalani ooforektomi, namun hal tersebut tidak ditemukan pada tikus yang sebelumnya dilakukan pengangkatan kelenjar pituitari (Choi, 2007). Penelitian yang dilakukan Cramer dan Welch bertujuan untuk menilai hubungan antara kadar gonadotropin dengan estrogen. Adanya sekresi gonadotropin dalam jumlah yang tinggi ternyata mengakibatkan peningkatan stimulasi estrogen pada epitel permukaan ovarium. Hal tersebut diduga berperan dalam meningkatkan risiko terjadinya kanker ovarium (Choi, 2007). 32 2.2.4 Stadium kanker ovarium Stadium kanker ovarium ditentukan berdasarkan pada penemuan yang dilakukan saat melakukan eksplorasi. Stadium kanker ovarium menurut International Federation of Gynecology and Obstetrics (FIGO) berdasarkan pada hasil evaluasi pembedahan terhadap tumor ovarium primer dan penemuan penyebarannya dapat dilihat pada tabel 2.4 (Berek dan Natarajan, 2007). Tabel 2.4 Kriteria Stadium Kanker Ovarium Menurut FIGO Stadium Kriteria I Pertumbuhan tumor terbatas pada ovarium Ia Pertumbuhan tumor terbatas pada satu ovarium, cairan ascites tidak mengandung sel-sel ganas, tidak ada pertumbuhan tumor pada permukaan luar tumor, kapsul utuh Ib Pertumbuhan tumor terbatas pada kedua ovarium, cairan ascites tidak mengandung sel-sel ganas, tidak ada pertumbuhan tumor pada permukaan luar tumor, kapsul utuh. Ic Tumor pada stadium Ia atau Ib tetapi dengan pertumbuhan tumor pada permukaan luar dari satu atau kedua atau kapsul pecah atau cairan ascites atau cairan bilasan peritoneum mengandung sel-sel ganas II Pertumbuhan tumor pada satu atau kedua ovarium dengan perluasan ke rongga pelvis IIa Penyebaran dan atau metastasis ke uterus dan atau tuba fallopi IIb Penyebaran tumor ke organ pelvis lainnya IIc Tumor dengan stadium IIa atau IIb, tetapi dengan pertumbuhan tumor pada pemukaan luar dari satu atau kedua ovarium atau kapsul pecah atau cairan ascites atau cairan bilasan peritoneum mengandung sel-sel ganas III Tumor melibatkan satu atau kedua ovarium dengan implantasi di luar pelvis dan atau terdapat pembesaran kelenjar limfe inguinal atau retroperitoneal. Metastasis pada pemukaan liver sesuai dengan stadium III. Tumor terbatas pada pelvis, tetapi pemeriksaan histologi menunjukkan penyebaran tumor ke usus halus atau omentum (Berek dan Natarajan, 2007) 33 Tabel 2.4 Kriteria Stadium Kanker Ovarium Menurut FIGO (lanjutan) Stadium Kriteria IIIa Tumor secara makroskopis terbatas pada pelvis dan tidak ada pembesaran kelenjar limfe, tetapi pemeriksaan histologi menunjukkan penyebaran ke permukaan peritoneum abdominal IIIb Tumor pada satu atau kedua ovarium dengan penyebaran di permukaan peritoneum berdiameter tidak lebih dari 2 cm dan didukung oleh hasil pemeriksaan histologi. Tidak ada penyebaran ke kelenjar limfe IIIc Terdapat penyebaran pada peritoneum abdominal dengan diameter lebih dari 2 cm atau terdapat penyebaran ke kelenjar limfe retroperitoneal atau inguinal atau keduanya IV Pertumbuhan tumor meliputi satu atau kedua ovarium dengan metastase jauh. Bila terdapat efusi pleura, harus ditemukan sel-sel ganas pada pemeriksaan sitologi. Metastasis pada parenkim liver sesuai dengan stadium IV (Berek dan Natarajan, 2007) 2.3 Imunohistokimia Imunohistokimia merupakan suatu teknik untuk menentukan keberadaan suatu antigen atau protein target dalam jaringan atau sel dengan menggunakan reaksi antigen-antibodi. Teknik ini diawali dengan prosedur histoteknik, yaitu suatu prosedur pembuatan irisan jaringan yang kemudian diamati di bawah mikroskop. Setelah terbentuk suatu irisan jaringan, selanjutnya dapat dilakukan prosedur imunohistokimia (Fatchiyah, 2006). Interaksi antara antigen dan antibodi merupakan suatu reaksi kimia yang tidak kasat mata, sehingga diperlukan visualisasi adanya ikatan tersebut dengan melabel antibodi yang digunakan dengan enzim atau fluorokrom. Enzim yang digunakan untuk melabel selanjutnya direaksikan dengan substrat kromogen, yaitu substrat yang menghasilkan produk akhir berwarna dan tidak larut, yang dapat diamati dengan mikroskop cahaya. Pengecatan imunohistokimia yang menggunakan 34 fluorokrom untuk melabel antibodi, dapat langsung diamati tanpa harus direaksikan dengan bahan-bahan yang menghasilkan warna di bawah mikroskop fluorescence (Fatchiyah, 2006). Terdapat dua metode dasar dalam melakukan identifikasi antigen pada suatu jaringan melalui pemeriksaan imunohistokimia, yaitu (CCRC, 2009a): a. Metode langsung (direct method) Metode langsung merupakan metode pengecatan satu langkah, oleh karena hanya melibatkan satu jenis antibodi, yaitu antibodi yang berlabel. Salah satu contoh antibodi berlabel adalah antiserum terkonjugasi Fluorescein isothiocyanate (FITC) dan rodhamin. b. Metode tidak langsung (indirect method) Metode tidak langsung menggunakan dua macam antibodi, yaitu antibodi primer yang tidak berlabel dan antibodi sekunder yang berlabel. Antibodi primer berperan dalam mengenali antigen yang diidentifikasi pada jaringan (first layer) sedangkan antibodi sekunder akan berikatan dengan antibodi primer (second layer). Antibodi kedua merupakan anti-antibodi primer. Pelabelan antibodi sekunder diikuti dengan penambahan substrat berupa kromogen. Kromogen merupakan suatu gugus fungsi senyawa kimiawi yang dapat membentuk senyawa berwarna bila bereaksi dengan senyawa tertentu. Penggunaan kromogen fluorescent dye seperti FITC, rodhamin dan texas-red disebut metode immunofluorescence, sedangkan penggunaan kromogen enzim seperti peroksidase, alkali fosfatase atau glukosa oksidase disebut metode immunoenzyme. 35 Untuk menjamin agar antibodi dapat mengikat antigen, maka sel harus difiksasi dengan ditempelkan pada bahan pendukung padat sehingga antigen menjadi immobile. Hal ini dapat dilakukan dengan menumbuhkan sel pada slide mikroskop, coverslip, atau bahan pendukung plastik yang sesuai. Secara umum, terdapat dua macam metode fiksasi, yaitu pelarut organik dan reagen crosslinking. Pelarut organik seperti alkohol dan aseton akan memindahkan lipid, mendehidrasi sel dan mengendapkan protein. Reagen cross-linking seperti paraformaldehid membentuk jembatan intermolekuler melalui gugus amino bebas (CCRC, 2009a). Imunohistokimia melibatkan inkubasi sel dengan antibodi. Antibodi akan berikatan dengan antigen atau protein spesifik di dalam sel. Antibodi yang tidak berikatan dapat dipisahkan dengan pencucian, sedangkan antibodi yang berikatan dideteksi secara langsung dengan antibodi primer berlabel, maupun secara tidak langsung dengan antibodi sekunder berlabel enzim atau fluorescence (CCRC, 2009a). 36 BAB III KERANGKA BERPIKIR, KONSEP DAN HIPOTESIS PENELITIAN 3.1 Kerangka Berpikir Sampai saat ini penyebab pasti dari kanker ovarium masih diperdebatkan, namun beberapa faktor risiko yang dianggap mampu mengakibatkan terjadinya kanker ovarium, antara lain: faktor genetik, umur, kehamilan, penggunaan obat kontrasepsi hormonal, terapi hormon pengganti pada masa menopause, Indek Massa Tubuh (IMT) dan riwayat adanya keluarga dengan kanker ovarium, mamae, dan kolon. Berbagai kelainan genetik diduga berperan dalam menentukan terjadinya kanker ovarium. Beberapa gen dan ekspresi protein gen yang mengalami kelainan dan terlibat dalam karsinogenesis terjadinya kanker ovarium telah diketahui. Kelainan pada gen dan ekspresi protein gen tersebut dapat dibagi menjadi tiga, yaitu onkogen yang memicu pertumbuhan, inaktivasi gen supresor tumor dan perubahan gen apoptosis. Pertama adalah onkogen, beberapa gen yang termasuk dalam kelompok ini diantaranya adalah gen HER2-neu, RAS, MYC, dan CDK1. Onkogen merupakan suatu kelainan pada gen yang mengakibatkan terjadinya peningkatan aktivasi pertumbuhan dan atau pembelahan seluler, sehingga akan mengarahkan sel pada pertumbuhan yang tidak terkendali. Kedua adalah inaktivasi gen supresor tumor. Gen-gen yang termasuk dalam kelompok ini meliputi BRCA1, BRCA2 dan P53. Adanya inaktivasi pada BRCA1 36 37 dan BRCA2 mengakibatkan terjadinya gangguan penyembuhan kerusakan sel atau DNA. P53 yang mengalami inaktivasi, misalnya pada sel yang mengalami mutasi atau kehilangan gen P53, maka ekspresi p53 tidak terjadi atau terjadi ekspresi p53 namun tidak dapat mengaktivasi proses transkripsi pada beberapa gen target seperti gen inhibitor kinase dipendent-cyclin CDKN1A (P21) dan GADD45. Kegagalan ekspresi p21 mengakibatkan siklus sel tidak dapat berhenti pada akhir fase G1 dan ekspresi GADD45 mengakibatkan tidak terjadinya perbaikan DNA. Keberadaan onkogen dan inaktivasi gen supresor tumor selanjutnya akan mengakibatkan proliferasi sel menjadi tidak terkontol. Ketiga, perubahan pada gen pengatur apoptosis, terutama diperankan oleh BAX dan BCL2. Pada perubahan fungsi proapoptosis dari gen BAX, di mana tidak terjadi aktivasi BAX akan mengakibatkan sel tidak mampu mengalami proses apoptosis. Perubahan fungsi anti apoptosis gen BCL2, justru akan memperberat ketidakmampuan sel untuk mengalami proses apoptosis. Pada akhirnya, proliferasi sel yang tidak terkendali dan kegagalan proses apoptosis akan berdampak pada terfiksasinya mutasi pada sel yang membelah, khususnya DNA sehingga mengarahkan sel menuju proses transformasi ganas, salah satunya adalah kanker ovarium. 38 3.2 Konsep Penelitian Secara skematis konsep penelitian diperlihatkan pada gambar 3.1. Genetik Onkogen HER2-neu, RAS, MYC, CDK1 ↑Aktivasi pertumbuhan Inaktivasi gen supresor tumor Perubahan gen apoptosis BRCA1 BRCA2 P53 BCL2 BAX (-) DNA repair (GADD45) (-) cycle cell arrest (P21) Inhibisi apoptosis↑ Proliferasi sel tidak terkontrol - Umur - Paritas - Indek Massa Tubuh (IMT) - Riwayat kontrasepsi hormonal - Riwayat terapi hormonal pada masa menopause - Riwayat keluarga kanker ovarium, mamae dan kolon Penurunan apoptosis Kanker Ovarium Stadium Kanker Ovarium Gambar 3.1 Konsep Penelitian 3.3 Hipotesis Penelitian Adapun hipotesis pada penelitian ini adalah: Ada hubungan antara ekspresi protein 53 (p53) dengan stadium kanker ovarium. 39 BAB IV METODE PENELITIAN 4.1 Rancangan Penelitian Rancangan penelitian ini adalah observasional analitik (cross-sectional). Secara sistematik penelitian dapat digambarkan sebagai berikut. p53 (+) Stadium I p53 (-) p53 (+) Stadium II p53 (-) Kanker Ovarium p53 (+) Stadium III p53 (-) p53 (+) Stadium IV p53 (-) Gambar 4.1 Rancangan Penelitian 39 40 4.2 Tempat dan Waktu Penelitian Penelitian ini dilaksanakan di Bagian Kebidanan dan Penyakit Kandungan, Patologi Anatomi dan Rekam Medis Rumah Sakit Umum Pusat (RSUP) Sanglah, Denpasar. Waktu Penelitian dilaksanakan mulai Juli 2011 sampai Juli 2013. 4.3 Populasi Penelitian Populasi target penelitian adalah pasien kanker ovarium yang berobat ke RSUP Sanglah. Populasi tarjangkau penelitian adalah pasien kanker ovarium yang telah menjalani pembedahan di RSUP Sanglah dari tahun 2008 sampai 2013, di mana jaringan hasil pembedahannya tersebut telah dibuat blok parafin di Bagian Patologi Anatomi RSUP Sanglah. 4.4 Sampel Penelitian Sampel penelitian ini adalah pasien kanker ovarium yang telah menjalani pembedahan di RSUP Sanglah dari tahun 2008 sampai 2013, di mana jaringan hasil pembedahannya tersebut telah dibuat blok parafin di Bagian Patologi Anatomi RSUP Sanglah serta memenuhi kriteria inklusi dan eksklusi. 4.4.1 Kriteria inklusi Kriteria inklusi penelitian adalah: a. Blok parafin telah diperiksa secara histopatologis, sehingga telah terdiagnosis pasti kanker ovarium. b. Data rekam medis yang lengkap, meliputi: stadium kanker ovarium, umur, paritas, Indek Massa Tubuh (IMT), riwayat kontrasepsi hormonal, riwayat terapi hormonal pada masa menopause, riwayat keluarga kanker ovarium, mamae, dan kolon. 41 4.4.2 Kriteria eksklusi Kriteria eksklusi penelitian adalah: a. Pasien pernah menjalani kemoterapi sebelum pembedahan (neoadjuvant). b. Blok parafin rusak sehingga tidak dapat digunakan atau dianalisis. c. Data rekam medis pasien kanker ovarium tidak ditemukan atau tidak lengkap. 4.4.3 Perhitungan besar sampel Besar sampel pada penelitian ini dihitung dengan menggunakan rumus sebagai berikut (Araoye, 2003): Zα 2 (pq) n= ……..……………………………………………………….......(1) d 2 Keterangan: n = besar sampel Zα = 1,96 (α = 0,05) p = 11,9% (prevalensi dari stadium kanker ovarium di populasi) q = 88,1% (1-p) d = 10% (penyimpangan absolut penelitian) Berdasarkan hasil perhitungan dengan menggunakan rumus di atas, diperoleh besar sampel penelitian adalah 43,8 buah. Sehingga dalam penelitian ini diambil sampel penelitian sebanyak 44 buah blok parafin. 4.4.4 Cara pengambilan sampel Blok parafin dari pasien kanker ovarium yang telah menjalani pembedahan di RSUP Sanglah dari tahun 2008 sampai 2013 serta telah memenuhi kriteria inklusi dan eksklusi, kemudian dipilih dengan cara random sampling sebanyak 44 buah. 42 4.5 Variabel Penelitian 4.5.1 Identifikasi variabel Identifikasi variabel adalah sebagai berikut: 4.5.1.1 Variabel bebas : stadium kanker ovarium 4.5.1.2 Variabel tergantung : protein 53 (p53) 4.5.1.3 Variabel terkontrol : umur, paritas, Indek Massa Tubuh (IMT), riwayat kontrasepsi hormonal, riwayat terapi hormonal pada masa menopause, riwayat keluarga kanker ovarium, mamae, dan kolon. 4.5.2 Definisi operasional variabel Adapun definisi operasional variabel penelitian adalah sebagai berikut: a. Protein 53 (p53) adalah suatu polipeptida yang diekspresikan atau dikode oleh gen P53 yang dinilai secara imunohistokimia menggunakan antibodi monoklonal p53 Labvision, secara semikuantitatif, diantara 200 epitel ganas, diamati dengan mikroskop cahaya binokuler merk Olympus dengan pembesaran 400 kali. Penghitungan dilakukan pada sepuluh lapangan pandang dimulai dari bagian tumor dengan ekspresi p53 terkuat ke bagian yang lebih lemah. Pemeriksaan imunohistokimia p53 dikerjakan di Bagian Patologi Anatomi RSUP Sanglah. Interpretasi p53 dilakukan tanpa mengetahui data klinikopatologi pasien. Sel yang mengekspresikan p53 akan tampak berwarna coklat pada membran sel. Penilaian ekspresi p53 ditentukan berdasarkan analisis persentase sel tumor yang positif dan intensitas pewarnaan, yang kemudian diberikan skor 0, 1+, 2+, dan 3+ (Rosai, 2004). Kemudian dari skor 43 tersebut dikelompokkan menjadi dua yaitu ekspresi p53 dikatakan (+) apabila skor 1+, 2+, atau 3+. Ekspresi p53 dikatakan (-) apabila skor 0, (Yamashita, 2004). b. Stadium kanker ovarium adalah derajat beratnya kanker ovarium menurut International Federation of Gynecology and Obstetrics (FIGO) yang diperoleh berdasarkan evaluasi pembedahan terhadap tumor ovarium primer dan penyebarannya, yang terdiri dari stadium I, II, III, dan IV. Stadium kanker ovarium diperoleh dari data atau rekam medis pasien. c. Umur adalah usia pasien dalam tahun yang diperoleh dari rekam medis pasien. d. Paritas adalah jumlah janin viabel yang dilahirkan, diperoleh dari rekam medis pasien. e. Indek Massa Tubuh (IMT) adalah indek antopometri yang dihitung dengan menggunakan parameter berat badan dan tinggi badan, yaitu barat badan (dalam kilogram) dibagi dengan kuadrat dari tinggi badan (dalam meter). Barat badan dan tinggi badan diperoleh dari catatan rekam medis. Kemudian hasil perhitungan tersebut dimasukkan dalam kelompok berdasarkan kategori IMT menurut Departemen kesehatan (Depkes) tahun 1994, dapat dilihat pada tabel 4.1 (Supariasa, 2001). Tabel 4.1 Kategori Indek Massa Tubuh (IMT) untuk Indonesia Kategori IMT (kg/m2) Kurang berat badan berat < 17,0 Kurang berat badan ringan 17,0 – 18,5 Normal > 18,5 – 25,0 Kelebihan berat badan ringan > 25,0 – 27,0 Kelebihan berat badan berat > 27,0 (Supariasa, 2001) 44 f. Riwayat kontrasepsi hormonal adalah alat atau metode kontrasepsi hormonal yang pernah dipergunakan, yang diperoleh dari rekam medis pasien. g. Riwayat terapi hormonal pada masa menopause adalah penggunaan obat hormonal setelah pasien tidak mengalami menstruasi selama satu tahun, yang diperoleh dari rekam medis pasien. h. Riwayat keluarga kanker ovarium, mamae dan kolon adalah adanya keluarga pasien yang sebelumnnya atau sedang menderita kanker ovarium, mamae dan kolon yang diperoleh dari rekam medis pasien. 4.6 Alur Penelitian Blok parafin kanker ovarium di Bagian Patologi Anatomi RSUP Sanglah dari pasien kanker ovarium yang menjalani pembedahan di RSUP Sanglah dari tahun 2008 sampai 2013. Blok parafin tersebut telah diperiksa secara histopatologi di Bagian Patologi Anatomi dan terdiagnosis pasti kanker ovarium. Blok parafin kanker ovarium selanjutnya harus memenuhi kriteria inklusi dan eksklusi penelitian. Pada kriteria inklusi, blok parafin telah diperiksa secara histopatologis, sehingga telah terdiagnosis pasti kanker ovarium di Bagian Patologi Anatomi RSUP Sanglah. Selanjutnya blok parafin tersebut didata kelengkapan rekam medisnya di Bagian Rekam Medis RSUP Sanglah. Kelengkapan yang dicari, meliputi: stadium kanker ovarium, umur, paritas, Indek Massa Tubuh (IMT), riwayat kontrasepsi hormonal, riwayat terapi hormonal pada masa menopause, riwayat keluarga kanker ovarium, mamae dan kolon. Pada kriteria eksklusi, antara lain: pasien pernah menjalani kemoterapi sebelum pembedahan (neoadjuvant), 45 blok parafin rusak sehingga tidak dapat digunakan atau dianalisis dan data rekam medis pasien kanker ovarium tidak ditemukan atau tidak lengkap. Blok parafin dari semua pasien kanker ovarium yang telah menjalani pembedahan di RSUP Sanglah dari tahun 2008 sampai 2013 serta telah memenuhi kriteria inklusi dan eksklusi, kemudian dipilih dengan cara random sampling sebanyak 44 buah. Sampel blok parafin ini dikelompokkan berdasarkan atas stadium kanker ovarium yang diperoleh dari data rekam medis, yaitu: kanker ovarium stadium I, II, III, dan IV. Kemudian masing-masing kelompok stadium dilakukan pemeriksaan ekspresi p53 dengan teknik imunohistokimia peroksidase anti-peroksidase memakai antibodi primer p53. Akhirnya, dilakukan analisis terhadap hasil pemeriksaan ekspresi p53 pada masing-masing kelompok stadium kanker ovarium. Secara sistematis alur penelitian ditunjukkan pada gambar 4.2. 46 Blok parafin pasien kanker ovarium Kriteria inklusi Kriteria eksklusi Random sampling Sampel penelitian Stadium I Stadium III Stadium II Stadium IV Ekspresi p53 (+)/(-) Analisis Gambar 4.2 Alur Penelitian 4.7 Instrumen Penelitian dan Metode Pemeriksaan 4.7.1 Instrumen penelitian Instrumen untuk alat-alat tulis yaitu meja tulis, formulir penelitian, komputer, kertas dan alat tulis serta perlengkapan lainnya. 4.7.2 Metode pemeriksaan Teknik pemeriksaan yang digunakan pada penelitian ini adalah dengan menggunakan pemeriksaan imunohistokimia. Adapun langkah-langkah pemeriksaan imunohistokimia p53 adalah sebagai berikut (CCRC, 2009b): 47 a. Potong jaringan empat mikrometer, kemudian ditempelkan pada gelas objek yang sebelumnya telah dilapisi poly-L-lysine. b. Inkubasi dalam oven dengan suhu 37°C selama satu malam. c. Deparafinisasi dengan xylene sebanyak tiga kali, masing-masing tiga menit. d. Rehidrasi preparat dengan menggunakan etanol 100%, etanol 95% dan etanol 70%, masing-masing selama dua menit, dua menit, satu menit dan terakhir dengan air selama satu menit. e. Rendam dalam peroxidase blocking solution pada suhu kamar selama sepuluh menit. f. Inkubasi preparat dalam prediluted blocking serum dengan suhu 25°C selama sepuluh menit. g. Rendam preparat di dalam antibodi monoklonal anti-p53 dengan suhu 25°C selama sepuluh menit. h. Cuci preparat dengan Phospate Buffer Saline (PBS) selama lima menit. i. Inkubasi preparat dengan antibodi sekunder dengan suhu 25°C selama sepuluh menit. j. Cuci preparat dengan PBS selama lima menit. k. Inkubasi preparat dengan peroksidase dalam suhu 25°C selama sepuluh menit. l. Cuci preparat dengan PBS selama lima menit. m. Inkubasi preparat dengan kromogen Diaminobenzinidine (DAB) dengan suhu 25°C selama sepuluh menit. n. Inkubasi preparat dengan Hematoxylin Eosin selama tiga menit. o. Cuci preparat dengan air mengalir. 48 p. Bersihkan preparat dan tetesi dengan mounting media. q. Tutup preparat dengan coverslip. Kemudian setelah dilakukan pengecatan imunohistokimia p53 atau dipulas dengan antibodi monoklonal p53, selanjutnya sediaan dilakukan interpretasi sebagai berikut (Rosai, 2004): a. Interpretasi p53 dilakukan tanpa mengetahui data klinis dan patologik dari setiap kasus. b. Perhitungan ekspresi p53 dilakukan secara semikuantitatif. Pertama, dilakukan penghitungan persentase sel ganas yang tercatat positif di antara 200 sel ganas, menggunakan mikroskop cahaya binokuler merk Olympus dengan pembesaran 400 kali. c. Pewarnaan yang dinyatakan positif hanya membran sel yang berwarna coklat. Intensitas pewarnaan dievaluasi secara objektif yaitu lemah, sedang dan kuat. i. Skor diperoleh berdasarkan kombinasi antara persentase sel yang terpulas dan intensitas pewarnaannya, dengan rentang skor 0, 1+, 2+, 3+ (tabel 4.2). Kemudian dari skor tersebut dikelompokkan menjadi dua yaitu ekspresi p53 dikatakan (+) apabila skor 1+, 2+, atau 3+. Ekspresi p53 dikatakan (-) apabila skor 0, (Yamashita, 2004). 49 Tabel 4.2 Interpretasi Pulasan Imunohistokimia p53 Pola Pulasan Tidak ada sel terpulas atau terpulas kurang 10% Skor 0 Terpulas lebih dari 10% sel, intensitas pulasan lemah, membran sel terpulas hanya sebagian. 1+ Terpulas lebih dari 10% sel, intensitas pulasan lemah sampai sedang, Membran sel terpulas komplit. 2+ Terpulas lebih dari 10% sel, intensitas kuat dan komplit (Rosai, 2004) 3+ 4.8 Pengumpulan dan Analisis Data 4.8.1 Pengumpulan data Data hasil penelitian yang diperoleh dari Bagian Obstetri dan Ginekologi, Patologi Anatomi dan Rekam Medis RSUP Sanglah dikumpulkan dan dimasukkan ke dalam formulir penelitian (terlampir). 4.8.2 Analisis data Data pada formulir penelitian kanker ovarium diolah dengan menggunakan SPSS 17,0 for windows. Kemudian dilakukan beberapa tes atau uji, antara lain: a. Karakteristik sampel disajikan secara deskriptif, dengan menggunakan tabel dan narasi. b. Uji One Sample Kolmogorov-Smirnov untuk normalitas data dan Levene’s Test untuk homogenitas data. c. Uji Korelasi dengan menggunakan Uji Spearman. BAB V HASIL PENELITIAN Selama periode penelitian, sebanyak 44 sampel blok parafin dijadikan sampel penelitian yang dilaksanakan di Bagian Obstetri dan Ginekologi, Patologi Anatomi dan Rekam Medis RSUP Sanglah. 5.1 Karakteristik Sampel Penelitian Pada penelitian ini dilakukan uji normalitas data dengan uji kolmogorovsmirnov dan uji homogenitas data dengan Levene’s Test terhadap variabel umur, Indek Massa Tubuh (IMT), paritas dan riwayat kontrasepsi hormonal. Hasil analisis menunjukkan bahwa data pada variabel umur, IMT, paritas, dan riwayat kontrasepsi hormonal berdistribusi normal (p>0,05) dan homogen (p>0,05), sedangkan untuk membandingkan nilai rerata masing-masing variabel digunakan uji One Way Anova. Tabel 5.1 Distribusi Umur, IMT, Paritas, dan Riwayat Kontrasepsi Hormonal pada Kelompok Stadium Kanker Ovarium Variabel Stadium Kanker Ovarium I (n=7) rerata±2SD II (n=9) rerata±2SD III (n=21) rerata±2SD IV (n=7) rerata±2SD p 40,86±5,24 43,56±12,70 45,57± 9,77 57,86±8,78 0,814 19,9±1,51 25,15±4,04 21,76±4,95 21,38±3,75 0,304 Paritas 1,57±0,78 1,33 ±0,70 2,00±1,30 2,43±0,97 0,057 Kontrasepsi hormonal 1,71±0,48 1,78±0,44 1,90±0,30 1,71±0,48 0,562 Umur (tahun) IMT (kg/m2) 50 51 Pada Tabel 5.1 menunjukkan bahwa antar kelompok stadium kanker ovarium tidak memiliki perbedaaan pada variabel umur, IMT, paritas, dan riwayat kontrasepsi hormonal dengan nilai p>0,05. Pada penelitian ini tidak dilakukan uji normalitas dan homogenitas data terhadap variabel riwayat terapi hormonal pada masa menopause dan riwayat keluarga kanker ovarium, mamae, kolon oleh karena seluruh sampel penelitian memperoleh data yang sama. 5.2 Hubungan antara Ekspresi p53 dengan Stadium Kanker Ovarium Penilaian terhadap hubungan antara ekspresi p53 dengan stadium kanker ovarium dilakukan analisis dengan menggunakan uji korelasi Spearman. Hasil analisis tersebut disajikan pada Tabel 5.2. Tabel 5.2 Hubungan antara Ekspresi p53 dengan Stadium Kanker Ovarium Variabel Stadium Kanker Ovarium I (n=7) II (n=9) III (n=21) IV (n=7) r p (+) 0 2 5 1 -0,099 0,522 (-) 7 7 16 6 Ekspresi p53 Pada Tabel 5.2 menunjukkan bahwa Ekspresi p53 pada stadium I tidak ada yang positif, stadium II sebanyak 2 sampel, stadium III sebanyak 5 sampel, dan stadium IV sebanyak 1 sampel. Penilaian terhadap hubungan antara ekspresi p53 dengan stadium kanker ovarium dilakukan dengan menggunakan uji korelasi Spearman, di mana diperoleh tidak terdapat hubungan antara ekspresi p53 dengan stadium kanker ovarium (p>0,05). BAB VI PEMBAHASAN 6.1 Karakteristik Sampel Penelitian Pada penelitian ini rerata umur pada kelompok stadium kanker ovarium stadium I adalah 40,86 ± 5,24 tahun, stadium II adalah 43,56 ± 12,70 tahun, stadium III adalah 45,57 ± 9,77 tahun dan stadium IV adalah 57,86 ± 8,78. Penelitian ini sesuai dengan angka kejadian kanker ovarium pada umumnya di mana cenderung meningkat seiring dengan bertambahnya umur, terutama pada umur di atas 50 tahun. Sebanyak 80% dari kejadian kanker ovarium ditemukan pada umur wanita lebih dari 45 tahun, namun pada beberapa kasus kanker ovarium juga dapat ditemukan pada umur yang relatif lebih muda daripada kanker pada wanita lainnya, yaitu antara umur 20 sampai 30 tahun (Fauzan, 2009). Penelitian di Amerika Serikat pada tahun 2001 memperoleh hasil yang sama, di mana risiko terjadinya kanker ovarium kurang dari 3 kasus per 100.000 wanita pada umur di bawah 30 tahun, namun cenderung meningkat seiring dengan peningkatan umur dan menjadi 54 kasus per 100.000 wanita pada umur 75 sampai 80 tahun. Penelitian yang sama juga dilakukan oleh Rauf dan Masadah (2009) di mana diperoleh rerata umur penderita kanker ovarium adalah 55 tahun. Penelitian yang dilakukan oleh Faizal (2011) di Rumah Sakit Wahidin Sudirohusodo, Makasar memperoleh hasil yang serupa di mana kelompok umur yang paling banyak menderita kanker ovarium adalah kelompok umur 41 sampai 50 tahun yaitu 52 53 sebanyak 62,7% dan paling sedikit adalah 31 sampai 40 tahun yaitu sebanyak 10,8%. Hal tersebut sesuai dengan salah satu mekanisme terjadinya kanker ovarium yaitu berdasarkan pada teori Incessant ovulation. Teori Incessant ovulation ini beranggapan bahwa adanya trauma berulang pada ovarium selama proses ovulasi, mengakibatkan epitel ovarium mudah terpajan atau terpapar oleh berbagai faktor risiko sehingga dapat mengakibatkan terjadinya kelainan atau abnormalitas genetik. Adanya ovulasi dan semakin bertambahnya umur seorang wanita dapat menyebabkan terperangkapnya fragmen epitel permukaan ovarium pada cleft atau invaginasi pada permukaan dan badan inklusi pada kortek ovarium. Beberapa penelitian telah membuktikan bahwa terdapat hubungan antara frekuensi metaplasia dan neoplasma pada daerah-daerah ovarium yang mengalami invaginasi dan terbentuknya badan inklusi (Choi, 2007). Pada penelitian ini diperoleh rerata Indek Massa Tubuh (IMT) dalam rentang normal, hanya pada stadium II yang memiliki rerata IMT yang termasuk dalam kelompok berat badan berlebih. Rerata IMT pada masing-masing kelompok kanker ovarium stadium I adalah 19,9 ± 1,51 kg/m2, stadium II adalah 25,15 ± 4,04 kg/m2, stadium III adalah 21,76 ± 4,95 kg/m2, dan stadium IV adalah 21,38 ± 3,75 kg/m2. Beberapa penelitian membuktikan bahwa peningkatan IMT dapat meningkatkan risiko terjadinya kanker ovarium (Reeves, 2007). Penelitian yang dilakukan oleh Anders (2003) memperoleh hasil bahwa risiko relatif terjadinya kanker ovarium memiliki kecenderungan meningkat sesuai dengan peningkatan IMT. Pada IMT kurang dari 18,5 kg/m2 memiliki risiko sebesar 1,09, IMT antara 54 18,5 sampai 24,9 kg/m2 memiliki risiko sebesar 1,00, IMT antara 25,0 sampai 29,9 kg/m2 memilki risiko sebesar 1.43, dan IMT lebih dari 30,0 kg/m2 memiliki risiko sebesar 1,56 untuk menderita kanker ovarium. Penelitian yang dilakukan oleh European Prospective Investigation into Cancer and Nutrition tahun 2006 memperoleh hasil bahwa pada wanita dengan IMT di atas 30 kg/m2 atau obesitas memiliki risiko relatif sebesar 1,59 untuk terjadinya kanker ovarium dibandingkan dengan wanita dengan IMT normal. Penelitian yang berbeda memperoleh hasil bahwa peningkatan IMT pada wanita premenopause meningkatkan risiko terjadinya kanker ovarium dengan risiko relatif sebesar 1,72 (Schouten, 2008). Penelitian yang dilakukan oleh Lahmann (2009) juga memperoleh hasil di mana risiko terjadinya kanker ovarium pada wanita obesitas dengan IMT lebih dari 30 kg/m2 sebesar 1,26 lebih besar dibandingkan dengan IMT normal. Penelitian yang dilakukan oleh Faizal (2011) di Rumah Sakit Wahidin Sudirohusodo, Makasar memperoleh hasil di mana pada IMT yang lebih dari 30 kg/m2 memiliki risiko 2,03 kali lebih besar dibandingkan dengan wanita yang memiliki IMT yang kurang dari 30 kg/m2. Obesitas menyebabkan kadar estrogen dalam tubuh juga meningkat serta beberapa zat lemak dapat menghasilkan estrogen yang pada umumnya berbentuk estrion dan estradiol. Mekanisme perubahan dari zat lemak atau kolesterol dapat dijelaskan melalui biosintesis hormonal, di mana semua hormon steroid termasuk estrogen berasal dari kolesterol. Cadangan lemak di dalam tubuh memainkan peranan yang penting sebagai bahan untuk memproduksi hormon, khususnya hormon estrogen. Pada kondisi di mana cadangan lemak yang tinggi, yang dinilai 55 melalui IMT yang tinggi dapat mengakibatkan peningkatan kadar estrogen di dalam darah. Peningkatan kadar estrogen tersebut mengakibatkan aktivasi jalur Phosphatidylinositol-3-kinase (PI3K), Mitogenic-Activated Protein Kinase (MAPK), dan transkripsi Faktor c-myc melalui reseptor estrogen jalur lain seperti Insulin-like growth factor-1 (IGF-1), Transforming growth factor- α (TGF-α), dan Epidermal Growth Factor Receptor (EGFR). Estrogen juga bekerja melalui jalur anti-apoptosis yaitu BCL-2, yang merupakan suatu protein anti-apoptosis dan meningkatkan kemampuan invasif sel melalui protein fibulin-1, cathepsin D, dan kallikreins (Choi et al., 2001). Berbagai penelitian telah mengemukakan bahwa Estrogen Reseptor-α (ER-α) bertanggung jawab dalam proses proliferasi ovarium, sementara Estrogen Reseptor-β (ER-β) bertanggung jawab dalam proses modulasi dan differensiasi sel. Peningkatan perbandingan antara ER-α:ER-β rasio juga telah diamati pada kanker ovarium. Peningkatan estrogen tersebut meningkatan suatu molekul Vascular Endothelial Growth Factor (VEGF), meningkatan kemampuan adhesi sel, dan meningkat kemampuan sel dalam melakukan migrasi. Pada akhirnya, semua hal tersebut berdampak pada proliferasi abnormal pada sel yang membelah sehingga sel akan masuk menuju proses menuju transformasi ganas dalam hal ini adalah kanker ovarium (Capen et al., 2004). Pada penelitian ini diperoleh rerata paritas adalah dua. Rerata paritas pada kelompok kanker ovarium stadium I adalah 1,57 ± 0,78, stadium II adalah 1,33 ± 0,70, stadium III adalah 2,00 ± 1,30, dan stadium IV adalah 2,43 ± 0,97. Paritas merupakan salah satu faktor risiko yang penting dalam menentukan terjadinya 56 kanker ovarium. Wanita yang sudah pernah hamil memiliki risiko mengalami kanker ovarium sebesar 50% lebih rendah daripada wanita yang belum pernah hamil atau nullipara. Bahkan, wanita yang telah beberapa kali hamil risiko terjadinya kanker ovarium menjadi semakin berkurang (Czyz, 2008). Penelitian yang dilakukan oleh Cancer Research United of Kingdom pada tahun 2006 menyimpulkan bahwa semakin tinggi jumlah paritas maka semakin rendah kemungkinan risiko terjadinya kanker ovarium. Pada wanita yang tidak memiliki anak atau nullipara memiliki risiko dua kali lipat lebih besar untuk terjadinya kanker ovarium daripada wanita dengan paritas tiga atau lebih (Granstrom, 2008). Penelitian yang dilakukan oleh Sriwidyani (2008) juga memperoleh 78,1 kasus kanker ovarium adalah multiparitas, terutama adalah paritas dua. Penelitian yang dilakukan oleh Faizal (2011) di Rumah Sakit Wahidin Sudirohusodo, Makasar memperoleh hasil yang berbeda di mana kejadian kanker ovarium tidak memiliki hubungan dengan tingkat paritas. Paritas adalah banyaknya kelahiran hidup atau jumlah anak yang dimiliki oleh seorang wanita. Pada saat terjadinya ovulasi akan terjadi kerusakan pada epitel ovarium dan untuk proses perbaikan kerusakan ini maka diperlukan waktu tertentu. Apabila kerusakan epitel ini terjadi berkali-kali terutama jika sebelum penyembuhan sempurna tercapai, atau dengan kata lain waktu yang dibutuhkan oleh sel untuk istirahat tidak cukup, maka proses perbaikan tersebut akan mengalami gangguan sehingga dapat terjadi transformasi menjadi sel-sel neoplastik. Hal tersebut menjelaskan bahwa wanita yang memiliki paritas lebih dari dua akan menurunkan risiko terjadinya kanker ovarium. 57 Pada penelitian ini diperoleh bahwa sebagian besar sampel penelitian tidak memiliki riwayat penggunaan kontrasepsi hormonal baik pada kanker ovarium stadium I, II, III, dan IV. Penelitian lainnya melaporkan bahwa penggunaan pil kontrasepsi selama kurang lebih satu tahun dapat menurunkan risiko kejadian kanker ovarium sebesar 11%, sedangkan apabila pemakaian mencapai lima tahun maka risiko terjadinya kanker ovarium dapat semakin menurun, bahkan mencapai 50% (Fauzan, 2009). Penelitian yang dilakukan oleh Beral (2008) juga memperoleh hasil bahwa penurunan risiko relatif terjadinya kanker ovarium sesuai dengan lamanya pemakaian kontrasepsi oral, di mana pada wanita yang memakai kontrasepsi oral selama kurang dari satu tahun memiliki risiko relatif 1 dan semakin menurun mencapai 0,42 pada pemakaian yang lebih dari lima belas tahun. Setelah dilakukan analisis lanjutan terhadap jenis hormon pada obat kontrasepsi, diperoleh bahwa hormon yang berperan dalam menurunkan risiko terjadinya kanker ovarium tersebut adalah progesteron. Penggunaan obat yang menggandung hormon estrogen saja khususnya pada wanita pascamenopause justru meningkatkan risiko terjadinya kanker ovarium. Pada penggunaan kombinasi progesteron dan estrogen atau progesteron saja akan menurunkan risiko terjadinya kanker ovarium (Busman, 2008). Pada penelitian ini seluruh sampel tidak memiliki riwayat terapi hormonal pada masa menopause dan riwayat keluarga kanker ovarium, mamae, kolon. 58 6.2 Hubungan antara Ekspresi p53 dengan Stadium Kanker Ovarium Pada penelitian ini telah dilakukan pemeriksaan imunohistokimia terhadap 44 sampel blok parafin kanker ovarium. Sebanyak 8 dari 44 (18,18%) sampel blok parafin yang didapatkan ekspresi p53 yang positif, di mana masing-masing 2 buah pada stadium II, 5 buah pada stadium III, dan 1 buah pada stadium IV. Pada stadium I tidak ditemukan satu pun sampel yang positif mengalami ekspresi p53. Setelah dilakukan analisis statistik tidak diperoleh adanya hubungan antara ekspresi p53 dengan stadium kanker ovarium dengan nilai p = 0,522 (p>0,05). Penelitian ini memperoleh hasil yang serupa dengan penelitian yang dilakukan oleh Marks (2006) di mana menyimpulkan bahwa ekspresi p53 positif tidak berhubungan dengan stadium kanker ovarium dan derajat histopatologis, namun sangat berhubungan dengan kejadian mutasi dari gen P53 itu sendiri. Penelitian yang dilakukan oleh Psyarii dkk. (2007) juga menyimpulkan bahwa ekspresi p53 tidak berhubungan dengan stadium dan derajat differensiasi kanker ovarium. Penelitian yang sama juga diperoleh oleh Marcus (2010) yang menyimpulkan bahwa mutasi dari gen P53 lebih banyak ditemukan pada kanker ovarium stadium dini dibandingkan dengan stadium lanjut dan ekspresi p53 tidak berhubungan dengan derajat stadium kanker ovarium. Penelitian ini memperoleh hasil yang berbeda dengan beberapa penelitian lainnya yang menghubungkan antara ekspresi p53 dengan stadium kanker ovarium. Penelitian yang dilakukan oleh Adiyanti (2007) yang bertujuan untuk menilai hubungan antara ekspresi p53 dengan stadium kanker ovarium di Rumah Sakit Sardjito, Yogyakarta. Penelitian tersebut memperoleh hasil bahwa terdapat 59 hubungan yang signifikan antara p53 dengan stadium kanker ovarium. Penelitian yang dilakukan oleh Rauf dan Masadah (2009) dari Universitas Hassanudin, Makasar terhadap 41 pasien kanker ovarium. Penelitian ini bertujuan untuk mengidentifikasi nilai prognostik ekspresi p53 terhadap kanker ovarium. Pada penelitian tersebut diperoleh sebesar 58,5% sampel mengalami ekspresi p53 positif, di mana hasil positif terbanyak ditemukan pada kanker ovarium stadium IV, kemudian diikuti dengan stadium III, II, dan I. Penelitian lainnya yang dilakukan oleh Lobna (2010) memperoleh hasil bahwa sebanyak 42 (73,7%) dari 57 sampel mengalami ekspresi p53 positif. Adanya ekspresi p53 yang positif tersebut memiliki hubungan dengan stadium kanker ovarium, khususnya pada stadium lanjut. Pada penelitian yang memperoleh hasil adanya hubungan antara ekspresi p53 dengan stadium kanker ovarium mengemukakan bahwa pada kanker ovarium di mana sel normal ovarium telah kehilangan fungsi dari gen P53, ekspresi p53 tetap terjadi bahkan cenderung mengalami ekspresi yang berlebih atau overekspresi. Ekspresi p53 yang berlebih disebabkan oleh karena adanya mutasi dari gen P53. Berbagai penelitian telah membuktikan bahwa mayoritas mutasi terhadap P53 yang ditemukan dalam berbagai keganasan berupa missense mutation dan sebagian besar terletak pada domain DNA binding inti. Ekspresi p53 yang berlebih yang dihasilkan oleh gen yang mengalami mutasi tidak akan mampu berperan dalam mengaktivasi proses transkripsi pada beberapa gen target seperti gen inhibitor cyclin-dipendent kinase CDKN1A (P21) dan GADD45, sehingga tidak terjadi aktivasi p21 yang mengakibatkan siklus sel tidak berhenti pada akhir fase 60 G1 dan tidak terjadi aktivasi GADD45, yang mengakibatkan perbaikan DNA tidak terjadi (Syaifudin, 2007; Kumar dkk., 2010). Pada penelitian ini tidak ditemukan hubungan antara ekspresi p53 dengan stadium kanker ovarium, hal ini kemungkinan disebabkan oleh karena jalur karsinogenesis dari kanker ovarium yang bersifat multistep, kegagalan P53 pada kondisi kanker ovarium, dan ekspresi p53 yang bersifat labil. Kanker ovarium merupakan suatu keganasan ginekologi yang memiliki patofisiologi penyakit yang bersifat multistep, di mana terdapat berbagai jalur karsinogenesis yang diduga berperan penting dalam menentukan terjadinya kanker ovarium. Selain jalur p53 yang merupakan suatu inaktivasi gen supresor tumor yang dianalisis pada penelitian ini. Beberapa gen dan ekspresi protein gen yang mengalami kelainan dan terlibat dalam jalur karsinogenesis terjadinya kanker ovarium telah diketahui. Kelainan pada gen dan ekspresi protein gen tersebut dapat dibagi menjadi empat, yaitu onkogen sebagai gen pemicu pertumbuhan sel, inaktivasi gen supresor tumor, perubahan pada gen apoptosis, dan kerusakan gen yang terlibat pada perbaikan DNA (Kumar dkk., 2010). Pertama adalah onkogen, beberapa gen yang termasuk dalam kelompok ini diantaranya adalah gen HER2-neu, RAS, MYC, dan CDK1. Onkogen merupakan suatu kelainan pada gen yang mengakibatkan terjadinya peningkatan aktivasi pertumbuhan dan atau pembelahan seluler, sehingga akan mengarahkan sel pada pertumbuhan yang tidak terkendali (Kumar dkk., 2010). Kedua adalah inaktivasi gen supresor tumor. Gen-gen yang termasuk dalam kelompok ini meliputi P53. Adanya inaktivasi pada P53, misalnya pada sel yang 61 mengalami mutasi atau kehilangan gen P53, maka ekspresi p53 tidak terjadi atau terjadi ekspresi p53 namun tidak dapat mengaktivasi proses transkripsi pada beberapa gen target seperti gen inhibitor kinase dipendent-cyclin CDKN1A (P21) dan GADD45. Kegagalan ekspresi p21 mengakibatkan siklus sel tidak dapat berhenti pada akhir fase G1 dan ekspresi GADD45 mengakibatkan tidak terjadinya perbaikan DNA (Syaifudin, 2007). Ditambah lagi, adanya efek proapoptosis yang dimiliki oleh p53 melalui peningkatan sintesis Bax, sehingga pada sel yang mengalami mutasi atau kehilangan gen P53, maka tidak akan terjadi aktivasi gen apoptosis BAX. Kegagalan aktivasi pada gen BAX mengakibatkan sel tidak mengalami apoptosis. Keberadaan onkogen dan inaktivasi gen supresor tumor selanjutnya akan mengakibatkan proliferasi sel menjadi tidak terkontol. Ketiga, perubahan pada gen pengatur apoptosis, terutama diperankan oleh BAX dan BCL2. Pada perubahan fungsi proapoptosis dari gen BAX, di mana tidak terjadi aktivasi BAX akan mengakibatkan sel tidak mampu mengalami proses apoptosis. Perubahan fungsi anti apoptosis gen BCL2, justru akan memperberat ketidakmampuan sel untuk mengalami proses apoptosis (Kumar dkk., 2010). Keempat adalah adanya kerusakan pada gen yang memperbaiki DNA atau DNA repair gen. Gen yang termasuk dalam kelompok ini berfungsi untuk mencegah adanya penumpukan sel yang mengalami mutasi. Apabila terjadi gangguan atau kerusakan pada jalur ini maka sel akan kehilangan kemampuannya untuk mengidentifikasi dan memperbaiki gen yang mengalami kerusakan. Adapun 62 gen yang termasuk dalam kelompok ini, antara lain adalah gen BRCA 1 dan BRCA 2 (Kumar dkk., 2010). Selain itu, pada sel yang telah berubah menjadi kanker, dalam hal ini adalah kanker ovarium maka sel tersebut telah kehilangan fungsi dari gen P53, sehingga sudah dapat dipastikan tidak terjadi ekspresi p53 yang berperan dalam mengaktivasi proses transkripsi pada beberapa gen target seperti gen inhibitor cyclin-dipendent kinase CDKN1A (P21) dan GADD45, sehingga tidak terjadi aktivasi p21 yang mengakibatkan siklus sel tidak berhenti pada akhir fase G1 dan tidak terjadi aktivasi GADD45, yang mengakibatkan perbaikan DNA tidak terjadi. Pada sel yang mengalami mutasi atau kehilangan gen P53, juga tidak ditemukan adanya aktivasi pada gen apoptosis yaitu BAX yang mengakibatkan sel gagal mengalami apoptosis (Syaifudin, 2007; Kumar dkk., 2010). Selain hal tersebut di atas, ekspresi p53 tidak berhubungan dengan stadium kanker ovarium juga dapat disebabkan oleh karena p53 yang diekspresikan oleh gen P53 merupakan protein antigen yang memiliki sifat cukup labil. Sifat yang labil tersebut mengakibatkan protein ini agak sulit untuk ditangkap atau diikat oleh antibodi pada pemeriksaan imunohistokimia, sehingga kecil kemungkinan akan terjadi ikatan antara antigen dengan antibodi yang telah terlabel dengan enzim atau fluorokrom. Pada akhirnya pemeriksaan imunohistokimia p53 cenderung memberikan hasil yang negatif (Fatchiyah, 2006). 63 6.3 Kelemahan Penelitian Penelitian ini menggunakan sampel berupa blok parafin dari jaringan pasien kanker ovarium yang telah menjalani pembedahan di RSUP Sanglah dari tahun 2008 sampai 2013. Pada saat operasi jaringan yang dikeluarkan dari tubuh penderita harus langsung dilakukan fiksasi dengan menggunakan buffer formalin, sebelum dilanjutkan dengan langkah-langkah proses pembuatan blok parafin. Adapun tujuan fiksasi dengan menggunakan buffer formalin terkait dengan keberadaan protein ekspresi gen, dalam hal ini adalah p53, bahwa buffer formalin dapat mencegah kerusakan protein yang ada pada jaringan. Sehingga protein yang ada pada jaringan tersebut akan selalu ada sepanjang waktu, baik secara kuantitas maupun kualitas setelah diproses menjadi blok parafin. Pada penelitian ini menggunakan sampel blok parafin dari jaringan pasien kanker ovarium yang telah menjalani pembedahan di RSUP Sanglah dari tahun 2008 sampai 2013. Setelah dilakukan kajian secara retrospektif di bagian Patologi Anatomi RSUP Sanglah terkait dengan metode pembuatan blok parafin, khususnya teknik fiksasi jaringan, diperoleh informasi bahwa pada sampel blok parafin yang dibuat di bawah tahun 2012, fiksasi jaringan tidak dilakukan dengan mengunakan buffer formalin melainkan dengan menggunakan fiksasi alkohol. Penggunaan fiksasi alkohol tentunya akan menggakibatkan kerusakan protein ekspresi gen yang ada pada jaringan, dalam hal ini adalah p53. Sehingga walaupun langkah selanjutnya dalam pembuatan blok parafin telah dikerjakan dengan benar, tetap saja ekspresi protein gen yang ada tidak dapat ditemukan dalam kondisi yang sebenarnya. Hal ini yang mengakibatkan ekspresi p53 pada 64 saat pengecatan immunohistokimia dari blok parafin ditemukan negatif atau tidak terjadi ekpsresi p53. Pada penelitian ini jumlah sampel penelitian ditentukan berdasarkan data Badan Registrasi Kanker pada tahun 2006, dimana angka kejadian kanker ovarium di populasi sebesar 11,9%. Oleh karena penelitian ini menilai hubungan antara ekspresi p53 dengan stadium kanker ovarium, maka jumlah sampel penelitian seharusnya ditentukan berdasarkan atas jumlah sampel terbanyak yang diperoleh dari angka prevalensi masing-masing kelompok stadium kanker ovarium, bukan berdasarkan angka prevalensi dari kanker ovarium di populasi. Penelitian ini menggunakan angka prevalensi dari kanker ovarium di populasi sebagai patokan dalam menentukan jumlah sampel penelitian oleh karena belum ditemukannya angka prevalensi dari masing-masing kelompok stadium kanker ovarium di populasi. BAB VII SIMPULAN DAN SARAN 7.1 Simpulan Adapun simpulan pada penelitian ini adalah ekspresi p53 tidak berhubungan dengan stadium kanker ovarium. 7.2 Saran Berdasarkan simpulan di atas, terdapat beberapa rekomendasi yang diajukan oleh penulis, antara lain adalah: 1. Oleh karena jalur karsinogenesis dari kanker ovarium yang bersifat multistep, maka dalam rangka mendukung pengembangan ide pemanfaatan gen dan ekspresi gen sebagai deteksi dini dalam diagnostik kanker ovarium, diperlukan penelitian lanjutan guna menilai jalur karsinogenesis yang lain, seperti pada jalur onkogen, perubahan gen apoptosis, dan gen yang terlibat dalam perbaikan DNA. 2. Akibat ekspresi p53 yang bersifat labil, maka diperlukan suatu protokol standar untuk pemeriksaan imunohistokimia p53 mulai dari jaringan tersebut dikeluarkan dari tubuh penderita sampai menjadi sediaan yang siap dilakukan interpretasi dan teknik interpretasi sediaan imunohistokimia p53 tersebut. 65 66 DAFTAR PUSTAKA Adiyanti,V.P. 2007. Hubungan antara ekspresi P53 dan BeL-2 serta indeks apoptosis dengan stadium karsinoma ovarium di RS. Dr. Sardjito Yogyakarta. (serial online), [cited 2010 Sep. 11]. Available from: URL:http://etd.ugm.ac.id/ index.php?mod=penelitian_detail&sub=PenelitianDetail&act=view&typ=html&b uku_id=43262&obyek_id=4 Anders, E., Tretli, S., Bjorge, T. 2003. Height, Body Mass Index, and Ovarian Cancer: A Follow-Up of 1.1 Million Norwegian Women. (serial online), [cited 2012 Aug. 20]. Available from: URL: http://jnci.oxfordjournals.org/content/95/16/1244.full.pdf American Cancer Society. 2010. Cancer Facts and Figures 2010. (serial online), [cited 2010 Aug. 10]. Available from: URL: http://documents.cancer.org/acs/groups/cid/documents/ webcontent/003130pdf.pdf. Araoye, M.O. 2003. Sample Size in: Research Methodology with Statistic for Health and Social Sciences. Ilorin: Nathadex Publishers. P. 115-122. Ari .2008. Karsinoma Ovarium: DETAK. (serial online), [cited 2010 Sep. 20]. Available from: URL: http://www.detak.org/aboutcancer.php?id=21&c_id=0. Ayadi, L., Chaabouni, S., Khabir, A., Amouri, H. 2010. Correlation Between Immunohistochemical Biomarkers Expression and Prognosis of Ovarian carcinomas in Tunisian Patients. (serial online), [cited 2013 Sep. 28]. Available from: URL: http://www.wjon.org/index.php/wjon/article/view/213/144. Badan Registrasi Kanker. 2006. Kanker di Indonesia Tahun 2006 Data Histopatologik. Jakarta: Yayasan Kanker Indonesia. Bai, L. & Zhu, G. 2006. p53: Structure, Function and Therapeutic Applications. (serial online), [cited 2010 Aug. 19]. Available from : URL: http://mupnet.com/ JOCM%202(4)%20141-153.pdf. Beral, V. 2007. Ovarian Cancer and Hormone Replacement Therapy in The Million Women Study. (serial online), [cited 2010 Aug. 28]. Available from: URL: http://www.thelancet.com/journals/lancet/article/PIIS0140-6736(07)605340/fulltext. Beral, V. 2008. Ovarian Cancer and Oral Contraceptives: Collaborative Reanalysis of Data from 45 Epidemiological Studies Including 23,257 Women with Ovarian Cancer and 87,303 Controls. (serial online), [cited 2010 Aug. 29]. 67 Available from: URL: http://www.cancernewsincontext.org/2010/03/oralcontraceptives-reduce-cancer.html. Berek, J.S. & Natarajan, S. 2007. Ovarian and Fallopian Tube Cancer. In: Berek, J.S., editor. Berek & Novak’s Gynecology. 14th. Ed. Philadhelpia: Lippincott William & Wilkins. p. 1457-1548. Busman, B. 2008. Kanker Ovarium, dalam: Aziz, M.F., Andriono, Siafuddin, A.B, editors. Buku Acuan Nasional Onkologi dan Ginekologi. Jakarta: Yayasan Bina Pustaka Sarwono Prawirohardjo. Cancer Chemoprevention Research Center (CCRC) Fakultas Farmasi Universitas Gajah Mada (UGM). 2009a. Prosedur Tetap Pengamatan Ekspresi Protein dengan Metode Imunohistokimia. (serial online), [cited 2010 Oct. 1]. Available from: URL: http://ccrc.farmasi.ugm.ac.id/wp-content/uploads/2009/02/03012imunositokimia.pdf. Cancer Chemoprevention Research Center (CCRC) Fakultas Farmasi Universitas Gajah Mada (UGM). 2009b. Prosedur Tetap Pengecatan Imunohistokimia p53. (serial online), [cited 2010 Oct. 1]. Available from: URL: http://ccrc.farmasi.ugm.ac.id/wp-content/uploads/sop-ihc-p53-laras.pdf. Chen, S., Parmigiani, G. 2007. Meta-analysis of BRCA1 and BRCA2 Penetrance. (serial online), [cited 2010 Sep. 12]. Available from: URL: http://jco.ascopubs.org/content/25/11/1329.full.pdf. Choi, J.H., Wong, A.S.T., Huang, H.F., Leung, P.C. 2007. Gonadotropins and Ovarian Cancer. Endocrine Reviews. 28 (4): 440-461. Colditz, G.A. 2004. Handbook of Cancer Risk Assesment and Prevention. (serial online), [cited 2010 Aug. 18). Available from: URL: http://riskfactor.cancer.gov/cancer_risk_prediction/workshop/JNCI_Workshop_C ommentary.pdf. Capen, C. 2004. Mechanisms of Hormone-Mediated Carcinogenesis of The Ovary. (serial online), [cited 2013 Aug. 13). Available from: URL: http://tpx.sagepub.com/content/32/2_suppl/1 Czyz, A.H. 2008. Ovarian Cancer- Risk factors: Imaginis. (serial online), [cited 2010 Sep. 19]. Available from: URL http://www.imaginis.com/ovariancancer/ovarian-cancer-risk-factors-1. Fatchiyah. 2006. Imunohistokimia. [Kuliah] Universitas Brawijaya, 24 November. Faizal, A. 2011. “Faktor Risiko Kanker Ovarium di RSUP Wahidin Sudirohusodo Makassar” (tesis). Makassar: Universitas Hasanuddin. 68 Fauzan, R. 2009. “Gambaran faktor penggunaan kontrasepsi terhadap angka kejadian kanker ovarium di RSUPN Dr. Cipto Mangunkusumo Jakarta berdasarkan pemeriksaan histopatologik tahun 2003-2007” (tesis). Jakarta: Universitas Indonesia. Granstrom, C. 2008. Population Attributable Fractions for Ovarian Cancer in Swedish Women by Morphological Type. (serial online), [cited 2010 Oct. 21]. Available from: URL: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC2359681/. Havrilesky, L., Darcy, K.M., Hamdan, H., Priore, R.L., Leon, J., Bell, J., Berchuck, A. 2002. Prognostic Significance of P53 Mutatuin and p53 Overexpression in Advanced Epithelial Ovarian Cancer: A Gynecologic Oncology Group Study. (serial online), [cited 2010 Oct. 12]. Available from: URL: http://jco.ascopubs.org/content/21/20/3814.full.pdf+html. Hogdall, E.V.S., Christensen, L., Kjaer, S.K. 2007. CA125 Expression Pattern, Prognosis and Correlation with Serum CA125 in Ovarian Tumor Patients. From The Danish “MALOVA” Ovarian Cancer Study. (serial online), [cited 2010 Aug. 21]. Available from: URL: http://info.cancerresearchuk.org/cancerstats/types/ovary/ riskfactors/. Karst, A.M. & Drakin, R. 2009. Ovarian Cancer Pathogenesis: A Model in Evolution. (serial online), [cited 2010 Aug. 4]. Available from: URL: http://www.hindawi.com/journals/jo/2010/932371.html. Karyana, K. 2005. “Profil Kanker Ovarium di Rumah Sakit Sanglah Denpasar periode Januari 2002 sampai Desember 2004” (tesis). Denpasar: Universitas Udayana. Kumar, V., Kabbas, A., Fausto, N. 2010. Robbins and Cotran Pathologic Basis of Disease 8th ed. (serial online), [cited 2010 Aug. 18]. Available from: URL: http://www.microsoft.com/isapi/redir.dll?prd=ie&pver=6&ar=msnhome. Lahmann, P.H. 2009. Anthropometric Measures and Epithelial Ovarian Cancer Risk in The European Prospective Investigation into Cancer and Nutrition. (serial online), [cited 2010 Sep. 18]. Available from: URL: http://www.ncbi.nlm.nih.gov/pubmed/19821492. Marks, J.R. Davidoff, A.M., Kerns, B.J., Humphrey, P.A., Pence, J.C. Dodge, R.K. 2006. Overexpression and Mutation of p53 in Epithelial Ovarian Cancer. (serial online), [cited 2013 Sep. 11]. Available from: http://cancerres. aacrjournals.org/content/51/11/2979.full.pdf 69 Marcus, Q.B., Baba, T., Lee, P.S., Barnet, J.C. 2010. Expression signatures of TP53 mutations in serous ovarian cancers. (serial online), [cited 2013 Aug. 16]. Available from: URL: http://www.biomedcentral.com/1471-2407/10/237 Nagell, V., DePriest, P.D., Ueland, F.R. 2007. Ovarian Cancer Screening with Annual Transvaginal Sonography: Findings of 25,000 Women Screened. (serial online), [cited 2010 Aug. 26]. Available from: URL: http://onlinelibrary.wiley.com/doi/10.1002/ cncr.22594/pdf. Parveen, Z., Qureshi, A.N., Akbar, M., Zafar, A., Subhani, A. 2009. Palliative Surgery for Intestinal Obstruction Due to Recurrent Ovarian Cancer. (serial online), [cited 2010 Sep. 14]. Available from: URL: http://info.cancerresearchuk.org/cancerstats/ types/ovary/riskfactors/ Psyrri, A., Kountourakis, P., Yu, Z., Papadimitriou, C., Markakis, S., Camp, R.L., Economopoulos, T., Dimopoulos, M.A. 2007. Analysis of p53 protein expression levels on ovarian cancer tissue microarray automated quantitative analysis elucidates prognostic patient subsets. (serial online), [cited 2010 Sep. 14]. Available from: URL: http://annonc.oxfordjournals.org/content/18/4/709.full.pdf+html. Rauf, S., Masadah, R. 2009. The Prognostic Value of The p53 Expression and Mutation in Ovarian Cancer. Medical Journal of Indonesia. 18 (2): 81-90. Reeves, G.K. 2007. Cancer Incidence and Mortality in Relation to Body Mass Index in The Million Women Study: Cohort Study. (serial online), [Accessed: 2010 Aug. 5]. Available from: URL: http://www.bmj.com/content/335/7630/1134.abstract. Rosai, J. 2004. Breast. In Rosai and Ackerman’s Surgical Paathology. 9th ed. Edinburg: Mosby. p. 1763-1876. Schouten, L.J. 2008. Height, Body Mass index, and Ovarian Cancer: a Pooled Analysis of 12 Cohort Studies. (serial online), [cited 2010 Sep. 10]. Available from: URL: http://info.cancerresearchuk.org/cancerstats/types/ovary/riskfactors/. Supariasa, I.D.N. 2001. Penilaian Status Gizi. Jakarta: EGC. Sriwidyani. 2008. “Korelasi Ekspresi HER-2/neu dengan Tipe Histologik dan Derajat Diferensiasi Karsinoma Ovarium” (tesis). Denpasar: Universitas Udayana. Syaifudin, M. 2007. Gen Penekan Tumor p53, Kanker dan Radiasi Pengion. (serial online), [cited 2010 Aug. 20]. Available from : URL: http://www.batan.go.id/ptkmr/Biomedika/Publikasi%202007/MS_BAlara_Vol_8_ 3_Apr07.pdf. 70 Yamashita. 2004. P53 and BCL-2 Scoring Breast Cancer Res.6. p. 24-30. Zhou, B. 2008. Hormone Replacement Therapy and Ovarian Cancer Risk: a Meta-analysis. (serial online), [cited 2010 Sep. 11]. Available from: URL: http://info. cancerresearchuk.org/cancerstats/types/ovary/riskfactors/. 71 Lampiran 1. Formulir Penelitian PENELITIAN HUBUNGAN POSITIF ANTARA PROTEIN 53 (p53) DENGAN STADIUM KANKER OVARIUM A IDENTITAS PASIEN Nama Umur Alamat Nomor Parafin Blok Nomor Rekam Medis B DATA KLINIS Jumlah Paritas Stadium Kanker Ovarium IMT (BB/(TB)2) Riwayat Kontrasepsi Hormonal Riwayat Terapi Hormonal Riwayat Keluarga Kanker Ovarium, Mamae dan Kolon C PEMERIKSAAN IMUNOHISTOKIMIA p53 Skor 72 Lampiran 2. Data Penelitian No Nama pasien CM Umur Std intensitas % hasil Paritas rwy kel mnp IMT KB HOR No Parafin 1 Suati ni wayan 01.44.62.10 50 IIIC negatif 0 - 2 tidak ya 18.9 tidak tidak 245/pp/2011 2 Suriani ni nengah 01.44.94.40 34 IC negatif 0 - 2 tidak tidak 18.3 ya tidak 385/PP/2011 3 Mawe Ni wayan 01.45.18.86 48 IA negatif 0 - unmarried tidak tidak 21.2 tidak tidak 442/pp/2011 4 Gandri ni made 01.45.44.57 59 IIIC negatif 0 - 3 tidak ya 22.0 tidak tidak 554/pp/2011 5 Nuryani 00.44.13.72 49 IIIC negatif 0 - 3 tidak ya 21.6 ya tidak 668/pp/2011 6 Yuli armini ketut 01.46.84.91 30 IIB negatif 0 - 1 tidak tidak 26.8 ya tidak 1151/pp/2011 7 rumiati 01.46.67.88 40 IIIC negatif 0 - unmarried tidak tidak 29.6 tidak tidak 1246/pp/2011 8 Sabin ni made 01.44.95.40 64 IV negatif 0 - 3 tidak ya 17.3 tidak tidak 1306/pp/2011 9 Sri suartini 01.46.61.79 44 IC negatif 0 - 2 tidak tidak 20.0 tidak tidak 1391/pp/2011 10 Luh witi 01.47.05.36 60 IV negatif 0 - 3 tidak ya 22.8 ya tidak 1460/pp/2011 11 Sari wiyani 01.38.48.90 48 III negatif 0 - 2 tidak tidak 19.4 ya tidak 1737/pp/2011 12 nurminah husen 01.47.90.00 45 IIIC negatif 0 - 2 tidak ya 19.1 tidak tidak 1914/pp/2011 13 siti nuria 01.47.69.39 28 IIA negatif 0 - 2 tidak tidak 28.3 ya tidak 1992/pp/2011 14 Sukarini 01.47.21.38 44 IIIB kuat 90 + unmarried tidak tidak 21.2 tidak tidak 2024/pp/2011 15 widiastri ni made 01.23.13.40 43 IV negatif 0 - 2 tidak tidak 23.8 tidak tidak 2139/pp/2011 16 narti ni nyoman 01.48.31.89 36 IIA negatif 0 - 2 tidak tidak 19.4 tidak tidak 2208/pp/2011 17 merta ni nengah 01.49.25.03 50 IIC negatif 0 - 2 tidak ya 22.5 tidak tidak 2527/pp/2011 18 Latri nyoman 01.49.63.90 47 IIA negatif 0 - 0 tidak tidak 32.3 tidak tidak 2667/pp/2011 19 sudiasih kadek 01.46.20.82 37 IIIB negatif 0 - 3 tidak tidak 38.2 tidak tidak 2965/pp/2011 20 taluh wayan 01.52.30.28 61 IV negatif 0 - 2 tidak ya 26.8 tidak tidak 4335/pp/2011 21 rasmini ni wayan 01.52.52.09 36 IC negatif 0 - 2 tidak tidak 18.9 tidak tidak 4474/pp/2011 22 sari ni kt 01.48.35.96 48 IV negatif 0 - 2 tidak ya 23.5 ya tidak 4497/pp/2011 23 suwartini ni made 01.50.80.92 39 IA negatif 0 - 1 tidak ya 20.5 ya tidak 175/pp/2012 24 tinggen ni kt 01.53.48.73 52 IIIC sedang 5 + 4 tidak ya 24.6 tidak tidak 263/pp/2012 25 surti ni keetut 01.53.50.97 55 IIC negatif 0 - 0 tidak ya 22.0 tidak tidak 0479/pp/2012 26 alit ruktini ni gusti 01.53.39.11 39 IC negatif 0 - 0 tidak tidak 18.2 tidak tidak 507/pp/2012 27 Nyemplo ni ketut 01.53.95.99 67 IIA negatif 0 - 0 tidak ya 28.4 tidak tidak 721/pp/2012 28 komang seniwati 01.54.14.54 35 IIIC negatif 0 - 2 tidak tidak 23.3 tidak tidak 917/pp/2012 29 sontri ni nyoman 01.54.80.49 56 IIIA kuat 5 + 3 tidak ya 15.2 tidak tidak 1097/pp/2012 30 komang seniwati 01.55.67.92 44 IIC kuat 50 + 2 tidak tidak 23.3 tidak tidak pp0016912012 73 31 01.55.81.11 58 IIIC negatif 0 - 1 tidak ya 24.5 tidak tidak pp0017092012 32 ni luh murti putri sang ayu made 01.18.69.85 39 IIIC negatif 0 - 2 tidak tidak 15.5 tidak tidak pp0012852012 33 erni mutiara 01.55.43.48 48 IIIC kuat 90 + unmarried tidak tidak 23.8 tidak tidak pp0013212012 34 Nur zannah 01.55.04.87 63 IV negatif 0 - 4 tidak ya 17.7 tidak tidak pp0013242012 35 Ni made tirta 01.14.23.14 35 IIC sedang 30 + 0 tidak tidak 23.4 tidak tidak pp0013482012 36 made suparingsih 01.55.66.84 66 IV sedang 40 + 4 tidak ya 17.8 tidak tidak 554/pp/2012 37 wayan taluh 01.52.30.28 46 IIIC negatif 0 - 0 tidak tidak 20.0 tidak tidak 4335/pp/2011 38 Nyoman Sari 01.60.66.47 46 IA negatif 0 - 2 tidak tidak 22.2 tidak tidak 0022/pp/2013 39 Ni Made Nili 01.60.65.71 45 IIIC negatif 0 - 2 tidak tidak 19.8 tidak tidak 0154/pp/2013 40 karmini 01.61.98.89 51 IIIC negatif 0 - 4 tidak tidak 20.4 tidak tidak pp/000829/2013 41 Mihin 01.61.89.00 50 IIIC negatif 0 - 4 tidak tidak 22.0 tidak tidak pp/0012462013 42 ni kadek astini 01.55.59.01 44 IIIC negatif 0 - 3 tidak tidak 21.2 tidak tidak pp0014632013 43 No name tidak ada 13 IIIC kuat 100 + unmarried tidak tidak 17.6 tidak tidak pp004202/pp/12 44 No name tidak ada 48 IIIC negatif 0 2 tidak tidak 19,2 tidak tidak pp004103/pp/12 74 Lampiran 3. Perhitungan Statistik One-Sample Kolmogorov-Smirnov Test paritas N Normal Parameters a,,b IMT 44 44 44 1.86 46.36 22.102 1.112 10.835 4.4290 Absolute .201 .096 .146 Positive .201 .096 .146 Negative -.185 -.095 -.094 Kolmogorov-Smirnov Z 1.335 .636 .970 .057 .814 .304 Mean Std. Deviation Most Extreme Differences Umur Asymp. Sig. (2-tailed) a. Test distribution is Normal. b. Calculated from data. Test of Homogeneity of Variances Levene Statistic df1 df2 Sig. paritas 1.713 3 40 .180 Umur 1.172 3 40 .332 IMT 1.041 3 40 .385 75 Oneway Descriptives N paritas 1.57 .787 .297 stadium 2 9 1.33 .707 .236 stadium 3 21 2.00 1.304 .285 stadium 4 7 2.43 .976 .369 44 1.86 1.112 .168 stadium 1 7 40.86 5.242 1.981 stadium 2 9 43.56 12.700 4.233 stadium 3 21 45.57 9.770 2.132 stadium 4 7 57.86 8.783 3.320 44 46.36 10.835 1.633 stadium 1 7 19.900 1.5166 .5732 stadium 2 9 25.156 4.0439 1.3480 stadium 3 21 21.767 4.9513 1.0805 stadium 4 7 21.386 3.7583 1.4205 44 22.102 4.4290 .6677 Total N riwayat Mean Std. Deviation Std. Error stadium 1 7 2.00 .000 .000 stadium 2 9 2.00 .000 .000 stadium 3 21 2.00 .000 .000 stadium 4 7 2.00 .000 .000 44 2.00 .000 .000 stadium 1 7 1.71 .488 .184 stadium 2 9 1.78 .441 .147 stadium 3 21 1.90 .301 .066 stadium 4 7 1.71 .488 .184 44 1.82 .390 .059 Total kontrasepsi Std. Error 7 Total IMT Std. Deviation stadium 1 Total Umur Mean Total 76 HRT stadium 1 7 2.00 .000 .000 stadium 2 9 2.00 .000 .000 stadium 3 21 2.00 .000 .000 stadium 4 7 2.00 .000 .000 44 2.00 .000 .000 Total ANOVA Sum of Squares paritas Umur IMT Between Groups df Mean Square 5.753 3 1.918 Within Groups 47.429 40 1.186 Total 53.182 43 Between Groups 1221.102 3 407.034 Within Groups 3827.079 40 95.677 Total 5048.182 43 Between Groups 123.812 3 41.271 Within Groups 719.677 40 17.992 Total 843.490 43 F Sig. 1.617 .200 4.254 .011 2.294 .093 77 ANOVA Sum of Squares riwayat kontrasepsi HRT df Mean Square Between Groups .000 3 .000 Within Groups .000 40 .000 Total .000 43 Between Groups .323 3 .108 Within Groups 6.222 40 .156 Total 6.545 43 Between Groups .000 3 .000 Within Groups .000 40 .000 Total .000 43 F Sig. . . .693 .562 . . Correlations p53 Spearman's rho p53 Correlation Coefficient Sig. (2-tailed) N Stadium Correlation Coefficient Sig. (2-tailed) N Stadium 1.000 -.099 . .522 44 44 -.099 1.000 .522 . 44 44 78 Lampiran 4. Hasil Pemeriksaan Imunohistokimia p53 Positif Negatif