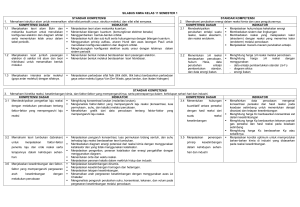
Kesetimbangan Kimia
advertisement

Kesetimbangan Kimia
Kesetimbangan Kimia
cC + dD
Jika A dan B direaksikan, pada suatu titik akan
tercapai dimana tak terdapat perubahan lebih
lanjut dalam sistem, titik ini disebut
kesetimbangan.
Kesetimbangan kimia adalah suatu
kesetimbangan dinamik. Spesi-spesi dalam
reaksi terus terbentuk secara konstan namun
tanpa terjadi perubahan total dalam konsentrasi
sistem.
Kesetimbangan Kimia
!
"
%
#
!
#
$"
−
#
&
'
(
$
) '
'
Kesetimbangan Kimia
* (
)
'
+
→
,
)
.
'
,
(
.(
' ,
Kesetimbangan Kimia
.
(
,
,
*
Tetapan Kesetimbangan
eE + fF
tetapan kesetimbangan dapat dituliskan sebagai:
=
Dengan Kc adalah tetapan kesetimbangan untuk reaksi
kesetimbangan homogen
[ ]n adalah konsentrasi semua spesi dipangkatkan dengan
koefisien dalam persamaan reaksi yang setara.
Tetapan Kesetimbangan
"$
CaO(s) + CO2(g)
Penulisan tetapan kesetimbangan untuk sistem
heterogen tidak melibatkan konsentrasi zat padat
atau zat cair murni, karena aktivitas zat padat dan zat
cair murni sama dengan 1.
Kc = [CO2]
Tetapan Kesetimbangan
*
'/
(
0
1
.
,
/
',
/
Penulisan Tetapan Kesetimbangan
"$
2NH3(g) + CO2(g) + H2O(g)
1 2
Jawab: Kc = [NH3]2[CO2][H2O]
Tidak ada hubungan yang jelas antara laju
reaksi dengan besarnya tetapan
kesetimbangan, namun apabila nilai tetapan
kesetimbangan sangat besar, maka reaksi akan
berlangsung bertahun-tahun untuk mencapai
kesetimbangan pada suhu kamar. Contoh:
reaksi H2(g) + O2(g)
2H2O(g), Kc = 2,9 x 1031.
Penentuan Tetapan Kesetimbangan
%
(
3
'
)
(
'
(
!
!
)
5'
58 456
5'
5599 6
!
!
3
2 4'
2
5'
5545567
5'
555556 .
Penentuan Tetapan Kesetimbangan
*
!
: 5'
5599 6
!
: ;
!
: ;
5'
58 45& 5'
5599 6 : ;5'
5529<6 : 5'
55=4>6
:
)
!
: 5'
55455? 5'
5529< 6 : 5'
555 6
=
=
Tekanan Parsial dan Tetapan
Kesetimbangan
*
!
.
-
'
'
+
%
0
Tekanan Parsial dan Tetapan
Kesetimbangan
'
eE + fF
=
Kp digunakan ketika tekanan parsial dituliskan dalam
satuan atmosfer. Secara umum, Kp = Kc, pada kasus
tertentu: Kp = Kc(RT) ng; dimana ng = (e+f) – (a+b).
Tekanan Parsial dan Tetapan
Kesetimbangan
'
955"
.
3)
Kp = Kc(RT) ng
T = 700 + 273 = 973 K
R = 0,08206 atm.L.mol-1K-1
ng = 2 – (2+1) = -1
@
2H2S(g)
(
: 8'85;859
Perhitungan Kesetimbangan
' A'
eE + fF
=
Kuosien reaksi, Q, memiliki bentuk yang sama
dengan Kc, namun perbedaannya adalah bahwa Q
berlaku untuk semua jenis konsentrasi pada kondisi
apa saja, bukan hanya konsentrasi pada saat
kesetimbangan.
Kuosien Reaksi
.
A&
A
AB
(
A:
(
AC
(
,
+
('
'
,
,
Contoh Kuosien Reaksi
42
!
2 4'2
! '
(
3
(
'
D E: 2' 4;85&$67D
!E: $'=9 ;85&8 67D !
E:
='<$ ;85& 6
3)
A B ('
'
=
=
!
#!$" −
$" −! ! $"
−"
Menghitung Konsentrasi pada
Kesetimbangan
3
(
'
"
1
(
"
"
' ;85&85
855
)
"
3
5'5=46'
@
Menghitung Konsentrasi pada
Kesetimbangan
Menghitung Konsentrasi pada
Kesetimbangan
!
"
#
$
Menghitung Konsentrasi pada
Kesetimbangan
Menghitung Konsentrasi pada
Kesetimbangan
.
;'
"
: 5'5=4? ; : 5'5=46
" : ; : ='8; 85&>6
: ; : ='8; 85&>6
(
)
"
Meramalkan Pergeseran
kesetimbangan
*
F
'
*
(
-
Meramalkan Pergeseran
kesetimbangan
)
G
%
%
*
,
Perubahan Konsentrasi
*
'
'
Perubahan Konsentrasi
!
(
.
%
(
Log Konsentrasi
. ,
%
(
.
Perubahan Tekanan
*
H
(
*
*
&
Perubahan Tekanan
. (
(
'
0
,
!
1 "
!
1"
Perubahan Temperatur
*
1
(
,
Hubungan Temperatur dengan
Tetapan Kesetimbangan K
'
I
!
!%
∆G = RTln(Q/K) = RTlnQ – RTlnK
Dengan memilih nilai Q pada keadaan standar, pada saat semua
konsentrasi 1 M (atau tekanan 1 atm), maka nilai ln Q = 0 dan ∆G =
∆G0, sehingga:
∆Go = - RTlnK
Pada setiap kondisi selain sistem kesetimbangan, kespontanan reaksi
dapat pula ditentukan:
∆G = ∆Go + RTlnQ
Jadi, jika Q<K, lnQ/K < 0, reaksi bergeser ke kanan (∆G <0)
Jika Q>K, lnQ/K > 0, reaksi bergeser ke kiri (∆G>0)
Jika Q = K, lnQ/K = 0, reaksi dalam kesetimbangan (∆G = 0)
Hubungan Temperatur dengan
Tetapan Kesetimbangan K
Dengan menggabungkan persamaan
∆Go = - RTlnK dengan ∆Go = ∆HoT∆
∆S, diperoleh persamaan van’t Hoff
yang menunjukkan hubungan antara K
dengan termperatur.
=−
()
"
∆
%&'
*
'
" "
−
+ +"
Temperatur naik akan menaikkan nilai
Kc untuk sistem dengan ∆Hrks positif
(endoterm).
Temperatur naik akan menurunkan
nilai Kc untuk sistem dengan ∆Hrks
negatif (eksoterm)
'
&