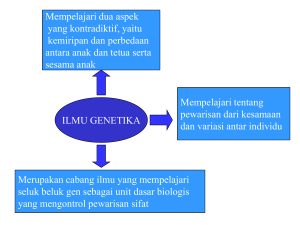
IV. METODA FENELITIAN 4.1. Tcknologi
advertisement

IV. METODA FENELITIAN 4.1. Tcknologi pcmataagan induk ikan pantau jantan dan betina Teknologi pematangan induk ikan pantau sebagai ikan uji dalam penelitian dilajcukan dalam keramba yang telah disiapkan di Desa Ranah, Kecamatan Kampar Kabupaten Kampar dan dalam bak fiber di Laboratorium Balai Benih Ikan Fakultas Perikanan dan Ilmu Kelautan Universitas Riau (Lampiran 1). Induk ikan diperoleh dari hasil tangkapan yang biasa dilakukan oleh para nelayan di perairan Sungai Kampar, Riau. Induk ikan yang akan dimatangkan diseleksi dengan karetaria memiliki tingkat kematangan gonad II dan dari spesies Rasbora lateristriata Blkr sesuai dengan rencana penelitian. Selama pemeliharaan, ikan diberi pakan Tubex sp dan pellet dengan kandungan protein 32 % dengan tujuan agar ikan dapat matang gonad secara homogen dan dalam waktu yang singkat, sesuai dengan perlakuan yang telah dicobakan pada ikan kapiek (Puntim schwanefeldi Blkr) yang berasal dari perairan Sungai Kampar pada tingkat kematangan gonad II diberi pakan pellet + vitamin E 10 %/IOO g diet dapat mencapai tingkat kematangan gonad IV dalam waktu 2,5 bulan (Sukendi, Putra dan Yurisman, 2006). Induk ikan pantau yang telah mencapai tingkat kematangan gonad IV dari \ hasil pematangan (Lampiran 2) maka selanjutnya dilakukan gonadosomatik Indeks (GSI) dengan menggunakan formula pengukuran yang dikemukakan Effendie(I992)yaitu: Bobot gonad (g) = ------------------- x 100% Bobot tubuh (g) i Untuk menduga jumlah telur yang dihasilkan maka dilakukan pula perhitungan nilai fekunditas berdasarkan metoda sub contoh dengan gravimetrik (Nikolsky, 1963) yaitu : F : t = B : b dimana : F = fekunditas (butir), t = jumlah telur dari contoh gonad (butir), B = bobot gonad seluruhnya (g) dan b = bobot contoh gonad (g). Untuk seleksi pematangan gonad induk ikan pantau jantan dilakukan pengukuran volume semen yang dihasilkan dengan cara menampung semen 13 menggunakan spuit tanpa jarum, hal ini karena keberhasilan pembenihan bukan saja tergantung pada kualitas telur, tetapi juga sangat ditentukan dengan kualitas spermatozoa dari induk ikan jantan. Dari hasil pengukuran parameter tersebut diatas akan diperoleh teknologi pematangan gonad induk ikan pantau jantan dan betina yang tepat siap dipijahkan dengan pemberian pakan tersebut di atas. 4.2. Pemijahan buatan ikan pantau 4.2.1. Teknologi penggunaan dosis kombinasi hCG dan ekstrak kelenjar hipofisa ikan mas untuk meningkatkan daya rangsang ovulasi dan kualitas telur induk ikan pantau betina Periakuan dan Rancangan Perlakuan penyuntikan kombinasi hCG dengan ekstrak kelenjar hipofisa ikan mas terhadap induk ikan pantau betina dilakukan berdasarkan hasil penelitian sebelumnya terhadap induk ikan kapiek (Puntius sckwcmefeldi Blkr) (Putra dan Sukendi, 2005), dimana perlakuan yang terbaik adalah kombinasi 800 IU hCG/kg bobot tubuh + 2 dosis. Maka untuk induk ikan pantau betina yang akan diteliti ini dicoba untuk menaikkan dan menurunkan dosis pada induk ikan kapiek yang diperoleh sebelumnya, yaitu dengan perlakuan : P. A P. B P. C P. D P. E P. F = = = = = = Kontrol (1 ml larutan Na Cl fisiologis 0,65 %/kg bobot tubuh) hCG 400 lU/kg bobot tubuh + CPE 2 dosis hCG 600 lU/kg bobot tubuh + CPE 2 dosis ' hCG 800 lU/kg bobot tubuh + CPE 2 dosis hCG 1000 lU/kg bobot tubuh + CPE 2 dosis hCG 1200 lU/kg bobot tubuh + CPE 2 dosis Ulangan dari masing-masing perlakuan dilakukan tiga kali sehingga jumlah keseluruhan induk ikan pantau betina yang diperlakukan ada sebanyak 18 ekor. Sedangkan wadah tempat induk ikan diperlakukan terdiri dari akuarium ukuran 60 x 60 x 40 cm yang telah dilengkapi dengan aerasi. Penyuntikan dilakukan dua kali dimana penyuntikan pertama menggunakan hCG sedangkan penyuntikan kedua menggunakan ekstrak kelenjar hipofisa ikan mas sesuai dengan peran kedua hormon tersebut dalam proses reproduksi ikan (Gambar 2 sebelumnya). 1 14 Rancangan yang digunakan adalah Rancangan Acak Lengkap (RAL) dengan model rancangan sebagai berikut: Yij i = u, + T i + Z ij dimana: Y ij = jj. Ti £ ij = = = Hasil pengamatan individu yang mendapat perlakuan ke - i dan ulanganke-j Rata-rata umum Pengaruh perlakuan ke-i Pengaruh galat perlakuan ke - i ulangan ke - j Peubah yang diukur untuk mewakili respons daya rangsang ovuiasi dan kualitas telur induk ikan pantau betina terdiri atas : 1. Waktu laten Waktu laten ditentukan dengan cara menghitung selisih antara waktu penyun-tikan terakhir dengan saat terjadi ovuiasi yang dinyatakan dengan satuan jam. 2. Jumlah telur yang diovulasikan Perhitungan jumlah telur yang diovulasikan dilakukan dengan menggunakan rumus sebagai berikut : x n dimana : A a b n 3. = = = = Jumlah telur (butir) yang berhasil diovulasikan Berat (gram) semua telur yang diovulasikan Berat (gram) sub sampel telur Jumlah rata-rata (butir) sub sampel telur Diameter telur Diameter telur ditentukan dengan cara mengambil sampel pengurutan ikan yang telah diberi perlakuan, telur dari hasil kemudian dari telur yang diperoleh diambil sebanyak 50 butir untuk diukur diameternya di bawah mikroskop yang telah dilengkapi dengan mikrometer okuler. 4. Kematangan telur Kematangan telur ditentukan dengan cara mengambil 50 butir telur hasil pengurutan, kemudian ditetesi larutan transparan yang terdiri atas larutan alkohol 95 % sebanyak 85 cc, formaldehida 40 % sebanyak 10 cc dan asam 15 asetat 100 % sebanyak 5 cc (Woynarovich dan Horvath, 1980). Setelah 5 - 1 0 menit diamati di bawah mikroskop telur yang intinya telah berpindah ke pinggir. Persentase kematangan telur ditentukan dengan menggunakan rumus sebagai berikut: T K x 100% M dimana: K T M = Prosentase kematangan telur = Jumlah telur yang intinya telah menepi = Jumlah keseluruhan telur contoh yang diamati Selain pengukuran parameter tersebut diatas dilakukan pula pengamatan preparat histologi ovarium ikan uji dari masing-masing perlakuan. Pengamatan preparat histologi ini bertujuan untuk melihat perkembangan yang terjadi pada ovarium ikan uji akibat perlakuan yang diberikan, terutama perkembangan oosit di dalam ovarium. Waktu pembuatan preparat histologi ovarium setelah perlakuan dibuat berdasarkan waktu laten yang terkecil (terbaik) pada waktu pengamatan pengaruh perlakuan terhadap daya rangsang ovulasi dan kualitas telur sebelumnya. Pembuatan preparat histologi berdasarkan metoda mikroteknik Gunarso (1989). Dari hasil pengukuran parameter dan pengamatan preparat histologi ini akan ditemukan teknologi penggunaan dosis kombinasi hCG dan ekstrak kelenjar hipofisa ikan mas untuk meningkatkan daya rangsang ovulasi dan kualitas telur induk ikan pantau betina 4.2.2. Teknologi penggunaan dosis kombinasi hCG dan ekstrak hipofisa ikan mas untuk meningkatkan volume semen dan kualitas spermatozoa induk ikan pantau jantan Perlakuan dan Rancangan Perlakuan penyuntikan kombinasi hCG dengan ekstrak kelenjar hipofisa ikan mas terhadap induk ikan pantau jantan dilakukan berdasarkan hasil penelitian sebelumnya terhadap induk ikan betutu (Oxyeleotris marmorata Blkr) (Nuraini dan Sukendi, 2005), dimana perlakuan yang terbaik adalah kombinasi 800 IU hCG/kg bobot tubuh + 2 dosis. Maka untuk induk ikan pantau jantan yang akan diteliti ini 16 sama seperti induk ikan betina sebelumnya dicoba untuk menaikkan dan menurunkan dosis pada induk ikan betutu yang diperoleh sebelumnya, yaitu dengan perlakuan : P. A P. B P. C P. D P. E P. F = = = = = = Kontrol (1 ml larutan Na Cl fisiologis 0,65 %/kg bobot tubuh) hCG 400 lU/kg bobot tubuh + CPE 2 dosis hCG 600 lU/kg bobot tubuh + CPE 2 dosis hCG 800 lU/kg bobot tubuh + CPE 2 dosis hCG 1000 Ill/kg bobot tubuh + CPE 2 dosis hCG 1200 lU/kg bobot tubuh + CPE 2 dosis i Sama dengan perlakuan pada induk ikan pantau betina sebelumnya, maka setiap perlakuan dilakukan tiga kali ulangan sehingga jumlah keseluruhan induk ikan pantau jantan yang diperlakukan ada sebanyak 18 ekor. Wadah tempat induk ikan jantan diperlakukan juga terdiri dari akuarium ukuran 60 x 60 x 40 cm yang telah dilengkapi dengan aerasi. Mctoda pcnyimtikan dilakukan sama dengan induk ikan pantau betina, yaitu dua kali dimana penyuntikan pertama menggunakan hCG sedangkan penyuntikan kedua menggunakan ekstrak kelenjar hipofisa ikan mas. Penelitian menggunakan Rancangan Acak Lengkap (RAL) dengan model rancangan sebagai berikut: dipiana : Y ij = u. = Ti = £ ij = Yij = ii + T i + Z ij Hasil pcngamatan individti yang mcndapat pcrlakuan ke - i dan ulangan ke-j Rata-rata umum Pengaruh perlakuan ke-i Pengaruh galat perlakuan ke - i ulangan ke - j Peubah yang diukur untuk mewakili respons volume semen kualitas spermatozoa induk ikan pantau jantan terdiri atas : 1. Volume semen (ml) Volume semen diukur dengan cara menyedot semen yang berhasil distripping dari induk ikan pantau jantan dengan memakai sptiit tanpa jarum 1,0 dan 2,0 ml kemudian ditentukan volumenya. 2. Konsentrasi Spermatozoa Konsentrasi spermatozoa ditentukan dengan menggunakan metoda petunjuk Toelihere (1985) dengan alat hemositometer, yaitu dengan cara : semen dihisap 17 dengan pipet merah sampai tanda 0,5. Kemudian pipet diangkat dari cairan semen, dan dihisap sedikit udara ke dalam pipet serta ujung pipet yang tersentuh semen dibersihkan dengan tissue. Selanjutnya dihisap larutan NaCl 3 % yang mengandung eosin (50 ml akuades + 2 ml eosin 2 % + 1,5 gram NaCl), sampai angka 101 dan kemudian dikocok dengan hati-hail Beberapa tetes diambil (± 5 tetes) dan dibuang dari pipet tersebut, lalu ujung pipet dibersihkan lag! dengan tissue. Larutan semen dari pipet tersebut diteteskan tepat di pinggir gelas penutup yang menutup gelas obyek Neubauer. Spermatozoa yang terdapat dalam lima kamar dihitung menurut arah diagonal, yaitu di sudut empat kamar dan satu kamar di tengah. Karena setiap kamar mempunyai 16 ruangan kecil, maka di dalam lima kamar terdapat 1 6 x 5 =80 ruangan kecil. Seluruh gelas hcmosilomctcr memiliki 400 ruangan kecil dengan volume 0,1 mm 3 dan pengenceran 200 kali. Jika jumlah spermatozoa di dalam lima kamar adalah X, maka konsentrasi spermatozoa yang didapat adalah X x 400/80 x 10 x 200 = X x 0,01 juta sperma/mm3 atau X x 10 7 sel/ml. Motilitas spermatozoa Pengukuran spermatozoa diukur bersamaan dengan penentuan konsentrasi spermatozoa. Setelah diketahui jumlah total spermatozoa dalam lima kamar (80 ruangan kecil) pada gelas obyek Neubauer, kemudian dihitung jumlah spermatozoa yang imotil (pergerakan tidak progresif seperti melingkar, mundur atau diam), sehingga didapatkan jumlah spermatozoa yang motil (pergerakan progresif atau gerakan aktif maju ke depan). Nilai motilitas spermatozoa dapat ditentukan dengan menggunakan rumus : Jumlah spermatozoa motil Motilitas spermatozoa = x 100 % Jumlah total spermatozoa Viabilitas spermatozoa Penentuan nilai viabilitas spermatozoa spermatozoa dengan eosin dilakukan berdasarkan pewarnaan 2 %. Pengamatan dilakukan dengan cara menghitung perbandingan spermatozoa yang hidup (tidak terwarnai) dengan yang mati (terwarnai) oleh eosin dan dinyatakan dalam persen. Nilai viabilitas spermatozoa ditentukan dengan menggunakan rumus : Jumlah spermatozoa hidup Viabilitas spermatozoa = x 100% Jumlah total spermatozoa 4.3. Teknologi fertilitas dan penetasan telur dalam pembenihan ikan pantau Teknologi yang dilakukan dalam fertilisasi dan penetasan telur adalah dengan mencampur telur dari induk ikan pantau betina hasil kombinasi penyuntikan hCG dan ekstrak kelenjar hipofisa ikan mas yang terbaik dengan semen dari induk ikan pantau jantan hasil kombinasi penyuntikan hCG dan ekstrak kelenjar hipofisa ikan mas yang terbaik. Teknologi ini diambil scbanyak dilakukan dengan cara sebagai berikut : Telur 150 butir dengan mengggnakan sendok kecil dari induk ikan betina dicampur dengan semen sebanyak 0,5 ml dari induk ikan jantan. Sebelum pembuahan, semen diencerkan sebanyak 100 kali (0,5 ml semen + 49,5 ml larutan NaCl fisiologis 0,65 %), dengan tujuan untuk memperbanyak volume semen sehingga motilitas dan viabilitas meningkat. Untuk meningkatkan nilai pembuahan, ke dalam telur yang telah dicampur dengan semen ditambahkan 1 ml larutan pembuahan (4 gram NaCI + 3 gram urea/liter akuabides). Untuk inkubasi telur ditebarkan ke dalam wadah (akuarium) sebanyak 12 buah yang dianggap sebagai ulangan (Lampiran 3). Peubah yang diukur untuk mewakili respons fertilitas dan penetasan telur terdiri atas: 1. Fertilitas Nilai fertilitas telur ditentukan dengan menggunakan rumus yang dikemukakan oleh Suseno dan Cholik (1982) yaitu : Jumlah telur yang dibuahi Fertilitas = Jumlah telur sampel 2. Daya tetas ( x 100% Daya tetas telur ditentukan dengan menggunakan rumus yang dikemukakan oleh Suseno dan Cholik (1982) yaitu : 19 Jumlah telur yang menetas Dayatetas = x 100% Jumlah telur dibuahi Selama inkubasi dalam proses fertilisasi dan penetasan telur dilakukan pula pengamatan terhadap proses perkembangan embrio, sehingga diketahui gambaran perkembangan embrio (embriogenesis) hasil fertilisasi telur dan semen yang diperoleh dari kombinasi penyuntikan hCG dan ekstrak Kelenjar hipofisa ikan mas terbaik terhadap induk ikan pantau jantan dan betina.