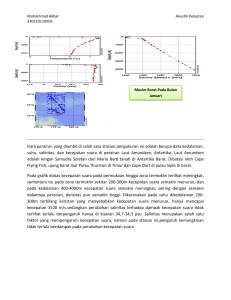
Pengaruh Konsentrasi Bahan Organik, Salinitas, dan
advertisement

Seminar Nasional Pascasarjana XIII – ITS, Surabaya 15 Agustus 2013 ISBN No. Pengaruh Konsentrasi Bahan Organik, Salinitas, dan pH Terhadap Laju Pertumbuhan Alga Dwi Ratri Mitha Isnadina 1*, Joni Hermana 2 Institut Teknologi Sepuluh Nopember, Surabaya, Indonesia1* [email protected] Institut Teknologi Sepuluh Nopember, Surabaya, Indonesia2 Abstrak Kinetika pertumbuhan mikroorganisme, baik alga maupun bakteri, mempengaruhi oksidasi bahan organik dan produksi biomassa. Pertumbuhan alga dipengaruhi oleh sumber karbon, sumber nutrisi dan kondisi lingkungan tumbuhnya. Koefisien pertumbuhan alga dapat diformulasikan menggunakan persamaan Monod. Berdasarkan persamaan Monod, semakin besar konsentrasi bahan organik maka semakin cepat laju pertumbuhan, sehingga semakin banyak biomassa yang dihasilkan. Pada penelitian ini, akan dilakukan uji terhadap pengaruh konsentrasi bahan organik sebagai sumber karbon terhadap pertumbuhan. Variabel lain yang digunakan dalam penelitian ini adalah salinitas dan pH yang mewakili kondisi lingkungan. Selain itu, akan dilakukan perhitungan koefisien biokinetik dalam nilai µ, µmax, Y, dan Ks. Konsentrasi bahan organik divariasikan menjadi 3 yaitu 250 mg/L, 430 mg/L dan 800 mg/L. Kondisi lingkungan tumbuh alga dalam pH asam (pH 4,5 dan pH 6) serta pH basa (pH 9) sedangkan penambahan konsentrasi salinitas dibagi menjadi 0,8 dan 1,5 ppt. Penelitian dilakukan selama 14 hari untuk masing-masing konsentrasi bahan organik dan dilakukan analisis parameter VSS, COD, dan klorofil a setiap hari selama penelitian berlangsung. Laju pertumbuhan spesifik (µ) tertinggi terjadi pada reaktor uji dengan konsentrasi awal bahan organik sebesar 757,6 mg/L dengan penambahan salinitas sebesar 1,5 ppt dan dalam kondisi pH 9 yaitu sebesar 0,438 hari-1. Laju pertumbuhan maksimum (µmax) sebesar 0,448 hari-1, koefisien produksi (Y) sebesar 0,162 mg VSS/mg COD, dan Ks sebesar 50,1 mg/L. Konsentrasi bahan organik dan pH memiliki pengaruh yang besar, sedangkan variasi salinitas tidak berpengaruh besar pada penelitian ini. Katakunci: Koefisien biokinetik, Konsentrasi bahan organik, Pertumbuhan alga, pH, Salinitas 1. Pendahuluan Mikroalga memiliki peran penting dalam pengolahan limbah domestik dimana mikroalga berperan dalam menurunkan nutrien, logam berat, dan patogen, namun mikroalga sensitif terhadap pencemar beracun. Selain itu, mikroalga menghasilkan oksigen (O2) yang dibutuhkan bakteri heterotrof untuk mengolah polutan organik (Muñoz dan Guieysse, 2006). Beberapa dekade terakhir, banyak dilakukan penelitian mengenai pengolahan air limbah dengan memanfaatkan peran mikroalga pada High Rate Algal Ponds (HRAP). HRAP adalah kolam yang didesain secara ekologis dengan adanya simbiosis antara bakteri aerobik dan alga (Craggs et al. 2004). Mikroalga dan bakteri memiliki peran penting dalam pengolahan air limbah dengan HRAP, oleh karena itu pertumbuhan mikroorganisme tersebut merupakan fokus utama untuk menjaga performa HRAP. Pertumbuhan mikroorganisme dipengaruhi oleh beberapa faktor seperti sumber nutrien, sumber karbon, dan faktor lingkungan (oksigen terlarut, suhu, pH, dan salinitas). Kinetika pertumbuhan mikroorganisme mempengaruhi oksidasi bahan organik dan produksi biomassa (Metcalf dan Eddy, 2004). Formulasi yang sering digunakan dalam hubungan mikroorganisme dengan oksidasi bahan organik adalah Persamaan Monod. Berdasarkan Persamaan Monod, semakin besar konsentrasi bahan organik, maka semakin cepat laju pertumbuhan bakteri. Pertumbuhan bakteri akan mendorong pertumbuhan mikroalga pada kultur campuran karena bakteri akan menghasilkan karbon dioksida (CO2) yang merupakan sumber karbon mikroalga. Simbiosis mutualisme antara mikroalga dan bakteri muncul pada pengolahan dengan HRAP. Variasi harian bahan organik pada badan air dapat mempengaruhi pertumbuhan mikroorganisme karena bahan organik adalah sumber karbon bakteri. Selain itu, faktor lingkungan seperti pH dan salinitas juga mempengaruhi metabolisme mikroorganisme. Variasi salinitas terjadi di daerah sekitar muara akibat adanya pasang surut air laut dimana salinitas mempengaruhi tekanan osmosis pada sel mikroorganisme. Sedangkan variasi pH disebabkan adanya aktifitas biologis pada lingkungan perairan dimana pH mempengaruhi kinerja enzim dalam metabolisme sel. Koefisien biokinetik digunakan untuk memprediksi laju oksidasi substrat dan pertumbuhan Seminar Nasional Pascasarjana XIII – ITS, Surabaya 15 Agustus 2013 ISBN No. biomassa dapat divariasikan sebagai fungsi dari sumber air limbah, populasi mikroba, dan suhu (Metcalf dan Eddy, 2004). Penelitian ini bertujuan untuk mengkaji pengaruh konsentrasi bahan organik, salinitas, dan pH terhadap laju pertumbuhan alga. Selain itu, dicari nilai koefisien pertumbuhan alga pada penelitian ini. 2. Metode Bagian ini meliputi penjelasan mengenai waktu dan tempat pelaksanaan penelitian; alat dan bahan yang digunakan; metode penelitian dan analisis parameter serta cara pengolahan data. 2.1. Waktu dan Tempat Penelitian Penelitian dilakukan pada bulan Maret – Juni 2013 di Laboratorium Kualitas Air, Jurusan Teknik Lingkungan, FTSP-ITS. 2.2. Alat dan Bahan Penelitian ini menggunakan reaktor batch dengan volume 10 L yang terbuat dari plastik dan dilengkapi dengan pompa submersible seperti Gambar 1. Alat lain yang digunakan adalah peralatan laboratorium untuk analisis parameter pH, COD (Chemical Oxygen Demand), VSS (Volatile Suspended Solids), dan klorofil a. Gambar 1. Sketsa Reaktor Keterangan: Reaktor A = pH 4,5; Salinitas 0,8 ppt. Reaktor B = pH 6; Salinitas 0,8 ppt. Reaktor C = pH 9; Salinitas 0,8 ppt. Reaktor D = pH 4,5; Salinitas 1,5 ppt. Reaktor E = pH 6; Salinitas 1,5 ppt. Reaktor F = pH 9; Salinitas 1,5 ppt. Reaktor Kontrol = tanpa larutan penyangga dan tanpa penambahan nilai salinitas. Bahan yang dibutuhkan adalah reagen yang dibutuhkan untuk analisis parameter, kultur alga, dan media kultur. Kultur alga berasal dari saluran drainase Jl. Arief Rahman Hakim karena memiliki nilai indeks keanekaragaman terbesar berdasarkan analisis awal karakteristik. Media kultur mengandung larutan gula sebagai sumber bahan organik, larutan NaCl untuk variasi salinitas, buffer fosfat sebagai larutan penyangga pH dan nutrisi yang komposisinya berdasarkan Bold’s Bassal Medium yang dituliskan pada Tabel 1. Tabel 1. Komposisi Nutrisi Bold’s Bassal Medium Jumlah di Konsentrasi Media Bahan Kimia pada Larutan Kultur Stock (g/L) (mL/L) NaNO3 25,00 10 CaCl2.2H2O 2,50 10 MgSO4.7H2O 7,50 10 K2HPO4 7,50 10 KH2PO4 17,50 10 NaCl 2,50 10 Trace element 1 a. CuSO4.5H2O 1,57 b. (NH4)6Mo7O24 0,09 c. ZnSO4.7H2O 8,82 d. MnSO4.H2O 0,59 H3 B3 11,40 1 EDTA-KOH Solution 1. EDTA Na2 50,00 2. KOH 31,00 FeSO4.7H2O 4,98 1 H2SO4 1 mL/L 2.3. Metode Penelitian Penelitian berlangsung selama 14 hari dalam reaktor batch dalam skala laboratorium. Pengambilan sampel dilakukan tiap hari kecuali Sabtu, Minggu, dan Hari Libur Nasional. Penelitian ini menggunakan 3 variabel yaitu konsentrasi bahan organik, salinitas, dan pH. Bahan organik divariasikan menjadi 250, 430, dan 800 mg/L. Salinitas divariasikan menjadi 0,8 dan 1,5 ppt. pH divariasikan menjadi pH 4,5; 6 dan 9. Reaktor 10 L terdiri dari media kultur sebanyak 7,5 L dan 2,5 L kultur alga. Kultur yang digunakan bukan kultur murni alga melainkan campuran antara alga dan mikroba. Parameter yang dianalisis adalah Chemical Oxygen Demand (COD), Volatile Suspended Solids (VSS), dan Klorofil a. Analisis COD menggunakan metode Closed Reflux, Titrimetric; analisis VSS menggunakan metode Fixed and Volatile Solids Ignited at 550oC; dan analisis klorofil a menggunakan metode Spectrophotometric Determination of Chlorophyll. Metode analisis berdasarkan Standard Method (APHA, 1998). 2.4. Pengolahan Data Hasil analisis parameter selanjutnya digunakan untuk menentukan nilai koefisien biokinetik. Koefisien biokinetik yang ditentukan pada penelitian ini adalah nilai µ, µmax, Ks, dan Y. Cara menentukan nilai koefisien tersebut adalah sebagai berikut: Seminar Nasional Pascasarjana XIII – ITS, Surabaya 15 Agustus 2013 ISBN No. • Nilai µ Nilai µ dapat ditentukan dengan menggunakan persamaan berikut (Perez-Garcia et al., 2010): (1) µ = (ln Xt n − ln Xt 0 ) ( t n − t 0 ) € € € € dimana: µ = laju pertumbuhan spesifik, hari-1. Xtn = konsentrasi biomassa hari ke-n, mg/L. Xt0 = konsentrasi biomassa hari ke-0, mg/L. tn = hari ke-n, hari. = hari ke-0, hari. t0 Plotkan nilai (t) terhadap (ln X) dan buat garis regresinya. Nilai slope adalah nilai µ. • Nilai µmax dan Ks. Nilai µmax dan Ks dapat ditentukan dengan menggunakan persamaan berikut (Okpokwasili dan Nweke, 2005): S0 (2) µ = µmax K s + S0 dimana: µmax = laju pertumbuhan maksimum, hari -1. S0 = konsentrasi awal bahan organik, mg/L. Ks = konstanta kejenuhan bahan organik, mg/L. Plotkan nilai (1/S0) terhadap (1/µ) dan buat garis regresinya. Nilai slope adalah nilai K s dan nilai intercept adalah nilai 1 . µmax µmax • Nilai Y Nilai Y dapat ditentukan dengan menggunakan persamaan berikut (Metcalf dan € Eddy, 2004): ΔX (3) Y= ΔS dimana: Y = koefisien produksi, mg VSS/ mg COD. ΔX = selisih biomassa, mg VSS/L. ΔS = selisih konsentrasi bahan organik, mg COD/L. 3. Pembahasan Laju pertumbuhan alga dipengaruhi oleh dua faktor utama. Faktor pertama adalah sumber nutrisi dan energi, sementara faktor kedua adalah faktor lingkungan seperti pH, suhu, dan salinitas. Pada penelitian ini dilakukan pengkayaan bahan organik pada kultur tumbuh untuk melihat pengaruh sumber karbon organik pada pertumbuhan alga. Selain itu, dilakukan uji terhadap pertumbuhan alga di lingkungan yang bukan merupakan kondisi optimumnya. Kemampuan tumbuh alga dilihat dari nilai koefisien biokinetik yang didapatkan. Penelitian ini membutuhkan 7 reaktor untuk masing-masing konsentrasi bahan organik seperti Gambar 1. Konsentrasi bahan organik direncanakan sebesar 250, 430, dan 800 mg/L. Namun dari hasil analisis didapatkan konsentrasi awal bahan organik sebesar 232,0; 418,7; dan 757,6 mg/L. Running I adalah percobaan dengan konsentrasi awal bahan organik sebesar 232 mg/L, Running II adalah percobaan dengan konsentrasi awal bahan organik sebesar 418,7 mg/L, dan Running III adalah percobaan dengan konsentrasi awal bahan organik sebesar 757,6 mg/L. 3.1. Perhitungan Koefisien Biokinetik Perhitungan nilai koefisien berdasarkan biomassa yang dihitung dalam nilai VSS (mg/L) dan klorofil a (mg/L). Nilai VSS menggambarkan banyaknya biomassa baik alga maupun bakteri, sedangkan nilai klorofil a menggambarkan konsentrasi pigmen klorofil pada sampel. Nilai klorofil a bukan merupakan nilai berat alga. Laju pertumbuhan spesifik (µ) adalah kecepatan pertumbuhan alga selama fase eksponensial dimana pada penelitian ini dinyatakan dalam satuan hari-1. Fase eksponensial pada penelitian ini rata-rata terjadi mulai hari ke-0 hingga hari ke-3. Contoh grafik hubungan nilai (t) terhadap (ln X) dapat dilihat pada Gambar 2 dan 3. Gambar 2. Hubungan t (hari) dengan ln X (VSS) Reaktor Kontrol Gambar 3. Hubungan t (hari) dengan ln X (klorofil a) Reaktor Kontrol Selanjutnya dicari nilai µmax dan Ks. µmax adalah laju pertumbuhan maksimum dimana saat konsentrasi bahan organik semakin banyak, laju pertumbuhan cenderung konstan atau turun. Sedangkan Ks menunjukkan kepekaan konsen- Seminar Nasional Pascasarjana XIII – ITS, Surabaya 15 Agustus 2013 ISBN No. trasi bahan organik terhadap pertumbuhan biomassa. Ks adalah konsentrasi bahan organik pada setengah laju pertumbuhan maksimum. Contoh grafik hubungan nilai (1/S0) terhadap (1/µ) dapat dilihat pada Gambar 4 dan Gambar 5. Nilai koefisien selanjutnya adalah nilai Y atau biomass yield adalah rasio jumlah produksi biomassa dan jumlah substrat yang digunakan (Metcalf dan Eddy, 2004). Hasil perhitungan keseluruhan koefisien biokinetik dapat dilihat pada Tabel 2 dan Tabel 3. Lanjutan Tabel 2. S0 232,0 418,7 757,6 232,0 418,7 757,6 232,0 418,7 757,6 232,0 418,7 757,6 232,0 418,7 757,6 Gambar 4. Hubungan 1/S0 dengan 1/µ (VSS) Reaktor Kontrol Gambar 5. Hubungan 1/S0 dengan 1/µ (Klorofil a) Reaktor Kontrol Persamaan Monod pada dasarnya digunakan untuk kultur murni bakteri yang tumbuh dengan substrat organik tunggal, namun berdasarkan penelitian terdahulu yang telah dilakukan menunjukkan bahwa model tersebut juga dapat digunakan dengan baik untuk kultur campuran antara alga dan bakteri heterotrof pada kondisi karbon organik yang bermacam-macam. Koefisien biokinetik tersebut dapat digunakan untuk memperkirakan oksidasi bahan organik dan produksi biomassa. Tabel 2. Koefisien Biokinetik Berdasarkan Nilai VSS Koefisien Biokinetik S0 µ µmax Ks Reaktor A (pH 4,5; Salinitas 0,8 ppt) 232,0 0,256 0,027 137,3 418,7 0,018 757,6 0,099 Reaktor B (pH 6; Salinitas 0,8 ppt) 232,0 0,259 0,439 150,2 418,7 0,358 757,6 0,342 Y 0,132 0,000 0,059 0,538 0,296 0,165 Koefisien Biokinetik µ µmax Ks Reaktor C (pH 9; Salinitas 0,8 ppt) 0,284 0,508 169,5 0,407 0,383 Reaktor D (pH 4,5; Salinitas 1,5 ppt) 0,244 0,089 112,6 0,077 0,153 Reaktor E (pH 6; Salinitas 1,5 ppt) 0,254 0,406 125,8 0,357 0,320 Reaktor F (pH 9; Salinitas 1,5 ppt) 0,376 0,448 50,1 0,378 0,438 Reaktor Kontrol 0,259 0,749 444,9 0,351 0,486 Y 0,621 0,309 0,131 0,252 0,000 0,099 0,375 0,290 0,172 0,746 0,221 0,162 0,421 0,293 0,146 Tabel 3. Koefisien Biokinetik Berdasarkan Nilai Klorofil a Koefisien Biokinetik S0 µ µmax Ks Y Reaktor A (pH 4,5; Salinitas 0,8 ppt) 232,0 0,380 0,399 48,7 0,00020 418,7 0,254 0,00012 757,6 0,515 0,00003 Reaktor B (pH 6; Salinitas 0,8 ppt) 232,0 0,485 0,499 15,4 0,00032 418,7 0,436 0,00026 757,6 0,524 0,00005 Reaktor C (pH 9; Salinitas 0,8 ppt) 232,0 0,621 0,573 21,4 0,00037 418,7 0,376 0,00017 757,6 0,792 0,00028 Reaktor D (pH 4,5; Salinitas 1,5 ppt) 232,0 0,416 0,251 74,1 0,00017 418,7 0,241 0,00007 757,6 0,329 0,00005 Reaktor E (pH 6; Salinitas 1,5 ppt) 232,0 0,541 0,485 19,9 0,00039 418,7 0,484 0,00024 757,6 0,515 0,00004 Reaktor F (pH 9; Salinitas 1,5 ppt) 232,0 0,507 0,750 139,2 0,00034 418,7 0,449 0,00014 757,6 0,776 0,00040 Reaktor Kontrol 232,0 0,668 0,849 73,1 0,00026 418,7 0,653 0,00020 757,6 0,835 0,00029 3.2. Analisis Pengaruh Konsentrasi Bahan Organik Sumber bahan organik yang digunakan pada penelitian ini adalah sukrosa atau gula pasir, walaupun glukosa dan asetat yang banyak digunakan sebagai sumber karbon pada budidaya mikroalga berdasarkan hasil penelitian terdahulu (Perez-Garcia et al., 2011). Data yang digunakan untuk analisis adalah laju pertumbuhan reaktor kontrol pada tiga konsentrasi bahan organik yang berbeda (S0 = 232 mg/L; S0 = 418,7 mg/L; dan S0 = 757,6 mg/L). Data tersebut digunakan karena pada reaktor kontrol tidak ada pengontrolan nilai pH dan penambahan konsentrasi Seminar Nasional Pascasarjana XIII – ITS, Surabaya 15 Agustus 2013 ISBN No. salinitas, sehingga kondisi lingkungannya tidak terikat pada variabel tersebut. Dilihat pada Tabel 2, nilai laju pertumbuhan spesifik semakin naik sejalan dengan bertambahnya konsentrasi bahan organik. Hal tersebut membuktikan bahwa peningkatan konsentrasi bahan organik juga akan meningkatkan laju pertumbuhan spesifik mikroorganisme. Namun bila dilihat dari Tabel 3, nilai laju pertumbuhan spesifik pada S0 = 418,7 mg/L lebih kecil dibandingkan laju pertumbuhan spesifik pada S0 = 232 mg/L, namun selisih antara keduanya tidak terlalu mencolok. Hasil analisis tersebut sesuai dengan penelitian yang dilakukan oleh Kayombo et al. pada tahun 2003. Penelitian Kayombo et al. menyimpulkan bahwa semakin besar konsentrasi bahan organik, maka laju pertumbuhan spesifik mikroorganisme juga semakin tinggi dengan fase eksponensial terjadi selama 3,5 – 5,3 hari. Pada kultur campuran, terdapat simbiosis antara mikroalga dan bakteri yang menyebabkan pertumbuhan bakteri mempengaruhi pertumbuhan mikroalga. Bahan organik merupakan sumber karbon metabolisme bakteri dimana metabolisme tersebut menghasilkan CO2 yang merupakan sumber karbon mikroalga. CO2 dimanfaatkan oleh mikroalga untuk fotosintesis saat terdapat energi cahaya dan menghasilkan O2 yang digunakan oleh bakteri untuk metabolisme. Metabolisme mikroalga dapat mengalami perubahan saat bahan organik eksternal tinggi dan terjadi keterbatasan karbon inorganik. Mayoritas mikroalga adalah mikroalga fotoautotrof, namun saat salah satu dari dua kondisi tersebut terjadi akan menyebabkan perubahan metabolisme menjadi fotoheterotrof atau miksotrof. Fotoheterotrof merupakan proses dengan dua faktor penting yang mempengaruhi pertumbuhan yaitu substrat karbon organik dan intensitas cahaya. Namun, ini belum diteliti secara sistematis dan dimodelkan (Chojnacka dan Noworyta, 2004). Jadi dapat disimpulkan bahwa bahan organik mempunyai efek langsung dan tidak langsung terhadap laju pertumbuhan alga. 3.3. Analisis Pengaruh pH pH merupakan salah satu kondisi lingkungan yang mempengaruhi pertumbuhan alga. Perubahan pH pada badan air terjadi akibat proses biologis yang terjadi. pH mempengaruhi kelarutan dan ketersediaan ion mineral, sehingga mempengaruhi penyerapan ion mineral oleh sel. pH juga mempengaruhi kinerja enzim yang dapat menghambat proses fotosintesis dan pertumbuhan alga. Selain itu, perubahan pH menyebabkan redistribusi berbagai jenis karbon inorganik yang mungkin memiliki efek yang buruk terhadap proses pertumbuhan. Karbon inorganik yang banyak dimanfaatkan oleh alga adalah CO2 karena (1) CO2 adalah bentuk karbon iorganik yang digunakan oleh enzim ribulose 1,5- biphosphate carboxylase dan (2) alga tersuspensi yang tumbuh pada kondisi dimana ada keterbatasan karbon menunjukkan respon kinetik fraksi CO2 pada karbon organik terlarut (Liehr et al., 1988). Berdasarkan nilai rerata laju pertumbuhan spesifik, dapat disimpulkan bahwa pertumbuhan paling baik terjadi pada kondisi pH 9. Hal tersebut sesuai dengan kisaran pH optimum untuk pertumbuhan alga yaitu pH 7 – 9. Laju pertumbuhan spesifik terkecil terjadi pada media kultur dengan pH 4,5. Kondisi pH asam dalam sel dapat mengakibatkan gangguan pada proses biokimia sel yang selanjutnya mempengaruhi pertumbuhan sel tersebut (Gunawan, 2012). 3.4. Analisis Pengaruh Salinitas Faktor lingkungan yang mempengaruhi pertumbuhan selain pH adalah salinitas (Bartley et al., 2013). Perubahan salinitas mempengaruhi alga dengan tiga cara: (1) tekanan osmotik, (2) tekanan ion, dan (3) perubahan rasio ionik akibat permeabilitas membran (Mata et al., 2010). Peningkatan konsentrasi garam berhubungan dengan penurunan laju fotosintesis. Laju fotosintesis tertinggi terjadi pada media alami dan menurun dengan meningkatnya salinitas. Salinitas mempengaruhi laju pertumbuhan yang dibuktikan dengan nilai laju pertumbuhan reaktor kontrol lebih besar dibandingkan laju pertumbuhan reaktor yang ditambahkan nilai salinitas. Namun pada penelitian ini juga, laju pertumbuhan alga pada kondisi 0,8 ppt dan 1,5 ppt tidak banyak perbedaan nilai sehingga disimpulkan bahwa variasi salinitas yang ditentukan (0,8 dan 1,5 ppt) tidak memberikan efek yang besar terhadap pertumbuhan alga. Hal tersebut dapat dilihat dari laju pertumbuhan yang mengalami kenaikan dan penurunan namun selisih antara keduanya kecil. Alga memiliki rentang salinitas optimum yang berbeda-beda. Penelitian yang dilakukan oleh Asulabh et al. (2012) menyimpulkan bahwa alga air tawar masih mampu bertahan dan tumbuh pada kondisi dengan tingkat salinitas sebesar 2 ppt. Alga memiliki respon terhadap lingkungan dengan variasi salinitas kecil yaitu dengan menghasilkan glukosil-gliserol untuk meningkatkan salinitas dalam sel (Sigee, 2005). 4. Kesimpulan Laju pertumbuhan alga pada penelitian ini dipengaruhi konsentrasi bahan organik dan pH, sedangkan penambahan salinitas pengaruhnya tidak sebesar konsentrasi bahan organik dan pH. Data analisis parameter digunakan untuk menentukan koefisien biokinetik dalam nilai µ, µmax, Ks, Seminar Nasional Pascasarjana XIII – ITS, Surabaya 15 Agustus 2013 ISBN No. dan Y. Koefisien biokinetik dihitung berdasarkan nilai VSS dan klorofil a dimana nilai koefisien yang didapat berbeda-beda untuk masing-masing kondisi kultur. Pertumbuhan alga terbaik terjadi di reaktor dengan konsentrasi awal bahan organik (S0) sebesar 757,6 mg/L dan pH 9 dengan penambahan salinitas sebesar 1,5 ppt berdasarkan nilai µ yang dihitung atas nilai VSS. 5. Pustaka APHA, AWWA, WAE, (1998). Standard Methods for the Examination of Water and Waastewater 20th Edition. Washington, D.C.: American Public Health Association Asulabh, K.S., Supriya, G., dan Ramachndra, T.V., (2012). Effect of Salinity Concentrations on Growth Rate and Lipid Concentration in Microcystis sp., Chlorococcum sp., and Chaetoceros sp. In National Conference on Conservation and Management of Wetland Ecosystems. Kerala, India, November, 6-9 Chojnacka, K. dan Noworyta, A., (2004). Evaluation of spirulina sp. growth in photoautotrophic, heterotrophic, and mixotrophic cultures. Enzyme and Microbial Technology, 34: p. 461-465 Craggs, R.J., Zwart, A., Nagels, J.W., dan DaviesColley, R.J., (2004). Modelling sunlight disinfection in a high rate pond. Ecological Engineering, 22: p. 113-122 Gunawan, (2012). Pengaruh perbedaan pH pada pertumbuhan mikroalga klas Chlorophyta. Bioscientiae, 2(9): p. 62-65 Kayombo, S., Mbwette, T.S.A., Katima, J.H.Y., dan Jogersen, S.E., (2003). Effects of substrate concentrations on the growth of heterotrophic bacteria and algae in secondary facultative ponds. Water Research, 37: p. 2937-2943 Liehr, S.K., Eheart, W., dan Suida, Mt., (1988). A modelling study of the effect of pH on carbon limited algal biofilms. Water Research. 22(8): p. 1033-1041 Mata, T.M., Martins, A.A., dan Caetano, N.S., (2010). Microalgae for biodiesel production and othe application: A review. Renewable and Sustainable Energy Reviews, 14: p. 217-232 Metcalf dan Eddy, (2004). Waste Water Engineering: Treatment, Disposal, and Reuse. New York: McGraw-Hill Muñoz, R. dan Guieysse, B., (2006). Algal-bacterial processes for the treatment of hazardous contaminants: A review. Water Research, 40: p. 2799-2815 Okpokwasili, G.C., dan Nweke, C.O., (2005). Microbial growth and substrate utilization kinetics. Affrican Journal of Biotechnology, 5(4): p. 306-317 Perez-Garcia, O., de-Bashan, L.E., Hernandez, JuanPablo, dan Bashan, Y., (2010). Efficiency of growth and nutrient uptake from wastewater by heterotrophic, autotrophic, and mixotrophic cultivation of Chlorella vulgaris immobilized with Azospirillum brasilense. Journal Phycol., 46: p. 800-812 Perez-Garcia, O., Escalante, F.M.E., de-Bashan, L.E., dan Bashan, Y., (2011). Heterotrophic cultures of microalgae: Metabolism and potential products. Water Research, 45: p. 11-36 Sigee, D.C., (2005). Freshwater Microbiology, Biodivesity, and Dynamic of Microorganisms in the Aquatic Environment. West Sussex, England: John Willey & Sons