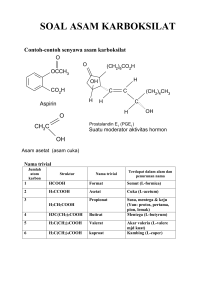
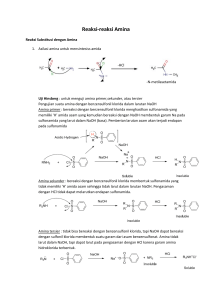
BAB VI ASAM KARBOKSILAT DAN TURUNANNYA 6.1. Tujuan
advertisement

97 BAB VI ASAM KARBOKSILAT DAN TURUNANNYA 6.1. Tujuan Perkuliahan Dalam kegiatan pembelajaran ini Anda akan mempelajari gambaran umum tentang asam karboksilat dan turunannya, yang meliputi rumus umum, tata nama, sifat fisika, perbedaan antara asam karboksilat dan turunannya, sumber terdapatnya, manfaat, kegunaan, dan dampak penggunaannya terhadap kesehatan manusia dan kelestarian lingkungan agar Anda memiliki sikap yang penuh pertimbangan moral dalam memanfaatkan senyawa asam karboksilat dan turunannya dalam kehidupan sehari-hari, memiliki kesadaran lingkungan yang baik sebagai individu dan sebagai warga masyarakat sehingga mampu menjadi panutan bagi orang lain dalam memanfaatkan senyawa asam karboksilat dan turunannya. Melalui pembelajaran ini, Anda diharapkan dapat: 1. Menjelaskan definisi senyawa asam karboksilat dan turunannya. 2. Menjelaskan perbedaan senyawa asam karboksilat dan turunannya. 3. Mendeskripsikan sifat fisika dan sifat kimia dari asam karboksilat dan turunannya. 4. Memberi nama senyawa asam karboksilat dan turunannya sesuai aturan IUPAC. 5. Menuliskan reaksi-reaksi yang spesifik dari senyawa asam karboksilat dan turunannya. 6. Menjelaskan efek dan efek negatif dari penggunaan senyawa asam karboksilat dan turunannya terhadap kesehatan makhluk hidup dan lingkungan. 7. Memiliki sikap dan perilaku yang pro lingkungan dalam mengaplikasikan senyawa asam karboksilat dan turunannya dalam kehidupan sehari-hari. 98 8. Membuat daftar senyawa asam karboksilat dan turunannya dari bahan alam dan sintetis yang memiliki efek terhadap kesehatan, dan lingkungan serta menjelaskan pentingnya senyawa tersebut. 9. Menunjukkan perilaku sehari-hari yang sesuai dengan pengetahuan yang telah dimiliki dalam bentuk laporan jurnal. 10. Memberikan pertimbangan moral pro lingkungan yang bijaksana terhadap fenomena yang terjadi dalam kehidupan sehari-hari 6.1. Uraian Materi Perkuliahan 6.1.1. Struktur Asam karboksilat dan turunannya Asam karboksilat memiliki struktur umum sebagai berikut: Asam karboksilat aromatik Asam karboksilat alifatik Gambar 6.1. Struktur Asam Karboksilat Warna merah merupakan gugus karboksil, biasanya ditulis dalam bentuk terkondensasi sebagai -COOH atau –CO2H. Istilah asam karboksilat diambil dari istilah karbonil dan hidroksil, dua unit struktural yang membentuk gugus karboksil. kata asam menginformasikan sifat dari molekul ini yang dapat berdisosiasi dalam air untuk melepaskan proton. Dalam bab ini kita juga akan mempelajari ester, yang memiliki struktur umum sebagai berikut: 99 Gambar 6.2. Rumus Umum Ester Warna merah dalam struktur menunjukkan gugus asil. Gugus asil adalah bagian dari kelompok fungsional dari turunan asam karboksilat, termasuk ester, asam klorida, asam anhidrida, dan amida. Gambar 6.3. Bentuk Molekul Ester dan Ester 6.2.1. Struktur dan Sifat Fisika dari Asam Karboksilat a. Sifat Fisika Gugus karboksil terdiri dari dua gugus fungsional yang sangat polar, gugus karbonil dan gugus hidroksil. Jadi asam karboksilat adalah senyawa yang sangat polar. Bisa berikatan hidrogen satu sama lain dan dengan molekul pelarut polar seperti air, sebagai konsekuensi dari ikatan hidrogen antarmolekul, titik didih senyawa ini lebih tinggi daripada aldehida, keton, atau alkohol dengan berat molekul yang sebanding. Perbandingan titik didih alkana, alkohol, eter, aldehid, keton, dan asam karboksilat dengan berat molekul sebanding dapat dilihat di bawah ini: 100 Gambar 6.4. Struktur dan Sifat Fisika dari Senyawa Organik Seperti alkohol, asam karboksilat yang lebih kecil yang larut dalam air (Gambar 6.4). Namun, kelarutan akan semakin berkurang seiring dengan bertambahnya jumlah atom karbon pada rantai alkilnya. Misalnya, asam asetat (asam karboksilat ditemukan dalam cuka) benar-benar larut dalam air, tetapi asam heksadekanoat (asam karboksilat dengan enam belas atom karbon yang ditemukan dalam minyak sawit) tidak larut dalam air. Asam karboksilat dengan berat molekul yang rendah berat molekul memiliki rasa asam yang tajam, dan aroma yang tidak menyenangkan. Asam format, HCOOH, asam semut, merupakan bahan kimia yang digunakan sebagai pertahanan pada semut, menyebabkan sensasi terbakar dari gigitan semut. Asam asetat, CH3COOH, ditemukan dalam cuka; asam propionat, CH3CH2COOH, bertanggung jawab untuk rasa tajam yang khas dari keju Swiss; dan asam butirat, CH3CH2CH2COOH, menyebabkan bau tengik dan gas gangren pada mentega. Asam karboksilat dengan rantai yang lebih panjang disebut asam lemak dan merupakan komponen penting dari membran biologis dan trigliserida, ini merupakan bentuk penyimpanan lemak dalam tubuh. 101 Latihan. 1. Yang manakah masing-masing dari pasangan berikut memiliki titik didih yang lebih rendah? a. Asam Heksanoat atau 3-heksanon. b. 3-Heksanon atau 3-heksanol. c. 3-Heksanol atau heksana. d. Dipropil eter atau heksanal. e. Heksanal atau asam heksanoat. 2. Gugus fungsi sebagian besar bertanggung jawab terhadap sifat fisik dan sifat kimia dari berbagai senyawa kimia. Mengapa Anda memprediksi bahwa asam karboksilat yang lebih polar dan memiliki titik didih lebih tinggi dari alkohol dengan berat molekul yang sebanding? b. Tatanama Dalam sistem nomenklatur I.U.P.A.C. penamaaan asam karboksilat mengikuti aturan berikut: • Tentukan senyawa induk, rantai karbon yang berkelanjutan terpanjang yang mengikat gugus karboksil. • Ganti akhir -a dari nama senyawa induk alkana dengan akhiran asam -oat. Jika terdapat dua gugus karboksil, menggunakan akhiran asam –dioat. • Berikan nomor rantai, atom karbon karboksil adalah karbon nomor 1. • Namai dan nomori substituen dengan cara yang biasa. Contoh penamaan asam karboksilat: 102 Gambar 6.5. Penamaan Asam Karboksilat Latihan: Senyawa induk : pentana (menjadi asam pentanoat) Posisi gugus—COOH : harus atom karbon nomor 1. Nama substituent : 2-bromo and 4-metil Nama senyawa : Asam-2-Bromo-4-metilpentanoat Senyawa induk : oktana (menjadi asam oktanoat). 103 Posisi gugus—COOH: harus atom karbon nomor 1. Nama substituent : 3,5,7-bromo Nama senyawa : Asam-3,5,7-Tribromo-oktanoat. Turunan asam karboksilat dari sikloalkana diberi nama dengan menambahkan akhiran asam karboksilat pada nama sikloalkana. Gugus karboksil selalu pada atom karbon 1 dan substituen lain diberi nama dan nomor seperti biasa. Gambar 6.6. Asam sikloheksanakarboksilat. Latihan: 1. Tentukan nama I.U.P.A.C. untuk masing-masing struktur berikut 104 2. Tuliskan struktur untuk masing-masing asam karboksilat berikut. a. asam-2,3-Dihidroksibutanoat. b. asam-2-Bromo-3-kloro-4-metilheksanoat. c. asam-1,4-Sikloheksanedikarboksilat. d. asam-4-Hidroksikloheksanakarboksilat. Selain nama IUPAC, nama umum sering juga dipergunakan. Seringkali namanama ini telah berevolusi dari sumber senyawa tertentu. Tabel 15.1 menunjukkan nama I.U.P.A.C. dan nama umum dari beberapa asam karboksilat, serta sumber-sumber terdapatnya dan kata-kata Latin atau Yunani yang memunculkan nama-nama umum. Tidak hanya awalan yang berbeda dari nama pada sistem IUPAC, akhirannya juga berbeda. 105 Tabel 6.1. Nama IUPAC dan Nama Umum dari Asam Karboksilat dan Turunannya Perhatikan, huruf Yunani digunakan untuk menunjukkan posisi substituen. Atom karbon terikat pada gugus karboksil adalah α-karbon, berikutnya adalah β-karbon, dan seterusnya. Beberapa contoh nama umum adalah Gambar 6.7. Contoh, Cara Penamaan Senyawa Asam Karboksilat 106 Senyawa induk: Asam kaproat Asam valerat Substituen: Bromo Kloro Nama senyawa: Asam β-Bromokaproat Asam-γ-klorokaproat Asam benzoat adalah asam karboksilat aromatik yang paling sederhana. Gambar 6.8. Asam Benzoat Dalam banyak kasus asam karboksilat aromatik diberi nama, dalam sistem baik, karena turunan asam benzoat. Umumnya, akhiran asam -uat atau asam -at melekat pada awalan yang tepat. Namun, "nama umum" asam benzoat tersubstitusi (misalnya, asam toluat dan asam ftalat) sering digunakan. Gambar 6.9. Beberapa Contoh Asam Karboksilat Tersubstitusi Gugus fenil seringkali dijadikan sebagai substituen, dan nama induk berasal dari rantai asam alkanoat. Contoh: 107 Asam-2-feniletanoat. (Asam-α-Fenilasetat) Asam-3-fenilpropanoat. Asam-β-Fenilpropanoat) Gambar 6.10. Cara Penamaan Asama Karboksilat Aromatik Latihan: Berinama senyawa senyawa aromatik berikut: a. b. 108 jawaban: a. Senyawa ini merupakan turuanan yang sederhana dari asam benzoat. Substituen, Cl, melekat pada karbon-4 dari cincin benzena. Nama senyawa ini adalah asam 4klorobenzoat atau asam p-klorobenzoat. b. Pada senyawa ini, fenil merupakan substituen. Gugus fenil terikat pada atom karbon4 (atau γ-karbon, dalam sistem nomenklatur umum). Senyawa induk asam pentanoat (asam valerat dalam sistem penamaan umum). Oleh karena itu nama senyawa ini adalah asam 4-fenilpentanoat atau asam γ-fenilvalerat. c. Beberapa Asam Karboksilat yang Penting: Tabel 15.1 menunjukkan, banyak asam karboksilat terbentuk di alam. Asam lemak dapat diisolasi dari berbagai sumber: minyak sawit, minyak kelapa, mentega, susu, lemak babi, dan lemak sapi. Asam karboksilat yang lebih kompleks juga dapat ditemukan dalam berbagai bahan makanan. Asam sitrat ditemukan dalam buah jeruk dan sering digunakan untuk memberikan rasa tajam pada permen asam, dan juga ditambahkan ke makanan sebagai pengawet dan antioksidan. Asam adipat (asam heksadienoat) memberikan rasa getir pada minuman ringan dan membantu untuk memperlambat kerja mikroba. Bakteri dalam susu menghasilkan asam laktat sebagai produk fermentasi gula. Asam laktat kontribusi rasa tajam untuk yogurt dan mentega susu. Asam laktat juga digunakan sebagai pengawet makanan untuk menurunkan pH ke tingkat yang dapat menghambat pertumbuhan mikroba yang menyebabkan pembusukan makanan. Asam laktat juga diproduksi dalam sel otot ketika seseorang berolahraga keras. Jika tingkat asam laktat di otot dan aliran darah menjadi cukup tinggi, otot tidak bisa terus bekerja dan tubuhpun terasa pegal. 109 Gambar 6.11. Asam Mono-oat, Di-oat Dan Poli-oat 6.2.2. Ester a. Struktur dan Sifat Fisik Ester memiliki sifat agak polar dan aroma yang menyenangkan. Banyak ester ditemukan dalam bahan makanan alami. Beberapa contohnya: minyak pisang (3metilbutil etanoat, nama umum: isoamil asetat), nenas (etil butanoat, nama umum, etil butirat), dan rasberry (isobutil metanoat, nama umum, isobutil format). Ester sederhana latut dalam air. Ester mendidih kira-kira pada suhu yang sama dengan aldehida atau keton yang memiliki berat molekul sebanding. b. Tatanama Ester adalah turunan asam karboksilat, merupakan senyawa organik yang berasal dari asam karboksilat. Ester terbentuk dari reaksi asam karboksilat dengan alkohol. Kedua senyawa pembentuknya ini tercermin dalam nama ester yang dihasilkan. Aturan penamaan ester adalah sebagai berikut: • Gunakan nama alkil atau aril dari nama alkohol pembentuknya sebagai nama pertama. • Akhirat asam -at dari nama asam karboksilat diganti dengan akhiran -oat dan mengikuti nama pertama. Sebagai contoh, asam etanoat bereaksi dengan metanol untuk menghasilkan metil etanoat: 110 Gambar 6.12. Reaksi Esterifikasi Demikian pula, asam asetat dan etanol bereaksi untuk menghasilkan etil asetat, dan produk dari reaksi antara asam benzoat dan isopropil alkohol adalah isopropil benzoat. Latihan menulis nama I.U.P.A.C. dan nama umum dari ester. Nama senyawa karboksilat pembentuknya Nama IUPAC Nama umum Asam butanoat Asam butirat Menggantikan akhiran -at dari asam dengan Butanoat akhiran -oat Nama gugus alkil dari alkohol Etil pembentuknya Butirat Nama senyawa ester Etil butirat Etil etanoat Nama IUPAC Nama senyawa karboksilat pembentuknya Asam etanoat etil Nama umum Asam asetat Menggantikan akhiran -at dari asam dengan etanoat akhiran -oat Nama gugus alkil dari alkohol pembentuknya propil asetat Nama senyawa ester Propil asetat Propil etanoat propil 111 Penamaan ester analog dengan penamaan garam asam karboksilat. Perhatikan perbandingan berikut: Gambar 6.13. Penamaan Ester 6.2.3. Kimia Rasa dan Aroma Senyawa asam karboksilat sering berbau busuk. Misalnya, asam butirat merupakan salah satu senyawa berbau dengan aroma yang tidak bisa dibayangkan. Gambar 6.14 Struktur Asam Butirat Bau asam butirat dapat dijumpai dalam mentega tengik. Asam butirat dapat dihasilkan dari reaksi fermentasi yang dilakukan oleh Clostridium perfringens. Organisme ini merupakan penyebab paling aroma gas gangren yang berbau busuk. Dengan membentuk ester asam butirat, senyawa yang dapat menghasilkan senyawa dengan bau yang menyenangkan. Misalnya, metil butirat digunakan dalam perasa buah nenas buatan. 112 Gambar 6.15. Struktur Metil Butirat Dan Etil Butirat Ester-ester volatil memiliki aroma dan rasa yang enak. Rasa buah alami adalah campuran ester yang kompleks dan senyawa organik lainnya. 113 Gambar 6.16 Struktur Kimia Beberapa Essens Buah-buahan 6.2.4. Asam Klorida dan Asam Anhidrida Asam klorida merupakan turunan asam karboksilat dengan rumus umum Gambar 6.17. Rumus Kimia Senyawa Turunan Asam Karboksilat 114 Penamaannya, dengan mengganti akhir -at asam dari nama umum dengan -il klorida atau akhir asam -oat dari nama IUPAC asam karboksilat dengan -oil klorida. Sebagai contoh, Gambar 6.18. Penamaan Senyawa oil-Klorida Asam klorida merupakan bahan kimia yang beracun yang harus ditangani secara hati-hati. Memiliki sifat sedikit polar dan mendidih kira-kira pada suhu yang sama seperti aldehida atau keton dengan berat molekul yang sebanding. Senyawa ini banyak dipergunakan dalam sintesis ester dan amida, dua dari turunan asam karboksilat lainnya. Anhidrida asam adalah molekul dengan rumus umum sebagai berikut: Gambar 6.19. Rumus Umum Anhidrida Asam Struktur di atas mengungkapkan bahwa anhidrida asam sebenarnya dua molekul asam karboksilat yang telah kehilangan molekul air. Kata anhydride berarti "tanpa air." 115 Gambar 6.20 Pembentukan An-Hidrida Anhidrida asam merupakan molekul yang simetris jika kedua kelompok asilnya sama. Senyawa ini diberi nama dengan mengganti kata asam dari asam karboksilat dengan kata anhidrida. Sebagai contoh, Gambar 6.21. Contoh Anhidrida Rantai Lurus Dan Aromatik Bila dua gugus asil tidak simetris, nama senyawa asam anhidrida dimulai dengan nama kedua asam karboksilat induk ditambah dengan kata anhidrida. Nama-nama asam karboksilat diatur berdasarkan ukuran atau abjad. Sebagai contoh: Gambar 6.22. Penamaan Anhidrida Reaksi Sintesis anhidrida etanoat dari asam etanoat adalah sebagai berikut: 116 Gambar 6.23. Reaksi Pembentukan Asetat Anhidrida dari Asam Etanoat Reaksi hidrolisis asam anhidrida dapat berlangsung lebih cepat dengan menggunakan katalis asam atau basa. Gambar 6.24. Reaksi Pembentukan Asam Propionat dari Propionat anhidrida Asam anhidrida juga dapat bereaksi dengan alkohol. Reaksi ini menghasilkan ester dan asam karboksilat. Ini adalah contoh dari reaksi transfer gugus asil, seperti yang ditunjukkan pada reaksi umum berikut: Gambar 6.25. Reaksi Transfer Gugus Asil 6.2.5. Senyawa Alam berenergi Tinggi a. Posfoester dan Tioester Alkohol dapat bereaksi dengan asam fosfat untuk menghasilkan ester fosfat, atau phosphoester, seperti dalam reaksi berikut: 117 Gambar 6.26. Reaksi Pembentuka Ester Posfat Ester fosfat dari gula sederhana atau monosakarida sangat penting dalam jalur biokimia sebagai sumber energi untuk semua fungsi kehidupan. Salah satu jalur tersebut adalah glikolisis. Jalur ini merupakan tahap pertama dalam pemecahan gula. Reaksi pertama di jalur ini adalah pembentukan ester glukosa fosfat. Fosforilasi glukosa menghasilkan glukosa-6-fosfat dapat dilihat dalam persamaan berikut: Gambar 6.27. Fosforilasi Glukosa Reaksi ini dapat berlangsung karena adanya sumber energi dari adenosin trifosfat (ATP), yang merupakan sumber energi universal untuk semua organisme hidup. ATP terdiri dari basa nitrogen (adenin) dan ester fosfat dari gula ribosa. (Gambar 15.5). Kelompok trifosfat tempat melekatnya ribosa terdiri dari tiga kelompok fosfat yang terikat satu sama lain dengan ikatan anhidrida posfatoik. Ketika dua kelompok fosfat 118 bereaksi dengan satu sama lain, dengan melepaskan sebuah molekul. Karena molekul airnya hilang, ikatan yang dihasilkan disebut anhidrida posfatoik. Gambar 6.28. Reaksi Pembentukan An-Hidrida Posfat Beberapa senyawa turunan asam karboksilat penting dalam kehidupan sehari-hari, dapat dilihat pada uraian berikut. b. Turunan Asam Karboksilat Khusus Aspirin (asam asetilsalisilat) adalah obat yang paling banyak digunakan di dunia. Ratusan juta dolar dihabiskan setiap tahun untuk senyawa ini. Aspirin digunakan sebagai pereda nyeri (analgesik) dan mengurangi demam (antipiretik). Obat ini menghambat respon inflamasi dengan menghambat enzim siklooksigenase, enzim pertama dalam jalur sintesis prostaglandin. Prostaglandin bertanggung jawab terhadap rasa sakit dan demam. Aspirin dan obat anti nyeri lainnya lainnya mengurangi rasa sakit dan demam dengan mengurangi sintesis prostaglandin. aspirin menimbulkan masalah bagi beberapa individu, karena aspirin menghambat pembekuan darah, penggunaannya tidak dianjurkan selama kehamilan. Sebagai penggantinya asetaminofen, tilenol, sering diresepkan. Dikenal juga analgesik baru yang lebih ringan bagi perut, yaitu ibuprofen (nama lainnya “Motrin” dijual sebagai, Advil, Nuprin) dan naproxen (nama lainnya “Naprosyn” dijual sebagai, Naprelan, Anaprox, dan Aleve). 119 Gambar 6.29. Beberapa Senyawa Bahan Obat c. Pheromones Feromon, merupakan zat kimia yang dihasilkan oleh kelenjar endokrin hewan, aromanya keluar menyebar ke luar tubuh yang menjadi ciri khas penanda untuk sesama jenis hewan. Senyawa ini menjadi sarana komunikasi hewan untuk menarik lawan jenisnya, sebagai alat pertahanan, teritorial atau sinyal alam. Feromon Istilah secara harfiah berarti "membawa" dan "untuk merangsang" (Yunani, pherein, untuk membawa, Yunani, Hormon, untuk menggairahkan). 120 Di antara semua feromon, feromon serangga telah paling intens dipelajari. Banyak feromon serangga adalah asam karboksilat atau turunan asam. Contoh kelompok bahan kimia feromon dari beberapa serangga dapat dilihat pada gambar berikut: Tetrasesenil asetat (tetracecenyl acetat), Feromon sex serangga penggerek jagung Eropa Asam-9-keto-2-trans-dekanoat. Feromon bersosialisasi ratu lebah/feromon bangsawan lebah (feromon-queen bee socializing/royalty pheromone) cis-7-Dodesil asetat Feromon seks serangga kubis (cabbage looper sex pheromone) Gambar 6.30. Beberapa Senyawa Hormon Sex 6.3. Latihan Soal 1. Manakah dari pasangan senyawa berikut yang memiliki titik ddidih terendah? a. Asam heksanoat atau 3-heksanon b. 3-Heksanon atau 3-heksanol c. 3-Heksanol atau heksana d. Dipropil eter atau heksanal 121 e. Heksanal atau asam heksanoat 2. Tulislah Rumus struktur dari senyawa asam akrboksilat berikut; a. Asam-2,3-dihidroksibutanoat. b. Asam-2-bromo-3-kloro-4metilheksanoat. c. Asam-1,4-sikloheksadikarboksilat. d. Asam-hidroksi-sikloheksanakarboksilat. 3. Gambarkan rumus struktur dari senyawa berikut: a. Asam-o-toluat. b. Asam-2,4,6-tribromobenzoat. c. Asam-2,2,2-phenisl-sikloheksanakarboksilat. 4. Manakah dari pasangan senyawa berikut yang memiliki titik didih tertinggi? a. Asam heptanoat atau 1-heptanol. b. Propanal atau 1-propanol. c. Metil penatnoat atau asam pentanoat. d. 1-Butanol atau asam butanoat. 5. Tulislah rumus terkondensasi dari senyawa berikut: a. Anhidrida dekanoat. b. Anhidrida asetat. c. Valerat anhidrat. d. Benzoil klorida. 6. Tulislah rumus terkondensasi dari: a. Propanoil klorida. b. Heptanoil klorida. c. Pentanoil klorida. 7. Deskripsikan sifat fisika dari asam klorida. 8. Deskripsikan sifat fisika dari asam anhidrida. 9. Identifikasi gugus fungsi yang terdapat pada senyawa berikut. Apakah efek negative dari senyawa berikut terhadap makhluk hidup dan lingkungan. 122 a. (dioksan atau dikenal juga sebagai dioksin). b. morphin. c. d. asam sitrat. Koniin (Senyawa beracun yang diminum Sokrates) 10. Tuliskan minimal 5 senyawa organik dari asam karboksilat dan turunannya yang berpotensi sebagai bahan pencemar pada lingkungan. 6.4. Perspektif Nilai Karakter Kesadaran Lingkungan dari Senyawa Asam Karboksilat dan Turunannya Anda sudah banyak mengetahui manfaat dari dampak negatif dari penggunaan bahan kimia organik bagi kesehatan dan lingkungan. Tapi belum lengkap kalau yang ini belum Anda ketahui, yaitu tentang adanya kandungan timbal asetat dalam minyak rambut 123 yang biasa dipakai untuk menghitamkan rambut, bahan berbahaya pada kosmetika dan bahan kimia lainnya dalam rumah tangga. Lebih baik Ada baca link berikut: • http://www.erfolgkimia.com/2013/06/timbal-asetat-dalam-pewarna-rambut.html • http://www.anehdidunia.com/2014/08/produk-kecantikan-kosmetikberbahaya.html • http://alfiafauzaazhari.blogspot.co.id/2012/11/bahaya-bahan-kimia-dalamkebutuhan.html Bagaimana sikap dan perilaku Anda setelah mengetahui ini semua. Pilihan ada pada Anda. Ayo memilih untuk hidup yang lebih baik. 6.5. Referensi Denniston, K.J., dan Joseph J. T., 2003, Organic and Biochemistry, 4-th Edition, New York, The McGrawn-Hill Companies. McMurry, J., 2012, Organic Chemistry, 8-th Edition, Canada: Brooks/Cole Cengage Learning. diakses di www.cengage.com/global pada tanggal 21 desember 2013 Silberberg, M.S., 2010, Principles of General Chemistry, second edition, New York, The McGrawn-Hill Education. Whitten, K. W.,Raymond, E.D., M.Larry P., George, G. S., 2010, Chemistry, Ninth Edition, Canada, Brooks/Cole, Cengage Learning. diakses di www.cengage.com/global pada tanggal 10 Juli 2014 124 BAB VII AMINA DAN AMIDA 7.1. Tujuan Perkuliahan Dalam kegiatan perkuliahan ini Anda akan mempelajari gambaran umum tentang amina dan amida, yang meliputi rumus umum, tata nama, sifat fisika, perbedaan antara amina dan amida, sumber terdapatnya, manfaat, kegunaan, dan dampak penggunaannya terhadap kesehatan manusia dan kelestarian lingkungan agar Anda memiliki sikap yang penuh pertimbangan mataual dalam memanfaatkan senyawa amina dan amida dalam kehidupan sehari-hari, memiliki kesadaran lingkungan yang baik sebagai individu dan sebagai warga masyarakat sehingga mampu menjadi panutan bagi atauang lain dalam memanfaatkan senyawa amina dan amida. Melalui pembelajaran ini, Anda diharapkan dapat: 1. Menjelaskan definisi senyawa amina dan amida. 2. Menjelaskan perbedaan senyawa amina dan amida. 3. Mendeskripsikan sifat fisika dari amina dan amida. 4. Memberi nama senyawa amina dan amida sesuai aturan IUPAC, CA dan nama umum. 5. Menjelaskan dampak dan efek negatif dari penggunaan senyawa amina dan amida terhadap kesehatan makhluk hidup dan lingkungan. 6. Memiliki sikap dan perilaku yang pro lingkungan dalam mengaplikasikan senyawa amina dan amida dalam kehidupan sehari-hari. 7. Membuat daftar senyawa amina dan amida dari bahan alam dan sintetis yang memiliki efek terhadap kesehatan, dan lingkungan serta menjelaskan pentingnya senyawa tersebut. 125 8. Menunjukkan perilaku sehari-hari yang sesuai dengan pengetahuan yang telah dimiliki dalam bentuk laporan jurnal. 9. Memberikan pertimbangan moral pro lingkungan yang bijaksana terhadap fenomena yang terjadi dalam kehidupan sehari-hari 7.2. Uraian Materi Salah satu kelompok senyawa organik yang mengandung nitrogen adalah amina. Senyawa amina ditandai oleh adanya gugus amino (-NH2). Atom nitrogen dari gugus amino mungkin memiliki satu atau lebih atom hidrogen yang dapat digantikan oleh gugus organik. Struktur umum dari amina yang dibentuk ditunjukkan di bawah ini: Senyawa amina sangat umum terdapat dalam sistem biologis dan menunjukkan aktivitas fisiologis yang penting, salah satunya adalah histamin, histamin berkontribusi terhadap inflamasi membran, hidung tersumbat dan sekresi lendir dalam hidung yang berlebihan. Senyawa yang dapat membantu meringankan gejala tersebut adalah antihistamin. Efedrin adalah salah satu senyawa kelompok antihistamin yang telah diekstrak dari daun tanaman ma-huang di Cina selama lebih dari dua ribu tahun. Senyawa amin ini berfungsi sebagai decongestan. Decongestan ini membantu untuk menciutkan selaput lendir yang membengkak dan mengurangi sekresi lendir dalam hidung. Struktur histamin dan efedrin yang ditunjukkan di bawah ini. 126 Histamin Efedrin Selanjutnya, senyawa lain yang juga mengandung nitrogen yang akan dibahas adalah senyawa amida. Amida adalah produk dari reaksi antara amina dan turunan asam karboksilat. Struktur umum sebagai berikut: Gambar 7.1. Rumus Struktur Umum dari Amida Asam amino yang merupakan subunit yang ditandai dengan adanya gugus amino dan gugus karboksil. Asam amino berikatan satu sama lainnya melalui ikatan peptida membentuk rantai protein. Ikatan peptida terjadi antara gugus amino dari satu asam amino bereaksi dengan gugus karboksil dari asam amino lain. 7.2.1. Amina a. Struktur dan Sifat Fisika Amina. Amina adalah senyawa organik penting di alam yang merupakan turunan dari amonia. 127 Struktur molekul amina berbentuk piramida, dimana atom nitrogen dapat mengikat tiga gugus atau atom dan memiliki sepasang elektron bebas. Amina diklasifikasikan sesuai dengan jumlah gugus alkil atau aril yang terikat pada nitrogen. Pada amina primer, salah satu hidrogen digantikan oleh sebuah gugus organik, amina sekunder, dua hidrogen diganti dan pada amin tersier tiga gugus organik menggantikan hidrogen: Gambar 7.2. Amina dan Turunannya Contoh: Dengan membandingkan struktur amina dan ammonia, manakah dari senyawa berikut yang merupakan amina primer, sekunder, atau tersier. 128 Jawaban: , amina primer. satu atom H diganti dengan Alkil. , amin sekunder, dua atom H diganti dengan Alkil. , amin tersier, tiga atom H diganti dengan Alkil. Latihan: 1. Tentukan apakah senyawa amina berikut ini termasuk amin primer, sekunder, atau tersier. Atom nitrogen lebih elektronegatif dibandingkan atom hidrogen dalam amina. Akibatnya, ikatan N-H adalah polar, sehingga memungkinkan terbentuknya ikatan hidrogen antara molekul amina atau antara molekul amina dan air (Gambar 16.2). 129 Gambar 7.3. Ikatan Hidrogen pada Amina Ikatan hidrogen (a) dalam metilamin dan (b) antara metilamina dan air. Garis putus-putus mewakili ikatan hidrogen. Latihan: 1. Merujuk pada Gambar 16.2 dan ilustrasikanlah ikatan hidrogen yang mungkin terjadi antara dua molekul amina primer dan air. Kemampuan amina primer dan sekunder untuk membentuk ikatan hidrogen tercermin dari titik didihnya (Tabel 16.1). Amina primer memiliki titik didih yang lebih tinggi dibandingkan alkana dengan berat molekul yang sama tetapi jauh lebih rendah dibandingkan dengan alkohol yang sebanding. Perhatikan contoh berikut: Amina tersier tidak memiliki ikatan N-H, oleh karena itu tidak dapat membentuk ikatan hidrogen antar molekul dengan amina tersier lainnya. Akibatnya, titik didihnya lebih rendah dibandingkan amina primer atau sekunder dengan berat molekul yang sebanding. Ini terlihat dalam perbandingan titik didih propanamin (propilamine: Mr 59 ) 130 dan N, N-dimethylmethanamine (trimetilamina: Mr 59). Trimetilamina, amina tersier, memiliki titik didih 2.9oC, sedangkan propilamina, amina primer, memiliki titik didih 48.7 oC. Ini terjadi karena molekul trimetilamina tidak dapat membentuk ikatan hidrogen antarmolekul. 131 Ikatan hidrogen antarmolekul yang dibentuk oleh amina primer dan sekunder tidak sekuat ikatan hidrogen dibentuk oleh alkohol karena nitrogen tidak seelektronegatif oksigen. Untuk alasan ini amina primer dan sekunder memiliki titik didih lebih rendah dari alkohol (Tabel 16.2). Semua amina dapat membentuk ikatan hidrogen antarmolekul air (O-H dan N). Akibatnya, amina dengan jumlah atom C kecil (enam atau lebih sedikit karbon) larut dalam air. Seperti yang terjadi pada senyawa organik lainnya, kelarutan dalam air berkurang seiring dengan makin bertambahnya jumlah atom C dari rantai hidrokarbon (hidrofobik). Latihan: 1. Manakah dari masing-masing pasangan senyawa berikut yang memiliki titik didih yang lebih tinggi? Jawaban: Molekul di sebelah kanan, heksanamin, memiliki titik didih lebih tinggi dari molekul di sebelah kiri, N, N-dimetilmetanamin (trietilamina). Trietilamina adalah amina tersier. Oleh karena itu, ia tidak memiliki ikatan N-H dan tidak dapat membentuk ikatan hidrogen antarmolekul dengan molekul trietilamina lainnya. Tugas: 1) Manakah dari pasangan senyawa berikut yang memiliki titik didih yang lebih tinggi? Jelaskan alasan Anda. a) Metanol atau metilamin. b) Dimetilamin atau air. c) Metilamin atau etilamin. d) Propilamin atau butana. 132 2) Bandingkan titik didih metilamin, dimetilamina, dan trimetilamina. Jelaskan mengapa titik didihnya berbeda. b. Tatanama. Beberapa sistem penamaan amina telah berevolusi, selain IUPAC untuk penamaan amina juga mempergunakan nama menurut Chemical Abstracts atau CA sistem. Sistem ini telah disetujui untuk digunakan oleh IUPAC dan akan disajikan di sini karena logis dan mudah digunakan. Dalam sistem CA akhiran -a dari nama senyawa induk dihilangkan, dan ditambah akhiran –amin. Misalnya, Untuk amina sekunder atau tersier awalan N-alkil ditambahkan ke nama senyawa induk. Sebagai contoh, N-Metiletanamina N,N-Dimetilmetamin. Dalam sistem tata nama IUPAC, rantai induk adalah rantai karbon berkelanjutan terpanjang yang mengikat gugus amino. Nama alkana induk digunakan sebagai akhiran dan didahului oleh kata amino dan angka yang menunjuk posisi gugus amino pada rantai. Perhatikan contoh berikut: Aminoetana 1-Aminopropana 2-Aminopropana 133 Dalam sistem penamaan CA, keberadaan substituen pada -N- ditunjuk oleh awalan N. N-Metil-1-aminopropana N,N-Dimetil-1-aminopropana Beberapa amina aromatik memiliki nama khusus yang juga telah disetujui untuk digunakan dalam sistem tatanama IUPAC, misalnya, amina benzena diberi nama anilin. Dalam sistem CA, anilin bernama benzenamine. Anilin atau m-Toluidin atau benzanamin. meta-toluidin o-Toluidin atau orto-toluidin p-Toluidine atau para-toluidin Jika terdapat gugus tambahan yang melekat pada nitrogen dari amina aromatik, ini ditandai dengan huruf N yang selanjutnya diikuti dengan nama gugus. Latihan: 3) Namakanlah senyawa amina berikut dengan menggunakan sistem CA. Jawaban: Senyawa induk dari senyawa tersebut adalah propana, nama senyawa adalah propanamin, selanjutnya terdapat gugus tambahan yang melekat pada N adalah metil, nama senyawa menjadi N-metil. Nama lengkap senyawa adalah N-Metilpropanamin. Nama-nama umum yang sering digunakan untuk amina sederhana. Nama umum dari kelompok alkil terikat pada amina nitrogen diikuti oleh akhiran -amin. Setiap gugus 134 diurut menurut abjad dalam satu kata terus menerus diikuti oleh akhiran –amin. Perhatikan contoh. Metiamina Dimetilamina Trimetilamina Tabel 16.3 Perbandingan Nama Amin Sederhana Menurut Beberapa Sistem Penamaan. Senyawa c. Nama Menurut CA Nama Umum Nama IUPAC Senyawa Amin yang Penting pada Bidang Medis Meskipun amina memiliki peran yang berbeda dalam kehidupan sehari-hari, namun salah satu peran terpenting adalah dalam bidang kedokteran. Sejumlah obat yang berperan meningkatkan kualitas hidup berasal dari senyawa amina, sedangkan yang lainnya merupakan senyawa yang sangat adiktif, seperti kokain dan heroin. Amfetamin, seperti Benzedrin dan Methedrin, berperan merangsang sistem saraf pusat, meningkatkan tekanan darah dan denyut nadi dan sering digunakan untuk mengurangi kelelahan. Secara medis, senyawa ini telah digunakan untuk mengobati depresi dan epilepsi. Amfetamin juga dapat diterapkan sebagai pil diet karena 135 mengurangi nafsu makan. Penggunaannya dikendalikan oleh hukum federal karena penggunaan kelebihan amfetamin dapat menyebabkan paranoia dan penyakit mental. Banyak obat analgesik (penghilang rasa sakit) atau anestesi (pemati rasa nyeri) dari senyawa amina. Novocaine dan senyawa sejenis dengannya, digunakan sebagai anestesi lokal. Demerol adalah pereda nyeri yang sangat kuat. Efedrin dan neosnephrin digunakan sebagai dekongestan dalam obat batuk dan untuk semprotan hidung. Senyawa ini menyebabkan menyusutnya membran yang melapisi saluran hidung. Efek senyawa ini terkait dengan L-dopa dan dopamin dalam system saraf pusat. 136 Senyawa amin lainnya adalah obat sulfa, bahan kimia yang pertama kali digunakan untuk melawan infeksi bakteri. Latihan: 1) Dengan menggunakan struktur anilin sebagai struktur dasar, tulislah rumus struktur dari senyawa berikut: a) N-Metilanilin. b) N,N-Dimetilanilin. c) N-Etilanilin. d) N-Isopropilanilin. 2) Beri nama senyawa amin berikut menurut sistem penamaan CA dan sistem penamaan umum. 137 3) Gambarkan rumus struktur lengkap untuk masing-masing senyawa berikut: a) 2-Propanamin. b) 2-Metil-2-pentanamin. c) 3-Oktanamin. d) 4-Kloro-5-iodo-1-nonanamin. e) N-Etil-2-heptanamin. f) N,N-Dietil-1-pentanamin. 4) Gambarkan rumus struktur terkondensasi untuk masing-masing senyawa berikut: a) Dietilmetilamin. b) Triisopropilamin. c) 4-Metilpentilamin. d) Metil-t-butilamin. e) N-Metilanilin. f) Etilheksilamin. Banyak senyawa amina dan turunannya dikaitkan dengan kanker pada hewan dan dalam beberapa kasus kangker pada manusia. Sedikit yang diketahui tentang modus dari banyak senyawa amin. Banyak penelitian sedang dilakukan untuk menentukan bagaimana peran senyawa amina dalam perkembangan kanker. Tampaknya senyawa 138 karsinogen merusak DNA, menyebabkan mutasi pada gen yang mengontrol pembelahan sel. Sel yang mengalami mutasi ini membentuk sel-sel baru (sel kangker) diluar yang semestinya. Senyawa ini merusak DNA melalui reaksi alkilasi (menambahkan gugus alkil untuk) rantai DNA. Telah diketahui bahwa amina sekunder dapat bereaksi dengan zat-zat seperti asam nitrit (HNO2) untuk membentuk nitrosamin. Nitrosamin, pada gilirannya, dapat bereaksi lebih lanjut menghasilkan senyawa diazo. Senyawa diazo ini bertindak sebagai agen alkilasi untuk membentuk DNA teralkilasi. Reaksi adalah sebagai berikut: Banyak obat-obatan dan makanan yang kita konsumsi mengandung amina sekunder. Selain itu, ion nitrit banyak digunakan sebagai pengawet untuk daging, ham, sosis, dan produk daging lainnya. Nitrit menjadikan dagung berwarna warna merah muda yang disukai dan menjaga kestabilan warna merah. Senyawa ini juga dapat menghambat pertumbuhan beberapa bakteri berbahaya. Ada kemungkinan bahwa nitrit dalam makanan bisa bereaksi dengan cairan asam dalam air liur dan lambung untuk membentuk asam nitrit. Yang pada akhirnya akan membentuk alkilasi pada DNA. Untungnya, konsentrasi nitrit dalam makanan alami sangat rendah. Namun, penelitian terus dilakukan untuk menentukan apakah nitrit dan amina sekunder dalam makanan yang kita makan berperan untuk memicu kanker usus besar. 139 7.2.2. Amina Heterosiklik Amina heterosiklik adalah senyawa siklik yang memiliki minimal satu atom nitrogen dalam struktur cincin. Beberapa struktur dan nama-nama umum dari beberapa amina heterosiklik penting di alam dapat dilihat pada gambar berikut. Gambar 7.4. Struktur dan Nama-Nama Umum dari Beberapa Amina Heterosiklik Gambar berikutnya menunjukkan amina heterosiklik dengan cincin menyatu. Perhatikanlah struktur dari purin, indol, dan porfirin, yang ditampilkan sebagai rumus struktur dan diagram garis berikut. 140 M = Logam Cincin pirimidin dan purin ditemukan dalam DNA dan RNA. Struktur cincin porfirin ditemukan dalam hemoglobin (oksigen pembawa protein darah), mioglobin (protein pembawa oksigen ditemukan dalam jaringan otot), dan klorofil (pigmen warna hijau pada tanaman). Indol dan cincin piridin ditemukan pada alkaloid, yaitu senyawa nitrogen alami yang mengandung satu atau lebih cincin heterosiklik. Senyawa yang termasuk alkaloid adalah kokain, nikotin, kina, morfin, heroin, dan LSD (Gambar 16.3). 141 Lysergic acid diethylamide (LSD) adalah senyawa halusinogen yang dapat menyebabkan gangguan mental yang berat. Kokain diproduksi oleh tanaman koka. Dalam dosis kecil senyawa ini digunakan sebagai anestesi untuk sinus dan mata. Obat bius adalah obat yang menyebabkan kurangnya sensasi di setiap bagian dari tubuh (bius lokal) atau menyebabkan ketidaksadaran (anestesi umum). Pada dosis yang lebih tinggi, kokain menyebabkan perasaan euforia yang diikuti dengan depresi berat. Kokain, termasuk kelompok senyawa adiktif. Nikotin adalah salah satu senyawa heterosiklik amina sederhana dan tampaknya menjadi senyawa adiktif pada rokok. Morfin merupakan alkaloid pertama yang diisolasi dari getah opium poppy. Morfin adalah analgesik kuat, obat yang bertindak sebagai pembunuh rasa sakit. Senyawa ini termasuk narkotika yang kuat dan adiktif. Kodein, juga diproduksi oleh opium poppy, adalah analgesik kurang kuat dibandingkan morfin, tetapi merupakan salah satu penekan batuk yang paling efektif. Heroin diproduksi di laboratorium dengan menambahkan dua kelompok asetil dengan morfin. Pada awalnya dibuat dengan harapan menghasilkan senyawa dengan manfaat morfin dengan daya adiktif yang lebih rendah. Namun, ternyata heroin bahkan lebih adiktif daripada morfin. Strikhnin ditemukan dalam biji pohon Asia. Strikhnin sangat beracun dan biasa digunakan sebagai racun tikus. Kina, diisolasi dari kulit pohon cinchona, kina merupakan obat malaria pertama yang diketahui paling efektif. Vitamin B6 adalah salah satu vitamin yang larut dalam air yang dibutuhkan oleh tubuh. Struktur senyawa-senyawa ini dapat dilihat pada gambar 7.5 142 Gambar 7.5. Beberapa Senyawa Alkaloid 7.2.3. Amida Amida adalah produk yang terbentuk dalam reaksi antara turunan asam karboksilat dan amonia atau amina. Struktur umum dari suatu amida dapa dilihat pada gambar… Sisi ini dari asam karboksilat Sisi ini dari amin 143 7.2.4. Etanamida Gugus amida terdiri dari dua bagian: gugus karbonil dari asam karboksilat dan gugus amino dari amonia atau amina. Ikatan antara karbon karbonil dan nitrogen dari amina atau amonia disebut ikatan amida. Gambar 7.6. Ikatan Hidrogen pada Amida. a. Struktur dan Sifat Fisika Kebanyakan amida berbentuk padat pada suhu kamar, memiliki titik didih yang sangat tinggi, dan molekul yang sederhana larut cukup baik dalam air. Titik didih dan kelarutan ini disebabkan oleh ikatan hidrogen antarmolekul yang kuat antara ikatan N-H dari amida pertama dan gugus karbonil dari amida kedua, seperti yang ditunjukkan pada Gambar 16.4. Tidak seperti amina, amida bukan basa (proton akseptor). Alasannya adalah bahwa atom oksigen yang sangat elektronegatif dari gugus karbonil menyebabkan daya tarik yang sangat kuat antara pasangan elektron nitrogen dan gugus karbonil. Sebagai hasilnya, pasangan elektron sunyi tidak bisa "menahan" proton. Karena daya tarik gugus karbonil untuk elektron Nitrogen yang tidak pasangan, struktur ikatan C-N amida merupakan hibrida resonansi. 144 b. Tatanama. Nama umum dan nama IUPAC dari nama amida berasal dari nama umum dan nama IUPAC dari asam karboksilat. Caranya adalagh dengan menghilangkan akhiran -at dari nama umum atau akhiran –oat dari nama IUPAC asam karboksilat, dan menggantinya dengan akhiran –amida. Beberapa contoh nama umum dan nama IUPAC dapat dilihat pada Tabel 16.4 berikut: Tabel 16.4 Beberapa Nama Umum dan Nama IUPAC dari Amida sederhana Senyawa Nama IUPAC Asam etanoat, menjadi Etanamida atau Asam asetat, menjadi asetamida Nama Umum Asam propanoat, menjadi Propanamida, atau Asam propionat, menjadi Propionamida 145 Substituen pada nitrogen ditempatkan sebagai awalan dan ditandai dengan N diikuti dengan nama substituen tersebut. Tidak ada spasi antara awalan dan nama amida. Lihat contoh N-Metilpropanamida N-Propilheksanamida Barbiturat merupakan senyawa amida yang sering disebut sebagai “penenang”. Senyawa ini digunakan sebagai antikejang untuk epilepsi dan untuk orang yang menderita berbagai gangguan otak dalam bentuk neurosis, kegelisahan, dan ketegangan. Phenacetin dan asetaminofen juga termasuk senyawa amida. Asetaminofen adalah senyawa amida aromatik yang biasa digunakan sebagai pengganti aspirin, terutama untuk orang yang alergi dan tidak tahan terhadap aspirin. Senyawa ini pertama kali disintesis pada tahun 1893 dan merupakan bahan aktif dalam Tylenol dan Datril. Acetaminophen dipergunakan untuk mengurangi rasa sakit dan demam. Namun, ia tidak seperti aspirin, karena asetaminofen bukan obat anti-inflamasi. Fenasetin disintesis pada tahun 1887 dan digunakan sebagai analgesik selama hampir satu abad. Struktur dan sifat fenasetin mirip dengan asetaminofen. Namun, penggunaannya telah dilarang oleh US Food and Drug Administration pada tahun 1983 karena menyebabkan kerusakan ginjal dan kelainan darah. 146 Senyawa aspartam merupakan pemanis buatan atau Nutra sweet komersial yang terkenal. Meskipun sebagai pemanis senyawa aspartam bukan gula. Aspartam adalah metilester dari molekul yang terdiri dari dua asam amino, asam aspartat dan fenilalanin, bergabung melalui ikatan amida (Gambar 16.5a). Aspartam beresiko “Phenylketonurics”. Dalam proses pencernaan dan pemanasan suhu tinggi selama proses pemasakan kedua ikatan ester dan ikatan amida, melepaskan asam amino fenilalanin. Orang dengan kelainan fenilketonuria (PKU) tidak bisa memecah asam amino ini. Sebagai hasilnya, kondisi tersebut meningkatkan menyebabkan keterbelakangan mental pada bayi lahir. ikatan amida senyawa beracun yang dapat 147 Pada bulan Juli 2002, Food and Drug Administration menyetujui pemanis buatan baru yang disebut neotam, senyawa ini memiliki struktur inti yang sama seperti aspartam, tapi dengan penambahan gugus 3,3-dimetilbutil pada asam aspartat (Gambar 16.5b). Neotame dapat digunakan tanpa resiko pada orang-orang dengan PKU dan juga dapat mempertahankan rasa manis selama memasak. c. Hidrolisis Amida Hidrolisis amida memecahkan ikatan amida untuk menghasilkan asam karboksilat dan amonia atau amina. Sangat sulit untuk menghidrolisis ikatan amida. Reaksi ini memerlukan pemanasan amida dan adanya asam atau basa kuat. Jika basa kuat digunakan, hasilnya adalah amina dan garam dari asam karboksilat: 148 7.3. Latihan Soal 1. Prediksilah, manakah pasangan senyawa berikut yang tinggi kelarutan dalam air. Jelaskan alasan Anda. a. Pentana atau 1-butanamin. b. Sikloheksana atau 2-pentanamin. 2. Prediksilah, manakah pasangan senyawa berikut yang titik didihnya lebih tinggi. Jelaskan alasan Anda. a. Etanamin atau etanol. b. Butana atau 1-propanamin. c. Metanamin atau air. d. Etilmetilamin atau butana. 3. Jelaskan mengapa amina tersier seperti trietilamina memiliki titik didih lebih rendah daripada isomernya, amina primer, heksanamin. 4. Gunakan sistem penamaam CA untuk masing-masing amina berikut: 149 5. Gambarkan struktur masing-masing senyawa berikut: a. Dietilamin. b. Butilamin. c. 3-Dekanamin. d. 3-Bromo-2-pentanamin. e. Trifenilamin. 6. Gambarkan struktur masing-masing senyawa berikut: a. N,N-Dipropilanilin. b. Sikloheksanamin. c. 2-Bromosiklopentanamin. d. Tetraetilammonium iodida e. 3-Bromobenzenamin 7. Gambarkan struktur terkondensasi dari masing-masing senyawa berikut: a. 2-Pentanamin. b. 2-Bromo-1-butanamin. c. Etilisopropilamin. d. Siklopentanamin. 8. Gambarlah struktur terkondensasi dari masing-masing senyawa berikut: a. Dipentilamin b. 3,4-Dinitroanilin. c. 4-Metil-3-heptanamin. d. t-Butilpentilamin. 150 e. 3-Metil-3-heksanamin. f. Trimetilammonium iodida 9. Gambarkan semua isomer yang mungkin dari senyawa amina dengan rumus molekul C3H9N. 10. Klasifikasi masing-masing amina berikut, manakah yang amin primer, sekunder, atau tersier: a. Benzenamin. b. N-Etil-2-pentanamin. c. Etilmetilamin. d. Tripropilamin. e. m-Kloroanilin. 11. Jelaskan secara singkat mengapa amina dengan berat molekul rendah (kurang dari lima karbon) menunjukkan kelarutan yang cukup baik dalam air. 12. Sebagian besar obat yang mengandung gugus amina tidak berupa senyawa amina melainkan sebagai garam amonium. Kemukakan alasannya mengapa? 13. Putresin dan cadaverin adalah dua amina yang berbau, senyawa ini dihasilkan oleh daging busuk. Putresin adalah 1,4-Diaminobutane, dan cadaverine adalah 1,5diaminopentane. Gambarkan struktur kedua senyawa ini. 14. Cincin indole dan piridin dapat ditemukan pada alkaloid. Gambarkan setiap cincinnya. 15. Apakah yang dimaksud dengan alkaloid? 16. Buatlah daftar beberapa amina heterosiklik yang digunakan dalam pengobatan. 17. Bedakan antara istilah analgesik dan anestesi. 151 18. Gunakan tata nama IUPAC dan sistem umum nomenklatur untuk nama amida berikut: 19. Gunakan sistem tatanama IUPAC dan sistem tatanama untuk nama masing-masing amida berikut: 20. . Gambarkan rumus struktur terkondensasi dari masing-masing amida berikut: a. Etanamida b. N-Metilpropanamida c. N,N-Diethilbenzamida d. 3-Bromo-4-metilheksanamida e. N,N-Dimetilasetamida 152 21. Bahan aktif dalam banyak penolak serangga adalah N, N-diethylm-toluamide. Gambarkan struktur senyawa ini. Asam karboksilat dan amina apa yang dihasilkan dari hidrolisis senyawa ini? 22. Lidocaine sering digunakan sebagai anestesi lokal. Untuk tujuan pengobatan sering digunakan dalam bentuk garam hidroklorida yang karena garam larut dalam air. Tentukanlah gugus fungsi amida dari struktur lidokain hidroklorida ini. 23. Tentukan nama gugus fungsi yang terdapat pada penisilin antibiotik BT. 24. Tentukan, dimanakah terdapat gugus amida pada struktur sakarin, pemanis buatan berikut 153 Perspektif Nilai 1. Rokok Anda tentu sudah tahu bahwa Nikotin merupakan salah satu senyawa turunan Amina. Senyawa ini dapat Anda isolasi dari daun tembakau, bukalah link berikut untuk mengetahui bagaimana Anda dapat mengisolasi nikotin dari tembakau. http://www.kimia.clas.web.id/2015/10/praktikum-bahan-alam-isolasi-nikotin.html. Apakah Anda merokok? Syukurlah kalau Anda bukan perokok aktif, tapi kita juga tidak pantas menjadi perokok pasif. Bahaya selalu mengintai kita dari bahayanya asap rokok. Bukalah link berikut untuk mengetahui bahaya dari asap rokok: http://www.who.int/tobacco/publications/surveillance/fact_sheet_mortality_report.pdf. Rokok bukan hanya berbahaya bagi kesehatan tetapi juga mencemarkan lingkungan. Anda tahu mengapa? Bacalah link yang disediakan ini: https://theklc.wordpress.com/2014/01/12/pengaruh-rokok-terhadap-kerusakanlingkungan-hidup/. Tentu Anda belum puas dengan informasi yang disediakan dalam bahan ajar ini, silakan cari tahu lebih lanjut. Setelah mengetahui tentang zat kimia yang terkandung dalam rokok, efeknya terhadap kesehatan dan lingkungan, menurut Anda pantaskah Anda yang sudah belajar bahaya nikotin masih juga menjadi perokok? Berubahlah selagi punya kesempatan. Apa yang akan Anda lakukan untuk melindungi diri, keluarga, masyarakat dan lingkungan dari bahaya rokok. Lakukanlah! 2. Psikotropika Presiden Jokowi pernah menyatakan bahwa Indonesia sekarang mengalami masa darurat narkoba. Memang akhir-akhir ini narkoba sudah merambah sampai pelosok desa. Narkoba merupakan senyawa kimia turunan amin, Anda sudah mempelajarinya dalam bahan bacaan ini. Untuk lebih jelasnya tentang dampak narkoba terhadap kesehatan diri, keluarga, dan masyarakat, silakan and abaca link yang disediakan berikut. • https://www.google.co.id/?gws_rd=cr,ssl&ei=HmP8Vv_GMofHuASRnaqICA#q =apa+itu+MDMA+%28Methylene+Dioxy+Meth+Amphetamine%29.pdf 154 • http://www.indotipstricks.net/2015/07/bahaya-dan-kerugian-narkoba.html • http://dedihumas.bnn.go.id/read/section/artikel/2014/03/20/957/dampaklangsung-dan-tidak-langsung-penyalahgunaan-narkoba Anda juga dapat mencarinya lebih banyak lagi dari sumber-sumber lain. Anda tentu sepakat bahwa narkoba menghancurkan masa depan, membawa mala petaka bagi ummat manusia. Apa yang dapat Anda lakukan untuk mencegah maraknya penyalahgunaan narkoba di kalangan pelajar? 3. Pemanis Buatan Makanan dan minuman akan menjadi sedap rasanya bila ada pemanis. Pemanis yang banyak dipergunakan dalam indsutri makanan, minuman dan obat-obatan umumnya adalah pemanis buatan. Pemanis buatan ini termasuk dalam kelompok senyawa turunan amin. Informasi tentang pemanis buatan sudah Anda baca pada bahan ajar ini. Dalam mengkonsumsi bahan pemanis ini, Anda perlu mewaspadai efek negatifnya bagi kesehatan dan bagi lingkungan. Informasi tentang hal itu dapat And abaca pada link berikut: • http://www.republika.co.id/berita/gaya-hidup/info-sehat/15/03/15/nl6utvwaspadai-efek-buruk-pemanis-buatan-bagi-tubuh • http://www.smallcrab.com/kesehatan/300-aspartame-sama-dengan-formalin • http://www.amazine.co/17668/pemanis-buatan-fakta-informasi-perihalacesulfame-kalium/ • http://www.merdeka.com/teknologi/sungai-besar-di-kanada-tercemar-pemanisbuatan.html • http://www.neraca.co.id/article/52555/negeri-ini-dikepung-makanan-danminuman-beracun-oleh-fadil-abidin-pemerhati-masalah-sosial-kemasyarakatan 155 • http://portal.bangkabaratkab.go.id/content/bahan-tambahan-pada-pangan-danbahayanya-formalin-boraks-dan-pewarna-buatan Anda sudah membaca bahan bacaan pada link ini? Anda juga dapat menambah wawasan dengan mendapatkan bacaan dari sumber-sumber lain. Apakah yang Anda pikirkan setelah Anda mengetahui dampak-dampak mengkonsumsi bahan pemanis buatan bagi kesehatan manusia dan lingkungan. Mari kita menjaga kesehatan diri dan mejaga lingkungan dengan mengkomsumsi makanan alami. Apa Anda sepakat? Apa yang akan Anda lakukan selanjutnya? Wujudkan rencana-rencana baik Anda sesegera mungkin! 7.3.1. Referensi Denniston, K.J., dan Joseph J. T., 2003, Organic and Biochemistry, 4-th Edition, New York, The McGrawn-Hill Companies. McMurry, J., 2012, Organic Chemistry, 8-th Edition, Canada: Brooks/Cole Cengage Learning. diakses di www.cengage.com/global pada tanggal 21 desember 2013 Silberberg, M.S., 2010, Principles of General Chemistry, second edition, New York, The Mc-Grawn Hill Education. Whitten, K. W., Raymond, E.D., M. Larry P., George, G. S., 2010, Chemistry, Ninth Edition, Canada, Brooks/Cole, Cengage Learning. Diakses di www.cengage.com/global pada tanggal 10 Juli 2014