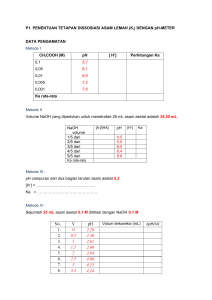
Analisa titrimetri (3) rev
advertisement
ANALISA TITRIMETRI Day, RA dan Underwood, AL., 2002. Analisis Kimia Kuantitatif, Penerbit Erlangga, Jakarta. Dasar Umum: aA+tT Hasil Beberapa istilah: Pereaksi T = Titran larutan standar Titik ekivalen Indikator Titik akhir titrasi Analisis Titrasi Salah satu metode kuantitatif Alat: Buret dan Erlenmeyer Titran: Larutan yang diketahui konsentrasinya (standar), ditempatkan di buret, titran harus bereaksi dengan target analisis. Sampel yang dianalisis ditaruh di dalam Erlenmeyer. Titrasi adalah proses pengukuran volume dari titran yang dibutuhkan untuk mencapai titik ekivalen Analisis Titrasi Cara titrasi: (Contoh Titrasi HCl dengan NaOH) Diisikan titran (HCl) ke dalam buret, posisi skala titran dicatat Sejumlah volume sampel (NaOH) dimasukkan ke dalam Erlenmeyer, ditambah 3-4 tetes indikator (PP) Kran buret dibuka pelan-pelan, titran diteteskan pelan-pelan ke Erlenmeyer. Erlenmeyer digoyang perlahan-lahan Penambahan titran dihentikan saat ada perubahan warna pada sampel (merah) yang tidak hilang dengan digoyang. Posisi skala titran dicatat Volume titran = posisi akhir – posisi awal REAKSI-REAKSI DALAM TITRIMETRI Asam - Basa: HA + OH- A- + H2O BOH + H3O+ B+ + 2H2O Titran biasanya: larutan standar elektrolit kuat (NaOH dan HCl) REAKSI-REAKSI UNTUK TITRIMETRI Oksidasi-reduksi (Redoks): Fe2+ + Ce4+ Fe3+ + Ce3+ 5Fe2+ + MnO4-+ 8H+ 5 Fe3+ + Mn2+ + 4H2O Besi tingkat oksidasi 2 disebut ferro Cerium sulfat = Ce4+ Permanganat = MnO4- = Fe2+ REAKSI-REAKSI UNTUK TITRIMETRI Pengendapan: Ag+ + X- AgX(s) X- : ion klorida, bromida, iodida atau tiosianat (SCN-) Pembentukan kompleks: Ag+ + 2CN- Ag(CN)2Reaksi tsb = dasar cara Liebig untuk menentukan sianida EDTA etilen diamin tetra asetat membentuk kompleks stabil dengan sejumlah ion logam PERSYARATAN REAKSI DALAM ANALISA TITRIMETRI Reaksi harus berlangsung sesuai persamaan reaksi kimia tertentu. Reaksi harus berlangsung sampai benar-benar selesai pada titik ekivalen Beberapa metode harus tersedia untuk menentukannya apabila titik ekivalen dicapai (misal: ada indikator) Reaksi berlangsung cepat, sehingga titrasi dapat berlangsung lengkap dalam beberapa menit. Latihan (post test)