kinetika kimia - E-learning UPN JATIM
advertisement
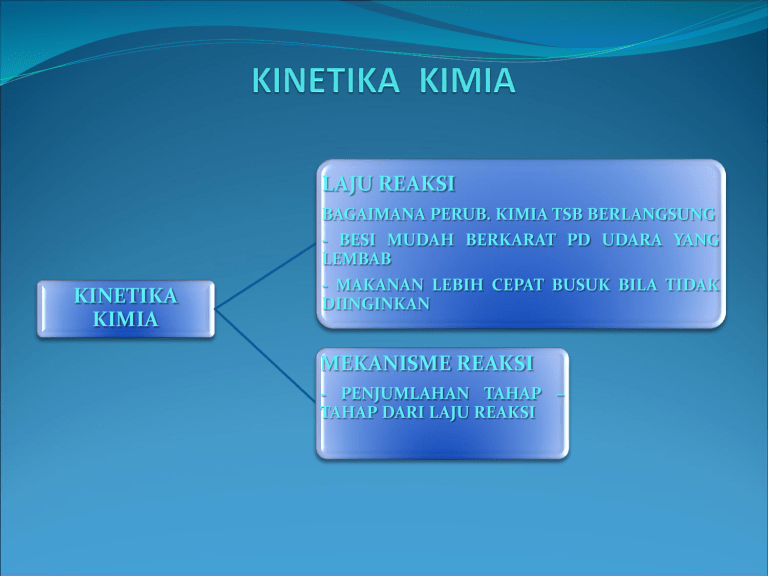
LAJU REAKSI BAGAIMANA PERUB. KIMIA TSB BERLANGSUNG - BESI MUDAH BERKARAT PD UDARA YANG LEMBAB KINETIKA KIMIA - MAKANAN LEBIH CEPAT BUSUK BILA TIDAK DIINGINKAN MEKANISME REAKSI - PENJUMLAHAN TAHAP – TAHAP DARI LAJU REAKSI LAJU REAKSI PERUBAHAN KONSENTRASI PEREAKSI ATAUPUN PRODUK DALAM SUATU SATUAN WAKTU. LAJU BERKURANGNYA SUATU PEREAKSI DAN LAJU BERTAMBAHNYA SUATU PRODUK SATUAN KONSENTRASI M ( Mol/liter) SATUAN WAKTU (detik, menit, jam, dll) SATUAN TEKANAN, P ( atm, mmHg, Pascal ) FAKTOR FAKTOR YANG MEMPENGARUHI LAJU REAKSI LAJU REAKSI SIFAT DASAR PEREAKSI TEMPERATUR KATALIS KONSENTRASI PEREAKSI ZAT SECARA NYATA BERBEDA LAJUNYA DALAM MENGALAMI PERUBAHAN KIMIA. CONTOH : H2 + F2 2 HF (BEREAKSI CEPAT, SECARA MELEDAK DALAM SUHU KAMAR) PERUBAHAN KIMIA TERLIHAT KARENA ADANYA REAKSI CEPAT 2H2O + O2 2H2O (BEREAKSI SANGAT LAMBAT PADA SUHU KAMAR) PERUBAHAN KIMIA HAMPIR TAK TERLIHAT KARENA LAMBATNYA REAKSI CONTOH DALAM KEHIDUPAN Ni DAN Fe MEMPUNYAI LAJU YANG BERLAINAN, Fe CEPAT BERKARAT DAN TERLIHAT ADANYA PERUBAHAN. PADA TEMPERATUR DAN KONSENTRASI YANG SAMA DENGAN Ni, Ni NAMPAK PADA PERMUKAANNNYA TIDAK BERUBAH. Na BEREAKSI CEPAT DENGAN H2O NaBEREAKSI LAMBAT DENGAN METIL ATAU ETIL ALKOHOL. HAL TERSEBUT DIATAS DIKARENAKAN : • SIFAT KEREAKTIFAN ANTAR MOLEKUL ATAU ATOM BERBEDA • KEREAKTIFAN ATOM INI DAPAT DIJELASKAN DENGAN ADANYA PERBEDAAN STRUKTUR ATOM • ENERGI DISOSIASI H2 DAN O2 ADALAH 436 Kj HARGA INI MENUNJUKKAN IKATAN KOVALEN YANG KUAT • ENERGI DISOSIASI F2 ADALAH 157 Kj < O2 HAL INI MENUNJUKKAN H2 DAN F2 MEMPUNYAI REAKSI YANG LEBIH CEPAT DARI PADA H2 DAN O2 • ENERGI PENGAKTIFAN (Ea) ADALAH ENERGI YANG HARUS DITAMBAHKAN KEDALAM MOLEKUL UNTUK MENCAPAI KEADAAN TRANSISI. TEMPERATUR LAJU REAKSI KIMIA BERTAMBAH DENGAN NAIKNYA TEMPERATUR KENAIKAN TEMPERATUR MENGAKIBATKAN SERINGNYA MOLEKUL MOLEKUL BERTABRAKAN, DAN TABRAKAN TERSEBUT SEMAKIN KERAS SAAT TEMPERATUR DINAIKKAN SEHINGGA MEMUNGKINKAN TERJADI SUATU REAKSI. JIKA SUATU REAKSI KIMIA MEMPUNYAI ENERGI PENGAKTIFAN YANG BESAR MAKA REAKSI AKAN CEPAT BERLANGSUNG JIKA SUHU DINAIKKAN. KATALIS SUATU ZAT YANG MEMPERCEPAT REAKSI NAMUN TIDAK MERUBAH REAKSI TERSEBUT. PENGARUH KATALIS UNTUK MEMPERCEPAT REAKSI ADALAH : DENGAN PEMBENTUKAN SENYAWA ANTARA (KATALIS HOMOGEN), CONTOH : A+B AB (REAKSI LAMBAT) A+C AC (REAKSI CEPAT) AC + B AB + C (REAKSI CEPAT) DENGAN ADSORPSI (KATALIS HETEROGEN) CONTOH PENGGUNAAN KATALIS 2SO2 + O2 2NO + O2 NO2 + SO2 2SO3 (KATALIS NO) 2NO2 SO3 + NO BIASANYA HANYA BERADA SEMENTARA H2SO4 / HCl CH3CO2H + C2H5OH AS.ASETAT ETIL ALKOHOL CH3CO2C2H5 + H2O ETIL ASETAT AIR DENGAN KATALIS REAKSI DAPAT DI CAPAI DALAM BEBERAPA JAM TANPA KATALIS REAKSI TERJADI DALAM BEBERAPA MINGGU KONSENTRASI LAJU REAKSI DAPAT DINYATAKAN SEBAGAI LAJU BERKURANGNYA SUATU PEREAKSI DAN LAJU BERTAMBAHNYA SUATU PRODUK A B+C LAJU BERKURANGNYA A PADA t1 [A1] PADA t2 [A2] LAJU RATA – RATA BERKURANGNYA = [A2] – [A1] = Δ [A] (t2) – (t1) Δt LAJU RATA – RATA BERTAMBAHNYA : [B2] – [B1] = [C2] – [C1] = Δ [B] = Δ [C] (t2) – (t1) (t2) – (t1) Δt Δt PADA LAJU RATA – RATA BERKURANGNYA A KARENA A1 > A2 MAKA NILAI MENJADI (-) SEDANGKAN LAJU SELALU BERNILAI (+) MAKA -.(-) = + SEHINGGA DAPAT DITULISKAN : - Δ [A] = Δ [B] = Δ [C] Δt Δt Δt PERSAMAAN HUKUM LAJU REAKSI SUATU PERSAMAAN YANG MEMERIKAN HUBUNGAN ANTARA LAJU REAKSI DAN KONSENTRASI PEREAKSI DENGAN k = TETAPAN REAKSI. MAKIN CEPAT REAKSI MAKA HARGA k MAKIN LAMBAT REAKSI MAKA HARGA k ADALAH JUMLAH SEMUA EKSPONEN DARI KONSENTRASI DALAM PERSAMAAN LAJU. ORDER PERTAMA ORDER REAKSI KIMIA ORDER DUA JIKA LAJU SUATU REAKSI KIMIA BERBANDING LURUS DENGAN PANGKAT SATU KONSENTRASI DARI HANYA SATU PEREAKSI. LAJU = k [A] CONTOH : N2O5 MESKIPUN MEMPUNYAI KOEFISIEN 2 NAMUN N205 MERUPAKAN ORDER REAKSI PERTAMA, MAKA LAJU REAKSI DITULISKAN : LAJU = k [N2O5] PERHITUNGAN k UNTUK REAKSI ORDER PERTAMA : k = 2.303 (log [A]o ) t [A]t WAKTU PARUH : k = 2.303 (log [A]o ) t 1/2 1/2[A]o JIKA LAJU SUATU REAKSI KIMIA BERBANDING LURUS DENGAN PANGKAT DUA SUATU PEREAKSI, 2A PRODUK ; LAJU = k [A] ^ 2 ATAU BERBANDING LURUS DENGAN PANGKAT SATU KONSENTRASI DARU DUA PEREAKSI, A+B PRODUK ; LAJU = k [A] [B] PERHITUNGAN k UNTUK REAKSI ORDER KE DUA k=1(1 - 1 ) t [A]t [A]o WAKTU PARUH : k = 1 ( 1 - 1 ) t1/2 1/2[A]o [A]o MEKANISME REAKSI MERUPAKAN TAHAPAN DARI TERJADINYA SUATU REAKSI KIMIA CONTOH TAHAPAN MEKANISME REAKSI : 2NO2 2NO + O2 2CO + O2 2CO2 2NO2 + 2 CO 2NO + 2CO2 NO2 + CO NO + CO2