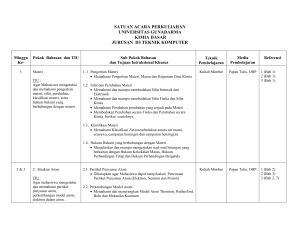
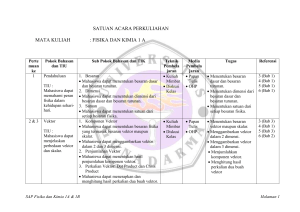
satuan acara perkuliahan
advertisement
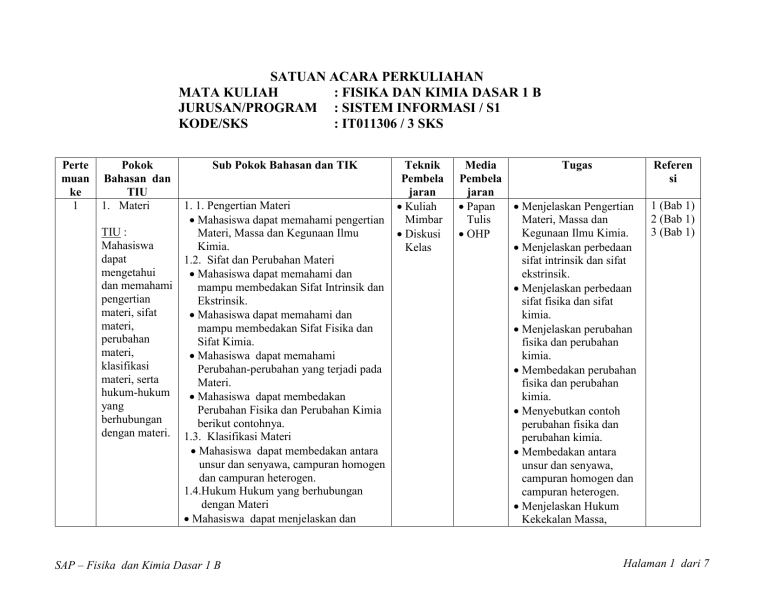
SATUAN ACARA PERKULIAHAN MATA KULIAH : FISIKA DAN KIMIA DASAR 1 B JURUSAN/PROGRAM : SISTEM INFORMASI / S1 KODE/SKS : IT011306 / 3 SKS Perte muan ke 1 Pokok Bahasan dan TIU 1. Materi Sub Pokok Bahasan dan TIK 1. 1. Pengertian Materi Mahasiswa dapat memahami pengertian TIU : Materi, Massa dan Kegunaan Ilmu Mahasiswa Kimia. dapat 1.2. Sifat dan Perubahan Materi mengetahui Mahasiswa dapat memahami dan dan memahami mampu membedakan Sifat Intrinsik dan pengertian Ekstrinsik. materi, sifat Mahasiswa dapat memahami dan materi, mampu membedakan Sifat Fisika dan perubahan Sifat Kimia. materi, Mahasiswa dapat memahami klasifikasi Perubahan-perubahan yang terjadi pada materi, serta Materi. hukum-hukum Mahasiswa dapat membedakan yang Perubahan Fisika dan Perubahan Kimia berhubungan berikut contohnya. dengan materi. 1.3. Klasifikasi Materi Mahasiswa dapat membedakan antara unsur dan senyawa, campuran homogen dan campuran heterogen. 1.4.Hukum Hukum yang berhubungan dengan Materi Mahasiswa dapat menjelaskan dan SAP – Fisika dan Kimia Dasar 1 B Teknik Pembela jaran Kuliah Mimbar Diskusi Kelas Media Pembela jaran Papan Tulis OHP Tugas Referen si Menjelaskan Pengertian Materi, Massa dan Kegunaan Ilmu Kimia. Menjelaskan perbedaan sifat intrinsik dan sifat ekstrinsik. Menjelaskan perbedaan sifat fisika dan sifat kimia. Menjelaskan perubahan fisika dan perubahan kimia. Membedakan perubahan fisika dan perubahan kimia. Menyebutkan contoh perubahan fisika dan perubahan kimia. Membedakan antara unsur dan senyawa, campuran homogen dan campuran heterogen. Menjelaskan Hukum Kekekalan Massa, 1 (Bab 1) 2 (Bab 1) 3 (Bab 1) Halaman 1 dari 7 Perte muan ke Pokok Bahasan dan TIU Sub Pokok Bahasan dan TIK Teknik Pembelaj aran Media Pembela jaran mampu mengerjakan soal-soal hitungan yang berkaitan dengan Hukum Kekekalan Massa, Hukum Perbandingan Tetap dan Hukum Perbandingan Berganda. 2&3 4 2. Struktur Atom 2.1. Partikel Penyusun Atom Mahasiswa dapat menjelaskan Penemuan Partikel Penyusun Atom TIU : (Elektron, Neutron dan Proton). Mahasiswa 2.2. Perkembangan Model Atom dapat Mahasiswa dapat memahami dan mengetahui menerangkan Model Atom Thomson, dan memahami Rutherford, Bohr dan Mekanika partikel Kuantum. penyusun 2.3. Elektron dalam Atom (Model Atom atom, Mekanika Kuantum) perkembangan Mahasiswa dapat menyebutkan dan model atom, menentukan Bilangan Kuantum dan susunan elektron (Utama, Azimut, Magnetik dan elektron dalam Spin). atom. Mahasiswa dapat menuliskan Konfigurasi Elektron. 3. Tabel 3.1. Perkembangan Tabel Periodik Periodik Mahasiswa dapat memahami Konsep Penyusunan Unsur menurut Lavoiser, SAP – Fisika dan Kimia Dasar 1 B Kuliah Mimbar Diskusi Kelas Papan Tulis OHP Kuliah Mimbar Diskusi Papan Tulis OHP Tugas Referen si Hukum Perbandingan Tetap dan Hukum Perbandingan Berganda. Menghitung massa zat dalam reaksi dengan menerapkan Hukum Kekekalan Massa, Hukum Perbandingan Tetap dan Hukum Perbandingan Berganda. Menjelaskan penemuan elektron, neutron dan proton. Menjelaskan Model Atom Thomson, Rutherford, Bohr dan Mekanika Kuantum. Menentukan bilangan kuantum n, l, m, dan s untuk setiap elektron dalam atom suatu unsur. Menuliskan konfigurasi elektron dalam atom suatu unsur. 1 (Bab 2) 2 (Bab 3) 3 (Bab 2, 7) Menjelaskan konsep dalam penyusunan unsur-unsur menurut 1 (Bab 3) 2 (Bab 3) 3 (Bab 8) Halaman 2 dari 7 Perte muan ke 5 Pokok Sub Pokok Bahasan dan TIK Bahasan dan TIU TIU : Dalton, Dobereiner, Newland, Mahasiswa Chancourtuis, Meyer, Mendeleev, dan dapat Moseley (Sistem Periodik Panjang). mengetahui 3.2. Sifat Periodik Unsur dan memahami Mahasiswa dapat menjelaskan Sifat perkembangan Logam, Jari-jari atom, Jari-jari ion, tabel periodik Afinitas Elektron, Keelektronegatifan dan sifat-sifat serta sifat-sifat Magnetik unsur dari periodik unsur. unsur-unsur pada Susunan Berkala Panjang. Teknik Pembelaj aran Kelas Media Pembela jaran 4. Tata Nama Kuliah Mimbar Diskusi Kelas Papan Tulis OHP 4.1. Bilangan Oksidasi Mahasiswa dapat memahami Konsep TIU : Bilangan Oksidasi dan Aturan Mahasiswa Penentuan Bilangan Oksidasi serta dapat mampu menyelesaikan soal-soal yang mengetahui berkaitan dengan bilangan oksidasi dan memahami unsur-unsur dalam senyawa. bilangan 4.2. Penamaan Senyawa Biner oksidasi, Mahasiswa dapat menjelaskan penamaan Penamaan Senyawa Biner ionik dan senyawa biner, Senyawa Biner Kovalen. penamaan Mahasiswa dapat menjelaskan senyawa Penamaan Asam-asam Biner. poliatomik dan 4.3. Penamaan Senyawa Poliatomik penamaan Mahasiswa dapat menjelaskan senyawa Penamaan Senyawa Poliatomik. komplek. 4.4. Penamaan Senyawa Kompleks SAP – Fisika dan Kimia Dasar 1 B Tugas Referen si Lavoiser, Dalton, Dobereiner, Newland, Chancourtuis, Meyer, Mendeleev, dan Moseley. Menjelaskan sifat logam, jari-jari atom, jari-jari ion, afinitas elektron, keelektronegatifan serta sifat-sifat magnetik unsur dari unsur-unsur pada Susunan Berkala Panjang. Menentukan bilangan oksidasi unsur-unsur dalam suatu senyawa. Menjelaskan aturan penamaan senyawa biner ionik dan senyawa biner kovalen serta memberi contohnya. Menjelaskan aturan penamaan asam biner serta memberi contohnya. Menjelaskan aturan penamaan senyawa poliatomik serta memberi contohnya. 1 (Bab 4) 2 (Bab 4) 3 (Bab 3) Halaman 3 dari 7 Perte muan ke Pokok Bahasan dan TIU Sub Pokok Bahasan dan TIK Teknik Pembelaj aran Media Pembela jaran Mahasiswa dapat menyebutkan nama senyawa Garam Asam, Garam Basa, Garam Rangkap dan Garam Kompleks. 6&7 5.1. Peranan Elektron dalam Pembentukan Kuliah Ikatan Kimia Mimbar Mahasiswa dapat memahami Konsep Diskusi TIU : Pembentukan Ikatan Kimia dan Kelas Mahasiswa Peranan Elektron Valensi dalam dapat Pembentukan Ikatan Kimia. mengetahui Mahasiswa dapat memahami Aturan dan memahami Oktet, Lambang Lewis, Struktur Lewis. peranan 5.2. Pembentukan Ikatan Ion elektron dalam Mahasiswa dapat memahami pembentukan pengertian Ikatan Ion dan Ikatan ikatan kimia, Kovalen serta perbedaan keduanya. pembentukan 5.3 Pembentukan Ikatan Kovalen ikatan ion, Mahasiswa dapat membedakan Ikatan pembentukan Kovalen Tunggal, Kovalen Rangkap ikatan kovalen, dan Kovalen Koordinat dan penyimpangan memberikan contoh-contohnya. aturan oktet, 5.4. Penyimpangan Aturan Oktet kepolaran Mahasiswa dapat menjelaskan Oktet ikatan dan Tak Lengkap dan Oktet Berkembang keelektronegati dan memberikan contoh-contohnya. fan serta 5.5. Kepolaran Ikatan dan bentuk Keelektronegatifan molekul. Mahasiswa dapat memahami dan dapat membedakan Ikatan Polar dan Non 5. Ikatan Kimia SAP – Fisika dan Kimia Dasar 1 B Papan Tulis OHP Tugas Referen si Menyebutkan nama senyawa Garam Asam, Garam Basa, Garam Rangkap dan Garam Kompleks. Menjelaskan Konsep Pembentukan Ikatan Kimia dan Peranan Elektron Valensi dalam Pembentukan Ikatan Kimia. Menjelaskan Aturan Oktet, Lambang Lewis, dan Struktur Lewis serta memberikan contohnya. Menjelaskan pengertian Ikatan Ion dan Ikatan Kovalen serta perbedaan keduanya serta memberikan contohnya. Membedakan Ikatan Kovalen Tunggal, Kovalen Rangkap dan Kovalen Koordinat serta memberikan contohcontohnya. Menjelaskan Oktet Tak Lengkap dan Oktet Berkembang serta memberikan contohnya. 1 (Bab 5) 2 (Bab 5) 3 (Bab 9) Halaman 4 dari 7 Perte muan ke Pokok Bahasan dan TIU Sub Pokok Bahasan dan TIK Teknik Pembelaj aran Media Pembela jaran Polar, serta konsep Keelektronegatifan yang berkaitan dengan jenis ikatan kimia yang terbentuk. 5.6. Bentuk Molekul Mahasiswa dapat memahami Bentuk Molekul antara lain Diatomik, Triatomik, Caturatom dan Pancatom. 8&9 10 & 11 6. Persamaan Kimia 6.1. Cara Menentukan Koefisien Reaksi Mahasiswa dapat mengerti Konsep Reaksi Kimia dan Persamaan Kimia. TIU : Mahasiswa dapat menentukan Mahasiswa Koefisien Reaksi pada suatu dapat Persamaan Reaksi. mengetahui 6.2. Jenis-Jenis Reaksi Kimia dan memahami Mahasiswa dapat menyebutkan dan cara membedakan macam- macam reaksi, menentukan diantaranya adalah Reaksi Kombinasi, koefisien Reaksi Penguraian, Reaksi Pertukaran, reaksi dan Reaksi Pertukaran Ganda dan Reaksi jenis-jenis Netralisasi. reaksi kimia. 7. Stoikiome 7.1. Bilangan Avogadro tri Mahasiswa dapat memahami dan Menjelaskan konsep Bilangan TIU : Avogadro. Mahasiswa 7.2. Massa Atom dan Massa Molekul dapat Mahasiswa dapat memahami konsep SAP – Fisika dan Kimia Dasar 1 B Kuliah Mimbar Diskusi Kelas Papan Tulis OHP Kuliah Mimbar Diskusi Kelas Papan Tulis OHP Tugas Referen si Membedakan Ikatan Polar dan Non Polar. Menjelaskan konsep keelektronegatifan untuk menentukan jenis ikatan kimia yang terbentuk. Menjelaskan dengan contoh Bentuk Molekul Diatomik, Triatomik, Caturatom dan Pancatom 1 (Bab 6) Menjelaskan pengertian 2 (Bab 2) Reaksi Kimia dan 3 (Bab 4) Persamaan Kimia. Menentukan Koefisien Reaksi pada suatu Persamaan Reaksi. Membedakan Reaksi Kombinasi, Reaksi Penguraian, Reaksi Pertukaran, Reaksi Pertukaran Ganda dan Reaksi Netralisasi. Menjelaskan konsep Bilangan Avogadro. Menjelaskan konsep Massa Atom Relatif dan Massa Molekul Relatif. 1 (Bab 7) 3 (Bab 3) Halaman 5 dari 7 Perte muan ke 12 & 13 Pokok Sub Pokok Bahasan dan TIK Teknik Bahasan dan Pembelaj TIU aran mengetahui Massa Atom dan Massa Molekul dan memahami Relatif. bilangan 7.3. Konsep Mol avogadro, Mahasiswa dapat memahami dan massa atom menjelaskan Konsep Mol serta dan massa kegunaannya dalam perhitungan. molekul, 7.4. Reaksi Kimia dalam Larutan konsep mol, Mahasiswa dapat mengerti cara reaksi kimia menentukan Konsentrasi dalam Satuan dalam larutan, Fisika (Jumlah Solute per satuan rumus molekul Volume Larutan, Persentase dan rumus Komposisi, Massa Solute per Massa empirik dan Solvent). hal-hal Mahasiswa dapat mengerti cara komplek menentukan Konsentrasi Larutan dalam dalam Satuan Kimia (Molaritas, Normalitas, stokiometri. Molalitas dan Fraksi Mol). 7.5. Rumus Molekul dan Rumus Empirik Mahasiswa dapat menentukan Rumus Empirik dan Rumus Molekul suatu Senyawa. 7.6. Hal-hal Kompleks dalam Stoikiometri Mahasiswa dapat menentukan Pembatas Reaksi dalam suatu Reaksi. Mahasiswa dapat membedakan antara Hasil Teoritis, Hasil Nyata dan Persen Hasil. 8. Gas 8.1. Sifat-sifat Gas Kuliah Mimbar Mahasiswa dapat memahami dan menjelaskan sifat-sifat umum gas. Diskusi SAP – Fisika dan Kimia Dasar 1 B Media Pembela jaran Tugas Referen si Menjelaskan Konsep Mol. Menghitung jumlah mol suatu zat. Menghitung konsentrasi zat dalam persen (% volume/volume, % massa/volume, dan % massa/massa). Menghitung konsentrasi zat dalam Molar, Normal, Molal dan Fraksi Mol. Menentukan Rumus Empirik dan Rumus Molekul suatu Senyawa. Menentukan Pembatas Reaksi dalam suatu reaksi. Membedakan antara Hasil Teoritis, Hasil Nyata dan Persen Hasil. Menghitung Hasil Teoritis dan Persen Hasil dalam suatu reaksi. Papan Tulis OHP Menjelaskan Sifat-sifat Gas. 1 (Bab 9) 2 (Bab 7) 3 (Bab 5) Halaman 6 dari 7 Perte muan ke Pokok Sub Pokok Bahasan dan TIK Bahasan dan TIU TIU : 8.2. Tekanan Gas Mahasiswa Mahasiswa dapat memahami konsep dapat Tekanan Gas. mengatahui 8.3. Beberapa Hukum yang berlaku pada dan memahami Gas sifat-sifat Mahasiswa dapat memahami dan umum gas, menggunakan Hukum Boyle, Hukum tekanan gas, Charles dan Hipotesis Avogadro untuk beberapa menyelesaikan soal-soal yang berkaitan hukum yang dengan gas. berlaku pada 8.4. Gas Ideal gas, persamaan Mahasiswa dapat memahami konsep gas ideal, persamaan gas ideal dan penentuan menggunakannya dalam perhitungan. massa molar Mahasiswa dapat menentukan massa gas serta massa molar (Mr) gas. jenis gas, gas 8.5. Gas dalam reaksi kimia dalam reaksi Mahasiswa dapat memahami konsep kimia dan gas dalam reaksi kimia. campuran gas. 8.6. Campuran gas Mahasiswa dapat memahami konsep penyampuran gas dan perhituangannya secara matematis. Teknik Pembelaj aran Kelas Media Pembela jaran Tugas Referen si Menjelaskan konsep Tekanan Gas. Menghitung volume gas dengan menerapkan Hukum Boyle, Hukum Charles, dan Hipotesis Avogadro. Menghitung jumlah molekul (mol) gas dengan Persamaan Gas Ideal. Menghitung massa molar (Mr) gas dengan Persamaan Gas Ideal. Menghitung volume atau jumlah molekul (mol) gas dalam suatu reaksi. Menghitung volume atau jumlah molekul (mol) gas dalam suatu campuran gas. Referensi : 1. Tety Elida S., dkk., Pengantar Kimia, Diktat Kuliah, Gunadarma, Jakarta, 1996 2. Keenan, Kleinfelter, Wood, Kimia Untuk Universitas jilid 1, terjemahan : A. Hadyana P, Erlangga, Jakarta, 1999 3. Petrucci, R.H, Kimia Dasar : Prinsip dan Terapan Modern jilid 1, terjemahan : Suminar Achmadi, Erlangga, Jakarta, 1996 4. Rosenberg, J.L., College Chemistry : Schaum’s Outline Series, Mc. GrawHill Book co., Singapore, 1985 5. Syukri S., Kimia Dasar 1, ITB, Bandung, 1999 SAP – Fisika dan Kimia Dasar 1 B Halaman 7 dari 7