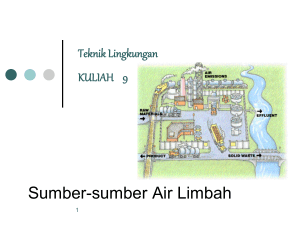
1 BAB I PENDAHULUAN 1.1 Latar Belakang Umumnya
advertisement

BAB I PENDAHULUAN 1.1 Latar Belakang Umumnya Negara berkembang dijadikan sebagai pusat industri. Dampak adanya industri berakibat terhadap pencemaran lingkungan karena adanya limbah industri. Limbah cair merupakan buangan cair yang tidak dapat dimanfaatkan lagi dan mengandung bahan-bahan yang membahayakan kesehatan manusia serta mengganggu lingkungan hidup (Perdana, 2007). Karakteristik limbah cair suatu industri dipengaruhi oleh limbah cair dari proses produksi, di antaranya adalah: penggunaan air, penggunaan bahan baku, penggunaan bahan pendukung dan penggunaan energi (Driessen dan Vereijken, 2003; Perdana, 2007). Industri bir memiliki nilai ekonomi dalam sektor agro-pangan. Bir merupakan salah satu minuman beralkohol yang diproduksi melalui proses fermentasi bahan berpati seperti biji malt, cereal dan diberi aroma flavor hops, tetapi tanpa proses penyulingan. Bahan yang digunakan dalam pembuatan bir berbeda-beda tergantung pada karakteristik bir tersebut sehingga rasa dan warna sangat berbeda baik jenis maupun klasifikasinya (Yusuf, 2012). Sebagian besar industri bir proses produksinya menggunakan air. Limbah cair industri bir mengandung limbah organik dengan tingkat polusi tergantung pada proses produksi bir dan kapasitas konsumsi air selama (Olafadehan dan Aribike, 2000; Driessen dan Vereijken, 2003). 1 proses tersebut 2 Umumnya limbah cair bir berwarna dan mengandung bahan organik yang mudah didegradasi seperti gula, pati terlarut, etanol, asam lemak, volatil dan lainlain yang dapat diukur dengan COD dan BOD (Driessen dan Vereijken, 2003). Limbah cair bir mengandung bahan organik tinggi dalam hal kebutuhan oksigen kimiawi dari 1000 mg/L sampai 4000 mg/L dan kebutuhan oksigen biokimia sampai 1500 mg/L sehingga menyebabkan racun bagi kehidupan perairan (Olafadehan dan Aribike, 2000). Proses daur ulang limbah industri atau Water Treatment Recycle Process adalah salah satu syarat yang harus dimiliki oleh industri yang berwawasan lingkungan (Smith dan Scott, 2005). Beberapa pabrik pembuatan bir tidak mempunyai fasilitas pengolahan limbah tersebut karena faktor biaya peralatan yang cukup mahal dan memerlukan tempat instalansi yang cukup luas. PT. Storm Beer merupakan salah satu industri bir yang sudah berkembang cukup lama di Bali namun untuk kasus penanganan limbah hanya ditanggulangi dengan menampung limbah ke dalam bak-bak penampungan dan langsung dibuang ke lahan perkebunan yang dapat berakibat merusak struktur tanah lahan perkebunan tersebut. Pengolahan limbah industri dapat dilakukan secara fisik, kimia, dan biologi serta kombinasi dari beberapa metode pengolahan. Beberapa teknik kombinasi pengolahan limbah secara alami seperti metode fisika dengan media filter alami dan metode biologi diharapkan dapat mengolah limbah cair bir dengan baik sehingga dapat dipergunakan kembali sebelum dibuang ke lingkungan tanpa menyebabkan pencemaran lingkungan. 3 Salah satu sistem pengolahan lingkungan yang menarik untuk dikembangkan adalah pengolahan biologi dengan biota tingkat tinggi, biota tingkat rendah maupun mikroorganisme. Mikroorganisme merupakan salah satu alternatif untuk mengatasi pencemaran lingkungan karena bersifat aman dan ramah terhadap lingkungan dan manusia (Waluyo, 2004). Pemanfaatan aktivitas mikroba aerob dalam mengolah limbah cair dapat menguraikan zat organik menjadi zat anorganik yang stabil dalam air limbah sehingga tidak memberikan dampak pencemaran terhadap lingkungan yang merupakan habitat berbagai mahluk hidup (Fardiaz, 2006). Umumnya proses degradasi di lingkungan dilakukan oleh konsorsium mikroba bukan satu jenis mikroba saja (Thompson et al., 2005). Konsorsium mikroba adalah campuran populasi mikroba dalam bentuk komunitas yang mempunyai hubungan kooperatif, komensal, dan mutualistik. Sistem pengolahan yang menggunakan campuran kultur mikroba akan memberikan hasil yang lebih efektif dibandingkan kultur murni karena adanya aktivitas katabolik kultur bakteri yang saling melengkapi satu sama lain dan produk dekomposisi yang dihasilkan dari suatu kultur dapat digunakan oleh kultur lain untuk proses dekomposisi selanjutnya sehingga dapat membantu peningkatan oksidasi bahan organik limbah cair (Jadhav et al., 2008). Isolasi bakteri merupakan langkah awal untuk mendapatkan konsorsium bakteri yang dapat digunakan untuk degradasi bahan pencemar tertentu (Thompson et al., 2005). Berdasarkan latar belakang tersebut, maka dilakukan penelitian mengenai pengolahan limbah cair produksi bir oleh konsorsium mikroba setelah perlakuan 4 fisika dengan media filter alami sehingga pada akhirnya limbah yang akan dibuang ke lingkungan sudah memenuhi standar baku mutu air buangan yang ada. 1.2 Rumusan Masalah Dari latar belakang di atas didapatkan permasalahan, sebagai berikut: 1. Apakah terdapat isolat bakteri culturable yang mempunyai kemampuan dalam menurunkan indikator COD, BOD, dan TSS pada limbah cair bir? 2. Bagaimanakah efektivitas konsorsium mikroba dalam menurunkan indikator BOD, COD, dan TSS pada limbah cair bir? 1.3 Tujuan Penelitian Berdasarkan latar belakang di atas, maka tujuan dari penelitian ini adalah: 1. Untuk mengetahui ada tidaknya bakteri culturable yang mempunyai kemampuan dalam menurunkan indikator COD, BOD, dan TSS pada limbah cair bir. 2. Untuk mengetahui efektivitas konsorsium mikroba dalam menurunkan indikator BOD, COD, dan TSS pada limbah cair bir. 1.4 Manfaat Penelitian Hasil penelitian ini diharapkan dapat dipakai sebagai alternatif penggunaan konsorsium mikroba yang dapat dimanfaatkan dalam pengolahan limbah cair bir sehingga lebih ramah lingkungan dan efektif secara mikrobiologis. Selain itu, penelitian ini juga diharapkan dapat memberikan informasi kepada mahasiswa, masyarakat umum, dan industri pemilik bir tentang pentingnya pengolahan limbah cair bir sebelum dibuang ke lingkungan. 5 BAB II KAJIAN PUSTAKA 2.1 Pencemaran Air Air merupakan salah satu sumber kekayaan alam yang dibutuhkan oleh makhluk hidup untuk kelangsungan hidupnya. Selain itu, air dibutuhkan untuk kelangsungan proses industri, kegiatan perikanan, pertanian, dan peternakan. Oleh karena itu, apabila air tidak dikelola dengan baik maka akan timbul kerusakan maupun kehancuran bagi makhluk hidup (Effendi, 2003). Pencemaran air adalah masuk atau dimasukkannya makhluk hidup, zat, energi atau komponen lain ke dalam air sehingga kualitas air turun sampai ke tingkat tertentu yang menyebabkan air kurang atau tidak dapat lagi berfungsi sesuai dengan peruntukannya (Effendi, 2003). Menurut Suharto (2011), pencemaran air adalah suatu keadaan air yang mengalami penyimpangan dari keadaan normalnya. Umumnya pencemaran air terjadi karena hasil kegiatan manusia seperti adanya deterjen, asam belerang, dan zat-zat kimia sisa pembuangan pabrik-pabrik kimia/industri. Pembuangan bahan kimia limbah maupun pencemar lain ke dalam air akan meracuni semua organisme di dalam suatu ekosistem air. Menurut Suharto (2011), kandungan bahan pencemar yang dapat menentukan indikator yang terjadi pada lingkungan air sebagai berikut: 5 6 1. Bahan buangan organik Bahan buangan organik berupa limbah yang dapat membusuk akan didegradasi oleh mikroorganisme sehingga mengakibatkan semakin berkembangnya mikroba pathogen. 2. Bahan buangan anorganik Bahan buangan anorganik berupa limbah yang tidak dapat membusuk dan sulit didegradasi oleh mikroorganisme. Apabila bahan buangan anorganik ini masuk ke lingkungan air, akan terjadi peningkatan jumlah ion logam di dalam air, selanjutnya kesadahan air akan meningkat (Ca2+ dan Mg2+). Selain itu, ion-ion tersebut dapat bersifat racun seperti timbal (Pb), arsen (As), dan air raksa (Hg). 3. Bahan buangan zat kimia Bahan buangan zat kimia banyak ragamnya seperti bahan pencemar air yang berupa sabun, bahan pemberantas hama, zat warna kimia, larutan penyamak kulit, dan zat radioaktif. 2.2 Limbah Industri Bir Bir merupakan salah satu minuman yang paling banyak dikonsumsi. Rata-rata konsumsi bir 23 liter/orang dalam per tahun dibandingkan dengan konsumsi teh, susu karbonat, dan kopi. Industri bir dalam dunia ekonomi dapat memproduksi bir melebihi 1,34 miliar hektoliter pada tahun 2002 (Levinson, 2002). Kualitas dan kuantitas limbah produksi bir tergantung pada berbagai proses pembuatannya seperti penanganan bahan baku, persiapan, fermentasi, filtrasi, dan kemasan (Kiijnhout dan Van Eerde, 1986). Komposisi limbah cair bir 7 berfluktuasi tergantung pada jenis proses yang digunakan dalam pabrik bir dan konsumsi air selama proses produksi. Air yang digunakan dalam produksi bir sebagian menjadi produk, sebagian hilang melalui proses evaporasi dan sebagian menjadi limbah (Driessen dan Vereijken, 2003). Tingkatan pH limbah ditentukan oleh jumlah dan jenis bahan kimia yang digunakan di unit pengolahan (misalnya soda kaustik, asam fosfat, asam nitrat dan lain-lain), kandungan nitrogen dan fosfor serta tergantung pada cara penanganan bahan baku dan jumlah ragi yang ada dalam air limbah (Rosenwinkel dan Seyfried, 1985). Umumnya komponen organik limbah cair produksi bir mudah didegradasi seperti gula, pati terlarut, etanol, asam lemak volatil, dan lain-lain. Kandungan organik ini menyebabkan nilai BOD/COD mencapai 1000-6000 mg/L. Kandungan padatan limbah bir (dinyatakan sebagai TSS) terutama berasal dari biji-bijian dan ragi (Driessen dan Vereijken, 2003). Tabel 2.1 Karakteristik limbah cair industri bir Parameter Flow COD BOD TSS T pH Nitrogen Phosphorous Unit mg/L mg/L mg/L o C mg/L mg/L Komposisi Limbah Bir 2000-6000 1200-3600 200-1000 18-40 4,5-12 25-80 10-50 Sumber: Driessen dan Vereijken (2003) Nilai Standar Limbah Bir 2-8 hl effluent/ hl beer 0,5-3 kg COD/ hl beer 0,2-2 kg BOD/ hl beer 0,1-0,5 kg TSS/ hl beer 8 Limbah produksi bir rata-rata mengandung 10-60 mg/L (SS/padatan tersuspensi), 1.000-1.500 mg/L (BOD), dan 1.800-3.000 mg/L (COD). Limbah cair bir dari proses fermentasi mengandung 3,7% padatan total dan 91% di antaranya menguap (Driessen dan Vereijken, 2003; World Bank, 1997). 2.3 Teknik-Teknik Pengolahan Limbah Berbagai teknik pengolahan limbah untuk menyisihkan bahan polutan telah dicoba dan dikembangkan selama ini. Teknik-teknik pengolahan limbah yang telah dikembangkan secara umum terbagi menjadi 3 metode pengolahan yaitu pengolahan limbah secara fisika dengan menyisihkan bahan-bahan tersuspensi berukuran besar dan yang mudah mengendap atau bahan-bahan yang terapung terlebih dahulu (Dayanti, 2009 dan Suharto, 2011). Penyaringan (screening) merupakan cara yang efisiensi dan murah untuk menyisihkan bahan tersuspensi yang berukuran besar. Bahan tersuspensi yang mudah mengendap dapat disisihkan secara mudah dengan proses pengendapan. Parameter desain yang utama untuk proses pengendapan ini adalah kecepatan mengendap partikel dan waktu tinggal air di dalam unit pengolahan atau hidrolis di dalam bak pengendap (Dayanti, 2009). Pengolahan air buangan secara kimia dilakukan dengan metode penghilangan/konversi senyawa-senyawa polutan dalam limbah cair dengan penambahan bahan-bahan kimia atau reaksi kimia lainnya. Penyisihan bahanbahan tersebut pada prisnsipnya berlangsung melalui perubahan sifat bahan-bahan tersebut, yaitu dari tak dapat diendapkan menjadi mudah diendapkan (flokulasi- 9 koagulasi), baik dengan atau tanpa reaksi oksidasi-reduksi, dan juga berlangsung sebagai hasil reaksi oksidasi (George et al., 2003). Pengolahan limbah secara biologi sebagai pengolahan sekunder merupakan pengolahan yang paling murah dan efisien. Berbagai metode pengolahan biologi dengan segala modifikasinya telah berupaya dikembangkan dalam beberapa tahun. Reaktor pengolahan secara biologi dapat dibedakan atas dua jenis yaitu: reaktor pertumbuhan tersuspensi (suspended growth reactor) dan reaktor pertumbuhan lekat (attached growth reaktor). Mikroorganisme yang tumbuh dan berkembang dalam keadaan tersuspensi disebut reaktor pertumbuhan tersuspensi. Proses lumpur aktif yang banyak dikenal berlangsung dalam jenis reaktor ini. Sedangkan mikroorganisme yang tumbuh di atas media pendukung dengan membentuk lapisan film untuk melekatkan dirinya disebut reaktor pertumbuhan lekat. Ditinjau dari segi lingkungan dimana berlangsung proses penguraian secara biologi, proses ini dapat dibedakan menjadi dua jenis yaitu: proses aerob yang berlangsung dengan hadirnya oksigen dan anaerob yang berlangsung tanpa adanya oksigen. Banyak sekali jenis pengolahan air limbah secara biologi, namun yang paling sering digunakan ialah sebagai berikut: trickling filter, cakram biologi, filter terendam, dan reaktor fludisasi. Untuk semua jenis air buangan tertentu, ketiga metode tersebut dapat diaplikasikan secara sendiri-sendiri atau kombinasi (Dayanti, 2009). 10 2.4 Parameter Pencemar Pada lingkungan air yang tercemar kadar oksigennya sangat rendah karena oksigen yang terlarut dalam air digunakan oleh mikroorganisme untuk memecah/mendegradasi bahan organik. Pengujian terhadap bahan-bahan organik penting dilakukan untuk mengetahui tingkat pencemaran air karena bahan organik yang digredasi oleh mikroba dengan bantuan oksigen dapat menurunkan oksigen terlarut dalam air dengan cepat. Untuk mengetahui adanya polutan tersebut dapat dilakukan dengan mengukur beberapa parameter kualitas air seperti COD (chemical oxygen demand), BOD (biologycal oxygen demand), TSS (total suspended solid), pH, dan mengukur kadar pencemar lain yang terkandung di dalam air secara kuantitatif (Fardiaz, 2006). Dalam penelitian ini yang digunakan sebagai parameter pencemar adalah COD (chemical oxygen demand), BOD (biologycal oxygen demand), TSS (total suspended solid), pH, dan suhu. COD (chemical oxygen demand) Chemical Oxygen Demand (COD) atau Kebutuhan Oksigen Kimia (KOK) adalah jumlah oksigen (mg O2) yang dibutuhkan untuk mengoksidasi zat-zat organik dan anorganik yang ada dalam sampel air, dimana pengoksidasi K2Cr2O7 digunakan sebagai sumber oksigen (oxidizing agent) dalam suasana asam. Dikromat sebagai oksidator dapat mengoksidasi bahan organik sekitar 95%-100% (Suharto, 2011). COD menggambarkan jumlah total oksigen yang dibutuhkan untuk mengoksidasi bahan organik secara kimiawi, baik yang dapat didegradasi secara 11 biologis (biodegradable) maupun yang sukar didegradasi secara biologis (non degradable) menjadi CO2 dan H2O (Fardiaz, 2006). Umumnya uji COD menghasilkan nilai kebutuhan oksigen yang lebih tinggi dibandingkan dengan uji BOD, karena bahan-bahan yang stabil terhadap reaksi biologi dan mikroorganisme dapat ikut teroksidasi dalam uji COD. Bahkan yang tidak dapat didegradasi secara biologis tersebut akan didegradasi secara kimiawi melalui proses oksidasi, jumlah oksigen yang dibutuhkan untuk mengoksidasi tersebut dikenal dengan nama COD (chemical oxygen demand) (Suharto, 2011). BOD (biochemical oxygen demand) Angka BOD (biochemical oxygen demand) disebut juga kebutuhan oksigen biokimiawi adalah suatu analisis empiris yang mencoba mendekati secara global proses-proses mikrobiologis yang sebenarnya terjadi di dalam air. Angka BOD adalah jumlah oksigen yang dibutuhkan oleh mikroorganisme aerob untuk menguraikan zat organik yang terdapat di dalam air. Pengukuran BOD diperlukan untuk menentukan beban pencemaran yang berasal dari air buangan penduduk ataupun industri dengan mendesain sistem pengolahan biologis (Fardiaz, 2006). Pengukuran BOD didasarkan atas reaksi oksidasi zat organik oleh oksigen dalam air, dan proses tersebut berlangsung disebabkan adanya bakteri aerobik. Pada kondisi suhu optimal, kecukupan nutrien, kecukupan oksigen terlarut, nilai pH optimal, maka mikroba dapat tumuh dan berkembang biak secara maksimal dengan menggunakan subtrat senyawa kimia organik dalam limbah cair (Suharto, 2011). 12 TSS (total suspended solid) TSS adalah jumlah berat dalam mg/liter kering lumpur yang ada dalam limbah setelah mengalami penyaringan dengan membran berukuran 0,45 mikron (Suharto, 2011). Kemudian dikeringkan dalam oven pada temperatur 103°C– 105°C, hingga diperoleh berat tetap. Partikel yang sama besar, partikel yang mengapung dan zat-zat yang menggumpal yang tidak tercampur dalam air, terlebih dahulu dipisahkan sebelum pengujian (Lenore et al., 1998). Padatan tersuspensi terdiri dari partikel-partikel yang ukuran maupun beratnya lebih kecil dari sedimen, misalnya tanah liat, bahan organik tertentu, sel mikroorganisme dan lainnya (Fardiaz, 2006). Penentuan zat padat tersuspensi (TSS) berguna untuk mengetahui kekuatan pencemaran air limbah domestik, dan juga berguna untuk penentuan efisiensi unit pengolahan air (BAPPEDA, 1995). Metode ini digunakan untuk menentukan residu tersuspensi yang terdapat dalam contoh uji air dan air limbah secara gravimetrik (Lenore et al., 1998). Suhu Suhu air limbah akan mempengaruhi kecepatan reaksi kimia serta tata kehidupan dalam air. Perubahan suhu memperlihatkan aktivitas kimiawi biologis pada benda padat dan gas dalam air. Suhu yang tinggi menyebabkan terjadinya pembusukan dan tingkatan oksidasi zat organik. Selain itu, suhu mempengaruhi aktivitas metabolisme maupun perkembangbiakan organisme (Effendi, 2003). 13 Derajat Keasaman (pH) Derajat keasaman (pH) seringkali dijadikan parameter baik buruknya kualitas suatu perairan. Hal ini dikarenakan pH mempunyai pengaruh besar terhadap kehidupan organisme di perairan. Nilai pH air digunakan untuk mengekpresikan kondisi keasaman (kosentrasi ion hidrogen) air limbah. Skala pH berkisar antara 1-14. Kisaran nilai pH 1-7 termasuk kondisi asam, pH 7-14 termasuk kondisi basa, dan pH 7 adalah kondisi netral. Derajat keasaman mempengaruhi daya racun bahan pencemaran dan kelarutan beberapa gas, serta menentukan bentuk zat di dalam air. Perubahan keasaman pada air buangan, baik ke arah alkali (pH naik) maupun ke arah asam (pH menurun), akan mengganggu kehidupan biota air. Selain itu, air buangan dengan pH rendah bersifat sangat korosif dan sering menyebabkan perkaratan pada pipa-pipa besi (Wardana, 1995). 2.5 Konsorsium Mikroba Konsorsium secara umum diklasifikasikan menjadi dua bagian, yaitu konsorsium yang sifatnya positif (mutualisme, sintrofisme, protokooperasi, dan komensalisme), maupun negatif (predasi, parasitisme, amensalisme, dan kompetisi) (Atlas, 1997; Cahyonugroho dan Hidayah, 2008). Mikroorganisme dapat berasosiasi dengan organisme lain secara fisik melalui dua mekanisme, yaitu keberadaan suatu organisme yang umumnya memiliki ukuran lebih kecil pada permukaan organisme lainnya yang umumnya berukuran lebih besar dan keberadaan suatu organisme pada organisme lain (Cahyonugroho dan Hidayah, 2008). 14 Penggunaan konsorsium mikroba yang tepat akan memberikan manfaat daripada kultur murni (Arief et al., 2010). Konsorsium mikroba akan memberikan hasil lebih efektif karena adanya aktivitas metabolisme yang saling melengkapi satu sama lain dalam sistem degradasi di lingkungan. Suatu kultur bakteri dapat menggunakan produk dekomposisi yang dihasilkan dari kultur lain untuk proses dekomposisi lebih jauh sehingga membantu peningkatan oksidasi bahan organik limbah cair (Jadhav et al., 2008). Hubungan antar bakteri korsorsium dalam keadaan substrat yang mencukupi tidak akan saling mengganggu, tetapi saling bersinergi sehingga menghasilkan efisiensi perombakan yang lebih tinggi selama proses pengolahan. Interaksi sinergisme antara konsorsium bakteri yang digunakan atau interaksinya dengan lingkungan menyebabkan terjadinya proses degradasi bahan cemaran organik di dalam limbah (Prakash et al., 2003). 2.6 Mikrorganisme Pendegradasi Limbah Bir Effluent limbah bir mengandung bahan organik tinggi dalam hal kebutuhan oksigen kimiawi (Olafadehan dan Aribike, 2000). Proses degradasi bahan organik sangat dipengaruhi oleh aktivitas mikroorganisme. Mikroorganisme dalam jumlah yang tidak terbatas menyebar di alam. Sumber-sumber untuk memperoleh mikroorganisme adalah tanah, lumpur, air, air buangan, makanan baik yang rusak maupun utuh, tanaman, dan sebagainya. Mikroorganisme dapat berupa alga, bakteri, ataupun fungi. Secara umum, mikroorganisme dapat hidup pada kondisi pH 6-8 (Muslimin, 1996; Budiyanto, 2004). Bakteri yang menggunakan senyawa organik sebagai energi atau sumber karbon untuk sintesa tergolong dalam jenis bakteri heterotrop. Salah satu contoh 15 bakteri heterotrop berdasarkan aktifitasnya terhadap oksigen adalah bakteri aerobik, bakteri ini memerlukan oksigen bebas terlarut untuk memecah senyawa organik untuk mendapatkan energi dalam pertumbuhan dan perkembangbiakan (Tjokrokusumo, 1999). Perkembangan penelitian dalam bidang bioremediasi telah menemukan spesies-spesies bakteri yang berpotensial untuk merombak bahan cemaran organik, yaitu Pseudomonas aeruginosa, Pseudomonas stutzeri, Serratia liquefaciens, dan Kurthia zopfii (Wignyanto et al., 2009 dan Suarsini, 2007). Pseudomonas merupakan bakteri yang penting dalam dekomposisi secara aerobik dan biodegradasi karena memegang peranan penting dalam siklus karbon. Pseudomonas berpotensi mendegradasi bahan organik yang terdiri dari protein, lemak, dan karbohidrat. Biodegradasi senyawa organik yang terjadi selama perlakuan meliputi biodegradasi amilum dilakukan oleh bakteri Serratia liquefaciens dan Pseudomonas stutzeri yang mampu menghasilkan enzim amilolitik. Biodegradasi protein dilakukan oleh bakteri Pseudomonas stutzeri atau Pseudomonas aeruginosa atau Serratia liquefaciens dengan mengeluarkan enzim proteolitik. Biodegradasi lemak dapat terjadi oleh bakteri Pseudomonas aeruginosa atau Serratia liquefaciens yang menghasilkan enzim lipolitik (Suarsini, 2007). Biodegradasi lemak dilakukan oleh Pseudomonas aeruginosa yang menghasilkan lipase, dilanjutkan Serratia liquefaciens menghasilkan esterase. Tahap aklimatisasi yang merupakan tahap adaptasi bagi pertumbuhan bakteri dapat 16 terlampaui karena adanya interaksi sinergisme di antara bakteri-bakteri pendegradasi tersebut (Suarsini, 2007). Selain itu, pada pengolahan limbah cair bir ditemukan bakteri yang dapat mengolah kandungan logam berat secara anaerobik seperti Clostridium ganghwense, Wolinella succinigenes, Sporosarcina dan Alicycliphlus sp, dan Micrococcus luteus (Sinbuathong et al., 2011). 2.7 Mekanisme Pendegradasi Limbah Bir Mikroorganisme dalam biomassa (bakteri dan protozoa) mengkonversi sebagian bahan organik terlarut menjadi produk akhir (air, karbon dioksida), dan sebagian lagi menjadi sel (biomassa) dalam sistem degradasi di lingkungan (Departemen Perindustrian, 2007). Menurut Tjokrokusumo (1999) Reaksi yang terjadi dalam proses degradasi limbah organik adalah: Biomassa Zat Organik + O2 CO2 + H2O +Energi Hal ini sesuai dengan pernyataan Suriawiria (1996) yang menyatakan bahwa senyawa organik di dalam limbah akan didegradasi oleh bakteri dengan mengeluarkan enzim untuk menghidrolisis senyawa organik kompleks (pati, protein, lemak) menjadi senyawa yang lebih sederhana, senyawa-senyawa kompleks tersebut akan diubah menjadi senyawa yang lebih sederhana seperti gula, gliserol, dan asam lemak serta asam-asam amino yang kemudian akan dilanjutkan dengan proses lain secara aerobik. Mikroorganisme akan menggunakan bahan-bahan organik untuk pertumbuhan, perbanyakan, dan sebagian lagi dipecah menjadi CO2 dan H2O. 20 BAB III KERANGKA BERPIKIR, KONSEP, DAN HIPOTESIS PENELITIAN 3.1 Kerangka Berpikir Industri bir mengandung limbah organik yang cukup tinggi sehingga dapat menyebabkan terjadinya pencemaran lingkungan. Pengolahan limbah bir merupakan salah satu upaya penyehatan lingkungan (Olafadehan dan Aribike, 2000). Berbagai upaya telah dipergunakan untuk mengungkapkan pilihan teknologi mana yang terbaik untuk pengolahan limbah, khususnya limbah cair bir. Pengolahan limbah industri dapat dilakukan secara fisik, kimia, dan biologi serta kombinasi dari beberapa metode. Salah satu sistem pengolahan lingkungan yang menarik untuk dikembangkan yaitu secara biologi menggunakan mikroorganisme. Penggunaan mikroorganisme untuk mengatasi pencemaran lingkungan dipakai sebagai salah satu alternatif karena bersifat aman, akrab, dan ramah terhadap lingkungan dan manusia. Isolasi bakteri merupakan tahap awal untuk mengambil mikroorganisme yang terdapat di alam dan menumbuhkannya dalam suatu medium buatan (Waluyo, 2004). Berdasarkan latar belakang tersebut di atas, maka dilakukan penelitian mengenai penggunaan konsorsium mikroba terhadap penurunan kualitas limbah cair bir berdasarkan parameter pencemar (BOD, COD, dan TSS) sehingga akhirnya limbah yang akan dibuang dapat digunakan kembali karena bersifat aman dan ramah lingkungan. 17 18 3.2 Konsep Penelitian Konsep dari penelitian ini adalah menemukan isolat bakteri culturable yang berpotensial sehingga dapat digunakan kembali secara konsorsium untuk mengolah kandungan bahan pencemar pada limbah cair bir. Berdasarkan kajian pustaka yang telah dikemukakan sebelumnya, konsep penelitian disajikan dalam bentuk bagan seperti terlihat pada gambar berikut: Limbah bir mengandung bahan-bahan organik dan alkohol Pencemaran lingkungan Metode pengolahan limbah bir metode secara fisika metode secara biologi metode secara kimia Kombinasi beberapa metode Pengolahan limbah cair secara biologi dengan bantuan mikroorganisme Isolasi mikroba Seleksi Isolat mikroba yang memiliki potensial menurunkan kandungan bahan organik pada limbah cair bir Identifikasi mikroba Penurunan parameter pencemar : BOD, TSS, COD, pH, dan Suhu Isolat yang terpilih diuji kembali secara kombinasi konsorsium Kombinasi konsorsium terbaik menguraikan limbah cair bir dan kualitas buangan limbah cair yang aman dan ramah untuk lingkungan Gambar 3.1 Bagan Konsep Penelitian 19 3.3 Hipotesis Penelitian Hipotesis yang diajukan dalam penelitian ini adalah: 1. Terdapat beberapa isolat bakteri culturable yang mempunyai kemampuan dalam menurunkan indikator COD, BOD, dan TSS. 2. Konsorsium mikroba dapat meningkatkan efektifitas dalam menurunkan indikator BOD, COD, dan TSS limbah cair bir. BAB IV METODOLOGI PENELITIAN 4.1 Rancangan Penelitian Rancangan penelitian yang akan digunakan dalam penelitian ini adalah: PENGAMBILAN SAMPEL 1. 2. PERLAKUAN SAMPEL Isolasi bakteri pada tanah yang tercemari limbah cair bir disekitar pabrik bir Sampling Limbah Cair bir Output: Jenis-jenis bakteri lokal yang berasal dari limbah bir Uji kemampuan masing – masing isolat dari tiap titik sampling terhadap penurunan parameter pencemar (COD, BOD, TSS). Isolat – isolat terbaik dipilih dan diuji kembali kemampuannya secara bersama (konsorsium). Output : Jenis isolat yang efektif menurunkan limbah bir berdasarkan parameter pencemar (COD, BOD dan TSS) PENGAMATAN HASIL PENGUJIAN a. b. c. Suhu dan pH limbah cair Bir Penurunan kandungan bahanbahan pencemar (COD, BOD dan TSS) Karakterisasi dan Identifikasi isolat bakteri konsorsium menggunakan kit MicrogenTM GN-ID A+B panel ANALISIS DATA Secara kualitatif yaitu dengan mendeskripsikan hasil karakterisasi dan identifikasi isolat bakteri untuk pengolahan limbah cair bir. Sedangkan secara kuantitatif yaitu dengan menghitung kadar parameter pencemar yang mampu didegradasi oleh isolat bakteri. Data yang diperoleh dibuat dalam bentuk grafik garis menggunakan program Microsoft Excel untuk masing – masing parameter seperti pH, TSS (Total Suspended Solid), COD (Chemical Oxygen Demand), dan BOD (Biological Oxygen Demand) dengan lama waktu perlakuan. Gambar 4.1 Bagan Rancangan Penelitian 20 21 4.2 Lokasi dan Waktu Penelitian Penelitian ini akan dilaksanakan di Laboratorium Mikrobiologi Jurusan Biologi FMIPA UNUD Bukit Jimbaran dan Laboratorium Instalasi Pengolahan Air Limbah (IPAL) Suwung-Bali pada bulan Mei hingga bulan November 2013. 4.3 Ruang Lingkup Penelitian Penelitian ini hanya dibatasi pada pengolahan limbah cair industri bir di PT. Storm Beer dengan menggunakan konsorsium mikroba lokal. Kualitas hasil air limbah didasarkan pada penurunan parameter BOD, COD, TSS, pH, dan suhu. 4.4 Penentuan Sumber Data Sampel utama pada penelitian ini adalah tanah yang tercemar oleh limbah cair bir disekitar pabrik bir. Sampel ini kemudian diisolasi untuk menemukan isolat bakteri pendegradasi limbah bir dan diuji kemampuannya dalam mengolah limbah bir berdasarkan pemeriksaan paramater pencemar. Setelah diperoleh isolat bakteri terbaik selanjutnya diidentifikasi. Sampel lain yang digunakan adalah sampel air limbah diambil dari bak penampungan air hasil pengolahan air limbah pabrik PT. Storm Beer. 4.5 Variabel Penelitian 4.5.1 Identifikasi dan klasifikasi variabel Variabel yang diamati dalam penelitian ini adalah penggunaan konsorsium mikroba terhadap kualitas limbah cair industri bir melalui pemeriksaan di laboratorium berdasarkan parameter pencemar BOD, COD, TSS, pH, dan suhu. Kedua variabel tersebut diklasifikasikan menjadi variabel bebas atau variabel 22 independent dan variabel bergantung atau dependent. Variabel bebas merupakan variabel yang akan memberikan pengaruh terhadap variabel bergantung. Variabel bebas dalam penelitian ini adalah konsorsium mikroba dari tanah yang telah tercemar limbah bir. Variabel tergantungnya adalah BOD, COD, TSS, pH, suhu limbah cair dan identifikasi mikroba. 4.5.2 Definisi operasional variabel Setelah variabel dalam penelitian ini diidentifikasi dan diklasifikasi maka variabel-variabel tersebut didefinisikan. Adapun definisi operasional variabel tersebut adalah sebagai berikut: 1. Konsorsium mikroba adalah campuran populasi mikroba dalam bentuk komunitas yang mempunyai hubungan kooperatif, komensal, dan mutualistik. Anggota komunitas yang mempunyai hubungan akan berasosiasi, sehingga lebih berhasil mendegradasi jika dibandingkan dengan dikerjakan oleh masing-masing individu (Jadhav et al., 2008). 2. Kualitas limbah cair industri bir adalah pemeriksaan air limbah di laboratorium dengan berbagai metoda analisis baku. 3. COD (chemical oxygen demand) menggambarkan jumlah total oksigen yang dibutuhkan untuk mengoksidasi bahan organik secara kimiawi, baik yang dapat didegradasi secara biologis (biodegradable) mapun yang sukar didegradasi secara biologis (non degradable) menjadi CO2 dan H2O (Boyd, 1998). 23 4. BOD (biochemical oxygen demand) adalah jumlah oksigen yang dibutuhkan oleh mikroorganisme aerobik untuk menguraikan hampir semua zat organik yang terlarut maupun yang tersuspensi di dalam air (Boyd, 1998). 5. TSS (total suspended solid) untuk mengetahui kekuatan pencemaran air limbah domestik, dan juga berguna untuk penentuan efisiensi unit pengolahan air (BAPPEDA, 1995). Metode ini digunakan untuk menentukan residu tersuspensi yang terdapat dalam contoh uji air dan air limbah secara gravimetrik (Lenore et al., 1998). 6. Suhu air limbah untuk mempengaruhi kecepatan reaksi kimia serta tata kehidupan dalam air. Perubahan suhu memperlihatkan aktivitas kimiawi biologis pada benda padat dan gas dalam air. 7. Derajat Keasaman (pH) digunakan untuk mengekpresikan kondisi keasaman (kosentrasi ion hidrogen) air limbah. Skala pH berkisar antara 1-14. Kisaran nilai pH 1-7 termasuk kondisi asam, pH 7-14 termasuk kondisi basa, dan pH 7 adalah kondisi netral (Wardana, 1995). 8. Identifikasi mikroba berguna untuk mempelajari morfologi bakteri secara detail karakter fisik, kimiawi, dan biologis mikroba sehingga dapat diketahui dan dimanfaatkan secara optimal. 4.6 Bahan Penelitian Bahan-bahan yang digunakan untuk penelitian ini adalah: media untuk isolasi bakteri berupa media cair; (NH4)2SO4; KH2PO4; Na2HPO4; MgSO4.7H2O; Fe(NH4)S; CaCl2.2H2O; serta komponen limbah cair bir sebanyak 200 ml, bahan untuk identifikasi bakteri menggunakan uji kit MicrogenTM GN-ID A + B panel, 24 dan media untuk pertumbuhan mikroba yang digunakan berupa NB (nutrient broth) dan NA (nutrient agar). 4.7 Instrumen Penelitian Instrumen penelitian terbagi menjadi dua bagian yaitu: (1) peralatan laboratorium yang diperlukan untuk pengukuran BOD, COD, TSS, peralatan untuk isolasi, dan identifikasi bakteri, (2) peralatan untuk pengukuran di lapangan seperti pH dan temperatur serta peralatan untuk pengambilan sampel di lapangan. 4.8 Prosedur Penelitian 4.8.1 Sampling air limbah Sampling air limbah dilakukan melalui metode Grab yaitu suatu sampel diambil pada waktu tertentu dan mampu mewakili limbah atau badan air secara keseluruhan (Kardono, 2008). Sampel air limbah diambil dari bak penampungan air hasil pengolahan air limbah. Air limbah dimasukkan ke dalam jerigen plastik berukuran ±25 liter yang sebelumnya telah dicuci bersih dan dibilas dengan akuades, kemudian sampel limbah yang telah diambil diidentifikasi warna dan baunya. Selain itu, dianalisis pH dan suhu dari limbah tersebut. 4.8.2 Penyiapan media NA (Nutrient Agar) Untuk membuat 1 liter medium NA Pronadisa, sebanyak 23 gram medium NA instan (Merck) dilarutkan dalam akuades dan volume akhirnya diatur sampai 1 liter. Campuran ini kemudian disterilkan dengan autoklaf pada tekanan 15 lbs dan temperatur 121oC selama 15 menit. Medium yang sudah steril ini selanjutnya disimpan pada suhu 4oC sampai diperlukan. 25 4.8.3 Penyiapan media cair buatan Komposisi media cair terdiri dari: (NH4)2SO4 (1,0 g); KH2PO4 (1,0 g); Na2HPO4 (3,6g); MgSO4.7H2O (1,0 g); Fe(NH4)S (0,01 g); CaCl2.2H2O (1,0 g) yang ditimbang dengan menggunakan timbangan merk OHAUS Galaxy 400; kemudian dilarutkan dalam 1,8 liter akuades. Selanjutnya, sebanyak 200 mL air limbah cair bir yang sudah disterilkan dan ditambahkan pada campuran tersebut (sebagai faktor pembatas) (Barrow dan Feltham, 2003; Sitorus et al., 2005). Campuran dikocok sampai semua campuran homogen kemudian dimasukkan ke dalam Erlenmeyer berukuran 2L. Erlenmeyer kemudian ditutup rapat dengan kapas, dilapisi aluminium foil, dan disterilkan dengan menggunakan autoklaf selama 15 menit dengan tekanan 15 psi dan suhu 121°C. Setelah disterilkan, media didiamkan pada suhu 37°C selama 5 menit dan selanjutnya media dapat disimpan dalam refrigerator sampai saat diperlukan (Waluyo, 2004). 4.8.4 Isolasi bakteri Isolat bakteri diambil dari sampel tanah yang tercemar oleh limbah cair bir di sekitar lokasi pabrik bir. Diambil tanah +30 g berdasarkan tiga titik sampling dengan kriteria tanah yang berbeda-beda. Tiap titik sampling diambil bagian atas, tengah dan untuk bagian bawah pada kedalaman +20 cm dari permukaan tanah sehingga total sampel sebanyak 9 sampel kemudian sampel dicomposit. Isolasi bakteri dilakukan dengan menggunakan metode pengenceran dan pour plate. Tanah ditimbang sebanyak 10 g dan dimasukkan ke dalam botol yang berisi 90 ml aquadesh steril. Sampel dikocok sampai homogen dan dilakukan pengenceran berseri dari 10-1 sampai 10-6 (Thompson et al., 2005). Setiap seri 26 pengenceran selanjutnya dipipet 1 ml lalu ditambahkan 15 ml media cair buatan dan diinkubasi selama 1 hari pada suhu 37oC (Sitorus et al., 2005). Bakteri yang tumbuh dari masing-masing sampel setelah diinkubasi selama 1 hari kemudian diseleksi lebih lanjut dengan menumbuhkan kembali secara bertahap dengan metode pour plate pada media NA (nutrient agar), diinkubasi pada suhu 37oC selama 48 jam. Selanjutnya dilakukan pemurnian koloni dengan metode gores kuadran hingga diperoleh koloni tunggal/terpisah. Koloni tunggal yang telah diperoleh diremajakan pada media agar miring dan diberi kode sesuai asal sumber sampel agar tidak tertukar dengan yang lain. Pada tahap pengujian masing-masing koloni bakteri tersebut diinokulasikan kembali dalam media NA dan diperbanyak pada 250 ml media NB (nutrient broth), diinkubasikan pada suhu 37oC selama 48 jam. Setelah tumbuh dapat digunakan sebagai kultur untuk diuji kemampuannya dalam menurunkan parameter pencemar limbah (BOD, TSS, dan COD) dan sebagian lagi disimpan dalam larutan gliserol 40% (v/v) pada suhu -20oC (Khehra dan Chimni., 2006). 4.8.5 Pengukuran pertumbuhan sel bakteri Isolat-isolat bakteri yang diperoleh dari hasil isolasi kemudian dibiakkan dalam media NB (nutrient broth) dan diinkubasi di rotary shaker pada suhu ruang selama 4 x 24 jam. Selama masa inkubasi pertumbuhan sel diukur dengan menggunakan spektrofotometer UV-VIS berdasarkan kerapatan optik pada panjang gelombang 660 nm setiap 24 jam sekali. Hasil pengukuran pertumbuhan selanjutnya digunakan untuk membuat kurva pertumbuhan (Waluyo, 2004). 27 4.8.6 Seleksi isolat bakteri berdasarkan uji kemampuannya dalam merombak limbah cair bir dengan parameter BOD, COD, dan TSS Seleksi isolat bakteri potensial dilakukan berdasarkan uji parameter pencemar (COD, BOD, dan TSS) dengan tahap awal mengukur kekeruhan dari kultur inokulum bakteri (optical density, OD) menggunakan spektrofotometer. Isolat-isolat bakteri yang diperoleh dari hasil isolasi dan sudah dibiakkan selanjutnya disentrifugasi dengan kecepatan 3500 rpm selama 30 menit dan dicuci dengan NaCl 0,8% sampai bersih, kemudian diatur OD-nya menjadi OD5 dengan cara suspensi sel sebanyak 10 ml diencerkan dengan NaCl 0,8% menjadi 250 ml pada panjang gelombang 660 nm. Selanjutnya, setelah OD masing-masing isolat sudah diatur lalu ditambahkan 750 ml limbah cair bir. Sedangkan bak lainnya hanya ditambahkan limbah cair bir sebanyak 1 L sebagai kontrol, masing-masing bak diaerasi dengan menggunakan aerator dan dianalisis dengan variasi waktu selama 0, 3, 6, 9 dan 12 hari. Setelah diukur parameter pencemar dari kemampuan masing-masing isolat bakteri tersebut, maka akan didapatkan isolat-isolat individu terbaik yang mampu menurunkan kandungan organik dalam waktu cepat dan maksimal. Parameter kualitas limbah cair yang diukur adalah BOD (biochemical oxygen demand), COD (chemical oxygen demand), TSS (total suspended solid) (Bridgewater et al., 2008). Isolat-isolat yang diduga menunjukkan kemampuan mendegradasi limbah cair bir dipilih dan diidentifikasi dengan menggunakan uji kit MicrogenTM GN-ID A+B panel (Seperti dijelaskan pada sub bab 4.8.12). Selanjutnya diuji 28 kembali untuk menyusun kombinasi konsorsium mikroba dalam menurunkan limbah cair bir berdasarkan parameter pencemar. 4.8.7 Pengukuran COD pada limbah Dipipet sebanyak 20 ml larutan sampel air limbah yang telah diproses oleh isolat bakteri ke dalam labu refluk, ditambahkan 0,4 g kristal HgSO4, beberapa buah batu didih dan 20 ml larutan H2SO4 pekat, kemudian diaduk dan didinginkan. Sebanyak 10 ml larutan K2CrO7 0,25 N ditambahkan dan diaduk kembali. Kondensor dipasang pada labu dan keran air pendingin dibuka, lalu ditambahkan larutan asam sulfat-perak sulfat sebanyak 25 ml melalui ujung atas kondensor sambil labu digoyang-goyangkan. Setelah itu, labu refluk dikocok kuat-kuat. Ujung kondensor ditutup dengan gelas piala kecil, campuran dipanaskan selama 2 jam. Setelah 2 jam, pemanas dimatikan dan kondensor dibilas dengan air suling, campuran didinginkan. Setelah campuran dingin, ditambahkan air suling hingga volumenya menjadi ±150 ml dan didinginkan pada suhu kamar. Sebanyak 1-2 tetes indikator ferroin ditambahkan pada larutan, kemudian larutan dititrasi dengan larutan standar Fe(NH4)2(SO4)2.6H2O 0,1 N sehingga warna berubah dari biru kehijauan menjadi coklat kemerahan. Volume titran yang diperlukan dicatat. Prosedur di atas juga dilakukan untuk pengukuran blanko. Perhitungan COD: 29 Keterangan: a = ml Fe(NH4)2(SO4)2 untuk titrasi blanko b = ml Fe(NH4)2(SO4)2 untuk titrasi sampel N = Normalitas larutan Fe(NH4)2(SO4)2 fp = faktor pengenceran Setelah didapat angka awal dan akhir, kemudian dihitung kemampuan isolat dalam melarutkan COD, serta dihitung keefektifannya (Lenore et al., 1998; Devolli et al., 2010). 4.8.8 Pengukuran kadar BOD pada limbah Diambil sebanyak 100 ml sampel air limbah yang telah diproses oleh isolat bakteri, diencerkan di beaker glass dengan air suling sehingga volumenya menjadi 300 ml. Sampel dibagi menjadi 2 botol winkler dan masing-masing botol winkler diberi nama. Misalnya 150 ml untuk BOD hari ke 0 dan 150 ml untuk BOD hari ke 5. Lalu ditambahkan 1 ml MnSO4 dan 1 ml alkali iodide azida ke dalam botol winkler hari ke 0 dan ke 5, sementara itu botol winkler BOD hari ke 5 dimasukkan ke dalam inkubator lalu diinkubasi selama 5 hari. Botol winkler BOD hari ke 0 ditutup dan dihomogenkan hingga terbentuk gumpalan yang sempurna (gumpalan dibiarkan mengendap 5 menit sampai 10 menit). Lalu ditambahkan 5 ml H2SO4 pekat, ditutup dan dihomogenkan hingga endapan larut sempurna. Diambil 100 ml sampel dengan pipet dan dimasukkan ke dalam erlenmeyer kemudian diteteskan indikator amilum/kanji berwarna biru, selanjutnya sampel dititrasi dengan Na2SO3 sampai warna biru hilang (tidak berwarna) dan dicatat 30 volume Na2SO3 yang terpakai. Untuk pekerjaan botol winkler BOD hari ke 5, selanjutnya nilai BOD diukur dengan cara yang sama. Perhitungan: Nilai BOD5 (mg/l) = × Keterangan: SP0 = oksigen terlarut sampel pada t = 0 SP5 = oksigen terlarut sampel pada t = 5 Blk0 = oksigen terlarut blanko pada t = 0 Blk5 = oksigen terlarut blanko pada t = 5 N = Normalitas larutan Na-Thio P = Faktor pengenceran (1/ Pengenceran) (Saeni dan Darusman, 1998; Devolli et al., 2010). 4.8.9 Pengukuran kadar TSS pada limbah Disiapkan kertas saring lalu diletakkan pada peralatan filtrasi, dipasang vakum dan dicuci dengan air suling 20 ml, selanjutnya dilakukan penyedotan untuk menghilangkan semua sisa air, matikan vakum, dan hentikan pencucian. Jika digunakan cawan Gooch dapat langsung dikeringkan, lalu dikeringkan dalam oven pada suhu 103ºC sampai dengan 105ºC selama 1 jam, dinginkan dalam desikator kemudian ditimbang sebagai berat awal. Diletakkan kertas saring pada peralatan filtrasi, selanjutnya sebanyak 20 ml sampel dimasukkan ke dalam peralatan penyaringan dan ditunggu sampai semua larutan melewati saringan, kertas saring dipindahkan dari peralatan penyaringan ke cawan, selanjutnya 31 dikeringkan dalam oven selama 1 jam dengan suhu 105 oC dan didinginkan dalam desikator kemudian ditimbang sebagai berat akhir. Perhitungan: TSS (mg/l) = Keterangan: A : Massa Cawan, kertas saring dan residu B : Massa Cawan dan kertas saring C : Volume sampel (mL) (Lenore et al., 1998; Devolli et al., 2010). 4.8.10 Pengukuran pH pada limbah cair bir Alat pH meter dikalibrasi dahulu dengan larutan buffer pH 4, 7 dan 10, kemudian dilakukan pengukuran pH air pada sampel limbah cair sebelum pengolahan dan setelah pengolahan yang didegradasi oleh isolat bakteri dengan mencelupkan elektroda ke dalam sampel, kemudian ditunggu beberapa menit. Diangkat dan dicatat suhunya (Saeni dan Darusman, 1998). 4.8.11 Pengukuran suhu pada limbah cair bir Pada pemeriksaan suhu digunakan alat pengukur yaitu termometer laboratorium. Termometer dicelupkan ke dalam sampel limbah cair sebelum pengolahan dan setelah pengolahan yang didegradasi oleh isolat bakteri, ditunggu beberapa menit. Diangkat dan dicatat suhunya (Saeni dan Darusman, 1998). 32 4.8.12 Identifikasi bakteri Isolat bakteri yang memiliki kemampuan terbaik dalam menurunkan limbah pencemar kemudian diidentifikasi untuk mengetahui morfologi bakteri pendegradasi tersebut. Identifikasi yang dilakukan berupa pewarnaan Gram untuk mengetahui sifat suatu bakteri (Pelczar dan Chan, 2005; Gerardi, 2006). Penentuan spesies bakteri dilakukan dengan menggunakan kit MicrogenTM GNID A + B panel. Isolat bakteri dalam media NA berusia 24 jam diambil sebanyak 7 lup kemudian dilarutkan dalam 10 mL larutan NaCl 0,85% steril. Sebanyak 20 µL dipipet ke dalam masing-masing lubang panel kit Microgen. Minyak mineral ditambahkan ke dalam lubang panel tertentu lalu diinkubasi selama 24 jam. Setelah 24 jam, ditambahkan reagen pada lubang panel tertentu sebanyak 20 µL sehingga nantinya akan terjadi perubahan warna. Pembacaan hasil uji dilakukan dengan mencocokkan perubahan warna pada tiap lubang panel uji terhadap colour chart yang tersedia (Hadioetomo, 1993). 4.9 Analisis Data Analisis data dilakukan secara kualitatif dan kuantitatif. Secara kualitatif yaitu dengan mendeskripsikan hasil karakterisasi dan identifikasi isolat bakteri untuk pengolahan limbah cair bir. Sedangkan secara kuantitatif yaitu dengan menghitung kadar parameter pencemar yang mampu didegradasi oleh isolat bakteri (Sarwono, 2009). Data yang diperoleh dibuat dalam bentuk grafik garis menggunakan program Microsoft Excel untuk masing-masing parameter seperti suhu, pH, TSS (total suspended solid), COD (chemical oxygen demand), dan BOD (biological oxygen demand) dengan lama waktu perlakuan dan dilanjutkan 33 dengan analisis secara statistik dengan menggunakan (ANOVA) satu arah dan bila hasilnya berbeda nyata pada p<0,05, maka analisis dilanjutkan dengan uji Tukey. BAB V HASIL PENELITIAN 5.1 Isolasi Bakteri dan Fase Pertumbuhan Sel Bakteri Berdasarkan Nilai Optical Density (OD) Selama Inkubasi Penentuan konsorsium bakteri yang tumbuh dilakukan dengan menggunakan metode seri pengenceran dan ditanam pada media NA (Nutrient Agar) yang sebelumnya sudah diaklimatisasi dengan medium cair buatan sebagai media seleksi. Koloni yang menunjukkan morfologi yang berbeda diambil sebagai isolat. Dari hasil pengamatan di Laboratorium ditemukan 11 koloni bakteri (Tabel 5.1). Tabel 5.1 Karakteristik Morfologi Koloni Bakteri No. Kode Isolat Karakteristik Koloni Bakteri 1. • • • Warna koloni kuning orange transparan Bentuk koloni bulat sedang bergradien Tepi koloni tidak rata/bergelombang NGS1 2. • • • Warna koloni putih Bentuk koloni bulat sedang bergradien Tepi koloni rata NGS2 3. • • • Warna koloni kuning Bentuk koloni bulat sedang bergradien Tepi koloni bergelombang NGS3 4. • • • Warna koloni putih agak kemerahan Bentuk koloni bulat bergradien Tepi koloni bergelombang NGS4 34 Gambar 35 No. Karakteristik Koloni Bakteri Kode Isolat 5. • • • Warna koloni putih agak transparan Bentuk koloni bulat kecil bergradien Tepi koloni tidak rata/bergelombang NGS5 6. • • • Warna koloni kuning Bentuk koloni bulat bergradien Tepi koloni tidak rata/bergelombang NGS6 7. • • • Warna koloni hijau transparan Bentuk koloni bulat sedang Tepi koloni rata NGS7 8. • • • Warna koloni putih Bentuk koloni seperti kapas Tepi koloni bergelombang menyebar NGS8 9. • • • Warna koloni putih Bentuk koloni menyebar Tepi koloni bergelombang menyebar NGS9 10. • • • Warna koloni putih susu Bentuk koloni bulat sedang Tepi koloni rata NGS10 11. • • • Warna koloni putih bening Bentuk koloni bulat sedang Tepi koloni rata NGS11 Gambar 36 Hasil isolasi bakteri dari tanah yang tercemar oleh limbah cair bir dengan menggunakan metode pengenceran berseri dari 10-1 sampai 10-6 ditemukan 11 isolat dengan karakteristik morfologi yang berbeda-beda. Seperti terlihat pada Tabel 5.1, dapat diketahui adanya perbedaan ciri morfologi koloni bakteri yaitu meliputi bentuk, warna, tepi, dan ukuran koloni. Pengukuran massa sel dapat dilakukan dengan mengukur kekeruhan biakan dengan menggunakan spektrofotometer. Penentuan kurva pertumbuhan pada konsorsium bakteri bertujuan untuk mengetahui waktu inokulasi yang tepat pada pengolahan limbah cair bir. Tahap inokulasi dilakukan pada saat mikroba mencapai jumlah optimum. Gambar 5.1 Rerata Kurva Pertumbuhan 11 Isolat Bakteri Selama Inkubasi yang Diukur Menggunakan Spektrofotometer UV-Vis pada panjang gelombang 660nm. K1 adalah rerata pola pertumbuhan 11 isolat bakteri dan K0 adalah kontrol (media tanpa isolat mikroba) Pola pertumbuhan pada Gambar 5.1 memperlihatkan kurva rerata pertumbuhan masing-masing individu mikroba mencapai jumlah optimum setelah 37 diinkubasi selama dua hari. Pada penelitian ini, didapatkan hasil bahwa pada hari kedua pengamatan sudah terlihat adanya fase eksponensial dengan jumlah sebesar 1,4 ± 0,1 (OD unit) (Gambar 5.1). Berdasarkan data tersebut maka inokulasi konsorsium mikroba dilakukan dengan starter inokulum yang berumur 2 (dua) hari. Seperti pada Gambar 5.1, kemungkinan penurunan nilai kurva pertumbuhan setelah hari ke-2 terjadi karena berkuranganya jumlah mikroba dalam media, yang ditunjukkan sebagai fase statis dan dilanjutkan dengan fase kematian yang ditunjukkan pada hari ke-4 selama masa inkubasi. 5.2 Efektivitas Bakteri Terhadap Perubahan Kadar COD, BOD, TSS, pH, dan Suhu Limbah Uji Selama Pengolahan dengan Berbagai Perlakuan Konsorsium Mikroba Dalam penelitian ini dianalisis pengaruh proses pengolahan limbah cair bir oleh mikroba yang telah diisolasi dari tanah tercemar limbah cair bir terhadap perubahan nilai parameter total padatan tersuspensi/total suspended solid (TSS), kebutuhan oksigen biologi/biological oxygen demand (BOD), kebutuhan oksigen kimia/chemical oxygen demand (COD), suhu, dan pH. 5.2.1 Uji potensi 11 isolat bakteri terhadap perubahan kadar COD, BOD, TSS, pH, dan suhu limbah uji selama pengolahan Seperti terlihat pada Gambar 5.2 menunjukkan fluktuasi COD pada pengolahan limbah cair bir yang diinokulasi dengan 11 isolat bakteri selama proses pengolahan (selama 12 hari). Parameter COD dengan perlakuan sebelas isolat serta kontrol mengalami penurunan setelah proses pengolahan. Nilai COD awal pada limbah cair bir yang tercatat adalah 3993,6±445,83 mg/L. Setelah akhir proses pengolahan dengan 11 isolat bakteri ini, nilai COD yang diinokulasikan 38 dengan isolat NGS4, NGS5, dan NGS7 didapatkan penurunan relatif lebih tinggi daripada isolat lainnya yang tercatat berkisar antara 2224,26±853,9 mg/L; 1724,28±864,8 mg/L; dan 2367,45±604 mg/L. Sedangkan, pada kontrol (tanpa perlakuan isolat bakteri) terlihat adanya sedikit penurunan terhadap konsentrasi nilai COD. Secara statistik untuk perlakuan NGS5 menunjukkan nilai signifikan (p<0,05) dibandingkan dengan perlakuan lain termasuk kontrol. Sedangkan pada perlakuan NGS8 dan NGS9 secara statistik menunjukkan nilai signifikan (p<0,05) dibandingkan perlakuan lain. Namun secara rata-rata nilai TSS dengan perlakuan isolat NGS4, NGS5, dan NGS7 lebih rendah dibandingkan dengan perlakuan isolat lain (Lampiran 5). Nilai COD selama 12 hari pengolahan dengan 11 isolat bakteri belum memenuhi nilai baku mutu menurut Kep.Men.Neg.L.H No: KEP-51/MENLH/10/1995 limbah bir sebesar 100 mg/L (Lampiran 1). Gambar 5.2 Perubahan Nilai COD dengan Perlakuan 11 Isolat Bakteri pada Pengolahan Limbah Cair Bir Selama 12 Hari. Setiap nilai merupakan rata-rata dari dua ulangan ± standar deviasi 39 Gambar 5.3 Perubahan Nilai BOD dengan Perlakuan 11 Isolat Bakteri pada Pengolahan Limbah Cair Bir Selama 12 Hari. Setiap nilai merupakan rata-rata dari dua ulangan ± standar deviasi Berdasarkan Gambar 5.3, terlihat bahwa secara umum nilai BOD pada semua perlakuan sampai akhir proses pengolahan mengalami penurunan sama seperti halnya dengan nilai COD (Gambar 5.2). Penambahan biakan isolat NGS5 setelah 12 hari menunjukkan bahwa nilai BOD limbah mengalami penurunan yang paling signifikan dengan nilai awal sebesar 652,2 mg/L menjadi 302,89 mg/L dibandingkan perlakuan isolat lain. Penurunan nilai BOD yang tidak berbeda jauh dengan isolat NGS5 diperlihatkan juga oleh isolat NGS4 dan NGS7 yaitu berkisar antara 317,11±25,1 mg/L dan 350,68±9,4 mg/L (Gambar 5.3). Sedangkan hal yang sama juga terjadi pada kontrol yang mengalami penurunan relatif tinggi dibandingkan dengan perlakuan penambahan isolat NGS8, NGS9, NGS10, dan NGS11, namun nilai kontrol lebih rendah dibandingkan dengan 40 perlakuan isolat NGS1, NGS2, NGS3, NGS4, NGS5, NGS6, dan NGS7. Secara statistik pengaruh perlakuan isolat NGS4 dan NGS5 terhadap konsentrasi BOD mempunyai perbedaan nilai yang signifikan (p<0,05) dibandingkan perlakuan lain (Lampiran 6). Nilai penurunan BOD selama 12 hari pengolahan belum mencapai nilai baku mutu limbah cair bir menurut Kep.Men.Neg.L.H No: KEP51/MENLH/10/1995 sebesar 40 mg/L (Lampiran 1). Gambar 5.4 Perubahan Nilai TSS dengan Perlakuan 11 Isolat Bakteri pada Pengolahan Limbah Cair Bir Selama 12 Hari. Setiap nilai merupakan rata – rata dari dua ulangan ± standar deviasi Pada Gambar 5.4 dapat dilihat nilai total padatan tersuspensi sebelum dan sesudah proses pengolahan selama 12 hari. Pada gambar tersebut, terlihat adanya nilai TSS yang awalnya tinggi mencapai 4258,75 mg/L mengalami penurunan pada masing-masing perlakuan isolat termasuk kontrol. Pada isolat NGS4, NGS5, dan NGS7 secara konsisten diperlihatkan bahwa ketiga isolat tersebut mampu 41 menurunkan nilai parameter pencemar termasuk nilai TSS dibandingkan perlakuan lain yaitu berkisar antara 2493,25±274,5 mg/L; 1722,50±167,9 mg/L, dan 2660,5±421,7 mg/L (Gambar 5.4). Pada kontrol menunjukkan penurunan konsentrasi nilai TSS selama pengolahan, namun nilai penurunan yang dicapai masih tinggi dibandingkan dengan perlakuan yang ditambahkan isolat bakteri. Nilai TSS selama 12 hari pengolahan dengan 11 isolat bakteri belum memenuhi nilai baku mutu menurut Kep.Men.Neg.L.H No: KEP-51/MENLH/10/1995 limbah bir sebesar 40 mg/L (Lampiran 1). Hasil analisis secara statistik menunjukkan bahwa nilai TSS dengan perlakuan NGS5 signifikan (p<0,05) dibandingkan dengan isolat lain, maka analisis dilanjutkan dengan uji Tukey. Serupa halnya perlakuan NGS4 dan NGS7 secara statistik berbeda nyata (p<0,05) dengan perlakuan lain dan kontrol (Lampiran 7). Hasil penelitan menunjukkan fluktuasi nilai pH pada limbah cair bir yang diinokulasi dengan starter yang berbeda (11 jenis isolat) selama proses pengolahan (12 hari). Berdasarkan pada Gambar 5.5, nilai pH dengan perlakuan isolat NGS4 dan NGS5 yang berkisar antara 6,51±0,4 dan 6,59±0,4 telah memenuhi baku mutu air limbah menurut Kep.Men.Neg.L.H No: KEP51/MENLH/10/1995 sebesar 6,0-9,0 (Lampiran 1). Sedangkan nilai pH pada perlakuan isolat lain (kecuali perlakuan isolat NGS4 dan NGS5) dan kontrol diperlihatkan masih terjadi penyimpangan nilai dari baku mutu air limbah. Pada awal proses sampai akhir proses pengolahan, pH semua perlakuan mengalami peningkatan dan secara statistik hasil nilai-nilai ini menunjukkan berbeda nyata 42 pada p<0,05. Hasil analisis statistik menunjukkan bahwa perlakuan dengan NGS4, NGS5, dan kontrol berbeda nyata dengan perlakuan lainnya (Lampiran 8). Gambar 5.5 Perubahan Nilai pH dengan Perlakuan 11 Isolat Bakteri pada Pengolahan Limbah Cair Bir Selama 12 Hari. Setiap nilai merupakan rata-rata dari dua ulangan ± standar deviasi Nilai suhu sebelum pengolahan tanpa perlakuan isolat adalah sebesar 24 oC, setelah pengolahan 12 hari nilai rata-rata suhu tiap perlakuan meningkat menjadi 28,1 oC. Sedangkan kontrol tanpa perlakuan isolat terlihat menunjukkan peningkatan suhu akibat adanya aktivitas bakteri indigenous. Nilai suhu maksimum diperoleh dengan perlakuan isolat NGS4, NGS5, dan NGS7 dibandingkan perlakuan isolat lain dengan nilai berturut-turut berkisar antara 26,97±0,8 oC; 27,82± 1,1 oC, dan 26,74± 1,2 oC (Gambar 5.6). Secara statistik 43 semua nilai temperatur dengan perlakuan isolat NGS5 dan kontrol ini signifikan (p<0,05) dibanding perlakuan lain (Lampiran 9). Gambar 5.6 NGS4 Perubahan Nilai Suhu dengan Perlakuan 11 Isolat Bakteri pada Pengolahan Limbah Cair Bir Selama 12 Hari. Setiap nilai merupakan rata-rata dari dua ulangan ± standar deviasi NGS5 NGS7 Gambar 5.7 Tiga Isolat Bakteri Terbaik dari Hasil Seleksi Berdasarkan Kemampuan Mendegradasi Limbah Cair Bir dengan Parameter Pencemar (BOD, COD, dan TSS) 44 NGS4 NGS5 NGS7 Gambar 5.8 Hasil Pewarnaan Gram isolat NGS4, NGS5, dan NGS7 dengan Mikroskop Cahaya pada Perbesaran 100x10 Seperti terlihat pada Gambar 5.7 dan Gambar 5.8 menunjukkan morfologi 3 isolat bakteri terbaik dari hasil seleksi sebelas isolat bakteri yang diduga mampu mengolah limbah cair secara optimal yaitu isolat dengan kode NGS4, NGS5, dan NGS7. Ketiga isolat tersebut diduga memiliki kemampuan terbaik dalam menurunkan kandungan limbah cair bir berdasarkan parameter pencemar BOD, COD, dan TSS. Tabel. 5.2 Hasil Uji Kit MicrogenTM GN-ID A + B Panel Uji Oksidase Motilitas Nitrat Lisin Ornitin H2S Glukosa Manitol Xilosa ONPG Indol Urease V.P. Sitrat Nama Isolat NGS4 NGS5 NGS7 + + + + + + + + + + + + + + + + + + + + + + Uji NGS4 + TDA Gelatin Malonat Inositol Sorbitol Rhamnosa Sukrosa Laktosa Arabinosa Adonitol Rafinosa Salicin Arginin Nama Isolat NGS5 NGS7 + + + + + + + + + + + + + 45 Berdasarkan hasil uji biokimia dengan menggunakan kit MicrogenTM GN-ID A+B panel didapatkan hasil antara lain: isolat NGS4 teridentifikasi sebagai Cronobacter sp. dengan nilai pendugaan sebesar 84,95%, isolat NGS5 teridentifikasi sebagai Pseudomonas fluorescent dengan nilai pendugaan sebesar 97,32%, dan isolat NGS7 teridentifikasi sebagai Aeromonas sp. dengan nilai pendugaan sebesar 86,43% (Tabel 5.2). Klasifikasi dari isolat NGS4, NGS5, dan NGS7 diperlihatkan pada Tabel 5.3. Tabel. 5.3 Klasifikasi Isolat NGS4, NGS5, dan NGS7 Nama isolat Klasifikasi Filum Kelas Ordo Family Genus Spesies NGS4 Proteobacteria Proteobacteria Enterobacteriales Enterobacteriaceae Cronobacter Cronobacter sp. NGS5 Proteobacteria Proteobacteria Eubakteriales Pseudomobadaceae Pseudomonas Pseudomonas fluorescent NGS7 Proteobacteria Proteobacteria Aeromonadales Aeromonadaceae Aeromonas Aeromonas sp. Sumber: Holt et al. (1994) 5.2.2 Uji potensi konsorsium bakteri terhadap perubahan Kadar COD, BOD, TSS, pH, dan suhu limbah uji selama pengolahan. Penentuan untuk membentuk konsorsium bakteri dilakukan dengan uji kemampuan terhadap 11 isolat bakteri secara individu. Hasil uji kemampuan setiap isolat menunjukkan 3 isolat bakteri diduga mampu mendegradasi limbah cair dengan baik dibandingkan isolat lainnya berdasarkan parameter pencemar BOD, COD, dan TSS. Selanjutnya ketiga isolat tersebut diuji kembali secara konsorsium dengan berbagai kombinasi isolat dan kombinasi campuran untuk 46 mengetahui sinergisme di antara mereka, yaitu isolat NGS4, NGS5, dan NGS7. Kombinasi 1 merupakan gabungan isolat NGS4 dan NGS5, kombinasi 2 merupakan gabungan isolat NGS4 dan NGS7, dan kombinasi 3 merupakan gabungan isolat NGS5 dan NGS7. Kombinasi campuran merupakan gabungan ketiga isolat NGS4, NGS5, dan NGS7. Nilai COD setelah pengolahan pada kombinasi konsorsium mikroba dalam mengolah limbah cair bir selama proses pengolahan 12 hari dapat dilihat pada Gambar 5.9. Gambar 5.9 Perubahan Nilai COD dengan Perlakuan Kombinasi Konsorsium Mikroba pada Pengolahan Limbah Cair Bir Selama 12 Hari. Kombinasi 1: isolat NGS4 dan NGS5, kombinasi 2: isolat NGS4 dan NGS7, kombinasi 3: isolat NGS5 dan NGS7, kombinasi campuran: isolat NGS4, NGS5, dan NGS7; dan kontrol: pengolahan tanpa isolat. Setiap nilai merupakan rata-rata dari dua ulangan ± standar deviasi Seperti terlihat pada Gambar 5.9, secara umum konsentrasi nilai COD mengalami penurunan pada masing-masing kombinasi konsorsium mikroba 47 setelah akhir proses pengolahan dengan rerata nilai awal sebesar 934,56 mg/L menjadi 728,31 mg/L. Setelah akhir proses pengolahan ini, penurunan nilai COD maksimum yang tercatat adalah 633,69±48,18 mg/L, yang dicapai oleh kombinasi campuran. Sementara itu, pada pengolahan yang diinokulasi dengan kombinasi 1, kombinasi 2, kombinasi 3, dan kontrol, penurunan nilai COD nya relatif lebih rendah daripada yang tercatat pada pengolahan yang diinokulasi dengan kombinasi campuran. Pada perlakuan kombinasi 1, kombinasi 2, kombinasi 3, dan kontrol menurunkan rerata nilai COD berturut-turut sebesar 882,64±28,15 mg/L; 859,981±15,62 mg/L; 868,384±29,10 mg/L; dan 886,216±19,69 mg/L. Nilai yang ditunjukkan oleh perlakuan kombinasi campuran ini secara statistik berbeda nyata (p<0,05) dengan perlakuan lainnya termasuk kontrol. Hal ini ditunjukkan pula dengan Gambar 5.9, bahwa secara nyata kombinasi campuran mengalami penurunan yang cukup signifikan dibandingkan perlakuan lain (Lampiran 10). Seperti terlihat pada Tabel 5.4, nilai penurunan yang dicapai oleh semua perlakuan konsorsium mikroba belum mencapai baku mutu limbah cair bir sebesar 100 mg/L. Hal ini serupa dengan persentase terhadap pengolahan dengan perlakuan kombinasi 1, kombinasi 2, kombinasi 3, dan kontrol yang masih rendah dibawah 50%, sedangkan pengolahan dengan perlakuan kombinasi campuran sudah mencapai diatas 50%. Walaupun persentase kombinasi campuran sudah lebih dari 50% namun kadar polutan tersebut masih terdapat penyimpangan dari baku mutu yang telah ditetapkan oleh Keputusan Menteri Lingkungan Hidup Nomor: Kep-51/MENLH/10/1995 tentang baku mutu limbah cair untuk kegiatan 48 industri. Pada perlakuan dengan kombinasi campuran untuk mencapai standar baku mutu limbah yang ditetapkan maka pengolahan harus mencapai penurunan nilai COD sebesar 68,6% Tabel 5.4 Persentase Nilai COD Limbah Setelah Perlakuan Selama 12 Hari Perlakuan Kontrol Kombinasi 1 Kombinasi 2 Kombinasi 3 Kombinasi campuran Nilai awal Nilai akhir 944 920,4 929,84 939,28 939,28 854,32 835,44 802,38 830,72 318,72 COD Persentase Penyimpangan Persentase terhadap BML terhadap pengolahan BML (%)* (%)** 9,5 754,32 88 9,23 735,44 88 13,7 702,38 87,5 11,55 730,72 87,9 66,06 218,72 68,6 BML*** 100 100 100 100 100 Keterangan: * Persentase COD dibandingkan antara nilai awal dan nilai akhir selama pengolahan ** Persentase penyimpangan penurunan nilai COD setelah pengolahan terhadap BML *** Baku mutu limbah (BML) berdasarkan Keputusan Menteri Negara Lingkungan hidup No. KEP-51/MENLH/10/1995 Tanggal 23 Oktober 1995. Berdasarkan pada Gambar 5.10 menunjukkan bahwa secara umum perlakuan dengan konsorsium mikroba mampu menurunkan nilai BOD selama proses pengolahan 12 hari. Pada hari pertama sebelum pengolahan, rerata nilai BOD dari kombinasi konsorsium sebesar 358,15 mg/L, selanjutnya setelah akhir proses mengalami penurunan sebesar 217,97 mg/L. Pada kombinasi campuran mencapai penurunan nilai BOD tertinggi sebesar 199,09±87,82 mg/L. Sedangkan penurunan nilai BOD terendah dicapai pada kombinasi 3 yaitu sebesar 319,24±12,71 mg/L. 49 Gambar 5.10 Perubahan Nilai BOD dengan Perlakuan Kombinasi Konsorsium Mikroba pada Pengolahan Limbah Cair Bir Selama 12 Hari. Kombinasi 1: isolat NGS4 dan NGS5, kombinasi 2: isolat NGS4 dan NGS7, kombinasi 3: isolat NGS5 dan NGS7, kombinasi campuran: isolat NGS4, NGS5, dan NGS7; dan kontrol: pengolahan tanpa isolat. Setiap nilai merupakan rata-rata dari dua ulangan ± standar deviasi Hasil yang dianalisis secara statistik pada perlakuan kombinasi campuran berbeda nyata (p<0,05) dengan perlakuan lain, termasuk kontrol. Sedangkan pada perlakuan kombinasi 3 dan kontrol berbeda nyata (p<0,05) dengan perlakuan lain (Lampiran 11). Secara visual nilai BOD pada Gambar 5.10 menunjukkan nilai penurunan yang berbeda dari tiap-tiap perlakuan, namun dari analisis statistik menunjukkan data yang seragam. Berdasarkan pada Tabel 5.5, nilai akhir yang diperoleh setelah proses pengolahan masih terdapat penyimpangan terhadap baku mutu limbah yang ditetapkan oleh Keputusan Menteri Lingkungan Hidup Nomor: Kep-51/MENLH/10/1995. Pada tabel yang sama, persentase penurunan nilai BOD tertinggi terhadap pengolahan limbah dicapai dengan perlakuan kombinasi 50 campuran sebesar 78,91% dan penurunan nilai BOD terendah dicapai dengan perlakuan kombinasi 1 sebesar 18,71%. Berdasarkan presentase perubahan nilai BOD yang diperoleh pada perlakuan kombinasi campuran terhadap pengolahan limbah lebih efektif karena efektivitas penurunan limbah mencapai diatas 50%. Sedangkan perlakuan kombinasi campuran terhadap baku mutu belum efektif karena tidak memenuhi baku mutu yang telah ditetapkan sehingga perlu penurunan nilai BOD sebesar 50% untuk mencapai standar baku mutu. Tabel 5.5 Persentase Perubahan Nilai BOD Limbah Setelah Perlakuan Selama 12 Hari Perlakuan Kontrol Kombinasi 1 Kombinasi 2 Kombinasi 3 Kombinasi campuran BOD Nilai Nilai Persentase Penyimpangan Persentase awal akhir terhadap BML terhadap pengolahan BML (%)* (%)** 363,52 264,85 27,14 224,85 84,9% 18,71 333,59 271,15 231,15 85,2% 329,31 216,99 34,1 176,99 81,5% 384,91 256,86 33,26 216,86 84,4% 379,45 80 78,91 40 50% BML*** 40 40 40 40 40 Keterangan: * Persentase BOD dibandingkan antara nilai awal dan nilai akhir selama pengolahan ** Persentase penyimpangan penurunan nilai BOD setelah pengolahan terhadap BML ***Baku mutu limbah (BML) berdasarkan Keputusan Menteri Negara Lingkungan hidup No. KEP-51/MENLH/10/1995 Tanggal 23 Oktober 1995. Berdasarkan pada Gambar 5.11 menunjukkan bahwa nilai TSS mengalami penurunan pada perlakuan masing-masing kombinasi konsorsium mikroba. Pada hari pertama sebelum perlakuan rerata nilai TSS berkisar antara 3288,83 mg/L. Setelah itu, mulai hari ke-3 sampai akhir proses, rerata nilai TSS pada semua perlakuan mengalami penurunan sebesar 1100,83 mg/L. Rata-rata nilai TSS yang 51 diperoleh pada kombinasi 1, kombinasi 2, kombinasi 3, kombinasi campuran dan kontrol dengan nilai berturut-turut sebesar 2160±87,68 mg/L; 2531±64,77 mg/L; 2139±38,75 mg/L; 848,9±206,61 dan 3744±189,78 mg/L. Gambar 5.11 Perubahan Nilai TSS dengan Perlakuan Kombinasi Konsorsium Mikroba pada Pengolahan Limbah Cair Bir Selama 12 Hari. Kombinasi 1: isolat NGS4 dan NGS5, kombinasi 2: isolat NGS4 dan NGS7, kombinasi 3: isolat NGS5 dan NGS7, kombinasi campuran: isolat NGS4, NGS5, dan NGS7; dan kontrol: pengolahan tanpa isolat. Setiap nilai merupakan rata-rata dari dua ulangan ± standar deviasi Nilai yang dicapai dari semua perlakuan kombinasi konsorsium mikroba belum memenuhi baku mutu limbah cair bir sebesar 40 mg/L. Pengolahan limbah cair bir dengan perlakuan kombinasi campuran secara konsisten menunjukkan penurunan yang paling signifikan jika dibandingkan dengan perlakuan lain, termasuk kontrol (Tabel 5.6). Secara statistik nilai-nilai ini tidak berbeda nyata pada p>0,05 yang menunjukkan bahwa pola perubahan TSS pada semua 52 perlakuan hampir serupa satu sama lainnya (Lampiran 12). Walaupun secara visual terdapat perbedaan nilai pada TSS untuk semua data. Tabel 5.6 Persentase Perubahan Nilai TSS Limbah Setelah Perlakuan Selama 12 Hari Perlakuan Kontrol Kombinasi 1 Kombinasi 2 Kombinasi 3 Kombinasi campuran Nilai awal 4195 3400 3700 3550 3473 Nilai akhir 3530 675 995 745 330 TSS Persentase Penyimpangan Persentase BML*** (%)* BML (%)** 15,85 3490 98,8% 40 80,14 635 94% 40 73,10 955 95,9% 40 79,01 705 94,6% 40 90,49 290 87,8% 40 Keterangan: * Persentase TSS dibandingkan antara nilai awal dan nilai akhir selama pengolahan ** Persentase penyimpangan penurunan nilai TSS setelah pengolahan terhadap BML ***Baku mutu limbah (BML) berdasarkan Keputusan Menteri Negara Lingkungan hidup No. KEP-51/MENLH/10/1995 Tanggal 23 Oktober 1995. Berdasarkan Tabel 5.6, pengolahan limbah cair bir dengan perlakuan kombinasi campuran menunjukkan presentase efektivitas yang cukup tinggi sebesar 90,49% dibandingkan dengan perlakuan lain dan kontrol. Sementara itu, presentase pengolahan yang diinokulasi dengan kombinasi 1, kombinasi 2, dan kombinasi 3 berturut-turut sebesar 80,14%, 73,10%, dan 79,01%. Presentase pengolahan terendah terjadi pada kontrol sebesar 15,85%. Pengolahan yang efektif ditunjukkan pada perlakuan kombinasi 1, kombinasi 2, kombinasi 3, dan kombinasi campuran berdasarkan persentase efektivitas diatas 50%. Sedangkan efektivitas terhadap baku mutu kemungkinan belum optimum akibat nilai yang dicapai dari semua perlakuan kombinasi konsorsium mikroba masih terdapat penyimpangan baku mutu limbah cair bir sebesar 40 mg/L. Penurunan nilai COD yang harus dicapai untuk memenuhi standar baku mutu yang ditetapkan menurut 53 Menteri Negara Lingkungan hidup No. KEP-51/MENLH/10/1995 dengan perlakuan kombinasi 1, kombinasi 2, kombinasi 3, dan kombinasi campuran berturut-turut sebesar 94%, 95,9%, 94,6%, dan 87,8%. Gambar 5.12 Perubahan Nilai pH dengan Perlakuan Kombinasi Konsorsium Mikroba pada Pengolahan Limbah Cair Bir Selama 12 Hari. Kombinasi 1: isolat NGS4 dan NGS5, kombinasi 2: isolat NGS4 dan NGS7, kombinasi 3: isolat NGS5 dan NGS7, kombinasi campuran: isolat NGS4, NGS5, dan NGS7; dan kontrol: pengolahan tanpa isolat. Setiap nilai merupakan rata-rata dari dua ulangan ± standar deviasi Seperti terlihat pada Gambar 5.12, menunjukkan bahwa secara umum kemampuan masing-masing kombinasi konsorsium mikroba mampu meningkatkan nilai pH secara signifikan selama proses pengolahan limbah cair. Rerata nilai awal pH sebelum perlakuan berkisar antara 5,39 dan setelah akhir proses pengolahan nilai pH menjadi 6,85. Hasil penelitian proses pengolahan limbah bir selama 12 hari menunjukkan bahwa nilai rata-rata pH untuk kombinasi 1 berkisar antara 6,07±0,5, kombinasi 2 berkisar antara 6,30±0,6, kombinasi 3 54 berkisar antara 6,31±0,5, kombinasi campuran berkisar antara 6,85±0,9 dan kontrol berkisar antara 5,48±0,2. Berdasarkan pada Lampiran 13. menunjukkan bahwa hasil uji ANOVA pada perlakuan kombinasi campuran dan kontrol secara statistik berbeda nyata (p>0,05) dengan perlakuan lainnya. Secara konsisten pengolahan yang diinokulasi dengan kombinasi campuran menunjukkan nilai yang paling tinggi jika dibandingkan dengan perlakuan lain dan kontrol. Gambar 5.13 Perubahan Nilai Suhu dengan Perlakuan Kombinasi Konsorsium Mikroba pada Pengolahan Limbah Cair Bir Selama 12 Hari. Kombinasi 1: isolat NGS4 dan NGS5, kombinasi 2: isolat NGS4 dan NGS7, kombinasi 3: isolat NGS5 dan NGS7, kombinasi campuran: isolat NGS4, NGS5, dan NGS7; dan kontrol: pengolahan tanpa isolat. Setiap nilai merupakan rata-rata dari dua ulangan ± standar deviasi Seperti halnya pH (Gambar 5.12), nilai suhu dengan berbagai kombinasi bakteri juga mengalami peningkatan yang cukup signifikan selama 12 hari setelah dilakukan inokulasi dengan rerata nilai awal sebesar 25,23oC dan setelah akhir 55 proses menjadi sebesar 27,02oC. Selama proses pengolahan, suhu maksimum yang tercatat adalah 28,39±1,6oC, yang dicapai oleh perlakuan kombinasi campuran. Sementara itu, pada perlakuan dengan kombinasi 1, 2, 3 dan kontrol, suhunya relatif rendah daripada kombinasi campuran yang ditunjukkan dengan nilai berturut-turut berkisar antara 25,84±0,4oC; 26,26±0,3oC; 25,9±0,7oC; dan 24,72±0,4oC (Gambar 5.13). Hasil uji secara statistik pada kombinasi campuran berbeda nyata (p>0,05) dengan perlakuan lain dan kontrol (Lampiran 14). BAB VI PEMBAHASAN 6.1 Isolasi Bakteri dan Fase Pertumbuhan Sel Bakteri Berdasarkan Nilai Optical Density (OD) Selama Inkubasi Pada penelitian ini, 11 isolat bakteri ditemukan dari tanah yang tercemari limbah cair bir (Tabel 5.1). Kemungkinan bakteri yang tumbuh mampu beradaptasi pada media mineral cair yang ditambahkan limbah cair bir sebagai faktor pembatas. Limbah cair bir yang berasal dari proses produksi bahan baku digunakan sebagai sumber karbon dan glukosa untuk aktivitas sel. Menurut Muslimin (1996) dan Waluyo (2009), bakteri dapat memanfaatkan bahan-bahan organik yang terkandung pada limbah sebagai nutrien yang dibutuhkan untuk tumbuh dan menghasilkan biomassa (Waluyo, 2009). Menurut Pelczar dan Chan (2005), faktor lain yang juga berpengaruh terhadap jumlah dan jenis dari mikroba adalah suhu, cahaya, kekeruhan, pH, serta kesediaan udara. Ditambahkan pula oleh Gosalam (1999), selain faktor lingkungan, kemampuan bakteri tumbuh dalam media merupakan proses perbanyakan sel yang dilakukan dengan pembelahan biner yang sangat dipengaruhi oleh faktor genetika dan faktor abiotik. Jumlah populasi bakteri dapat diperkirakan melalui konversi nilai OD ke dalam persamaan kurva standar yang telah diperoleh. Pada penelitian ini, didapatkan hasil bahwa pada hari kedua pengamatan sudah terlihat adanya fase eksponensial dengan jumlah yang berkisar antara 1,4 ± 0,1 (OD660 unit) (Gambar 5.1). Tahap inokulasi dilakukan pada saat mikroba mencapai jumlah optimum. 56 57 Pertumbuhan kultur bakteri pada hari kedua disebabkan oleh komposisi medium yang kaya dengan nutrisi yang diperlukan untuk proses pertumbuhan mikroba. Berdasarkan data tersebut kultur mikroba yang berumur 2 (dua) hari baik digunakan untuk starter inokulum atau agen oksidator dalam pengolahan limbah secara biologis. Menurut Sumarsih (2003), laju pertumbuhan mikroba sangat dipengaruhi oleh komposisi dan kuantitas penyusun media yang tersedia di dalam media pertumbuhan. Peningkatan yang terjadi terhadap konsentrasi biomassa mikroba erat kaitannya dengan penyediaan nutrisi yang mencukupi untuk pertumbuhan serta kondisi lingkungan yang sesuai akan mendukung proses pertumbuhan mikroba serta aktivitasnya untuk merombak bahan-bahan organik sehingga menjadi terlarut dalam waktu yang relatif pendek. Bakteri harus melewati fase aklimatisasi (proses adaptasi jika ditumbuhkan pada medium atau kondisi baru). Pada penelitian ini, fase adaptasi atau fase lagnya kemungkinan terjadi pada hari pertama masa inkubasi (Gambar 5.1). Mikroorganisme setelah melalui proses aklimatisasi, untuk penambahan zat kedua kalinya (dalam hal ini limbah) tidak akan mengalami proses ini lagi. Menurut Hidayat et al. (2006), selama fase lag, mikroba akan menyesuaikan sistem enzim yang dimiliki agar dapat memanfaatkan komponen media untuk pertumbuhannya. Setelah proses aklimatisasi, sistem enzimnya akan sesuai dengan komponen yang ada dalam substrat sehingga kekuatan mikroorganisme untuk mendegradasi akan lebih cepat. Menurut Atlas dan Bartha (1993), mikroba akan mampu hidup berdasarkan kemampuan bersaing dengan mikroba lainnya dalam memperebutkan nutrisi dan berdasarkan tipe dari nutrisi yang ada pada 58 suatu lokasi, sehingga besar kemungkinan mikroba yang lebih cepat beradaptasi sebab lingkungan serta nutrisi sesuai dengan tempat asalnya. Pada fase log yang dicapai dalam waktu dua hari dalam penelitian ini menunjukkan adanya periode pembiakan yang cepat dan didalamnya dapat teramati ciri khas sel-sel yang aktif. Hal ini menyebabkan konsumsi komponen media dalam kecepatan maksimum, sehingga akan terjadi penurunan konsentrasi media dan penurunan jumlah sel (Gambar 5.1). Menurut Sumarsih (2007), pertumbuhan mikroba mengalami penurunan disebabkan berkurangnya nutrisi dalam medium. Selain itu, selama fase ini beberapa bakteri akan menghasilkan senyawa metabolit dan adanya akumulasi metabolit primer di dalam media tumbuh. Menurut Bitton (2005), penurunan komponen medium yang dikombinasi dengan akumulasi metabolit akan mulai mengganggu laju pertumbuhan mikroba di dalam medium tersebut, sehingga pembiakan bakteri terhenti dan akan memasuki fase stasioner yang diikuti fase kematian. 6.2 Efektivitas Bakteri Terhadap Perubahan Kadar COD, BOD, TSS, pH, dan Suhu Limbah Uji Selama Pengolahan dengan Berbagai Perlakuan Konsorsium Mikroba 6.2.1 Uji potensi 11 isolat bakteri terhadap perubahan kadar COD, BOD, TSS, pH, dan suhu limbah uji selama pengolahan Pengolahan limbah dengan perlakuan 11 isolat bakteri menunjukkan bahwa secara konsisten perlakuan NGS4, NGS5, dan NGS7 mampu mereduksi bahan cemaran organik di dalam limbah cair bir dibanding dengan perlakuan isolat lain dan kontrol (Gambar 5.2-5.4). Pada penelitian ini, kemungkinan ketiga isolat tersebut mampu beradaptasi lebih baik dibanding perlakuan lain. Meskipun 59 secara umum perlakuan lain menunjukkan adanya sedikit penurunan tingkat degradasi. Hal ini disebabkan kemungkinan limbah cair bir yang mengandung bahan organik digunakan oleh mikroba tersebut untuk aktivitas sel sehingga pertumbuhan merupakan implikasi kemampuannya untuk merombak, memineralisasi dan mengasimilasi bahan organik tersebut. Tereduksinya bahan cemaran organik di dalam limbah oleh bakteri pendegradasi dapat diamati melalui indikator parameter kualitas limbah cair yang meliputi penurunan kadar BOD, COD, dan TSS. Hal serupa juga dilaporkan oleh Wignyanto et al. (2009), Paramita et al. (2012), yang menyatakan bahwa limbah yang diberikan perlakuan oleh bakteri mampu menguraikan bahan organik limbah sehingga menyebabkan kecilnya nilai parameter COD, BOD, dan TSS. Hal ini sesuai dengan pernyataan Suriawiria (1996) yang menyatakan bahwa senyawa organik di dalam limbah akan didegradasi oleh bakteri dengan mengeluarkan enzim untuk menghidrolisis senyawa organik kompleks (pati, protein, lemak) menjadi senyawa yang lebih sederhana. Pada penelitian ini, kontrol negatif berupa limbah tanpa penambahan inokulum mikroorganisme karena limbah yang digunakan tidak disterilisasi, sehingga apabila terjadi perubahan nilai parameter pada kontrol negatif, ada kemungkinan disebabkan oleh aktivitas mikroorganisme indigenous dalam limbah tersebut. Hal serupa juga dilaporkan oleh Paramita et al. (2012), yang melakukan analisis limbah organik pasar dengan menggunakan mikroorganisme alami tangki septik. 60 Pada proses pengolahan dengan perlakuan 11 isolat bakteri, setiap perlakuan terjadi peningkatan terhadap pH dan suhu (Gambar 5.5-5.6). Peningkatan nilai pH limbah terjadi karena bakteri mampu menguraikan bahan organik limbah. Menurut Sunu (2001), organisme yang merombak bahan organik limbah akan menyesuaikan diri pada kisaran pH 6,5-8,3. Ditambahkan pula oleh Eweis (1998), menyatakan bahwa pertumbuhan hampir semua mikroorganisme sangat tinggi pada pH antara 6-8. Menurut Utami (2012), suhu mempunyai pengaruh terhadap laju degradasi senyawa organik, laju pertumbuhan mikroba sebagai total jumlah pertumbuhan mikroba dipengaruhi oleh suhu, semakin tinggi suhu maka semakin cepat proses degradasi senyawa organik berlangsung. Ketiga koloni bakteri yang memiliki kemampuan degradasi lebih baik dibanding perlakuan isolat lainnya merupakan bakteri yang bersifat Gram negatif dan memiliki bentuk sel batang. Semua isolat memiliki kemampuan tumbuh optimum pada suhu 35-37 ºC (Gambar 5.7 dan Gambar 5.8). Hal ini menunjukkan bahwa semua isolat merupakan mesofilik. Identifikasi bakteri pendegradasi bahan organik limbah oleh isolat NGS4, NGS5, dan NGS7 berdasarkan pengamatan aktivitas biokimia adalah Cronobacter sp., Pseudomonas fluorescent, dan Aeromonas sp. seperti terlampir pada Tabel 5.2. Menurut Maisyah (2009), adanya aktivitas biokimia atau metabolisme mikroorganisme dapat diketahui kemampuan mikroorganisme untuk menggunakan dan menguraikan molekul yang kompleks seperti karbohidrat, lemak, protein, dan asam nukleat. Seperti yang dilaporkan oleh Salimin dan Rachmadetin (2011), bahwa bakteri Pseudomonas sp. dan Aeromonas sp. dapat menurunkan kadar nitrat dalam limbah cair yang diuraikan 61 menjadi gas nitrogen melalui proses denitrifikasi, yang berlangsung secara paralel dengan degradasi zat organik secara proses biooksidasi yang diberi aerasi dan nutrisi. Ditambahkan pula oleh Paramita et al. (2012), dalam analisisnya didapatkan bahwa bakteri-bakteri patogen yang terdapat dalam feses manusia termasuk dalam familia Enterobacteriaceae, mampu mendegradasi bahan organik sebagai sumber energi. Klasifikasi dari ketiga isolat yang telah diidentifikasi ditunjukkan pada Tabel 5.3. Ketiga koloni bakteri yang ditemukan diduga mempunyai peranan penting dalam mendegradasi limbah cair bir sehingga ditentukan sebagai konsorsium terpilih untuk dianalisis lebih lanjut agar mengetahui sinergisme di antara mereka. 6.2.2 Uji potensi konsorsium bakteri terhadap perubahan kadar COD, BOD, TSS, pH, dan suhu limbah uji selama pengolahan Nilai COD akan berkurang karena oksidasi bahan organik, tetapi nilai COD lebih tinggi dari BOD karena produksi beberapa zat yang sulit didegradasi. Hasil yang ditunjukkan pada Gambar 5.9 mengindikasikan bahwa pada perlakuan dan kontrol terjadi penurunan nilai COD. Hal ini juga didukung dengan efektivitas pengolahan terhadap konsentrasi penurunan nilai COD yang mencapai 66,06% (Tabel 5.4). Menurut Wignyanto et al. (2009), interaksi antara faktor pengaturan kecepatan aerasi dan waktu inkubasi juga berpengaruh nyata pada kualitas effluent limbah yang dihasilkan. Adanya penurunan COD menunjukkan bahwa bakteri pendegradasi mampu menguraikan bahan organik dalam limbah. Nilai COD yang kecil menunjukkan residu zat organik sedikit. Makin kecil nilai COD menunjukkan kualitas limbah cair hasil pengolahan semakin baik. 62 Nilai COD akhir yang dicapai dalam proses pengolahan belum memenuhi standar baku mutu berdasarkan Keputusan Menteri Negara Lingkungan Hidup No. KEP-51/MENLH/10/1995. Hal ini kemungkinan disebabkan kurang lamanya proses aerasi pengolahan serta perlu adanya sistem pengolahan lanjutan agar mencapai baku mutu yang ditetapkan. Hal ini sesuai dengan hasil penelitian Darmayanti (2002), menyatakan bahwa untuk perpanjangan waktu pengolahan akan menghasilkan penyisihan bahan organik yang lebih baik. Proses biodegradasi yang terjadi dalam limbah dapat dilihat dari nilai BOD yang semakin menurun (Gambar 5.10). Menurut Paramita et al. (2012), semakin kecil kadar BOD menunjukkan bahwa jumlah bahan organik dalam limbah sedikit, sebab oksigen yang dibutuhkan juga semakin sedikit. Senyawa organik akan diubah menjadi CO2, H2O, NH4, dan massa bakteri sebagai sumber energi. Didukung pula oleh George et al. (2003) dan Suhendrayatna et al. (2012), bahan organik yang terkandung dalam limbah cair menyediakan substrat untuk metabolisme mikroba aerobik sehingga dapat menyebabkan penurunan konsentrasi BOD. Serupa halnya dengan kadar COD, pada analisis kadar BOD belum memenuhi standar baku mutu yang ditetapkan (Tabel 5.5). Hal ini terjadi karena banyak zat organik yang sulit dioksidasi dan beberapa zat organik dapat menjadi inhibitor terhadap proses pengolahan BOD. Menurut Tchobanoglous et al (2003), zat organik tertentu dapat menjadi racun bagi mikroorganisme yang digunakan dalam tes BOD. Penurunan nilai TSS terlihat selama 12 hari pengolahan dengan berbagai kombinasi konsorsium (Gambar 5.11). Seperti yang dilaporkan Yazid et al. 63 (2012), peningkatan efisiensi reduksi TSS dapat dihubungkan dengan ketersediaan nutrien sebagai bahan makanan bagi bakteri, sehingga aktifitas metabolisme bakteri pun meningkat dan proses degradasi limbah dapat berlangsung lebih baik. Ditambahkan pula oleh Radojevic dan Vladimir (1999) dan Suriawiria (1996), penurunan nilai TSS terjadi karena faktor deposisi partikel dan proses dekomposisi bahan organik dari partikel menjadi endapan oleh mikroba. Senyawa organik di dalam limbah didegradasi oleh bakteri dengan mengeluarkan enzim untuk menghidrolisis senyawa organik kompleks (pati, protein, lemak) menjadi senyawa yang lebih sederhana. Senyawa yang lebih sederhana tersebut digunakan untuk metabolisme bakteri yang kemudian akan dilanjutkan dengan proses lain baik secara aerobik maupun anaerobik sehingga dihasilkan energi, CO2, H2O dan sisa metabolisme yang berupa lumpur yang mudah mengendap, sehingga dengan mekanisme tersebut bahan cemaran organik yang keberadaannya di dalam limbah semakin lama semakin berkurang. Hal serupa juga pernah dilaporkan oleh Paramita et al. (2012), dalam analisisnya pada limbah pasar dikatakan bahwa penurunan kadar TSS terjadi karena bahan organik mengalami degradasi pada saat proses hidrolisis. Selama proses hidrolisis, padatan tersuspensi berkurang karena telah berubah menjadi terlarut. Penurunan COD, BOD dan TSS kemungkinan juga disebabkan adanya aerasi. Menurut Arix (2009), aerasi berfungsi sebagai penyuplai oksigen sehingga mikroba dapat tumbuh dan berkembang biak dengan adanya oksigen dalam air, sehingga cukup untuk mendegradasi bahan organik. 64 Pada kontrol tanpa penambahan inokulum mikroorganisme terjadi sedikit penurunan nilai COD, BOD, dan TSS dibandingkan dengan perlakuan konsorsium mikroba. Hal ini kemungkinan disebabkan air limbah yang digunakan tidak disterilisasi, sehingga apabila terjadi perubahan nilai parameter pada kontrol, ada kemungkinan disebabkan oleh aktivitas mikroorganisme indigenous dalam limbah tersebut. Dilaporkan pula oleh Paramita et al. (2012), dalam analisisnya pada kontrol tanpa penambahan inokulum dalam mengolah limbah organik terhadap penurunan nilai COD, BOD, dan TSS berturut-turut berkisar antara 62,1%, 64,7%, dan 78,8%. Perubahan nilai pH selama 12 hari pengolahan limbah cair bir dapat dilihat pada Gambar 5.12. Menurut Choudhary et al. (2011), konsentrasi ion hidrogen (pH) menunjukkan intensitas karakter asam atau basa pada suhu tertentu. Dilaporkan pula oleh Paramita et al. (2012), perubahan pH dalam air limbah menunjukkan bahwa adanya aktivitas mikroorganisme yang mendegradasi bahan organik. Degradasi protein dan nitrogen organik yang menjadi ammonium (NH4) dapat menaikkan pH menjadi basa. Peningkatan pH terjadi saat proses hidrolisis dimana H+ digunakan untuk mengkatalisis reaksi pemutusan ikatan pada polisakarida, lipid dan protein. Ditambahkan pula oleh Iswanto et al. (2007), setelah proses degradasi bahan organik akan dilanjutkan pada proses asidogenesis dan asetogenesis yang dilakukan oleh berbagai kelompok bakteri. Peningkatan suhu terlihat selama proses pengolahan limbah cair bir dengan penggunaan konsorsium mikroba (Gambar 5.13). Menurut Haslam (1995) dan Singh et al. (2005), peningkatan suhu pada air limbah dapat mempercepat 65 proses laju degradasi senyawa organik, laju pertumbuhan mikroba (total jumlah pertumbuhan mikroba, kecepatan sintesis enzim, dan kecepatan inaktivasi enzim) dan penurunan pada kelarutan gas dalam air seperti O2, CO2, N2 dan CH4. Selain itu, peningkatan suhu pada air limbah dapat disebabkan oleh adanya aerasi. Pada penelitian ini, perlakuan dengan kombinasi campuran lebih efektif daripada kombinasi dari beberapa isolat dan kultur bakteri tunggal dalam mendegradasi kandungan bahan organik bir air limbah. Didukung pula oleh Milic et al. (2009), dalam analisisnya dijelaskan bahwa satu jenis mikroba hanya dapat mendegradasi senyawa jenis tertentu dari suatu limbah tetapi mikroba konsorsium memiliki kemampuan yang lebih tinggi dalam mendegradasi limbah tersebut. Menurut Worm dan Duffy (2003), diversitas dapat meningkatkan stabilitas komunitas karena keberadaan spesies yang lebih beragam mengakibatkan komunitas mampu beradaptasi terhadap kondisi lingkungan yang bervariasi. Ditambahkan pula oleh Atlas dan Bartha (1993), asosiasi sinergis memberikan kemampuan pada kombinasi populasi mikroba untuk melakukan sintesa suatu produk yang tidak bisa dilakukan mikroba tunggal. Menurut Cahyonugroho dan Hidayah (2008) dan Jadhav et al. (2008) air limbah adalah campuran senyawa kompleks, sedangkan setiap jenis bakteri memiliki kemampuan terbatas dalam mendegradasi air limbah. Konsorsium bakteri dapat digunakan sebagai starter yang potensial untuk pemulihan air limbah. Oleh karena itu, kehadiran aktivitas katabolik dari kultur bakteri dapat saling melengkapi dan produk dekomposisi yang dihasilkan dari suatu kultur dapat digunakan oleh kultur lain untuk proses dekomposisi lebih lanjut, sehingga 66 dapat membantu meningkatkan oksidasi air limbah dari bahan organik. Ditambahkan pula oleh Mlynarz dan Ward, (1995) dan De Souza et al. (1998), bakteri dari genera yang berbeda dapat saling bekerja sama dalam suatu lingkungan dan bertahan hidup melalui interaksi metabolit karena biakan campuran mempunyai kemampuan perombakan yang lebih sempurna serta mempunyai toleransi yang lebih tinggi terhadap metabolit yang bersifat toksik. BAB VII SIMPULAN DAN SARAN 7.1 Simpulan Berdasarkan pada hasil penelitian maka dapat disimpulkan bahwa: 1. Mikroba terbaik yang mampu menurunkan parameter pencemar BOD, COD, TSS, pH dan suhu adalah isolat NGS4 teridentifikasi sebagai Cronobacter sp., isolat NGS5 teridentifikasi sebagai Pseudomonas fluorescent, dan isolat NGS7 teridentifikasi sebagai Aeromonas sp. 2. Efektivitas konsorsium mikroba terhadap pengolahan limbah cair bir dengan perlakuan kombinasi 1, kombinasi 2, kombinasi 3 dan kombinasi campuran secara umum sudah efektif yang dinyatakan dengan angka diatas 50%, tetapi belum memenuhi baku mutu yang ditetapkan. 7.2 Saran Berdasarkan hasil penelitian ini dapat disarankan: 1. Perlu dilakukan penelitian lebih lanjut terhadap variabel kecepatan kemampuan masing-masing bakteri, variasi suhu dan variasi pH dalam mereduksi bahan organik. 2. Untuk penelitian selanjutnya, sebaiknya mikroba yang telah diperoleh diujikan kemampuannya terhadap proses pengolahan limbah cair bir dalam skala besar. 67 68 DAFTAR PUSTAKA Arief, M., Sulmartiwi, L., Prayogo, dan Saputri, H. M. 2010. Isolasi Bakteri Indigen Sebagai Pendegradasi Bahan Organik Pada Media Pembenihan Ikan Lele Dumbo (Clarias sp.) Sistem Resirkulasi Tertutup. Jurnal Ilmiah Perikanan dan Kelautan, 1: 2-117. Arixs. 2009. Extended Aeration System Lebih Efektif dan Efisien Tangani Limbah Cair. [Cited 2012 Des 25]. Available from: URL:File://H:/BAHAN%20SKRIPSI/1%202009/mod.php.html. Atlas, R. M. dan Bartha, R. 1993. Microbial Ecology, Fundamentals and Application. 3rd Edition. New York: The Benyamin/Cummings Publishing Company Inc. Atlas, R. M. 1997. Hand Book of Microbiological Media. Second Edition. New York: CRC Press, Inc. BAPPEDA TK. I Jawa Timur. 1995. Panduan Pelatihan Manajemen Laboratorium. Surabaya. Barrow, G.I. dan Feltham, R.K.A. 2003. Cowan and Steel's manual for identification of medical bacteria.3rd edition. edited and rev. Bitton, G. 2005. Waste Water Microbiology. and Sons Inc. 3rd Edition. New Jersey: John Wiley Boyd, C. E. 1998. Water Quality in Ponds for Aquaculture. Agricultural Experiment Station. Alabama: Auburn University. Budiyanto. 2004. Mikrobiologi Terapan. Malang: Universitas Muhammadiyah Malang. Bridgewater, A., Conner, B., dan Slezycki, M. 2008. “Minimization of Environmental Impact of Wachusett Brewing Company Processes” (undergraduate thesis). Worcester: Bachelor of Science Degree in the field of Chemical Engineering Faculty of the Worcester Polytechnic Institute. Cahyonugroho, O. H. dan Hidayah, E. N. 2008. Penyisihan Logam Chrom Menggunakan Konsorsium Mikroorganisme. Teknik Lingkungan, 1(1): 20-29. 69 Choudhary, R., Rawtani, P., dan Vishwakarma, M. 2011. Comparative study of Drinking Water Quality Parameters of three Manmade Reservoirs i.e. Kolar. Kaliasote and Kerwa Dam. Journal of Current World Environment, 6(1):145-149. Dayanti. 2009. Pengertian Limbah dan Teknik Pengolahan Limbah. [Cited 2012 Jun 26]. Available from: URL: http://dewiahdayanti.blogspot.com/2009/05/pengertian-limbah.html. Darmayanti, L. 2002. “Kinetika Pengolahan Air Buangan Rumah Potong Hewan pada Sequenching Batch Reactor Aerob dengan Parameter Rasio Waktu Pengisian terhadap Waktu Reaksi” (tesis). Bandung: Departemen Teknik Lingkungan ITB. Devolli, A., Shabani, A. S., Mali, A. S., dan Hila, N. 2010. Brewery Waste Water Management. Albania: Department of Industrial Chemistry. Faculty of Natural Science. [Cited 2013 Jun 25]. Available from: URL: http://www.pdfio.com/k-1339755.html. Departemen Perindustrian. 2007. Pengolahan Limbah Industri Pangan. Jakarta: Direktorat Jenderal Industri Kecil Menengah. Driessen, W. dan Vereijken, T. 2003. Recent developments in biological treatment of brewery effluent. Zambia: The Institute and Guild of Brewing Convention. [Cited 2012 Jun 26]. Available from: URL:http://www.environmentalexpert.com/Files%5C587%5Carticles%5C 3041%5Cpaques24.pdf. De Souza, M.L., Newcombe, D., Alvey, S., Crowley, D.E., Hay, A., Sadowsky, M.J., dan Wackett, L.P. 1998. Molecular Basis of a Bacterial Consortium: Interspecies Catabolism of Atrazine. Applied and Environmental Microbiology, 64: 178-184. Effendi, H. 2003. Telaah Kualitas Air Bagi Pengolahan Sumber Daya dan Lingkungan Perairan. Yogyakarta: Kanisius. Eweis, J. B. 1998. Bioremidiation Principles. Singapore: Mc Graw-Hill. Fardiaz, S. 2006. Polusi Air dan Udara. Yogyakarta: Kanisius. George, T., Franklin, L. B., dan Stensel, H. D. 2003. Wastewater Engineering: Treatment, Disposal and Reuse. 4th ed., New York: Mc Graw Hill Book Co. Gerardi, M. H. 2006. Wastewater Bacteria. New Jersey: John Willey. 70 Gosalam, S. 1999. “Uji Kemampuan Bakteri dari Ekosistem Mangrove dengan Perlakuan Pemupukan Dalam Mendegradasi Residu Minyak Bumi” (tesis). Bandung: Magister Program Pasca Sarjana ITB. Hadioetomo, R. S. 1993. Mikrobiologi Dasar dalam Praktek: Teknik dan Prosedur Dasar Laboratorium. Jakarta: PT Gramedia Pustaka Utama. Haslam, S. M. 1995. River Pollution, an Ecological Perspective. London UK: Belhaven Press. Hidayat, N., Padaga, M. C., dan Suhartini, S. 2006. Mikrobiologi Industri. Yogyakarta: ANDI. Iswanto, B., Astono, W., dan Sunaryati. 2007. Pengaruh Penguraian sampah terhadap kualitas air ditinjau dari perubahan senyawa organik dan nitrogen dalam reaktor kontinyu skala laboratorium, 4:1-3. Jadhav, S. U., Jadhav, U. U., Dawkar, V. V., dan Govindwar, S. P. 2008. Biodegradation of Disperse Dye Brown 3REL by Microbial Consortium of Galactomyces geotrichum TCC 1360 and Bacillus sp. VUS. Biotechnology and Bioprocess Engineering, 13: 232-239. Kardono. 2008. Persyaratan Laboratorium Lingkungan dan Kondisinya di Indonesia. Teknik Lingkungan, 9 (2): 109-120. Khehra, M. S. dan Chimni, S. S. 2006. Biodegradation of Azo Dye C. I. Acid Red 88 by An Anoxic-Anaerobic Sequential Bioreactor. Dyes and Pigments, 70: 1-7. Klijnhout, A. F. dan van Eerde, P. 1986. Centenary Review Some Characteristic of Brewery Effluent. Journal Institute of Brewing, 92: 426-434. Lenore, S. C., Arnold, E. G., dan Rhodes, T. 1998. Standard Methods for the Examination of Water and Waste Water 5220B. 20th Edition. Washington DC: American Public Health Association, American Water Works Association, Water Environment Federation. Levinson, J. 2002. Malting-brewing: a changing sector. BIOS International 2002, 5 (1): 5-12. Maisyah. 2009. Aktivitas Biokimia Mikroba. [Cited 2012 Jun 26]. Available from: URL: http://rgmaisyah.wordpress.com/2009/05/10/aktivitasbiokimia-mikrooganisme. 71 Milic, J., Beskoski, V., Ilic, M., Ali, S., Gojgic-Cvijovic, G., dan Vrvic, M. 2009. Bioremediation of Soil Heavily Contaminated With Crude Oil and Its Products: Composition of the Microbial Consortium. Journal of the Serbian Chemical Society, 74: 455-460. Mlynarz, T. D. dan Ward, O. P. 1995. Degradation of Polycyclic AromaticHydrocarbons (PAHs) by a Mixed Culture and its Component Pure Cultures, Obtained from PAH-Contaminated Soil. Canadian Journal of Microbiology, 41: 470−476. Muslimin, L. W. 1996. Mikrobiologi Lingkungan. Jakarta: PP-PSL. Olafadehan, O. A. dan Aribike, D. S. 2000. Treatment of Industrial Wastewater Effluent: Adsorption of Organic Compounds on Granular Activated Carbon. Journal Nigerian Society of Chemical Engineers, 19 (1,2): 50-57. Paramita, P., Shovitri, M., dan Kuswytasari, N. D. 2012. Biodegradasi Limbah Organik Pasar dengan Menggunakan Mikroorganisme Alami Tangki Septik. Jurnal Sains dan Seni ITS, 1 (1):23-26. Pelczar, M. J. dan Chan, E. C. S. 2005. Dasar-Dasar Mikrobiologi I. Jakarta: Universitas Indonesia (UI-Press). Perdana, G. 2007. Sistem Pengolahan Lingkungan dan Limbah Industri. Bandung: Yrama Widya. Prakash, B., Veeregowda, B. M., dan Krishnappa, G. 2003. Biofilms: A Survival Strategy of Bacteria [Review]. Current Science, 85 (9): 1299-1307. Radojevics, M. dan Vladimir B. N. 1999. Practical Environmental Analysis. Chambridge: The Royal Society of Chemistry. Rosenwinkel, K. H. dan Seyfried, C. F. 1985. Purification of Brewery Effluent. Hannover: Brauwelt International. Saeni, S. M. dan Darusman. 1998. Kimia Lingkungan. Bogor: Jurusan Kimia FMIPA IPB. Salimin, Z. dan Rachmadetin, J. 2011. Denitrifikasi Limbah Radioaktif Cair yang Mengandung Asam nitrat dengan Proses Biooksidasi. Yogyakarta: Pertemuan dan Presentasi Ilmiah Penelitian Dasar ilmu Pengetahuan dan Teknologi Nuklir. [Cited 2014 Jan 25]. Available from: http://elib.pdii.lipi.go.id/katalog/index.php/searchkatalog/byId/299030. Sarwono. 2009. Pendekatan Kuantitatif dan Kualitatif. [Cited 2012 Jun 26]. Available from: URL: http://jonathansarwono.info/memadu.pdf. 72 Sinbuathong, N., Sirirote, P., Watts, D., dan Chulalaksananukul, S. 2011. Heavy Metal Resistant Anaerobic Bacterial Strains from Brewery Wastewater. Lisbon: Proceedings of The Global Conference On Global Warming. [Cited 2013 Dec 25]. Available from: URL: http://www.cge.uevora.pt/GCGW/presentations/166-50-1-RV.pdf. Singh, R. P. dan Mathur, P. 2005. Investigation of Variations in Physico Chemical Characteristics of Fresh Water Reservoir of Ajmer city. Rajasthan. Indian Journal Enviromental Protection, 9: 57-61. Sunu, P. 2001. Melindungi Lingkungan dengan Menerapkan ISO14001. Jakarta: Grasindo. Sitorus, H., Widigdo, B., Lay, B,. dan Soewardi, K. 2005. Nitrifikasi Dalam Biodegradasi Limbah Tambak. Jurnal Ilmu-ilmu Perairan dan Perikanan Indonesia, 1: 59-67. Smith, P. G. dan Scott. J. G. 2005. Dictionary of Water and Waste Management. Second Edition. Great Britain: IWA Publishing. Suarsini, E. 2007. “Bioremediasi Limbah Cair Rumah Tangga Menggunakan Konsorsia Bakteri Indigen Dalam Menunjang Pembelajaran Masyarakat” (Disertasi). Malang: Program Magister Program Studi Biologi Universitas Negeri Malang. Suharto. 2011. Limbah Kimia Dalam Pencemaran Udara dan Air. Yogyakarta: Andi Offset. Suhendrayatna, Marwan, Andriani, R., Fajriana, Y., dan Elvitriana. 2012. Removal of Municipal Wastewater BOD, COD and TSS by PhytoReduction: A Laboratory-Scale Comparison of Aquatic Plants at Different Species Typha Latifolia and Saccharum Spontaneum. International Journal of Engineering and Innovative Technology (IJEIT), 2(6): 333-337. Sumarsih, S. 2003. Mikrobiologi Dasar. Yogyakarta: Jurusan Ilmu Tanah, Fakultas Pertanian UPN. Sumarsih, S. 2007. Pertumbuhan dan Perhitungan Jumlah Mikroba. Yogyakarta: Jurusan Ilmu Tanah, Fakultas Pertanian UPN. Suriawiria, U. 1996. Mikrobiologi Air. Bandung: Penerbit Alumni. Tchobanoglous, George, dan Franklin, L. B. 2003.WastewaterEngineering Treatment Disposal Reuse. 4th ed. America:McGraw-Hill Book Co. 73 Thompson, I. P., van der Gast, C. J., Ciric, L. dan Singer, A. C. 2005. Bioaugmentation for bioremediation: the challenge of strain selection. Environmental Microbiology, 7 (7): 909-915. Tjokrokusumo. 1999. Pengantar Engineering Lingkungan. Jilid 1. Yogyakarta: Sekolah Tinggi Teknik Lingkungan YLH. Waluyo, L. 2004. Mikrobiologi Umum. Malang: Universitas Muhammadiyah Malang Press. Waluyo, L. 2009. Mikrobiologi Lingkungan. Malang: Universitas Muhammadiyah Malang Press. Wardana, W. A. 1995. Dampak Pencemaran Lingkungan. Yogyakarta: ANDI Offset. Wignyanto, Hidayat, N., dan Ariningrum, A. 2009. Bioremediasi Limbah Cair Sentra Industri Tempe Sanan Serta Perencanaan Unit Pengolahannya (Kajian Pengaturan Kecepatan Aerasi dan Waktu Inkubasi). Jurnal Teknologi Pertanian, 10: 123-135. World Bank. 1997. Industrial Pollution Prevention and Abatement: Breweries. Draft Technical Background Document. Washington, D. C: Environment Department. Worm, B. dan Duffy, J. E. 2003. Biodiversity. Trends in Ecology and Evolution, 18: 628−632. Yazid, F. R., Syafrudin, dan Samudro. G. 2012. Pengaruh Variasi Konsentrasi dan Debit Pada Pengolahan Air Artificial (Campuran Grey Water dan Black Water) Menggunakan Reaktor UASB. Jurnal Presipitasi, 9: 31-40. Yusuf. 2012. Industri Bir. [Cited 2012 Sep 25]. Available http://yusufzae.blogspot.com/2012/06/makalah-bir-proses-industrikimia.html. from: 65