1. Lapisan Rangkap Listrik
advertisement
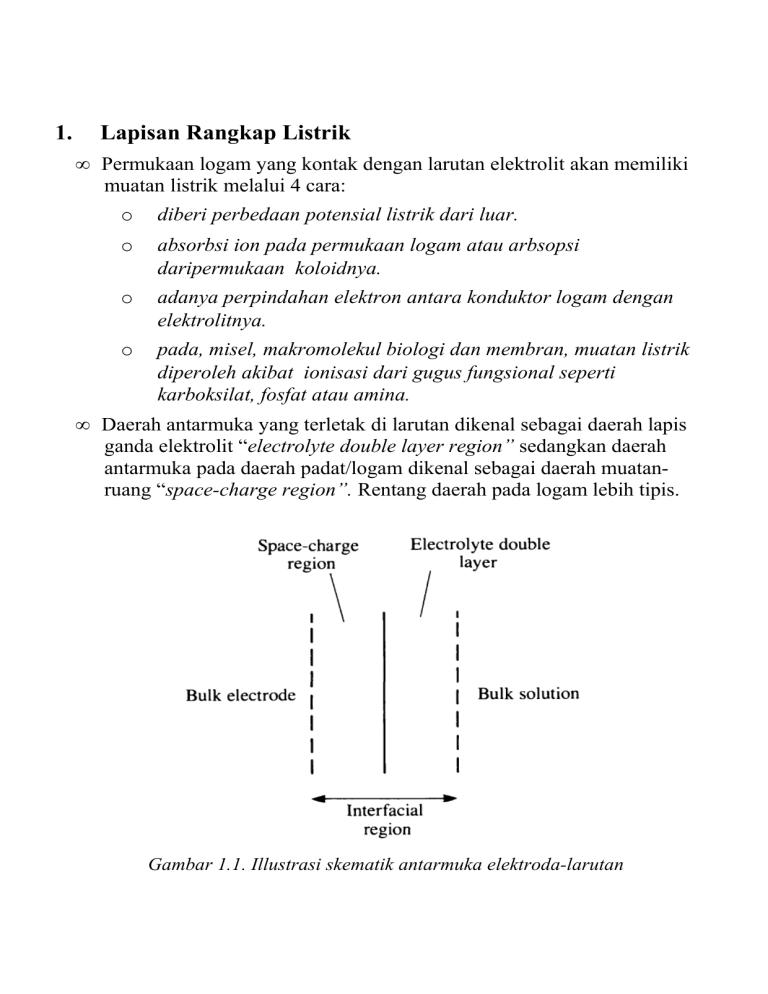
1. Lapisan Rangkap Listrik • Permukaan logam yang kontak dengan larutan elektrolit akan memiliki muatan listrik melalui 4 cara: o diberi perbedaan potensial listrik dari luar. o absorbsi ion pada permukaan logam atau arbsopsi daripermukaan koloidnya. o adanya perpindahan elektron antara konduktor logam dengan elektrolitnya. o pada, misel, makromolekul biologi dan membran, muatan listrik diperoleh akibat ionisasi dari gugus fungsional seperti karboksilat, fosfat atau amina. • Daerah antarmuka yang terletak di larutan dikenal sebagai daerah lapis ganda elektrolit “electrolyte double layer region” sedangkan daerah antarmuka pada daerah padat/logam dikenal sebagai daerah muatanruang “space-charge region”. Rentang daerah pada logam lebih tipis. Gambar 1.1. Illustrasi skematik antarmuka elektroda-larutan 2 3.1 Lapisan Ganda Rangkap Listrik. • Bila permukaan logam yang bermuatan listrik kontak dengan larutan elektrolit, permukaan tersebut akan menarik muatan yang berlawanan dan menolak muatan yang sejenis. • Akan terbentuk lapisan ganda muatan listrik, yaitu lapisan pada ‘permukaan logam’ dan lapisan pada ‘permukaan dekat logam’ yang memiliki muatan yang berbeda. • Beberapa model Lapisan-ganda Rangkap Listrik dikemukakan oleh Helmhotz, Gouy-Chapman, dan Stern. Model Helmhozt, beda potensial antara titik tertentu di LRL dgn fasa ruah adalah linear, semakin jauh dari elektroda semakin kecil hingga mencapai nol. Gouy Chapman, memperhitungkan adanya gerakan termal dari ion-ion. Stren, gabungan dari Helmholzt dan Guy-Chapman; Gambar 1.2. Beberapa model lapis rangkap listrik. 3 Gambar 1.3. Generall representation of the double layer formed at the metal-electrolyte interface. (http://www.springer.com/cda/content/document/cda_downloaddocument/9783540422297c1.pd f?SGWID=0-0-45-93943-p1396491) 3.2 Lapis ganda listrik : Tegangan permukaan, kerapatan muatan dan kapasitas • Daerah antarmuka pada suatu larutan adalah daerah yang memiliki harga potensial listrik, , yang berbeda dibandingkan dengan fasa ruahnya. • Terdapat penataan muatan positif dan negatif dimulai dari permukaan elektroda hingga ke fasa ruah. • Kapasitas lapis ganda adalah kontanta perbandingan antara potensial yang diberikan dengan muatan terhadap spesi dalam daerah antarmuka. Besarnya kapasitas lapis ganda pada berbagai potensial dapat dilakukan dengan teknik impendasi atau pengukuran elektrokapilaritas. Metoda ini diperkenalkan oleh Lippmann. 4 Gambar 1.4. Skematis alat pengukuran tegangan permukaan air raksa dengan metoda Lippmann. Gambar 1.5. Example of the influence of an electric field on a liquid structure. The water flowing from the tap in a bathroom is deviated by the electric field produced by a plastic hair-brush electrostatically 5 charged by friction on a sweater.(http://www.isisulp.org/lbc/Group/www/JC/thesis/node3.html) Gambar 1.6. The electrowetting effect. The contact angle of a conducting drop on an insulated conducting substrate is modulated by an applied voltage. (http://www.isis-ulp.org/lbc/Group/www/JC/thesis/node3.html) • Prinsip utama dalam pengukuran ini adalah kolom kapiler yang diisi dengan air raksa hingga tinggi h di beri beda potensial akan berada pada ketinggian yang sama. Pada kondisi ini tegangan permukaan akan diimbangi dengan gaya gravitasi, sehingga: 2 2 r c cos = r c Hg h g (1.1) dengan r c = jari-jari kapiler; = sudut kontak; = tegangan permukaan; Hg = rapat massa air raksa. • Aluran terhadap E dikenal sebagai kurva elektrokapiler. (Lihat Gambar 1.7.a). • Fluks massa untuk percobaan ini adalah 2 r c Hg h m1 = dengan adalah waktu hidup tetes (drop lifetime). (1.2) • Substitusi persamaan 1.2 ke dalam persamaan 1.1 akan memberikan 2 r c = m1 g t (1.3) • Aluran terhadap E akan memberikan Gambar 1.7.a. Sedangkan konversi menjadi kapasitas diperoleh dengan penurunan ganda terhadap perbedaan potensial, , antara logam/elektroda, M dengan larutan, S . Turunan pertama akan memberikan muatan pada permukaan yang dikenal sebagai persamaan Lippmann ∂ (1.4) =− M = S ∂ 6 dengan M = muatan pada logam (charge on metal) dan S = muatan pada larutan. Dan M S =0 . Gambar 1.7. Aluran skematik pada daerah rangkap. (a) tegangan permukaan vs potensial) (b) kerapatan muatan elektroda vs potensial (c ) kapasitas diferensial terhadap potensial. • Bila diambil potensial pembanding sembarang dan potensial yang berhubungan dengan potensial pembanding tersebut adalah E maka ∂ ~ ∂ E dan ∂ =− M ∂ E (1.5) • Persamaan Lippmann merupakan persamaan differensial dari elektrokapilaritas menunjukkan bahma muatan M bernilai nol saat 7 kemiringan kurva elektrokapilaritas adalah nol. Potensial dititik ini disebut sebagai titik muatan nol, E Z . • Turunan kedua dari kurva elektrokapilaritas akan memberikan nilai kapasitas diferensial, yaitu kapasitas diferensial , C d , dan kapasitas integral C i : Cd = ∂M (1.6) ∂ E • Kapasitas integral diperoleh dari ∂ M Ci = E−E z (1.7) E ∫E C d dE = E ∫E dE z (1.8) z 3.3 Medan Listrik dan Kapasitas listrik (Electric fields and capacitance) • Bila pada dua buah konduktor yang dipisahkan satu sama lain diberikan potensial listrik, maka akan terbentuk suatu medan listrik pada daerah yang memisahkan kedua konduktor tersebut. • Walau “medan listrik” ini sulit untuk dibayangkan adanya. Medan ini sama dengan medan magnet yang sifatnya tidak terlihat namun pengaruhnya dapat dirasakan. • Pada medan listrik terdapat 2 hal yang penting yaitu : Kekuatan medan (field force) dan fluks medan (field flux). • Field Force = kekuatan dari medan pada jarak tertentu. (the amount of “push” that a field exerts over a certain distance) • Field Flux = jumlah total atau pengaruh medan dalam ruang (the total quantity, or effect, of the field through space). • Analogi dengan gaya listrik VOLTAGE (push) dan CURRENT (flow) 8 Gambar 1.8. Medan listrik yang muncul saat 2 buah konduktor diberi suatu potensial. • Secara matematika, akan berlaku hubungan Hukum Ohm untuk kapasitor: dv i=C dt dengan i besarnya arus yang melalui suatu kapasitor; C adalah dv capasitansi dalam Farad; adalah perubahan potensial persatuan dt waktu. • Faktor yang mempengaruhi kapasitansi: Luas Jarak Jenis Material dielektrik 9 • Besarnya kapasitas untuks suatu konduktor mengikuti rumus A C= d dengan C adalah kapasitansi dalam Farad; permisivitas (absolut); A luas permukaan plat dalam m2; d jarak antara plat dalam m. Material Relative permittivity (dielectric constant) ============================================================ Vacuum ------------------------- 1.0000 Air ---------------------------- 1.0006 PTFE, FEP ("Teflon") ----------- 2.0 Polypropylene ------------------ 2.20 to 2.28 ABS resin ---------------------- 2.4 to 3.2 Polystyrene -------------------- 2.45 to 4.0 Waxed paper -------------------- 2.5 Transformer oil ---------------- 2.5 to 4 Hard Rubber -------------------- 2.5 to 4.80 Wood (Oak) --------------------- 3.3 Silicones ---------------------- 3.4 to 4.3 Bakelite ----------------------- 3.5 to 6.0 Quartz, fused ------------------ 3.8 Wood (Maple) ------------------- 4.4 Glass -------------------------- 4.9 to 7.5 Castor oil --------------------- 5.0 Wood (Birch) ------------------- 5.2 Mica, muscovite ---------------- 5.0 to 8.7 Glass-bonded mica -------------- 6.3 to 9.3 Porcelain, Steatite ------------ 6.5 Alumina ------------------------ 8.0 to 10.0 Distilled water ---------------- 80.0 Barium-strontium-titanite ------ 7500 • Kapasitor serial dan parallel 10 Kapasitor dalam disusun secara seri C total = 1 1 1 1 .... c1 c2 c3 Kapasitor disusun secara paralel c total =c 1c 2 c 3... 3.4 Model Helmholtz (1879) • Model ini memodelkan ada keteraturan dalam penataan muatan positif dan negatif pada kedua sisi dari antarmuka elektroda. • Model ini mirip dengan menggambarkan keadaan suatu kapasitor plat paralel dengan permukaan elektroda sebagai salah satu plat dan sisi plat lain terbentuk dari ion-ion yang menempel pada permukaan elektroda. 11 Gambar 1.9. Lapis rangkap listrik yang mirip dengan kapasitor elektrik yang terbentuk dari 2 plat yang berbeda muatan yang dipisahkan dengan jarak tertentu. Model ini mirip dengan model LRL Helmholzt. Gambar 1.10. Model Helmholtz untuk lapis rangkap listrik. (a) penataan ion secara kaku. (b) Variasi potensial elektrostatik sebagai fungsi dari jarak (c) variasi Cd terhadap potensial yang di berikan. • Besarnya harga kapasitas (capacity) adalah C d , H = r 0 (1.9) xH dengan x H merupakan jarak antara titik terdekat dari muatan, dan r adalah permisivitas relatif (relative permittivity) dan 0 = permisivitas vakum (permittivity of vacuum). -2 • Nilai r biasanya adalah 6-7, sehingga C d , H =10 F cm . • Turunnya potensial dari M ke S bersifat linier, dan C d , H bukan merupakan fungsi potensial yang diterapkan pada elektroda 12 • Kekurangan dari model Helmholtz adalah.pada model ini interaksi ionion yang terletak lebih jauh tidak diperhitungkan dan faktor konsentrasi tidak ikut diperhitungkan juga. 3.5 Model Gouy-Chapman (1910-1913). • Model ini dikembangkan secara terpisah oleh Gouy dan Chapman dengan memperhatikan besarnya potensial yang diberikan pada elektroda dan konsentrasi dari larutan. • Pada model ini lapisan rangkap listrik tidak akan kompak/padat seperti pada LRL Helmholtz, tetapi ion bebas bergerak, lapisan ini dikenal sebagai lapis rangkap baur (diffuse double layer). Tebal lapis rangkap ini juga tidak kompak namun mempunyai ketebalan yang bervariasi. Lihat Gambar 1.11.a Gambar 1.11. Lapis rangkap listrik model Gouy-Chapman. (a) Penataan ion pada permukaan berlangsung dengan model difusi. (b) Variasi potensial elektrostatik terhadap jarak.(c) Variasi C d terhadap jarak, 13 • Pada model ini distribusi dari spesi ion terhadap jarak dari permukaan elektroda akan mengikuti hukum distribusi Boltzmann n i=n0i exp [ −z i e kBT ] (1.10) 0 dengan =− S dan n i merupakan konsentrasi numerik dari ion i dalam fasa ruah. Dengan membagi larutan menjadi ketebalan dx maka pada jarak x dari permukaan elektroda kerapatan muatan (charge density) untuk semua ion i adalah : x=∑ ni z i e (1.11) i =∑ n0i z i e exp i [ −z i e kBT ] (1.12) • Persamaan Poisson yang menghubungkan antara potensial dengan distribusi muatan adalah 2 ∂ x x =− (1.13) 2 ∂x r 0 Dengan menggabungkan 1.12 dengan 1.13 maka akan diperoleh persamaan Poisson-Boltzmann 2 −zi e ∂ x e 0 =− n z exp ∑ 2 r 0 i i i kBT ∂x (1.14) • Persamaan ini sama dengan perlakuan interaksi ion pada larutan elektrolit encer yang diberikan oleh Debye-Huckel, dengan x sebagai ion pusat . Pada kasus Debye-Huckel, ion pusat adalah kecil dan bernilai kecil 2 maka akan dapat dibuat pendekatan e /k B T ≪1, dan dengan menggunakan suku pertama dari ekspansi ekponensial. • Untuk suatu elektroda yang memiliki dimensi yang jauh lebih besar dibandingkan ion, pendekatan linear tidak bisa diterapkan. • Untuk menyelesaikan 1.14 maka digunakan sifat dari turunan, 14 2 2 ∂ x 1 ∂ ∂ = 2 2 ∂ ∂ x ∂x (1.15) • Dengan cara ini maka persamaan Poisson-Boltzmann dapat disusun ulang menjadi 2 ∂ ∂x =− −z i c 2e n0i zi exp d ∑ r 0 i k BT (1.16) Integrasi dilakukan dengan menggunakan kondisi batas berikut: x=0 = ,0 (1.17) x ∞ 0 ∂ /∂ x=0 akan diperoleh, 2 ∂ ∂x = 2k B T r 0 [ ∑ n 0i exp i ] −zi e −1 kBT (1.18) Untuk elektrolit z:z ∂ = ∂x 0 1/ 2 8 k T ni r 0 sinh z e 2 kT (1.19) Persamaan 1.19 dapat diintegrasi jika ditulis dalam bentuk ∫ ,0 [ 0 1/ 2 ] d z e sinh 2 kBT 8 k B T ni =− r 0 x ∫0 dx (1.20) ¿ Hasil integrasinya adalah ] [ 0 1/ 2 2kbT tanh z e /4 k B T 8 k B T ni ln =− ze tanh z e ,0 / 4 k B T r 0 x (1.21) Yang dapat disusun ulang menjadi [ ] tanh z e / 4 k B T =exp [−x / x DL ] tanh z e , 0 / 4 k B T dengan x DL adalah jarak karakteristik dari tebal lapis difusi (1.22) 15 x DL= r 0 k B T 0 2 2 ni z e 2 1/ 2 (1.23) -8 -1 -1/2 Untuk air r =78 pada 298 K, x DL=3.04×10 z c cm Besarnya nilai C d diperoleh dari 1.19. Kerapatan muatan (charge density) dari lapisan baur adalah M = r 0 ∂ ∂x x=0 =8 k T r 0 n0i 1/ 2 sinh z e , 0 2 kBT setelah dilakukan dideferensiasi ∂ M C d , GC = ∂ ,0 = 2 2 0 1/2 2 z e r 0 n i kBT cosh z e , 0 2 kBT • Nilai cosh memberikan kenaikkan pada variasi dalam kapasitas dengan bentuk potensial yang terlihat pada Gambar 1.11. Puncak minimum dari kurva di indentifikasi sebagai titik muatan nol, E z dan bentuk kurva akan simetri sekitar E z • Untuk larutan encer pada suhu 2980 K 1 /2 −2 C d , GC = 228 z c∞ cosh 19.5 z ,0 F cm • Model ini lebih baik dibandingkan dengan model kapasitor plat paralel, namun model ini hanya berlaku untuk harga E yang dekat ke E z . Harus diingat bahwa pada permukaan konsentrasi adalah tinggi. 16 3.6 Kelemahan teori Gouy-Chapman. • Ci =exp 0 Ci • −z i F RT ni −z i e , kT ni Bila dikonversi ke satuan molar dan e /k =F / R maka persamaan Boltmann ini menjadi Dari Persamaan 1.11 dapat disusun ulang menjadi 0 =exp (1.12) Pada kasus larutan NaCl 1 M yang mengalami kontak dengan permukaan yang memiliki potensial a=0.1V . Maka berdasarkan persamaan 1.11, konsenstrasi ion klorida pada permukaan (di luar lapisan Helmholtz) akan sebesar 49M !! Kira-kira 30 ion klorida per nanometer kubik. Tolakkan antar ion pada struktur seperti diatas akan jauh lebih besar dari gaya tarik elektrostatik yang ada. Sehingga pada kasus ini pendekatan yang dilakukan tidak tepat, karena saat kita melakukan pendekatan interaksi elektrostatik antar ‘ion di larutan’ – ‘permukaan’ di perhitungkan tetapi interaksi antar ion di larutan di lupakan. Pendekatan yang dilakukan akurat untuk larutan encer namun tidak untuk larutan yang pekat. • Asumsi bahwa kerapatan muatan bersifat fungsi yang kontinu dari jarak ke permukaan adalah tidak 100% pada tingkar makroskopik. Tapi pendekatan ini dibenarkan jika fungsi waktu juga ikut diperhitungkan, yaitu karena adanya gerakkan termal dari ion. • Penggunaan konstanta dielektrik larutan untuk gaya-gaya elektrostatik jarak pendek tidak pas, karena pada jarak pendek momen dipol air terorientasi di sekitar ion atau pada permukaan bermuatan, sehingga sifat-sifat dielektrik di dekat permukaan tentunya berbeda dengan yang di dalam larutan dalam/ruah (bulk). • Pendekatan Gouy-Chapman ini sebaiknya di gunakan untuk mengamati sifat kualitatif atau semi kuantitatif dari sistem lapisan listrik ganda bukan aspek kuantitatifnya. Karena pendekatan kualitatifnya adalah akurat. 17 3.7 Model Stern (1924) • Model Stern menggabungkan model Helmholtz untuk potensial yang memiliki besar yang jauh dari E z dan model Gouy-Chapman untuk nilai potensial yang dekat dengan E z . • Lapis rangkap listrik yang kompak/padat terbentuk oleh lapisan ion pada lapis pertama yang dekat dengan elektroda dan kemudian diikuti dengan lapisan yang baur hingga fasa ruah dari larutan. Gambar 1.13. Model lapis rangkap lisrik menurut Stern. (a) Pengaturan ion yang kompak dan diikuti dengan lapis yang baur. (b) Variasi potensial elektrostatik terhadap jarak dari elektroda. (c ) Variasi C d dengan potensial. • Secara fisik pada potensial yang jauh dari E z elektroda menarik ion-ion dengan kuat sehingga ion tersebut terikat secara kuat, sedangkan pada potensial yang dekat dengan E z ion tersusun secara baur. • Dalam bentuk matematika model ini mirip dengan dua buah kapasitor yang disusun secara seri, sehingga. 18 1 1 1 = Cd c H C GC = xH 1 r 0 2 z 2 e 2 n0 / k T 1/ 2 cosh z e /2 k r 0 i B ,0 bT (1.24) (1.14) • Bidang yang memisahkan antara kedua zone (Helmholtz vs GouyChapman) disebut sebagai Outer Helmholzt Plane (OHP). 3.8 Model Grahame (1947) • Pada model ini ditambahkan faktor adsorpsi spesifik. Gambar 1.15 Gambar 1.15. Model Grahame untuk lapis rangkap listrik (untuk elektroda merkuri). • Adsorpsi spesifik : ion adsorpsi spesifik yang kehilangan solvasinya yang mendekati permukaan elektroda. Ion ini dapat memiliki muatan yang sama maupun berlawanan dari elektroda. 19 3.9 Model Bockris, Devanathan dan Muller (1963) • Pada model ini faktor pelarut yang bersifat polar (dipolar), misal seperti air. Pada pelarut yang bersifat polar ini interaksi antara elektroda dengan dipolnya harus juga ikut diperhitungkan. • Hal ini sangat penting, meningat bahwa konsentrasi pelarut adalah jauh lebih besar dari konsentrasi zat terlarut. Sebagai contoh air murni memiliki konsentrasi 55.5 mol dm-3. Gambar 1.16. Model Lapis Rangkap Listrik Bockris dkk. >>>>>>>>>>>>>>>>>>>>>>>> *********************** 3.10 Adsorpsi Spesifik • Berdasarkan model lapis rangkap listrik Grahame adsorpsi spesifik adalah adsorpsi ion pada permukaan elektroda setelah ion tersebut kehilangan sebagian atau seluruh proses solvasinya. Muatan ion yang teradsorpi dapat sama dengan muatan elektroda namun bisa juga berbeda. • Menurut IUPAC, Solvasi adalah interaksi antara zat terlarut dengan pelarut yang akan meningkatkan kestabilan zat terlarut dalam larutannya. 20 Gambar 1.17. Gambar solvasi ion natrium dalam air. • Adanya adsorpsi spesifik diperlihatkan oleh karakteristik kurva elektrokapilaritas untuk elektroda merkuri dapat berbeda bila elektrolit yang di gunakan berbeda pada konsentrasi yang sama. Gambar 1.18. Kurva elektrokapilaritas untuk merkuri yang kontak dengan berbagai jenis elektrolit. 21 • Dari kurva pada Gambar 1.18 terlihat bahwa untuk Na-Halida dan Khalida perbedaan mulai muncul pada nilai potensial positif untuk E Z , dan ini diduga karena interaksi yang terjadi adalah dengan anionnya. Pengaruhnya bertambah besar bila jari-jari anion bertambah kecil. • Besarnya adsorpsi spesifik juga berkorelasi dengan konsentrasi elektrolit, seperti halnya akan terjadi perubahan pada titik nol muatan yang dikarenakan oleh spesisfik adsorpsi dari muatan. Hal ini dikenal sebagai efek Esin-Markov, yang besarnya adalah; = 1 ∂ E Z RT ∂ ln a = M ∂ E Z ∂ (1.25) M • Turunan ini bernilai nol bila adsorpsi spesifik tidak ada. Untuk adsorpsi anion, dengan rapat muatan yang konstan, titik muatan nol bergeser ke arah negatif sehingga terjadi kesetimbangan kembali akibat adanya adsorpsi. Untuk kation, E Z bergerak ke arah yang positif. Dalam larutan yang encer, adsorsi spesifik hanya terjadi untuk daerah yang dekat pada EZ. • Percobaan menunjukkan bahwa adsorpsi spesifik lebih sering terjadi pada anion dibandingkan pada kation. Hal ini dapat difahami melalui model antarmuka permukaan. Karena kisi logam merupakan kisi kation dalam lautan elektron yang bergerak dengan bebas, sehingga akan lebih menarik anion yang berada dalam larutan. • Besarnya adsorpsi bergantung pada konsentrasi elektrolit. Besarnya area penutupan untuk suatu permukaan oleh adsorpsi spesifik dapat diungkapkan sebagai lapisan monolayer isoterm adsorpsi. Terdapat 3 jenis isoterm adsorpsi yaitu; Isoterm Langmuir. • Dianggap tidak terjadi interaksi antara spesi yang teradsorpsi, permukaan merupakan permukaan yang licin/halus sehingga dapat terjadi kejenuhan pada permukaan. Jika adalah fraksi yang menutupi permukaan maka, = a 1− i i ,∞ 22 Dengan β i adalah koefisien proporsionalisasi dan ai ,∞ adalah aktifitas spesi ke-i pada fasa ruah. Gambar 1.19. Kurva isoterm Langmuir Isoterm Temkin Pada isoterm Temkin energi adsorpsi merupakan fungsi dari area tertutup yang bernilai, RT i= ln i a i ,∞ 2g Dengan i adalah spesi i yang berlebih, dan g adalah parameter interaksi energi antara spesi teradsorpsi yang nilai nya bergantung pada area yang tertutup. 23 Gambar 1.20. Kurva Isoterm Temkin Isoterm Frumkin Interaksi pada isoterm Frumkin mengikuti persamaan; i 2g i i a i ,∞= exp s− i RT Atau i= − i RT i a i ,∞ ' ' ln s i 2g Dengan s adalah “maximum surface excess”. g adalah parameter interaksi, bila bernilai positif maka terjadi gaya atraktif sedangkan = negatif adalah gaya tolakkan. Bila g =0 dan Γ i s Γ θ maka akan diperoleh isoterm Langmuir. Sedangkan isoterm Temkin dapat diperoleh bila Γ i s Γ 0.5= 24 Gambar 1.1. Kurva Isoterm Frumkin. Adsorpsi dapat dipelajari dengan berbagai macam metoda elektrokimia, termasuk didalamnya kinetika dari adsorpsinya. 3.11 Elektroda logam padat • Merkuri tidak bersifat seperti elektroda padat yang umum. Merkuri bersifat cair sehingga atom merkuri selalu bergerak. Lebih-lebih atom yang terletak pada permukaan elektroda yang kontak dengan larutan. • Elektroda logam padat memiliki struktur yang jelas, dapat berupa suatu polikristalin atau monokristalin. Pada elektroda logam padat proses konduktansi merupakan proses elektronik yang utama. Konduktansi terjadi karena terdapat elektron valensi yang dapat bergerak bebas pada daerah yang dikenal sebagai daerah tingkat Fermi, E F . Dengan adanya elektron yang bergerak pada tingkat Fermi ini, maka distribusi elektonik dari atom menjadi meningkat. • Untuk suatu logam, tingkat kehunian dari tingkat elektronik yang dekat pada E F diberikan dalam ungkapan f= 1 E−E f 1exp k BT (1.26) 25 Dengan f merupakan kebolehjadian tingkat kehunian dari tingkat energi E dan k B merupakan konstanta Boltzman, f =0.50 saat E=E F . • Energi Fermi adalah potensial kimia dari elektron pada elektroda logam. Jika E=E F k B T maka f =0.27 dan jika E=E F −k B T maka f =0.73 . • Gambar 1.21 menggambarkan aluran dari persamaan 1.26; dan pada suhu nol kerapatan elektron pada daerah Fermi turun dengan tajam, tapi pada suhu yang lebih tinggi kebolehjadian penempatan ini menjadi lebih baur/kabur. Gambar 1.21. Kerapatan elektron yang menempati daerah fermi pada logam. • Untuk logam hanya elektron dengan energi k B T dari E F dapat berpindah tempat. • Struktur antarmuka dari suatu elektroda logam tergantung pada berbagai faktor. Jarak antar atom sangat bergantung pada bentuk kristalografi dan besarnya energi interaksinya. 26 • Antara kristal pada suatu meteri poli-kristalin tredapat 'patahan' dalam struktur yang memunculkan defek satu dimensi maupun dua dimensi seperti 'screw dislocation'. • Variasi elektrostatik sebagai fungsi jarak ditunjukkan pada Gambar 1.22 dan 1.23 Gambar 1.22. Variasi potensial elektrostatik sebagai fungsi elektroda metalik untuk model klasik. Gambar 1.23. Variasi potensial elektrostatik sebagai fungsi elektroda materi untuk model jellium. 27 Gambar 1.24. Variasi potensial terhadap jarak untuk elektroda logam yang dipisahkan dari larutan elektrolit tanpa memodifikasi muatan. Adalah besarnya potensial saat distribusi muatan relatif terhadap elektroda dan larutan. • Model ini berkorelasi dengan model kimia, dan menggambarkan keadaan bahwa elektron pada elektroda padat akan berpenetasi di daerah yang sempit pada area larutan. Hal ini terjadi karena adanya sifat gelombang dari elekron. • Pada model ini Potensial Galvani atau potensial listrik dalam, , berkaitan dengan E F dan Potensial Volta, potensial listrik luar, , adalah merupakan potensial di luar distribusi elektronik dari elektroda, kira-kira terletah diluar IHP, 10−5 cm dari permukaan. Selisih antar kedua potensial ini dikenal sebagai potensial permukaan, . 3.12 Elektroda semikonduktor. • Pada elektroda semikonduktor, tingkat elektronik yang dapat di gunakan lebih terbatas. Pada semikonduktor terdapat pemisahan antara pita valensi yang terisi dengan pita kondutansi yang kosong. Bila besarnya 28 pemisahan ini lebih dari 3 V. maka benda tersebut dikatakan sebagai isolator. • Promosi elektron dari valensi ke kondukansi akan mengakibatkan timbulnya ‘lubang/hole’ (kekurangan elektron), area yang ini akan bermuatan positif. Lubang/hole ini dapat yang dapat bergerak melalui kristal. Akibatnya konduktansi terjadi karena terdapat pergerakkan elektron pada pita konduktansi dan pergerakkan lubang pada pita valensi. Gambar 1.25. Model pita untuk suatu semikonduktor. Pada model ini pita valensi akan terisi secara penuh oleh elektron dan pita konduktansi akan kosong. Konduktansi terjadi karena adanya elektron yang dipromosikan dari Ev ke Ec . • Promosi elektron pada semikonduktor dari pita valensi ke pita hantaran dapat terjadi akibat eksitasi secara termal atau foton. • Letak tingkat energi Fermi adalah ditengah tengah gap-pita. Besarnya adalah E E c E E−F ~ v =E v g 2 2 29 • Dengan syarat bahwa besarnya E F diperoleh dari probabilitas kehuniannya mencapai 0.5. • Dengan ungkapan dalam energi band gap, E g , dengan mensubsitusi E=E C , dan E g ≫ kT banyaknya elektronyang dapat tereksitasi adalah. n ∝exp Tabel 1.1 −E g 2k b T Bandgap energy, E g , dan panjang gelombang g dari beberapa semikonduktor . • Keadaan elektronik lain yang akan ada pada sebuah permukaan semikonduktor adalah karena teradsorpsinya suatu spesi atau terjadi reorganisasi permukaan. Keadaan ini juga dapat membuat terjadi transfer elektron antara elektroda dengan larutan. • Bila semikonduktor merupakan padatan ionik. Maka konduktansi dapat merupakan konduktansi elektronik atau ionik. Konduktansi ionik terbentuk karena adanya defek pada kristal yang dapat mengalami pergerakkan. Jenis defek yang bersifat sepertin ini adalah Defek Frenkel dan Defek Schotty. 30 • Untuk memudahkan dalam pengamatan, dan karena mayoritas semikonduktor bersifat tidak ionik maka yang diperhatikan adalah faktor konduktor elektronik. • Karena elektron sulit bergerak pada semikonduktor, saat keadaan steady state tercapai, akan tercipta daerah variasi potensial yang terletak pada space charge region. Pada suatu semikonduktor intrinsik (kristal yang murni), hal ini tidak banyak bermanfaat. Gambar 1.26 Daerah space-change region pada suatu semikonduktor. • Lebih umum dipakai semikonduktor yang di kotori (doped), proses doping ini dilakukan secara eksternal. • Pada semikonduktor tipe-n, doping ini dilakukan dengan cara memasukkan atom yang ukurannya sama dengan atom dalam kisinya namun memiliki elektron yang lebih banyak. Misalnya silikon di doping dengan menggunakan fosfor atau arsenik • Dengan cara ini maka atom akan menempati posisi kristal dan akan mensupply elektron yang dapat bergerak melalui kisi kristal. Energi dari 31 elektron ini lebih kecil sedikit dari E c . Konduktansi elektronik dapat dilakukan dengan cara eksitasi termal dari pita yang tidak murni ke pita konduktansi. • Pada semikonduktor tipe-p, maka proses doping dilakukan dengan memasukkan atom yang memiliki defisiensi elektron dibandingkan dengan atom semikonduktornya. Energi atom ini lebih tinggi sedikit dari E v , lubang konduktansi pada pita valensi terjadi akibat promosi elektron dari E v ke pita yg kosong. • Dengan cara doping, sangat mungkin untuk merubah suatu senyawa padat yang bersifat insulator (karena bandgap lebar), menjadi suatu konduktor. Dalam elektrokimia proses doping ini dilakukan dengan cara membuat E F dekat ke E c (tipe-n), atau dekat ke E v (tipe-p) Gambar 1.27. Semikonduktor: (a) tipe-n; (b) tipe-p. Modus konduktansi elektron ditunjukkan oleh arah anak panah. 32 Grafik 1.28 Jenis daerah -space charge region pada semikonduktor tipe-n, tergantung pada potensial yang di kenakan pada potensial pita U fb , U adalah potensial (V) dan E c adalah potensial yang berhubungan E c dekat ke permukaan. sur 33 Gambar 1.29. • Karena daerah space-charge region, hampir semua drop potensial dapat terjadi. Sehingga kapasitasnya dapat dicari, C sc , dan darinya dapat dihitung E fb dengan menggunakan persamaan Mott-Schotty. [ ] k T 2 U −U fb − B e r 0 N D e dengan N D adalah kerapatan dari atom donor. −2 C sc = • Setelah E fb diketahui, dapat dihitung E v dan E c dari persamaan N E v =−E fbk B T ln D semikonduktor tipe p Nv E c =E fbk B T ln ND semikonduktor tipe n Nc








