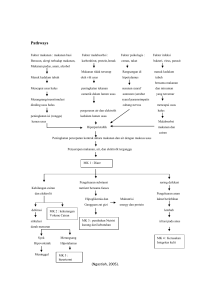
BAB V PENUTUP A. Kesimpulan Dari hasil analisis data dan
advertisement

BAB V PENUTUP A. Kesimpulan Dari hasil analisis data dan pembahasan secara deskriptif dan statistik, maka secara garis besar hasil analisis dapat disimpulkan sebagai berikut: 1. Penerapan Pendekatan Kontekstual (CTL) efektif pada materi Larutan Elektrolit dan Konsep Redoks SMA Negeri 1 Amarasi. Secara terperinci dapat disimpulkan sebagai berikut: a. Kemampuan guru dalam mengelola pelaksanaan kegiatan pembelajaran dengan menerapkan Pendekatan Kontekstual termasuk dalam kategori baik denga skor 3,69 b. Ketuntasan indikator hasil belajar dengan menerapkan pendekatan Kontekstual (CTL) adalah tuntas dan ketuntasannya terdiri dari 3 aspek: 1) Aspek Kognitif Pada indikator aspek kognitif semua siswa dikatakan tuntas karena rata-rata proporsi jawaban yang diperoleh siswa ≥ 70% yaitu sebesar 79%. 2) Aspek Psikomotor Pada indikator aspek psikomotor semua siswa dikatakan tuntas karena ratarata proporsi jawaban yang diperoleh siswa ≥ 70% yaitu sebesar 79,26%. 3) Aspek Afektif Pada indikator aspek afektif semua siswa dikatakan tuntas karena rata-rata proporsi jawaban yang diperoleh siswa ≥ 70% yaitu sebesar 76,8%. c. Ketuntasan hasil belajar siswa dengan menerapkan Pendekatan Kontekstual adalah tuntas dan ketuntasanya terdiri dari 3 aspek: 1) Aspek kognitif Pada aspek kognitif semua siswa dikatakan tuntas belajarnya karena rata-rata proporsi jawaban benar siswa adalah ≥ 70% yaitu sebesar %. 78,99 2) Aspek psikomotor Pada aspek psikomotor semua siswa dikatakan tuntas belajarnya karena ratarata proporsi siswa adalah ≥ 70% yaitu sebesar 77,93%. 3) Aspek afektif Pada aspek afektif semua siswa dikatakan tuntas belajarnya karena rata-rata proporsi jawaban benar siswa adalah ≥ 70% yaitu sebesar 77,47%. d. Motivasi siswa pembelajaran yang menerapkan Pendekatan Kontekstual (CTL) berada pada kriteria interprestasi skor sangat kuat dengan rata-rata 81,88%. Hal ini terlihat dari interprestasi skor motivasi siswa masing-masing siswa yang berada pada kriteria kuat dan sangat kuat. 2. Terdapat hubungan yang signifikan antara Motivasi terhadap hasil belajar siswa dalam penerapan pendekatan kontekstual materi pokok Larutan Elektrolit dan Konsep Redoks SMA Negeri 1 Amarasi 3. Terdapat pengaruh yang signifikan antara Motivasi siswa terhadap hasil belajar dalam dalam penerapan pendekatan kontekstual materi pokok Larutan Elektrolit dan Konsep Redoks SMA Negeri 1 Amarasi .\ B. Saran Berdasarkan kesimpulan dan hasil penelitian dilapangan maka penulis memberikan beberapa saran sebagai berikut: 1. Sebagai guru perlu lebih banyak menguasai strategi serta metode yang tepat yang dapat membangkitkan motivasi siswa sehingga tujuan pembelajaran dapat tercapai. 2. Pendekatan Kontekstual sangat baik dan efektif dalam pembelajaran kimia, karena itu disarankan agar guru mata pelajaran kimia dapat menerapkannya dalam pembelajaran untuk mendapatkan hasil yang baik pada materi pokok lain. 3. Perlu dilakukan penelitian lanjutan dengan menerapkan Pendekatan Kontekstual demi penyempurnaan perangkat pembelajaran yang digunakan dalam kegiatan pembelajaran. 4. Dalam menerapkan suatu Pendekatan atau strategi pembelajaran, guru perlu memperhatikan pengelolaan waktu dalam pelaksanaan pembelajaran sehingga semua aktivitas siswa benar-benar dikembangkan dan terakomodir. 5. Diperlukan waktu yang cukup banyak agar Kontekstual (CTL). dapat menerapkan Pendekatan DAFTAR PUSTAKA Adha, Muhammad Fauzin.2004. “Proses Peningkatan Prestasi Belajar siswa dengan menerapkan Pendekatan Kontekstual dalam Sintaks Model Pembelajaran Kooperatif pada Pokok Bahasan Usaha Siswa Kelas IA Semester II SLTP Adhyaksa Kupang Tahun Ajaran 2003/2004”. Skripsi. Kupang: Unwira BSNP. 2008. Kumplan Materi Pengembangan KTSP Seri Pembelajaran. Departemen Pendidikan Nasional: Jakarta. Daryanto ,dan Muljo Rahardjo ST, M.Pd. 2012. Model Pembelajaran Inovatif. Jogjakarta: Gava Media. Dimyati dan Mudjiono. 2009. Belajar Dan Pembelajaran. Jakarta: Rineka Cipta. Jihad dan Haris. 2008. Evaluasi Pembelajaran. Jogjakarta: Multi Pressindo Jogjakarta. Keban, Maria Leta. 2009.“Upaya Peningkatan Hasil Belajar Siswa SMP Melalui Penerapan Model Pembelajaran Berbasis Masalah pada Materi Pokok Makanan Manusia di SMPK St. Yoseph Naikoten Kupang Tahun Ajaran 2009/2010”. Skripsi. Kupang: Unwira. Kuftalan, B Maria. 2009.“ Efektifitas Penerapan Kontekstual dalam Pembelajaran Kimia Materi Pokok Asam-Basa dan Garam Kelas VII Semester Ganjil SMPK Santo Aloysius Niki-niki Tahun Pelajaran 2008/2009”. Skripsi. Kupang: Unwira, Khamidinal, et al. 2009. Kimia SMA/MA kelas X. Jakarta: Pustaka Insan Madani. Manek, Ivoni Fransiska. 2009.” Penerapan Strategi Motivasi Model ARCS dalam Pendekatan Kontekstual untuk Meningkatkan Kualitas Pembelajaran Materi Pokok Hukum Newton Pada Siswa Kelas VIIA SMPK Sancta Familia Sikumana Tahun Pelajaran 2008/2009 ”. Skripsi. Kupang : Unwira. Purba,Michael. 2006.Kimia untuk SMA kelas X. Jakarta: Erlangga. Sugiyono. 2008. Metode Penelitian Pendidikan. Bandung : Alfabeta Bandung. Suyanti, Retno Dwi. 2010. Strategi Pembelajaran Kimia. Jogjakarta : Graha Ilmu Sutanto, Petrus. 2006.“Penerapan Pendekatan Kontekstual (Contextual Teaching and Learning) dalam Pembelajaran Sains Materi Pokok Bahan Kimia Rumah tangga pada Siswa Kelas VIIA SMPK ‘disamakan’ Sancta Theresia Kupang Tahun Pelajaran 2006/2007”. Skripsi. Kupang : Unwira. Tukan, Maria Yosefina L.2009.“Penerapan Strategi motivasi ARCS dalam Model Pembelajaran langsung materi Pokok Pengukuran pada Siswa Kelas VIIA SMPK St. Yoseph Naikoten Kupang Tahun Pelajaran 2009/2010”. Skripsi. Kupang: Unwira. Thaal, Godilia. 2007. “Penerapan Pendekatan Kontekstual dalam Meningkatkan Prestasi Belajar Siswa Pokok Bahasan Persamaan Kuadrat pada Siswa Kelas IX Semester Genap SMP ‘diakui’ PGRI Kupang Tahun Pelajaran 2007/2008”. Skripsi. Kupang : Unwira. Trianto. 2007. Model-model Pembelajaran Inovatif Berorientasi Kontruktivistik. Surabaya: Prestasi Pustaka. Trianto. 2008. Pembelajaran Kontekstual. Jakarta: Cerdas Pustaka Publisher. Trianto. 2009. Mendesain Model Pembelajaran Inovatif –Progresif. Solo: Kencana Prenade Media Group. Lampiran 01 SILABUS 01 Sekolah Mata Pelajaran Kelas/Semester Alokasi Waktu Standar Kompetensi : 1.Memahami sifat-sifat elektrolit dan nonelektrolit serta reaksi oksidasi-reduksi Indikator Materi Kegiatan Pembelajaran Penilaian Pembelajaran Kompetensi Dasar 1.1. Mengi dentifikasi sifat larutan elektrolit berdasarkan data hasil percobaan : SMA Negeri 1 Amarasi :Kimia :X/II :2 x 45 Menit 1. Mengidentifikasi sifat larutan elektrolit dan nonelektrolit. 2. Membedakan larutan elektrolit dari larutan nonelektrolit 3. Menjelaskan hantaran listrik melalui larutan ataupun lelehan . Larutan elektrolit dan konsep redoks Siswa mengemukakan tentang Larutan elektrolit dan larutan non elektrolit, Siswa dikelompokkan dalam kelompok-kelompok kecil,siswa melakukan praktikum untuk mengetahui daya hantar listrik dari berbagai jenis air dan mempresentasekan di depan kelas dan kelompok lain mendengar dan menanggapi Guru menjelaskan mengenai larutan elektrolit dan non elektrolit serta daya hantar listrik. Kelompok yag berhasil diberikan penghargaan. Format penilaian Psikomotor (LKS) Format penilaian Kognitif (Kuis) Format penilaian Afektif (Keaktifan dalampembel ajaran) Alokasi Waktu Sumber 2x45 menit 1.Buku kimia SMA kelas X (penerbit Grafindo Media Pratama). 2.Buku kimia SMA kelas X (penerbit Erlangga) 3.Buku kimia SMA kelas X (penerbit pustaka Insan Madani ) Amarasi,...... Mei 2014 Mengetahui Kepala Sekolah SMA Negeri 1 Amarasi Drs. NOH RUKU NIP.19631117199303 Peneliti MARIA FEBRIANI HOAR SILABUS 03 Sekolah Mata Pelajaran Kelas/Semester Alokasi Waktu : SMA Negeri 1 Amarasi : Kimia : X/II : 2 x 45 Menit Standar Kompetensi : 1.Memahami sifat-sifat elektrolit dan nonelektrolit serta reaksi oksidasi-reduksi Kompetensi Dasar Indikator 1.1. Mengidentifika si sifat larutan elektrolit berdasarkan data hasil percobaan 1. Menuliskan nama unsur-unsur dalam senyawa sesuai dengan tata nama IUPAC Materi Pembelajaran Reaksi redoks Kegiatan Pembelajaran 2. Menjelaskan proses pengolahan limbah dengan metode lumpur aktif . Penilaian Alokasi Waktu Siswa menentukan nama unsur-unsur Format penilaian 2x45 dalam senyawa sesuai tata nama Kognitif (Kuis) menit IUPAC dan bagaimana cara pengolahan air kotor menjadi air Format penilaian bersih, siswa dikelompokkan dalam Afektif (Keaktifan kelompok-kelompok kecil kemudian dan sikap dalam mendiskusikan soal-soal mengenai pembelajaran) tata nama senyawa Guru menjelaskan tentang tata nama Format penilaian senyawa sesuai aturan IUPAC dan Psikomotor (LKS) proses pengolahan air kotor dengan metoda lumpur aktif. Siwa mempresentasekan hasil diskusinya di depan kelas dan kelompok lain menanggapi. Kelompok yang berhasil akan diberikan penghargaan. Sumber 1.Buku kimia SMA kelas X (penerbit Grafindo Media Pratama). 2.Buku kimia SMA kelas X (penerbitE rlangga) 3.Buku kimia SMA kelas X (penerbit pustaka Insan Madani ) Amarasi,...... Mei 2014 Mengetahui Kepala Sekolah SMA Negeri 1 Amarasi Drs. NOH RUKU NIP.19631117199303 Peneliti MARIA FEBRIANI HOAR SILABUS 02 Sekolah Mata Pelajaran Kelas/Semester Alokasi Waktu : SMA Negeri 1 Amarasi : Kimia : X/II : 2 x 45 Menit Standar Kompetensi : 1.Memahami sifat-sifat elektrolit dan nonelektrolit serta reaksi oksidasi-reduksi Kompetensi Dasar Indikator 1.2. Menjelaskan 1. perkembangan konsep reaksi oksidasi-reduksi dan 2. hubungannya dengan tata nama senyawa serta 3. penerapannya 4. Materi Pembelajaran Menjelaskan Perkembangan perkembangan konsep redoks konsep reaksi oksidasi reduksi. Membedakan dan mendeskripsikan perkembangan konsep redoks Menentukan bilangan oksidasi unsur-unsur dalam senyawa. Menjelaskan hubungan perkembangan konsep redoks dengan tata nama senyawa serta penerapannya dalam kehidupan Kegiatan Pembelajaran Siswa mengemukakan tentang konsep redoks dan perkembangannya serta dapat menentukan bilangan oksidasi unsur-unsur dalam senyawa. Siswa dikelompokkan dalam kelopokkelompok kecil. Siswa melakukan praktikum untuk menbuktikan terjadinya reaksi redoks dalam percobaan dan mempresentasekan didepan kelas kemudian kelompok lain menanggapi. Guru menjelaskan tentang perkembangan reaksi redoks dan bagaimana cara menentukan bilangan oksidasi unsur-unsur dalam senyawa. Guru menjelaskan hubungan perkembangan konsep redoks dengan tata nama senyawa serta penerapannya dalam kehidupan sehari-hari. Kelompok yang berhasil diberikan Penilaian Format penilaian Kognitif (Kuis) Format penilaian Psikomotor (LKS) Format penilaian Afektif (Keaktifan dan sikap dalam pembelajaran) Alokasi Sumber Waktu 2x45 1.Buku kimia menit SMA kelas X (penerbit Grafindo Media Pratama). 2.Buku kimia SMA kelas X (penerbit Erlangga) 3.Buku kimia SMA kelas X (penerbit pustaka Insan Madani) sehari-hari. penghargaan. III Amarasi,...... Mei 2014 Mengetahui Kepala Sekolah SMA Negeri 1 Amarasi Drs. NOH RUKU NIP.19631117199303 Peneliti MARIA FEBRIANI HOAR Lampiran 02 RENCANA PELAKSANAAN PEMBELAJARAN (RPP 01) Sekolah : SMA Negeri 1 Amarasi Mata pelajaran : Kimia Kelas/semester : (X) / II Alokasi waktu : 2x45 Menit I. Standar kompetensi 1. Memahami sifat-sifat elektrolit dan nonelektrolit serta reaksi oksidasi-reduksi II. Kompetensi dasar 1.2. Mengidentifikasi sifat larutan elektrolit berdasarkan data hasil percobaan III. Indikator 1. Mengidentifikasi sifat larutan elektrolit berdasarkan percobaan. 2. Membedakan larutan elektrolit dari larutan nonelektrolit 3. Menjelaskan hantaran listrik melalui larutan ataupun lelehan IV. Tujuan pembelajaran Agar siswa dapat: 1. Mengidentifikasi sifat larutan elektrolit berdasarkan percobaan. 2. Memahami dan menjelaskan perbedaan antara larutan elektrolit dan nonelektrolit 3. Menjelaskan hantaran listrik melalui larutan ataupun lelehan. V. Materi pokok Larutan elektrolit dan konsep redoks VI. Materi pembelajaran Larutan elektrolit dan nonelektrolit VII. Pendekatan pembelajaran Pendekatan kontekstual VIII. Metode pembelajaran Diskusi, pemberian tugas dan kerja kelompok IX. Langkah Pembelajaran Fase-fase CTL Kegiatan Guru 1. Kegiatan Pendahuluan I. Pembelajaran. Kegiatan Siswa Kategori Pendahuluan (15 menit) Menyampaikan TPK Mendengarkan Konstruktivisme pengarahan dari guru. (construktivisme) Memotivasi siswa dengan cara Mendengarkan dan memberikan pertanyaan. menjawab pertanyaan Pernahkah anda melihat orang dari guru yang terkena strom? Mengapa hal tersebut terjadi ? 2. Penyampaian Materi IIKegiatan Inti (60 menit) Pelajaran EEksplorasi larutan 3. Memancing Kinerja Siswa Mendengarkan Pemodelan elektrolit dan nonelektrolit serta penjelasan dari guru (Modeling) aplikasinya dalam kehidupan Mengamati dan sehari-hari, serta meminta memperagakan contoh perwakilan dari siswa untuk dari materi yang memperagakan contohnya di dipelajari dalam depan kelas. kehidupan sehari-hari. Memberikan kesempatan Mengajukan Bertanya kepada siswa untuk bertanya pertanyaan kepada (questioning) tentang konsep yang belum guru tentang materi dipahami yang masih belum dipahami 4. Pemberian Umpan Balik Elaborasi Membagi siswa dalam beberapaB bekerja dalam Masyarakat belajar kelompok, masing-masing (comunitylearning) kelompok dan kelompok berjumlah 4-5 orang mengajukan pertanyaan jika ada kesulitan. Membagikan LKS dan Berdiskusi dalam Inkuiri (inquiri) memberikan kesempatan kepada mengerjakan LKS siswa untuk mengerjakan LKS. sesuai dengan Membimbing kelompok yang kelompoknya masing- mengalami kesulitan dalam masing. mengerjakan LKS. Konfirmasi Meminta kepada perwakilan Masing-masing dari masing-masing kelompok kelompok untuk menjawab LKS. mendelegasikan Memberikan anggotanya untuk penghargaankepada kelompok menjawab LKS di yang medapatkan skor tertinggi. papan tulis Refleksi(reflection) Menjawab LKS di papan tulis. 5. Kegiatan Tindak lanjutIII. Penutup (15 menit) Menyimpulkan materi Mencatat poin-poin Penilaian autentik pembelajaran. penting dari materi (authentic Menginformasikan kepada yang telah dipelajari assessment) siswa bahwa pertemuan berikutnya akan diadakan evaluasi . X. Sumber belajar 1. Buku kimia SMA kelas X (penerbit Grafindo Media Pratama). 2. Buku kimia SMA kelas X ( penerbit Erlangga) 3. Buku kimia SMA kelas X ( penerbit pustaka Insan Madani ) XI. Penilaian 1. Teknik : tes tertulis 2. Instrumen : uraian 3. Contoh instrumen 1. Data hasil pengujian daya hantar listrik beberapa larutan : Larutan Pengamatan NyalaLampu Gelembung Gas 1 Terang Ada 2 Tidakmenyala Tidakada 3 Tidakmenyala Ada 4 Tidakmenyala Tidakada 5 Terang Ada Berdasarkan data tersebut diatas, klasifikasikan larutan elektrolit dan elektrolit. Jelaskan mengapa demikian? 2. Berikut ini hasil pengujian daya hantar berbagai jenis zat. Zat murni Bentuk Menghantar Bromin Cair Tidak Raksa Cair Ya Zink Padat Tidak Zink Cair Ya Air Cair Tidak Asam cuka Cair Tidak Kalium klorida Padat Tidak Kalium klorida Cair Ya Larutan H2SO4 Larutan Ya Larutan Cuka Larutan Ya a. Diantara zat murni yang diuji, golongan zat apakahyang dapat menghantar listrik? b. Diantara zat murni yang diuji, manakah yang tergolong senyawaion dan manakah yang tergolong senyawa kovalen. c. Apakah perbedaan antara elektrolit senyawa ion dengan elektrolit senyawa kovalen. Kunci jawaban 1. Berdasarkan data hasil percobaan diatas dapat dibedakan larutan elektrolit dan larutan nonelektrolit, yaitu yang termasuk larutan elektrolit ditandai dengan lampu menyala dan adanya gelembung gas, pada percobaan tersebut yang termasuk larutan elektrolit adalah larutan dengan nomor 1, 3 dan 5, bahkan lampunya mati akan tetapi terdapat gelembung gas.sedangkan nonelektrolit ditandai dengan lampu tidak menyala dan tidak adanya gelembung gas, pada percobaan tersebut yang termasuk larutan nonelektrolit adalah larutan dengan nomor 2 dan 4. 2. Berdasarkan diatas maka : a. Zat golongan yang dapat menghantarkan listrik adalah golongan zat cair, akan tetapi bukan semua zat cair menghantarkan listrik ,hanya sebagian yang dapat menghantar listrik yaitu zat yang dapat mengikat oksigen apabila dilarutkan dalam air. b. Yang tergolong senyawa ion adalah zat yang dapat menghantarkan listrik sedangkan zat yang merupakan senyawa kovalen yaitu zat-zat yang tidak menghantarkan listrik dan yang dapat menghantarkan listrik dalam bentuk larutan seperti asam sulfat (H2SO4)dan asam cuka (CH3COOH). c. Perbedaan antara keduanya adalah bahwa senyawa elektrolit ion dan elektrolit senyawa kovalen adalah bahwa elektrolit senyawa ion dapat menghantarkan listrik sedangkan elektrolit senyawa kovalen dapat menghantarkan listrik apabila dalam bentuk larutan ataupun dalam bentuk lelehan,akan tetapi tidak semua dapat menghantarkan listrik. Mengetahui Amarasi ,...Mei 2014 Kepala Sekolah SMA Negeri 1 Amarasi Drs. NOH RUKU HOAR NIP. 19631117199303 Peneliti MARIA FEBRIANI Lampiran 02b RENCANA PELAKSANAAN PEMBELAJARAN (RPP02) I. Sekolah :SMA Negeri 1 Amarasi Mata pelajaran :Kimia Kelas/semester :(X) / II Alokasi waktuta :2x45 Menit Standar kompetensi 2. Memahami sifat-sifat elektrolit dan nonelektrolit serta reaksi oksidasi-reduksi II. Kompetensi dasar 1.3. Menjelaskan perkembangan konsep reaksi oksidasi-reduksi dan hubungannya dengan tata nama senyawa serta penerapannya. III. Indikator 1. Membedakan dan mendeskripsikan perkembangan konsep redoks 2. Menentukan bilangan oksidasi unsur-unsur dalam senyawa IV. Tujuan pembelajaran Agar siswa dapat : V. 1. Menjelaskan perkembangan konsep redoks 2. Menentukan bilangan oksidasi unsur-unsur dalam senyawa. Materi pokok Larutan elektrolit dan konsep redoks VI. Materi pembelajaran Reaksi redoks VII. Model pembelajaran Pendekatan kontekstual VIII. Metode pembelajaran Diskusi, kerja kelompok dan pemberian tugas IX. Langkah Pembelajaran Fase-fase CTL 1. Kegiatan Pendahuluan Kegiatan Guru I. Kegiatan Siswa Kategori Pendahuluan (15 menit) Menyampaikan TPK Pembelajaran. Mendengarkan Konstruktivisme pengarahan dari guru (construktivisme) Memotivasi siswa dengan Mendengarkan dan cara memberikan menjawab pertanyaan pertanyaan. Pernahkah dari guru anda melihat rumah, tiang rumah terlihat karat? 2. Penyampaian Materi Pelajaran IIKegiatan Inti (60 menit) E Eksplorasi mengenai Mendengarkan penjelasan Pemodelan konsep redoks dan dari guru (Modeling) bagaimana menentukan Mengamati dan bilangan oksidasi unsur- memperagakan contoh unsur dalam senyawa serta dari materi yang meminta perwakilan dari dipelajari dalam siswa untuk kehidupan sehari-hari. memperagakan contohnya di depan kelas. 3. Memancing Memberikan kesempatan Mengajukan pertanyaan Bertanya Kinerja Siswa 4. Pemberian Umpan Balik kepada siswa untuk kepada guru tentang bertanya tentang konsep materi yang masih belum yang belum dipahami dipahami (questioning) Elaborasi Membagi siswa dalam beber erapa kelompok, Membentuk kelompok Masyarakat belajar diskusi (comunitylearning) Masing-masing kelompok te terdiri dari 4-5 orang Membagikan LKS Berdiskusi dalam danmemberikan mengerjakan LKS sesuai kesempatan kepada siswa dengan kelompoknya untuk mengerjakan LKS. masing-masing. Membimbing kelompok Bekerja dalam kelompok yang mengalami kesulitan dan mengajukan dalam mengerjakan LKS. pertanyaan jika ada Inkuiri(inquiri) kesulitan. Konfirmasi Meminta kepada Masing-masing perwakilan dari masing- kelompok masing kelompok untuk mendelegasikan menjawab LKS. anggotanya untuk Refleksi(reflection) menjawab LKS di papan Memberikan tulis penghargaankepada Menjawab LKS di papan kelompok yang tulis medapatkan skor tertinggi. 5. Kegiatan Tindak lanjutIII. Penutup (60 menit) Menyimpulkan materi Mencatat poin-poin Penilaian autentik pembelajaran. penting dari materi yang Menginformasikan kepada telah dipelajari siswa bahwa pertemuan berikutnya akan diadakan evaluasi . X. 4. Sumber belajar 1. Buku kimia SMA kelas X (penerbit Grafindo Media Pratama). 2. Buku kimia SMA kelas X ( penerbit Erlangga) 3. Buku kimia SMA kelas X ( penerbit pustaka Insan Madani ) Penilaian 1. Teknik : tes tertulis 2. Instrumen : uraian 3. Contoh instrumen : Soal 1. Tulislah pengertian oksidasi dan reduksi berdasarkan : a. Pengikatan atau pelepasan oksigen b. Serah-terima elektron c. Perubahan bilangan oksidasi 2. Tentukan bilangan oksidasi Mangan dalam a. Mn2+ b. MnO c. KMnO4 d. MnO4- (authenticassessment) Kunci jawaban 1. Pengertian berdasarkan : a. Pengikatan/pelepasan oksigen Oksidasi adalah pengikatan oksigen Reduksi adalah pelepasan oksigen b. Serah terima elektron Oksidasi adalah pelepasan elektron Reduksi adalah penyerapan elektron c. Perubahan bilangan oksidasi Oksidator adalah penurunan bilangan oksidasi Reduktor adalah pertambahan bilangan oksidasi 2. Bilangan oksidasi mangan dalam : a. Mn2+= +2 b. MnO = (1xBo Mn + 1xBo O ) = 0 = (1x Bo Mn + 1x (-2)) = 0 = Bo Mn = 0+2 = +2 c. KMnO4 =( 1xBo K + 1xBo Mn + 4x Bo O) =0 = (1x(+1) + BoMn + 4x(-2) = 0 = Bo Mn = 8-1 = +7 d. MnO4= ( 1x Bo Mn + 4x(-2) = -1 = Bo Mn = -1+8 = +7 Mengetahui Amarasi,... Mei 2014 Kepala Sekolah SMA Negeri 1 Amarasi Peneliti Drs. NOH RUKU HOAR NIP. 19631117199303 MARIA FEBRIANI Lampiran 03b RENCANA PELAKSANAAN PEMBELAJARAN (RPP03) I. : SMA Negeri 1 Amarasi Mata pelajaran : Kimia Kelas/semester : (X) / II Alokasi waktu : 2x45 Menit Standar kompetensi 1. II. Sekolah Memahami sifat-sifat elektrolit dan nonelektrolit serta reaksi oksidasi-reduksi Kompetensi dasar 1.2. Menjelaskan perkembangan konsep reaksi oksidasi-reduksi dan hubungannya dengan tata nama senyawa serta penerapannya. III. Indikator 1. 2. Menuliskan nama senyawa dalam raeksi redoks sesuai dengan tata nama IUPAC Menjelaskan proses pengolahan limbah dengan metoda lumpur aktif IV. Tujuan pembelajaran Agar siswa dapat : 1. Menentukan nama senyawa dalam reaksi redoks sesuai tata nama IUPAC 2. Menjelaskan proses pengolahan limbah dengan metoda lumpur aktif V. Materi pokok Larutan elektrolit dan konsep redoks VI. Materi pembelajaran Tata nama senyawa dan proses pengolahan limbah dengan metode lumpur aktif. VII. Model pembelajaran Pendekatan kontekstual VIII. Metode pembelajaran Diskusi, pemberiantugasdan kerjakelompok IX. Langkah Pembelajaran Fase-fase CTL Kegiatan Guru 1. Kegiatan I. Pendahuluan (15 menit) Pendahuluan Menyampaikan TPK Pembelajaran. Memotivasi siswa dengan cara memberikan pertanyaan. Setiap makhluk hidup memiliki nama sesuai dengan nama keturunannya, begitu pula dengan unsur-unsur dalam senyawa, bagaimanakah sistim penamaan pada unsur-unsur tersebut? Dan apakah penamaan tersebut sesuai aturan? 2. Penyampaian IIKegiatan Inti (60 menit) Materi PelajaranEEkplorasi bagaimana cara menentukan unsur-unsur dalam senyawa yang terlibat dalam reaksi redoks sesuai dengan tata nama IUPAC dan menjelaskan proses pengolahan limbah dengan metoda lumpur aktifserta meminta perwakilan dari siswa untuk memperagakan contohnya di depan kelas. 3. Memancing Memberikan kesempatan kinerja siswa kepada siswa untuk bertanya tentang konsep yang belum Kegiatan Siswa Mendengarkan pengarahan dari guru Kategori Konstruktivisme (construktivisme) Mendengarkan dan menjawab pertanyaan dari guru Mendengarkan penjelasan dari guru Pemodelan Mengamati dan (Modeling) memperagakan contoh dari materi yang dipelajari dalam kehidupan sehari-hari. Bertanya (questioning) dipahami 4. Pemberian Umpan Balik Elaborasi Membagi siswa dalam beberapa Membentuk kelompok Masyarakat belajar kelompok, masing-masing diskusi (comunitylearning) kelompok berjumlah 4-5 orang. Mengajukan pertanyaan kepada guru tentang materi yang masih belum dipahami Membagikan LKS danmemberikan kesempatan kepada siswa untuk mengerjakan LKS. Membimbing kelompok yang mengalami kesulitan dalam mengerjakan LKS. Konfirmasi Meminta kepada perwakilan dari masing-masing kelompok untuk menjawab LDS. Memberikan penghargaankepada kelompok yang medapatkan skor tertinggi. 5. Kegiatan Tindak lanjut III. Penutup (60 menit) Menyimpulkan materi pembelajaran. Menginformasikan kepada siswa bahwa pertemuan berikutnya akan diadakan evaluasi . Berdiskusi dalam mengerjakan LDS sesuai dengan kelompoknya masingmasing. Bekerja dalam kelompok dan mengajukan pertanyaan jika ada kesulitan. Inkuiri (inquiri) Masing-masing kelompok mendelegasikan anggotanya untuk menjawab LDS di papan tulis Menjawab LDS di papan tulis Refleksi(reflection) Mencatat poin-poin penting dari materi yang telah dipelajari Penilaian autentik (authenticassessment) X. XI. Sumber belajar 1. Buku kimia SMA kelas X (penerbit Grafindo Media Pratama). 2. Buku kimia SMA kelas X ( penerbit Erlangga) 3. Buku kimia SMA kelas X ( penerbit pustaka Insan Madani ) Penilaian 1. Teknik : tes tertulis 2. Instrumen : uraian 3. Contoh instrumen Soal 1. Tulislah nama IUPAC senyawa-senyawa berikut . a. CuO b. Cu2O c. Fe2S3 d. CO2 e. SnO2 f. FeSO4 g. As2O3 2. Jelaskan pengolahan air kotor dengan cara lumpur aktif Kunci jawaban 1. Nama IUPAC dari senyawa tersebut diatas adalah.... a. Tembaga oksida b. Tembaga(I) oksida ( Kupro Oksida) c. Besi(III) sulfida d. Karbon oksida e. Timah oksida f. Besi(II) sulfat (Fero sulfat) g. Arsen(III) oksida 2. Pengolahan air kotor dengan cara lumpur aktif Air kotor mengandung berbagai macam limbah, seperti bahan organik, lumpur, oli bakteri patogen, virusgaram-garaman, pestisida, detergen, logam berat dan berbagai macam limbah plastik. Lumpur aktif adalah lumpur yang kaya dengan bakteri aerob yaitu bakteri yang dapat menguraikan limbah organik yang dapat mengalami biodegradasi. Bakteri aerob mengubah sampah organik dalam air limbah menjadi biomassa dan gas CO2. Sementara nitrogen organik diubah jadi ammonium dan nitrat, fosforus organik diubah menjadi fosfat. Biomassa hasil degradasi tetap berada dalam tangki aerasi hingga bakteri melewati masa pertumbuhan cepatnya (log phase). Setelah itu akan mengalami flokulasimembentuk padatan yang lebih mudah mengenda. Dari tangki pengendapan sebagian lumpur dibuang, sebagiannya lagi disirkulasikan kedalam tangki aerasi. Kombinasi antara bakteri dalam konsentrasi tinggi dan lapar (dalam lumpur yang disirkulasi) dengan jumlah nutrien yang banyak (dalam air kotor), memungkinkan penguraian dapat berlangsung dengan cepat. Penguraian dengan metode lumpur aktif hanya memerlukan beberapa jam jauh lebih cepat Dibandingkan dengan penguraian serupa yang terjadisecara alami dalam selokan atau air sungai. Mengetahui Kepala Sekolah SMA Negeri 1 Amarasi Drs. NOH RUKU NIP. 19631117199303 Amarasi,... Mei 2014 Peneliti MARIA FEBRIANI HOAR Lampiran 03 LARUTAN ELEKTROLIT DAN KONSEP REDOKS 1. Larutan Elektrolit dan Non-elektrolit Pernahkah kalian membuat rangkaian listrik yang dihubungkan dengan beberapa baterai, saat praktikum di sekolah? Mungkin kalian pernah mencobanya pada pelajaran fisika. Dalam praktikum tersebut, kalian membuktikan bahwa terjadi aliran arus listrik. Salah satu cirinya, yaitu lampu dapat menyala. Lampu dapat menyala karena adanya aliran listrik dari baterai dengan bantuan larutan yang dapat menghantarkan listrik. Lalu, adakah larutan yang tidak dapat menghantarkan listrik? Bagaimana cara membedakan kedua larutan tersebut? Dengan memahami uraian berikut, kalian akan menemukan jawabannya. Lampu dapat menyala karena terjadi aliran arus listrik. Dengan demikian, dapat dikatakan bahwa menyalanya lampu merupakan salah satu gejala hantaran arus listrik. Berdasarkan sifat dalam menghantarkan listrik, suatu bahan dapat dibedakan menjadi tiga, yaitu konduktor, isolator, dan semikonduktor. Konduktor adalah bahan-bahan yang dapat menghantarkan listrik, contohnya logam dan paku besi. Isolator adalah bahan-bahan yang tidak dapat menghantarkan listrik, seperti karet dan kayu. Sedangkan semikonduktor adalah pertengahan dari sifat keduanya, misalnya silikon, germanium, dan karbon, begitu pula dengan larutan. Larutan ada yang dapat menghantarkan listrik (larutan elektrolit) dan tidak dapat menghantarkan listrik (non-elektrolit). Pada percobaan rangkaian listrik dengan bantuan air garam, lampu dapat menyala karena terjadi aliran listrik. Dengan demikian, dapat disimpulkan bahwa air garam termasuk larutan elektrolit. Bagaimanakah dengan larutan lainnya? Kalian dapat mempelajari penyebab perbedaan kemampuan tiap larutan dalam menghantarkan arus listrik dengan menyelidiki ada atau tidaknya senyawa ion dan senyawa kovalen polar pada larutan tersebut. 1. Pengertian Larutan Elektrolit dan Non-elektrolit a. Larutan Elektrolit Elektrolit berasal dari kata dalam bahasa Yunani yang berarti ‘pembawa listrik’. Larutan elektrolit dapat menghantarkan arus listrik karena mengandung ion-ion yang bergerak bebas. Ion-ion ini berperan menghantarkan arus listrik melalui larutan. Contoh larutan elektrolit adalah NaCl, HCl, CH3COOH, dan H2SO4. Pada larutan elektrolit yang dilengkapi elektroda dan rangkaian listrik, ion-ion negatifnya (anion) bergerak menuju elektroda yang bermuatan positif (anoda) dan melepaskan elektron. Sedangkan ion-ion positif (kation) bergerak menuju elektroda yang bermuatan negatif (katoda) dan mengambil elektron. b. Larutan Non-elektrolit Larutan non-elektrolit merupakan kebalikan dari larutan elektrolit. Larutan ini tidak mampu menghantarkan arus listrik karena pada saat berupa larutan, tidak ada ion-ion yang bergerak bebas di dalamnya. Adapun jenis ikatan yang dimiliki oleh larutan non-elektrolit adalah ikatan kovalen. Ikatan kovalen terbentuk karena penggunaan bersama pasangan elektron. Ketika berada dalam larutan, senyawa kovalen tidak mengalami ionisasi, sehingga tidak ada ion-ion yang dapat menghantarkan arus listrik. Contoh larutan non-elektrolit adalah larutan gula, larutan urea, dan alkohol. 2. Pengelompokan Larutan Elektrolit Berdasarkan Kemampuannya Menghantarkan Listrik Larutan elektrolit terdapat ion- ion yang mampu menghantarkan arus listrik, ion-ion itu terdapat dalam larutan karena senyawanya mengalami peruraian yang dikenal sebagai proses ionisasi. Proses ionisasinya ada yang sempurna dan ada pula yang hanya sebagian. Contoh ionisasi sempurna dapat terjadi pada larutan HCl. Ketika berada dalam larutan, HCl akan terurai menjadi ion H+ dan ion Cl–. Reaksi ionisasi yang terjadi yaitu: H+(aq) + Cl–(aq). Ion-ion H+ HCl(aq) akan bergerak menuju katoda, mengambil elektron dan berubah menjadi gas hidrogen. Reaksi yang terjadi yaitu: 2H+(aq) + 2e– H2(g) . Sedangkan ion-ion Cl- bergerak menuju anoda, melepaskan elektron, dan berubah menjadi gas klorin. Reaksi yang terjadi yaitu: 2Cl–(aq) Cl2(g) + 2e–. Jadi, arus listrik menguraikan HCl menjadi gas H2 dan gas Cl2. Reaksi penguraian ini disebut elektrolisis. Selanjutnya, kita akan mempelajari tentang besaran yang menandai kekuatan suatu elektrolit yang disebut derajat ionisasi (α). Besarnya derajat ionisasi dinyatakan dengan persamaan berikut. α= Berdasarkan tinggi rendahnya derajat ionisasi,dapat mengelompokkan larutan elektrolit menjadi larutan elektrolit kuat dan elektrolit lemah. Jika diberi arus listrik, larutan elektrolit yang memiliki daya hantar listrik kuat akan menunjukkan gejala nyala lampu terang dan timbul gelembung gas. Larutan tersebut dinamakan larutan elektrolit kuat. Kuatnya daya hantar ini disebabkan ion-ion dalam larutan terionisasi sempurna dan memiliki derajat ionisasi sama dengan satu ( = 1). Contoh larutan elektrolit kuat, yaitu : kelompok asam :H2SO4, HNO3, HCl, HBr, HI, dan HClO4; kelompok basa : NaOH, Ca(OH)2, Sr(OH)2, dan Ba(OH)2; kelompok garam : NaCl, KCl, dan MgCl2. Jika diberi arus listrik, pada larutan elektrolit yang memiliki daya hantar listrik lemah hanya timbul gelembung-gelembung gas, larutan ini dinamakan elektrolit lemah. Hal ini disebabkan ion-ion dalam larutan terionisasi sebagian. Jika diukur, derajat ionisasi elektrolit lemah berada di antara angka 0 dan 1 (0 <α< 1). Contoh larutan elektrolit lemah yaitu kelompok asam: CH3COOH, H2CO3, H3PO4, dan HCN, basa: NH4OH, Al(OH)3 , Fe(OH)3, dan garam merkuri. Tabel Perbedaan larutan elektrolit kuat dan elektrolit lemah No Elektrolit kuat Elektrolit lemah 1 Dalam air terionisasi sempurna α = Dalam air terionisasi sebagian ( 0 <α >1 1 2 Dalam larutan tidak terdapat Dalam larutan ada molekul zat terlarut molekul zat terlarut 3 Ion dalam larutan dalam jumlah Ion dalam larutan dalam jumlah sedikit banyak 4 Mempunyai daya hantar listrik kuatMempunyai daya hantar listrik lemah 3. Pengelompokan Larutan Elektrolit Berdasarkan Ikatannya Larutan elektrolit dapat menghantarkan arus listrik karena terurai menjadi ion-ionnya. Larutan lain yang dapat menghantarkan listrik yaitu larutan yang terdiri atas senyawa kovalen polar atau senyawa ion. a) Senyawa Kovalen Polar Senyawa kovalen polar terjadi karena adanya penggunaan bersama pasangan elektron antara dua atom non-logam yang memiliki keelektronegatifan yang besar. Molekul-molekul senyawa kovalen polar dapat diuraikan oleh air membentuk ion positif dan ion negatif yang bergerak bebas sehingga dapat menghantarkan listrik. Larutan elektrolit jenis ini meliputi senyawa-senyawa asam, antara lain: 1. Asam klorida (HCl) Asam klorida terionisasi sesuai reaksi berikut. H3O+(aq) + Cl-(aq) HCl(l) + H2O(l) 2. Asam sulfat (H2SO4) Asam sulfat terionisasi sesuai reaksi berikut. H2SO4(aq) + 2 H2O(l) 2 H3O+(aq) + SO2 –(aq) 3. Asam fosfat (H3PO4) Asam fosfat terionisasi sesuai reaksi berikut. H3PO4(aq) + H2O(l) H3O+(aq) + PO4–(aq) + H2(g). Berdasarkan uraian di atas,dapat disimpulan bahwa senyawa kovalen polar dapat menghantarkan listrik. Lalu, bagaimana dengan lelehan senyawa kovalen polar? Ternyata, setelah diuji coba, diketahui bahwa lelehan senyawa kovalen polar tidak dapat menghantarkan listrik, karena molekulmolekulnya bersifat netral. a) Senyawa Ion Senyawa ion terdiri atas atom logam dan non-logam, jika dilarutkan dalam air, ion-ion yang terikat kuat dalam zat padat akan lepas dan dapat bergerak bebas satu dengan yang lainnya. Dengan adanya ion-ion bebas inilah, maka larutan dapat menghantarkan listrik. Kristal senyawa ion tidak dapat menghantarkan listrik, karena ion-ion tersebut tidak dapat bergerak bebas. Sementara itu, jika senyawa ion dipanaskan hingga meleleh, ion-ion tersebut dapat bergerak bebas sehingga lelehan senyawa ion juga dapat menghantarkan listrik. Larutan elektrolit jenis ini meliputi beberapa senyawa berikut, antara lain: 1. Natrium klorida (NaCl) Natrium klorida terionisasi sesuai reaksi berikut. NaCl(aq) Na+(aq) + Cl–(aq) 2. Magnesium hidroksida [Mg(OH)2] Magnesium hidroksida terionisasi sesuai reaksi berikut. Mg(OH)2(aq) Mg2+(aq) + 2OH-(aq) 3. Aluminium hidroksida [Al(OH)3] Aluminium hidroksida terionisasi sesuai reaksi berikut. Al(OH)3(aq) Al3+(aq) + 3OH-(aq) 2.PENGERTIAN DAN PERKEMBANGAN KONSEP REDOKS Reaksi redoks banyak kita temukan dalam kehidupan sehari-hari. Misalnya ketika bahan makanan masuk ke dalam tubuh kita, lalu bereaksi dengan oksigen yang kita hirup sehingga menghasilkan energi. Energi tersebut kita gunakan untuk berpikir, membaca, belajar, dan melakukan banyak hal. Beberapa peran penting oksigen dalam kehidupan kita yaitu: a) Kendaraan bermotor dapat berjalan karena bahan bakarnya bereaksi dengan oksigen. b) Aktivitas memasak di dapur lancar dengan adanya bahan bakar elpiji atau minyak tanah yang bereaksi dengan oksigen. c) Lilin dapat kita nyalakan untuk penerangan d) Sampah dapat kita bakar sehingga kita terbebas dari bakteri. Selain menguntungkan mahluk hidup, oksigen juga dapat merugikan manusia, misalnya oksigen menyebabkan: a) Korosi pada kendaraan bermotor b) Alat-alat rumah tangga berkarat c) Pagar besi menjadi keropos d) Minyak goreng menjadi tengik atau rancid, semua terjadi karena adanya reaksi oksidasi oleh oksigen. Bagaimanakah perkembangan reaksi redoks? Apakah terjadi perubahan konsep reaksi redoks seiring dengan perubahan waktu? Perhatikanlah penjelasan berikut. a. Perkembangan Konsep Reaksi Redoks Konsep reaksi oksidasi dan reduksi mengalami beberapa perubahan makna. Pada awalnya, reduksi diartikan sebagai reaksi pelepasan oksigen dan oksidasi diartikan sebagai reaksi pengikatan oksigen. Dalam perkembangannya, reaksi redoks mengalami perubahan makna, yaitu reaksi perpindahan elektron atau transfer elektron. Konsep ini disebut juga teori pelepasan dan pengikatan elektron. Pada akhirnya, redoks diartikan sebagai reaksi perubahan bilangan oksidasi. Bagaimanakah perkembangan reaksi redoks lebih jauh? Perhatikanlah penjelasan berikut. 1) Reaksi Pelepasan dan Pengikatan Oksigen Reaksi redoks diartikan sebagai reaksi pelepasan dan pengikatan oksigen. a. Pembakaran Sampah Sampah rumah tangga yang bertumpuk, apabila tidak dibakar atau didaur ulang, tentu akan membusuk dan menimbulkan bencana besar. Sebab bakteri tumbuh subur dan menyebarkan berbagai macam penyakit. Pada umumnya, sampah rumah tangga berupa plastik, kertas, daun, dan sisa-sisa makanan. Jika sampah dibakar, maka terbentuk asap dan gas lain yang berbahaya. Kita bisa mengambil contoh pembakaran sampah plastik. Pembakaran plastik menghasilkan gas CO2 yang sangat berbahaya karena dapat menaikkan suhu bumi. Bahan dasar plastik berupa etena, vinil klorida, etuna dan lain- lain. Jika dibakar, etena (C2H4) berubah menjadi gas CO2 dan H2O. Reaksi yang terjadi adalah sebagai berikut. C2H4(g) + 3 O2(g) 2 CO2(g) + 2 H2O(l) Reaksi di atas merupakan reaksi oksidasi karena melibatkan pengikatan oksigen. Pada saat dibakar, etena bereaksi dengan oksigen. Hal ini menunjukkan bahwa dalam peristiwa pembakaran sampah plastik terjadi reaksi redoks. b. Pembakaran Lilin Lilin terdiri dari parafin padat yang berwarna putih dan sumbu berupa sehelai benang yang terbuat dari selulosa. Saat dibakar, sumbu lilin berubah menjadi hitam dan warna putih dari parafin seolah-olah hilang begitu saja. Selain itu, terdapat cairan di bagian atas lilin. Peristiwa pembakaran lilin juga merupakan peristiwa reaksi redoks. Pada reaksi ini, apakah terjadi pengikatan ataukah pelepasan oksigen? Simaklah penjelasan berikut. Bagian sumbu lilin terdiri dari selulosa. Selain terdapat pada lilin, selulosa juga terdapat pada kayu, kertas, dan kapas. Rumus umum selulosa yaitu Cn(H2O)m. Apabila selulosa bereaksi dengan oksigen, reaksi yang terjadi adalah: Cn(H2O)m(l) + O2(g) CO2(g) + H2O(l) . Reaksi tersebut merupakan reaksi redoks yang melibatkan oksigen. Pada saat lilin dibakar, selulosa bereaksi dengan oksigen sehingga terjadi pengikatan oksigen. Sementara itu, parafin termasuk golongan alkana dengan rumus C20H42 sampai dengan C40H82. Jika parafin dibakar (bereaksi dengan oksigen) terjadi reaksi sebagai berikut. C20H42 + 30,5 O2 20 CO2 + 21 H2O atau 2 C20H42 + 61 O2 40 CO2 + 42 H2O . Dari reaksi di atas, kita dapat melihat dengan jelas bahwa Cn(H2O)m dan C20H42 mengikat oksigen lalu keduanya membentuk gas CO2 dan H2O. Berarti kita dapat mengambil kesimpulan bahwa reaksi tersebut termasuk reaksi oksidasi karena terjadi pengikatan oksigen. Pada penjelasan sebelumnya, mengenai reaksi oksidasi (pengikatan oksigen), bagaimana dengan pelepasan oksigen? Perhatikan reaksi berikut: CuO(s) + H2(g) Cu(s) + H2O(l) tembaga (II) oksida tembaga. Apabila senyawa tembaga(II) oksida direaksikan dengan gas H2 maka terbentuk unsur tembaga dan air. Pada reaksi ini, terjadi pelepasan oksigen (reaksi reduksi). Setelah reaksi berakhir, senyawa tembaga(II) oksida berubah menjadi unsur tembaga. Pada reaksi pembakaran plastik dan lilin terjadi penangkapan oksigen sehingga keduanya mengalami reaksi oksidasi. Zat yang mengalami oksidasi disebut reduktor atau zat pereduksi, sedangkan pada reaksi senyawa tembaga(II) oksida terjadi pelepasan oksigen atau mengalami reaksi reduksi. Zat yang mengalami reduksi disebut oksidator atau zat pengoksidasi. b. Konsep Pelepasan dan Pengikatan Elektron Konsep pelepasan dan pengikatan oksigen pada reaksi redoks ternyata terlalu sempit, karena tidak dapat menjelaskan reaksi-reaksi redoks yang tidak melibatkan atom oksigen. Kemudian, konsep redoks semakin berkembang (tidak hanya berdasarkan pelepasan dan pengikatan oksigen saja), tetapi berdasarkan konsep pelepasan dan pengikatan elektron. Konsep pelepasan dan pengikatan elektron menjelaskan bahwa atom, ion, atau molekul dapat bereaksi jika saling memberi dan menerima elektron. Jadi, salah satu spesi (zat yang terlibat dalam reaksi) melepas elektron dan spesi yang lain menerima elektron. Pada peristiwa ini, pelepasan dan penerimaan elektron terjadi dalam waktu yang sama. Demikian halnya dengan reaksi redoks. Elektron yang dilepas suatu spesi, dalam waktu yang bersamaan diterima oleh spesi yang lain. Meskipun kita tidak melihat elektronnya berpindah, namun kita dapat mengamati perubahan pada kedua spesi tersebut. Perhatikan contoh reaksi pelepasan dan penerimaan elektron berikut: Ca2+ + 2 e- Ca Cl2 + 2 e- (Oksidasi) 2 Cl- (Reduksi) ___________________________________________ Ca + Cl2 CaCl2 Reaksi Redoks Dari reaksi di atas, kita mengetahui bahwa atom Ca melepaskan 2 elektron. Kemudian 2 elektron tersebut ditangkap oleh atom Cl. Jadi, atom Ca mengalami reaksi oksidasi karena melepaskan elektronnya. Oleh karena itu, atom Ca disebut sebagai reduktor. Sementara itu, atom Cl mengalami reaksi reduksi karena mengikat elektron dari atom Ca. Maka, atom Cl disebut sebagai oksidator. Perbedaan konsep reaksi oksidasi dan reduksi berdasarkan pelepasan dan pengikatan elektron dapat kalian perhatikan pada persamaan reaksi di atas. Reaksi oksidasi bisa ditandai dengan adanya elektron di ruas kanan, sedangkan pada reaksi reduksi, elektron terletak di ruas 2. c. Penentuan Bilangan Oksidasi Kalian sudah mempelajari konsep redoks berdasarkan kenaikan dan penurunan bilangan oksidasi pada penjelasan di atas. Bagaimana cara menentukan besarnya bilangan oksidasi tiap-tiap unsur dalam keadaan bebas maupun terikat pada senyawa? Adakah aturan-aturan tertentu dalam penentuan bilangan oksidasi? Penentuan bilangan oksidasi dari tiap-tiap unsur mengikuti aturan berikut. 1. Unsur-unsur bebas (Na, Cu, dan Ag), molekul dwi atom (H2, N2, dan O2), molekul poli atom (S8 dan P4), dan molekul netral (H2O, HNO3, dan KOH) memiliki bilangan oksidasi = 0. 2. Bilangan oksidasi logam golongan I A (logam alkali: Li, Na, K, Rb, dan Cs) dalam senyawa selalu +1. Misalnya: atom Na dalam NaCl, bilangan oksidasi Na = +1. 3. Bilangan oksidasi logam golongan II A (alkali tanah: Be, Mg, Ca, Sr, dan Ba) dalam senyawa selalu +2. Misalnya: atom Ca dalamCa(OH)2, bilangan oksidasi Ca = +2. 4. Bilangan oksidasi ion dari suatu atom sama dengan muatan ionnya. Misalnya: Bilangan oksidasi Na+ = +1 Bilangan oksidasi Ca2+ = +2 Bilangan oksidasi Fe3+ = +3 Bilangan oksidasi Cl- = -1 Bilangan oksidasi SO23 - = + 1 Bilangan oksidasi PO34 - = +2 5. Bilangan oksidasi atom H dalam senyawa adalah +1, kecuali pada senyawa hidrida (NaH dan CaH2), bilangan oksidasi H = -1. 6. Bilangan oksidasi atom O dalam senyawa adalah -2, kecuali pada senyawa peroksida (H2O2), bilangan oksidasi O = -1, sedangkan pada senyawa superoksida (KO2), bilangan oksidasi O = -1 . Sementara itu, bilangan oksidasi atom O dalam senyawa OF2 adalah +2. 7. Jumlah total bilangan oksidasi (biloks) atom dalam senyawa adalah 0, sedangkan jumlah total bilangan oksidasi atom dalam ion adalah sama dengan muatan ion tersebut. 3. TATA NAMA SENYAWA REDOKS MENURUT ATURAN IUPAC a. Senyawa biner yang berasal dari unsur logam dan non-logam Pemberian nama pada senyawa biner yang berasal dari unsur logam dan non-logam mengikuti seperangkat aturan, yaitu: 1) Memberi nama unsur logam terlebih dahulu, kemudian nama unsur non- logam ditambah dengan akhiran –ida. Contoh: NaCl = Natrium Klorida K2O = Kalium Oksida. Senyawa biner yang tersusun dari unsur logam dan non logam umumnya berbentuk senyawa ion, misalnya senyawa NaCl. Senyawa NaCl terdiri dari satu Na+ dan satu Cl–, sehingga muatan senyawa NaCl sama dengan nol. Selain senyawa NaCl, kita juga bisa memperhatikan senyawa K2O. Senyawa K2O terdiri atas dua K+ dan satu O2-, sehingga muatan senyawa K2O sama dengan nol. Tabel 2.3 Tata Nama Unsur Logam dan Non-logam Senyawa AgCl H2S BaCl2 AlBr3 NaBr LiH Mg3N2 Nama senyawa Perak Klorida Asam Sulfida BariumKlorida Aluminium(III) bromida Natrium Bromin Litium Hidrida Magnesium(II) Nitrit 2) Untuk unsur logam yang memiliki bilangan oksidasi lebih dari satu jenis, maka aturan penulisan nama senyawa sebagai berikut: nama logam + biloks logam dengan angka romawi dalam kurung + nama unsur kedua berakhiran -ida. Contoh: FeS = besi(II) sulfida Fe2S3 = besi(III) sulfide Tabel 2.4 Tata Nama Unsur Logam yang Memiliki Biloks > 1 Unsur Hg Hg Mn Mn Mn Mn Mn Biloks 1 2 2 3 4 6 7 Contoh senyawa HgCl HgCl2 MnO Mn2O3 Mn2O4 Mn2O6 Mn2O7 Nama senyawa Raksa(I) klorida Raksa(II)klorida Mangan(I) Oksida Mangan(III) Oksida Mangan(IV) Oksida Mangan(VI) Oksida Mangan(VII) oksida Selain itu, penamaan unsur logam yang memiliki bilangan oksidasi lebih dari satu, dapat juga dituliskan sebagai berikut. Logam yang memiliki bilangan oksidasi kecil diberi nama sesuai logamnya ditambah akhiran –o, sedangkan logam yang memiliki bilangan oksidasi besar diberi nama sesuai logamnya ditambah akhiran –i. Contoh: FeCl2 = Fero klorida Cu2O = Kupro oksida FeCl3 = Feri klorida CuO = Kupri oksida b. Senyawa biner yang berasal dari dua unsur non-logam Pada dasarnya tata nama senyawa biner yang berasal dari dua unsur non-logam hampir sama dengan senyawa biner yang berasal dari unsur logam dan non-logam. Cara penamaannya yaitu menuliskan unsur yang mempunyai bilangan oksidasi positif terlebih dahulu, kemudian unsur yang memiliki bilangan oksidasi negatif. Misalnya, senyawa HBr (hidrogen bromida). Unsur H ditulis terlebih dahulu karena memiliki bilangan oksidasi positif, sedangkan unsur Br ditulis setelah unsur H karena memiliki bilangan oksidasi negatif. Unsurunsur non-logam juga dapat membentuk lebih dari satu senyawa biner. Oleh karena itu, aturan dalam penamaan senyawa non- logam menggunakan awalan sebagaimana tertera pada Tabel berikut : Tabel 2.5 Awalan Senyawa Biner dari dua Unsur Non-logam Angka 1 2 3 4 5 Contoh pemberian Nama Angka Nama Mono 6 Heksa Di 7 Hepta Tri 8 Okta Tetra 9 Nona Penta 10 Deka nama senyawa biner yang tersusun dari dua unsur non-logam antara lain: NO = Nitrogen monoksida NO2 = Nitrogen dioksida N2O = dinitrogen monoksida BF3 = Boron trifluorida PCl5 = Fosfor pentaklorida 4. PENERAPAN KONSEP REDOKS DALAM MENGATASI MASALAH PENCEMARAN LINGKUNGAN (LUMPUR AKTIF) Air sangat bermanfaat bagi kehidupan sehari-hari karena digunakan untuk minum, mandi, mencuci pakaian, dan lain-lain. Air yang kita konsumsi seharihari merupakan air bersih. Apa yang terjadi jika air yang kita konsumsi sudah tercemar oleh limbah pabrik dan limbah rumah tangga? Simaklah penjelasan berikut.: a. Kualitas Air Kualitas air bisa diteliti dan diketahui berdasarkan sebuah test yang disebut test kit. Dengan menggunakan alat ini, kita bisa mengetahui indikasi air bersih dan tercemar. Faktor-faktor apa saja yang dijadikan indikator air bersih atau tercemar? 1) pH pH digunakan sebagai standar tingkat keasaman/kebasaan air. Air dikatakan bersifat asam jika memiliki pH < 7 dan basa jika memiliki pH > 8. Sementara itu, air dikatakan bersifat netral jika memiliki pH sekitar 7. Tumbuhan dan binatang air hanya bisa hidup pada pH netral. Limbah atau sampah yang dibuang ke sungai bisa menyebabkan pH air menjadi rendah atau tinggi. Akibatnya, tumbuhan dan binatang air tidak bisa beradaptasi dengan baik jika air memiliki pH rendah atau tinggi. 2) Tingkat kekeruhan air Tahukah kalian, bahwa air yang keruh akan menghalangi sinar matahari masuk ke dalam air? Padahal, sinar matahari diperlukan tumbuhan dan binatang air agar bisa hidup dan berkembang dengan baik. Hal ini berarti bahwa air yang keruh akan mengganggu kehidupan tumbuhan dan binatang air. 3) Adanya bio-indikator atau makro invertebrata Kualitas air juga bisa kita ketahui berdasarkan adanya bio-indikator atau makro invertebrata (biota). Biota yang dimaksud di sini adalah binatang kecil yang hidup di dalam air. Ada biota yang dapat hidup dalam air tercemar limbah/ sampah, namun ada juga biota yang hanya dapat hidup dalam air bersih. Jadi, biota dapat digunakan sebagai “tanda hidup” dari keadaansuatu air. 4) Kadar oksigen terlarut (DO = Dissolved Oxygen) Oksigen yang terlarut dalam air memungkinkan adanya kehidupan tumbuhan dan binatang air. Air yang tercemar berarti kekurangan oksigen. Dengan berkurangnya oksigen, maka semakin sedikit tumbuhan dan binatang air yang bisa hidup dalam air tersebut. Oleh karena itu, adanya oksigen terlarut dijadikan indikator kualitas air. Semakin kecil kadar oksigen terlarut (DO) dalam air, semakin rendah pula kualitas air. 5) BOD (Biological Oxygen Demand) BOD adalah banyaknya oksigen yang digunakan oleh bakteri aerob untuk menguraikan sampah organik. Semakin besar kadar BOD dalam air, berarti semakin banyak sampah organik dalam air. Dengan banyaknya sampah organik akan menurunkan kualitas air. Suhu Suhu air yang terlalu panas atau terlalu dingin tidak baik bagi tumbuhan dan binatang air. Suhu air juga memengaruhi kadar oksigen terlarut dalam air. Makin tinggi suhu air, maka makin sedikit kadar oksigen terlarut dalam air dan sebaliknya. 6) Kadar zat padat terlarut Zat padat terlarut dalam air antara lain berupa senyawa anorganik, misalnya garam sulfat dari natrium, kalium, dan magnesium. Semakin banyak kadar senyawa-senyawa tersebut dalam air, maka air semakin sadah. Faktorfaktor yang telah dijelaskan di atas merupakan indikator dalam mengidentifikasi air tercemar atau air bersih. b. Peranan Lumpur Aktif dalam Pengolahan Air Kotor Sumber pencemaran air antara lain berasal dari limbah rumah tangga dan limbah industri pabrik. Jenis pencemaran yang terdapat pada limbah rumah tangga berupa lemak, amilum, dan protein yang berasal dari sisa makanan keluarga sehari-hari. Sementara itu, limbah pabrik antara lain berasal dari industria batik, kertas, dan tekstil. Adanya limbah dalam air mengakibatkan pencemaran air dan menggangggu ekosistem tumbuhan dan binatang air. Oleh karena itu, limbah harus diolah. Pengolahan limbah bertujuan untuk: a) Mengurangi vahan kimia yang beracun b) Mengurangi organisme patogen (organisme yang menimbulkan penyakit) c) Menurunkan BOD (Biological Oxygen Demand), yaitu banyaknya oksigen yang digunakan oleh bakteri untuk menghancurkan zat organik secara oksidasi d) Menghilangkan bau tidak sedap karena terjadi pembusukan e) Menghilangkan senyawa yang dapat diuraikan oleh bakteri secara biologis Untuk mengolah limbah antara lain dengan proses lumpur aktif. Lumpur aktif (activated sludge) adalah lumpur yang mengandung banyak bakteri aerob yang dapat menguraikan limbah organik sehingga mengalami biodegradasi. Lumpur aktif disebut juga masa biologik kompleks . Selain menggunakan lumpur aktif, pengolahan limbah juga dilakukan dengan cara lain, yaitu menggunakan mikroba terfiksasi. Salah satu metodenya adalah metode saringan biologi ( trickling filter ) yang disebut juga bio filter, bakteri bed, atau percolating bed . Metode saringan biologi menggunakan suatu reaktor yang berisi media permeabel dan lapisan mikroba yang tumbuh pada permukaan media tersebut. Air limbah mengalir melalui media, kemudian mikroba pada media akan mendegradasi vahan organik dan anorganik yang terkandung dalam air limba yang dihasilkan bila limbah organik dialiri oksigen. Lumpur ini berfungsi sebagai media hidup bagi bakteri yang sengaja dibiakkan di dalamnya. Lumpur tersebut dinamakan lumpur aktif karena pada saat pengolahan limbah, lumpur ini selalu bergerak naik turun agar terjadi kontak antara limbah, oksigen, dan bakteri. Proses lumpur aktif merupakan proses aerobik. Pada proses ini, mikroba tumbuh dalam lumpur (flok) yang terdispersi. Pada flok ini lahakan terjadi biodegradasi. Proses lumpur aktif berlangsung dalam reaktor yang bersekat (an-aerobik baffled reaktor). Proses ini lebih praktis karena cocok untuk daerah tropis (mikroorganisme mesofilik), sedangkan bentuk reaktor bersekat memberikan kemudahan karena dapat memberikan kontak yang lebih baik antara lumpur aktif dengan limbah (upflow and downflow). Proses lumpur aktif menggunakan oksigen murni sebagai pengganti udara. Dengan demikian, lebih banyak bakteri yang tumbuh dan lebih banyak pula limbah organik yang diuraikan. Oksigen tersebut diperoleh dari aerator atau dari pengadukan secara mekanik yang berfungsi untuk menjaga agar semua lumpur berada dalam keadaan tersuspensi. Selama proses pengolahan berlangsung, harus ditambahkan oksigen yang optimal untuk menjaga agar oksigen yang terlarut dalam campuran > 2 mg/l, tetapi dengan penggunaan energi yang minimal. Untuk meningkatkan efisiensi pengolahan limbah dengan proses lumpur aktif, maka ditambahkan serbuk karbon aktif secara langsung ke dalam sistem pengolahan. Proses ini disebut proses batch. Pengolahan limbah dengan proses batch bertujuan untuk mengondisikan proses lum pur aktif dan menentukan dosis pemakaian karbon aktif. Penambahan serbuk karbon aktif dapat menjaga kestabilan proses pengolahan limbah melalui peningkatan penyisihan limbah organik, kemampuan pengendapan lumpur, dan mempersingkat waktu aerasi dibandingkan sistem pengolahan limbah konvensional. Proses pengolahan limbah cair dilakukan dengan: a) Tahap pendahuluan (memisahkan bahan pencemar yang tidak larut dalam air). b) Proses kimia (memisahkan bahan pencemar yang larut dalam air dan tidak dapat didegradasi atau diuraikan secara biologis. Selain itu, dengan menetralisir limbah sehingga pH-nya mendekati pH pertumbuhan bakteri anaerob). c) Proses fisika (pengendapan dan pengapungan). d) Proses biologis (menguraikan zat organik yang terdapat dalam limbah cair). Lampiran 04 LEMBAR KERJA SISWA 01 (LKS 01) Nama kelompok : Kelas : Hari/tanggal : XII.Standar kompetensi 2. Memahami sifat-sifat elektrolit dan nonelektrolit serta reaksi oksidasi-reduksi XIII. Kompetensi dasar 1.4. Mengidentifikasi sifat larutan elektrolit berdasarkan data hasil percobaan XIV. Indikator :Psikomotor Mengidentifikasi dan Membedakan larutan elektrolit dari larutan nonelektrolit berdasarkan percobaan menggunakan alat uji sederhana XV. Tujuan Siswa diharapkan dapat : 1. Mengidentifikasi sifat menghantarkan Arus listrik berbagai senyawa dan larutan dengan alat uji sederhana 2. Membedakan sifat Larutan Elektrolit dan Non Elektrolit berdasarkan percobaan XVI. Rumusan masalah Bagaimanakah cara membedakan sifat larutan elektrolit dari larutan nonelektrolit dan juga bagaimana cara mengidentifikasinya? XVII. Hipotesis Percobaan 01 Dasar teori Menurut ilmuwan ARRHENIUS SVANTE AUGUST dari swedia menerangkan teori ion tentang hantaran listrik melalui larutan. ARRHENIUS berpendapat bahwa zat-zat elektrolit dalam air akan terurai menjadi ion positif dan ion negatif. Ion-ion tersebut akan bergerak bebas sehingga menghantarkan listrik melalui larutan. Larutan elektrolit Larutan elektrolit adalah larutan yang dapat menghantarkan listrik. Larutan elektrolit ada 2 macam yaitu : a. Larutan elektrolit kuat adalah larutan yang dapat menghantarkan listrik dengan baik. Nilai derajat disosiasi(α) larutan elektrolit kuat adalah 1. Senyawa elektrolit kuat terbentuk dari ikatan ionik,contoh air aki ( asam sulfat), asam klorida, air garam dan lain-lain. b. Larutan elektrolit lemah adalah Larutan yang dapat menghantarkan listrik dengan lemah. Nilai derajat disosiasi(α) larutan elektrolit lemah antara 0 sampai 1. Senyawa elektrolit lemah terbentuk dari ikatan kovalen polar. Contoh air cuka, ammonium hidroksida, air dan lain-lain. Larutan Non Elektrolit Larutan Non Elektrolit adalah larutan yang tidak dapat menghantarkan listrik sama sekali. Nilai derajat disosiasinya adalah 0. Senyawa nonelektrolit terbentuk dari ikatan kovalen non polar. Contoh : minyak goreng, bensin, oli dan lain-lain. Uji elektrolit Untuk membedakan larutan elektrolit kuat, larutan elektrolit Lemah dan Larutan Nonelektrolit dapat dilakukan pengujian dengan alat uji elektrolit dengan kriteria sebagai berikut : 1. Larutan Elektrolit kuat ditandai dengan Lampu menyala dan muncul gelembung ga pada elektroda 2. Larutan Elektrolit lemah ditandai dengan lampu tidak menyala dan muncul gelembung gas pada elektroda 3. Larutan Nonelektrolit ditandai dengan lampu tidak menyala dan tidak ada gelembung gas Alat dan bahan i. Gelas kimia ii. Baterai iii. Paku iv. Lampu v. Aquades, Larutan NaCl, Larutan gula, Larutan HCl, Larutan Asam Cuka, Larutan Ammonium, Larutan kapur, Mizone, Air laut dan Air putih. Langkah kerja vi. Merangkai alat kondukmeter seperti gambar dibawah ini dan menyalakan alat tersebut. vii. Memasukkan masing-masing sampel yang terdiri dari air laut, air kapur, air putih, larutan gula, Asam cuka, Mizone, Larutan Natrium klorida, Larutan Ammonium dan Aquadest viii. Mencelupkan elektroda (paku) kedalam sampel pertama dan mengamati nyala lampu dan gelembung gas. ix. XVIII. Mengulang kembali langkah 3 sampai sampel yang ke-10 Data pengamatan Larutan yang di uji Aquadest Asam cuka Larutan Natrium Klorida Larutan gula Larutan kapur Larutan Asam Klorida Larutan Ammonium Air Laut Mizone Air putih Rumus zat terlarut Lampu menyala/mati Gelembung Keterangan XIX. Analisis data hasil pengamatan XX. Kesimpulan XXI. Pertanyaan penunjang 1. Gejala apakah yang menandai hantaran listrik melalui larutan? 2. Apa yang menyebabkan larutan elektrolit dapat menghantarkan listrik? 3. Senyawa atau larutan manakah yang tidak sesuai dengan teori dalam referensi setelah melakukan pengujian? Jelaskan penyebeb ketidaksesuaian itu dengan argumen yang kuat. LEMBAR KERJA SISWA 02 (LKS 02) Nama kelompok Kelas Hari/tanggal : : : XI. Standar kompetensi 3. Memahami sifat-sifat elektrolit dan nonelektrolit serta reaksi oksidasi-reduksi XII.Kompetensi dasar 1.5. Menjelaskan perkembangan konsep reaksi oksidasi-reduksi dan hubungannya dengan tata nama senyawa serta penerapannya. XIII. Indikator : Psikomotor Mengklasifikasikan senyawa yang tergolong oksidasi dan senyawa yang tergolong reduksi serta oksidator dan reduktor. XIV. Tujuan Percobaan Siswa dapat : 1. Menglasifikasikan senyawa oksidasi dan reduksi 2. Mengklasifikasikan senyawa oksidtor dan reduktor XV. Rumusan masalah Bagaimana cara mengklasifikasikan senyawa Oksidasi- Reduksi XVI. Hipotesis Percobaan 02 Dasar Teori Kita sering menjumpai berbagai peristiwa yang merupakan reaksi redoks. Pernahkah kalian memperhatikan paku berkarat? Karat pada paku terjadi karena peristiwa oksidasi. Peristiwa tersebut disebabkan adanya reaksi logam dengan oksigen. Beberapa jenis logam tidak mengalami korosi (perkaratan) seperti yang terjadi pada paku. Misalnya, sendok yang terbuat dari stainless steel. Logam biasa berbeda dengan stainless steel. Permukaan pada logam biasa tidak dilindungi apapun, sehingga mudah bereaksi dengan oksigen dan membentuk lapisan Fe2O3 yang terus menerus bertambah seiring waktu. Lapisan inilah yang sering disebut “karat”. Alat dan Bahan Percobaan 1. Alat percobaan a. Gelas kimia 200 mL sejumlah 2 buah b. Gelas ukur 25 mL sejumlah 2 buah c. Penjepit kayu sejumlah 2 buah 2. Bahan Percobaan a. 25 mL larutan CuSO4 0,1 M b. 25 mL larutan MgSO4 0,1 M c. Logam Mg ± 10 cm d. Logam Cu ± 10 cm Langkah Percobaan 1. Lakukanlah percobaan ini dengan berkelompok dua atau tiga orang. 2. Buatlah pembagian kerja sebagai berikut. Dua orang bertugas melaksanakan percobaan. Satu orang bertugas mengamati hasil percobaan dan mencatatnya dalam tabel hasil percobaan. 3. Untuk percobaan reaksi redoks, ikuti langkah kerja berikut. a. Siapkan 2 buah gelas kimia 200 mL. b. Masukkan larutan CuSO4 dalam gelas kimia I dan masukkan juga larutan MgSO4 dalam gelas kimia II. c. Amplaslah logam Mg dan logam Cu, lalu jepit logam Mg pada ujung penjepit I. Sementara itu, jepit logam Cu pada ujung penjepit II. Masukkan logam Mg ke dalam larutan CuSO4 dan masukkan juga logam Cu ke dalam larutan MgSO4. d. Amati perubahan yang terjadi selama reaksi berlangsung. XVII. Data pengamatan No. 1 2 3 Isilah tabel di bawah ini berdasarkan hasil pengamatan. Warna logam sebelum Warna logam setelah Jenis percobaan dicelupkan kedalam dicelupkan kedalam larutan larutan CH3COOH CuSO4 MgSO4 VIII. Analisis data hasil percobaan IX. Kesimpulan Apa kesimpulan dari percobaan ini? Diskusikan dengan teman-teman kalian, lalu tuliskan dalam laporan kegiatan dan presentasikan di depan temanteman. X. Pertanyaan penunjang Untuk memperjelas tujuan percobaan, jawablah pertanyan berikut. 1. Apakah terdapat perbedaan pada ujung kedua logam pada percobaan I dan II? Jelaskan alasannya. 2. Tuliskan persamaan reaksi yang terjadi pada percobaan I dan II. Nama kelompok I. LEMBAR KERJA SISWA 03 (LKS 03) : Kelas : Hari/tanggal : Standar kompetensi 2. II. Memahami sifat-sifat elektrolit dan nonelektrolit serta reaksi oksidasi-reduksi Kompetensi dasar 2.2. Menjelaskan perkembangan konsep reaksi oksidasi-reduksi dan hubungannya dengan tata nama senyawa serta penerapannya. III. Indikator : psikomotor Merangkai dan Membuat penjernih air sederhana IV. Tujuan Siswa diharapkan dapat : Membuat penjernih air sederhana dengan menggunakan bahan-bahan sederhana V. Rumusan masalah Bagaimanakah cara kerja alat penyaring sederhana untuk memperoleh air bersih? Hipotesis Percobaan 03 Dasar percobaan Cara-cara manusia untuk mendapatkan air bersih melalui proses pembuatan alat penyaringan atau penjernihan air. Ada beberapa cara menjernihkan/menyaring air untuk mendapatkan air bersih. Cara tersebut ada yang bersifat mekanik maupun kimiawi tergantung kondisi air. Sistem penjernihan dan penyaringan dengan memperlambat aliran. Sistem ini menggunakan bahan penyaring seperti sabut/ijuk, batu-batu, arang aktifnataupun potongan bata. Air yang melewati penyaring tersebut akan tersaring sehingga menghasilkan air yang jernih. Adapun kegunaan dari bahan-bahan tersebut adalah: 1. Serabut, digunakan kapasnya karena kapas tersebut dapat menyarap endapanendapan air yang membuat warna air keruh dan bisa melihat endapan-endapan yang menempel pada kapas berupa warna endapan air kotor tersebut. 2. Batu-batu atau kerikil berfungsi untuk menyaring material-material yang berukuran besar, contoh : daun-daun yang berada di sungai, lumut , ganggang dan lain-lain. 3. Arang aktif atau batu bata berfungsi untuk menyaring/ menghilangkan bau, warna, zat pencemar dalam air, sebagai pelindungdan penukaran resindalam alat/penyulingan air. Alat dan bahan 1. Alat : pisau, gunting dan paku 2. Bahan : botol air mineral, kerikil, kapas, arang, selang atau sedotan Langkah kerja 1. Menyiapkan alat dan bahan yang diperlukan. 2. Memotong dasar botol air mineral bekas sekitar 2 cm dari dasarbotol agak berlubang 3. Memberi lubang pada tutup botol sebagai jalan keluarnya air 4. Mencuci bahan-bahan yang akan digunakan sebagai komponen dalam penjernih air sederhana 5. Mengisi botol dengan dengan bahan-bahan yang sudah dicuci. Secara berurutan, pertama menuangkan pasir, kapas, sabut kelapa, kerikil kecil, lidi dan kemudian kerikil yang berukuran agak besar. 6. Menguji coba penjernih air sederhana dengan menuangkan air kotor yang keruh ke dalam penjernih air sederhana. 7. Mengamati air yang keluar dari penjernih air sederhana. VI. Data pengamatan No 1 2 3 4 5 6 Bahan yang di uji Pasir Kapas Sabut kelapa Kerikil kecil Lidi Kerikil agak besar Hasil percobaan VII. Analisis data hasil pengamatan VIII. Kesimpulan IX. Pertanyaan penunjang 1. Berdasarkan percobaan yang telah dilakukan bahan manakah yang menyaring air lebih jernih dan bahan manakah yang kurang jernih? 2. Jelaskan alasanmu! Nama Siswa : Lampiran 05 KUIS ( 01 ) 1. Jelaskan pengertian dari Larutan elektrolit dan Larutan nonelektrolit? 2. Tuliskanlah Perbedaan antara Larutan Elektrolit dan Larutan Nonelektrolit? 3. Mengapa NaCl dalam bentuk padatan tidak menghantarkan Listrik? Nama Siswa : KUIS ( 02 ) 1. Definisikan oksidasi dan reduksi sesuai istilah berikut : a. Pertukaran oksigen b. Pertukaran hidrogen c. Pertukaran electron 2. Tentukan bilangan oksidasi Mn dalam senyawa-senyawa berikut a. KMnO4 b. MnO4c. MnO d. MnO2 Nama Siswa : KUIS ( 03 ) 1. Tulislah nama IUPAC senyawa-senyawa berikut ini a. CuO b. CuO2 c. Mg(NO2)3 d. Fe2S3 e. HgCl2 2. Jelaskan pengolahan air kotor dengan cara lumpur aktif. Lampiran 06 Sekolah Tugas I : SMA Negeri 1 Amarasi Mata pelajaran : Kimia Kelas/semester : (X) / II Alokasi waktu : 2x45 Menit XXII. Standar kompetensi 3. Memahami sifat-sifat elektrolit dan nonelektrolit serta reaksi oksidasi-reduksi XXIII. Kompetensi dasar 1.6. Mengidentifikasi sifat larutan elektrolit berdasarkan data hasil percobaan XXIV. Indikator 4. Membedakan larutan elektrolit dari larutan nonelektrolit 5. Menjelaskan hantaran listrik melalui larutan ataupun lelehan Jawablah pertanyaan-pertanyaan berikut. 1. Berdasarkan tinggi rendahnya derajat ionisasi, larutan elektrolit dibedakan menjadi dua yaitu elektrolit kuat dan elektrolit lemah. Berilah penjelasan disertai contoh kedua larutan elektrolit tersebut. 2. Jelaskan perbedaan elektrolit kuat dan elektrolit lemah. 3. Mengapa senyawa ion jika dilarutkan dalam air dapat menghantarkan listrik, sedangkan kristal senyawa ion tidak dapat menghantarkan listrik? 4. Mengapa lelehan senyawa kovalen polar tidak dapat menghantarkan listrik? 5. Sebutkan senyawa apa saja yang termasuk senyawa kovalen polar dan senyawa ion. Lampiran 05b Sekolah T u g a s II : SMA Negeri 1 Amarasi Mata pelajaran : Kimia Kelas/semester : (X) / II Alokasi waktuta : 2x45 Menit XVIII. Standar kompetensi 4. Memahami sifat-sifat elektrolit dan nonelektrolit serta reaksi oksidasi-reduksi XIX. Kompetensi dasar 1.7. Menjelaskan perkembangan konsep reaksi oksidasi-reduksi dan hubungannya dengan tata nama senyawa serta penerapannya. XX. Indikator 3. Membedakan dan mendeskripsikan perkembangan konsep redoks 4. Menentukan bilangan oksidasi unsur-unsur dalam senyawa Soal Perhatikan reaksi di bawah ini. 2 Na 2 Na+ + 2eCl2 + 2 e– 2Cl_____________________________ 2 Na + Cl2 2 Na+ + 2 Cl– Dari reaksi di atas, tentukan atom yang berperan sebagai oksidator dan reduktor. Berilah penjelasan singkat. Tugas III X. Sekolah : SMA Negeri 1 Amarasi Mata pelajaran : Kimia Kelas/semester : (X) / II Alokasi waktu : 2x45 Menit Standar kompetensi 3. Memahami sifat-sifat elektrolit dan nonelektrolit serta reaksi oksidasi-reduksi XI. Kompetensi dasar 3.2. Menjelaskan perkembangan konsep reaksi oksidasi-reduksi dan hubungannya dengan tata nama senyawa serta penerapannya. XII. Indikator 3. Menuliskan nama senyawa dalam reaksi redoks sesuai dengan tata nama IUPAC 4. Menjelaskan proses pengolahan limbah dengan metoda lumpur aktif Soal 1. Berilah nama untuk senyawa-senyawa berikut. a. SnO b. CrO3 c. SnO2 d. FeSO4 2. Tuliskan rumus kimia senyawa-senyawa berikut. a. Asam nitrat b. Kobalt(II) Oksida c. Asam sulfat d. Mangan(III) Oksida Lampiran 07 LEMBAR DISKUSI SISWA (RPP 01) SOAL 1. Diketahui data hasil uji daya hantar listrik beberapa larutan berikut Larutan Lampu Gelembung gas 1 Menyala Ada 2 Redup Ada 3 Tidak menyala Tidak ada 4 Tidak menyala Ada Berdasarkan data tersebut diatas, tuliskanlah larutan yang merupakan larutan elektrolit kuat dan larutan elektrolit lemah. 2. Sebutkan perbedaan larutan elektrolit dan larutan nonelektrolit 3. Mengapa NaCl dalam bentuk padat tidak menghantarkan listrik, sedangkan dalam bentuk lelehan dapat menghantarkan listrik? LEMBAR DISKUSI SISWA (RPP 02) SOAL 1. Tentukan bilangan oksidasi Mn dalam senyawa-senyawa berikut a. KMnO4 b. MnO4c. MnO d. MnO2 2. Tentukan bilangan oksidasi masing-masing unsur dalam senyawa berikut. a. NH3 b. CF4 c. BaO2 d. CaO 3. Tulislah nama senyawa-senyawa berikut a. Timah(IV) Oksida b. Tembaga(II) Oksida LEMBAR DISKUSI SISWA (RPP 03) SOAL 1. Sebutkan dan jelaskan parameter yang digunakan untuk mengukur ais bersih. 2. Jelaskan pengolahan air kotor dengan metoda lumpur aktif Lampiran 08 SEKOLAH MATA PELAJARAN KELAS/SEMESTER STANDAR KOMPETENSI Kompetensi Dasar 1.1.Mengidentifik asi larutan elektrolit dan nonelektrolit berdasarkan data hasil percobaan. Indikator Kompetensi Membedakan larutan elektrolit dari larutan nonelektrolit KISI-KISI SOAL THB : SMA NEGERI 1 AMARASI : KIMIA : X /II :1. Memahami sifat-sifat larutan Elektrolit dan Nonelektrolit serta reaksi Oksidasi-Reduksi Indikator Soal Peserta didik dapat membedakan larutan elektrolit dari larutan nonelektrolit berdasarkan data percobaan. No. Soal 1. Soal Tingkatan Dari suatu percobaan diperoleh data sebagai berikut: Bahan Rumus zat NyalaLampu Hydrogen HCl Terang klorida, air Gula, air C12H22C11 Tidak menyala Asamcuka, air CH3COOH Nyala kurang terang Kekuatan larutan elektrolit yang sesuai dengan data diatas adalah…. a. CH3COOH > C12H22O11 b. C12H22O11>HCl c. CH3COOH <HCl d. HCl< CH3COOH e. C12H22O11> CH3COOH C2 Kunci Jawaban C Peserta didik dapat Membedakan larutan elektrolit dari larutan nonelektrolit berdasarkan percobaan. 2. Peserta didik dapat Membedakan larutan elektrolit kuat dari larutan elektrolit lemah 3. Data hasil pengujian daya hantar listrik beberapa larutan sebagai berikut: Larutan Pengamatan Nyala Lampu Gelembung Gas 1 Terang Ada 2 Tidak menyala Tidak ada 3 Tidak menyala Ada 4 Tidak menyala Tidak ada 5 Terang Ada Berdasarkan data diatas yang merupakan larutan elektrolit adalah larutan nomor…. a. 1 dan 3 d. 1 dan 5 b. 1 dan 4 e. 2 dan 4 c. 3 dan 5 Perhatikanlah data dibawah ini. 1. Mempunyai daya hantar listrik kuat 2. Dalam air terionisasi sebagian ( 0 <α >1 3. Mempunyai daya hantar listrik lemah 4. Ion dalam larutan dalam jumlah banyak 5. Dalam air terionisasi sempurna α = 1 Berdasarkan data tersebut diatas yang tergolong elektrolit kuat adalah nomor.... a. b. c. d. e. 1 dan 2 2 dan 3 1,4 dan 5 2,4 dan 5 3,4 dan 5 C2 D C2 C Peserta didik dapat Membedakan larutan elektrolit kuat dan elektrolit lemah 4. Berdasarkan soal nomor 3, yang tergolong larutan elektrolit lemah adalah nomor.... a. 1 dan 2 b. 1 dan 3 c. 2 dan 3 d. 2 dan 4 e. 3 dan 5 C2 C Peserta didik dapat Mengidentifikasi larutan elektrolit dan larutan nonelektrolit. 5. Data hasil uji elektrolit air dari berbagai sumber sebagai berikut: Nyalalampu Adanya Jenis air gelembung gas Air sumber Lambat Air laut Terang Cepat Air sungai Agak cepat Air hujan Lambat Pernyataan yang tepat untuk data diatas adalah…. a. Air laut tergolong elektrolit kuat b. Air sumber tergolong elektrolit paling kuat c. Daya hantar air sungai lebih kecil dari air hujan d. Daya hantar air hujan lebih besar dari air laut e. Air dari berbagai sumber adalah nonelektrolit C2 A Peserta didik dapat Membedakan elektrolit dan nonelektrolit 6. Elektron yang dapat terionisasi sempurna disebut…. a. Elektrolit kuat b. Elektrolit lemah c. Non elektrolit d. Asam e. Basa C2 A Peserta didik dapat membedakan elektrolit kuat dan nonelektrolit 7. Larutan senyawa dibawah ini dalam air bersifat elektrolit kuat kecuali.... a. NaOH b. H2SO4 c. CH3COOH d. HCl e. Ba(OH)2 C2 C Peserta didik dapat Membedakan larutan elektrolit kuat dan larutan elektrolit Lemah 8. Senyawa berikut yang termasuk larutan elektrolit kuat adalah…. a. Fruktosa(aq) b. Air garam dapur(aq) c. Gula(aq) d. Urea (aq) e. Glukosa(aq) C2 B Peserta didik dapat Mengidentifikasi larutan nonelektrolit dari larutan elektrolit berdasarkan data percobaan. 9. Data pengamatan daya hantar listrik beberapa larutan dalam air sebagai berikut: Larutan Nyala lampu Gelembung gas P Ada gelembung Q Terang Ada gelembun R Ada gelembung S Terang Ada gelembung T U V Terang Ada gelembung W Ada gelembung Yang tergolong larutan nonelektrolit adalah larutan dengan huruf…. a. P dan R d. R dan W b. R dan T e. T dan U c. U dan V C2 E Peserta didik dapat Mengidentifikasi larutan elektrolit berdasarkan hasil percobaan. 10. Dari hasil pengujian daya hantar listrik terhadap larutan P dan Q diperoleh hasil: Pada larutan P bola lampu menyala dan terjadi gelembung-gelembung gas sedangkan pada larutan Q bola lampu tidak menyala dan tidak terjadi gelembung-gelembung gas. Kesimpulan yang dapat diambil adalah…. C2 D Peserta didik dapat Membedakan zat nonelektrolit dari beberapa zat Peserta didik dapat Membedakan sifat larutan elektrolit lemah dari sifat larutan lain. Peserta didik dapat Mengidentifikasi larutan elektrolit. a. Larutan P adalah elektrolit karena mudah larut dalam air b. Larutan P adalah elektrolit karena terurai menjadi ion-ion c. Larutan Q adalah elektrolit karena tidak menghasilkan gelembung-gelembung gas d. Larutan P adalah elektrolit karena menghasikan gelembung-gelembung gas e. Larutan Q adalah elektrolit karena elektrolit karena tidak menghasilkan gelembung-gelembung gas. 11. Zat berikut yang tergolong larutan nonelektrolit adalah.... a. Ca(OH)2 d. NaOH b. HCl e. C6H12O6 c. NaCl C2 E 12. Larutan gas NH3 dalam air bersifat elektrolit lemah. Salah satu faktor yang menyebabkan larutan ini bersifat demikian adalah.... a. Larutan NH3 dalam air bukan senyawa ion b. Larutan gas NH3 dalam air terurai menjadi ion NH4+ dan OHc. Derajat ionisasi larutan NH3 dalam air sangat kecil d. Pengujian elektrolit pada elektrode tidak terbentuk gelembung gas e. NH3 dan air saling bereaksi membentuk NH4OH C2 C 13. Larutan elektrolit berikut yang dalam air menghasilkan ion OH- adalah.... a. Natrium klorida b. Asam cuka C2 E Menjelaskan Menjelaskan hantaran listrik hantaran listrik melalui larutan. melalui larutan atau lelehan berdasarkan percobaan. c. Garam dapur d. Asam klorida e. Kalium hidroksida 14. Hasil uji daya hantar listrik terhadap larutan A dan B diproleh C2 C C2 A hasil sebagai berikut. Di larutan A, lampu menyala dan terbentuk gelembung- gelembung gas. Di larutan B, lampu tidak menyala dan tidak terbentuk gelembung- gelembung gas. Kesimpulan yang dapatditarik dari data tersebut adalah…. a. Larutan A adalah nonelektrolit Karena hanya menghasilkan gelembung b. Larutan B adalah elektrolit karena tidak menghasilkan gelembung c. Larutan A adalah elektrolit karena terurai menjadi ionion yang dapat menyalakan lampu d. Larutan B adalah elektrolit karena tidak terurai menjadi ion-ion e. Larutan A adalah elektrolit karena mudah larut dalam air. Peserta didik dapat membedakan elektrolit senyawa kovalen dengan senyawa lain. 15. Diketahui data hasil pengujian daya hantar listrikberbagai zat sebagai berikut. Jenis Padatan Lelehan Larutan zat P Non konduktor Baik Baik Q Non konduktor Non konduktor Baik R Baik Baik (tidak larut) T Non konduktor Non konduktor Buruk Peserta didik dapat membedakan larutan penghantar listrik dari larutan lain. Peserta didik dapat menjelaskan larutan elektrolit. Elektrolit yang merupakan senyawa kovalen adalah.... a. P dan Q b. Q dan R c. R dan d. Q dan S e. Hanya S 16. Pada pengujian elektrolit lampu menyala terang bila elektrode alat uji elektrolit dicelupkan kedalam larutan.... a. CH3COOH d. NaCl b. NH4OH e. C2H5OH c. H2S 17. Pada pengujian elektrolit nyala lampu dalam larutan 0,1M HCl lebih terang dibandingkan dalam larutan 0,1M NH4OH. Hal ini disebabkan.... a. HCl adalah senyawa asam sedangkan NH4OH adalah senyawa basa b. HCl adalah senyawa kovalen polar sedangkan NH4OH adalah senyawa ion c. Jumlah ion dalam larutan HCl lebih banyak dari jumlah ion dalam larutan NH4OH d. Dalam larutan HCl terdapat ion H+ sedangkan dalam larutan larutan NH4OH terdapat OHe. HCl bersifat elektrolit sedangkan NH4OH bersifat nonelektrolit C2 D C2 C Peserta didik dapat membedakan zatzat penghantar listrik dengan zat lain. Peserta didik dapat membedakan elektrolit kuat dan elektrolit lemah Peserta didik dapat membedakan larutan penghantar listrik dengan larutan lain. 18. Zat dibawah ini yang cairannya ataupun larutannya dalam air dapat menghantarkan arus listrik adalah.... a. H2SO4 b. C6H5COOH c. H3PO4 d. H2C2O4.2H2O e. NaCl 19. Berikut ini hasil percobaan daya hantar listrik dari beberapa larutan. Zat Lampu Pengamatan lain 1 Nyala terang Banyak gelembung 2 Nyala redup Banyak gelembung 3 Tidak menyala Sedikit gelembung 4 Tidak menyala Tidak ada gelembung Dari data diatas pasangan yang digolongkan elektrolit kuat dan elektrolit lemah berturut-turut adalah.... a. 3 dan 4 b. 2 dan 4 c. 1 dan 4 d. 1 dan 2 e. 1 dan 3 20. Larutan berikut yang menjadi penghantar listrik terbaik adalah.... a. Glukosa 2 M b. Garam dapur 2 M c. Urea 2 M d. Cuka 2 M e. Amonia 2 M C2 E C2 D C2 B Peserta didik dapat membedakan nama alat ukur penghantar listrik dengan alat ukur lain. 21. Apa nama alat yang digunakan untuk mengetahui apakah suatu zat cair dapat menghantarkan listrik atau tidak adalah.... a. Termometer b. pH meter c. alat uji elektrolit d. alat refluks e. tabung reaksi C2 C Peserta didik dapat Menjelaskan hantaran listrik melalui lelehan 22. Garam dapur dalam bentuk lelehan dapat menghantarkan listrik karena.... a. Dalam bentuk lelehan dapat menghasilkan atomatom b. Dalam bentuk lelehan dapat menghasilkan ion-ion c. Dalam bentuk lelehan dapat menghasilkan molekulmolekul d. Dalam bentuk larutan tidak dapat menghasilkan atom-atom e. Dalam bentuk kristal tidak dapat terurai C2 B Peserta didik dapat mengidentifikasi zat-zat elektrolit 23. Peristiwa penguraian zat-zat elektrolit menjadi ion-ion positif dan negatif disebut.... a. Ionisasi b. Oksidasi c. Asimilasi d. Korosi e. reduksi C2 A Menjelaskan perkembangan Membedakan dan Peserta didik dapat menjelaskan hantaran listrik melalui larutan 24. Suatu zat padat dilarutkan dalam air, ternyata larutannya dapat menghantarkan arus listrik. Pernyataan yang tepat untuk menjelaskan peristiwa ini adalah.... a. Air menjadi kondutor listrik bila ada zat terlarut didalamnya b. Dalam air zat padat terurai menjadi atom-atom c. Dalam air zat padat terurai menjadi ion positif dan ion negatif d. Dalam air zat padat terurai menjadi molekul-molekul e. Air menjadi mudah terionisasi bila ada zat terlarut didalamnya C2 C Peserta didik dapat Menjelaskan larutan elektrolit berdasarkan fenomena garam dapur Peserta didik dapat membedakan perkembangan pengertian oksidasi 25. Garam dapur jika dilarutkan dalam air akan menghasilkan larutan elektrolit karena.... a. Bereaksi dengan air menghasilkan NaOH dan HCl b. Terurai menjadi Na+ dan Clc. Menguraikan air menjadi ion H+ dan ion OHd. Terurai menjadi logam Na dan gas Cl2 e. Garam dapur adalah senyawa kovalen polar 26. Perhatikanlah pernyataan-pernyataan berikut ini I : Reaksi Penggabungan dan pelepasan oksigen II: Reaksi Perubahan Blangan Oksidasi III : Reaksi Serah terima Elektron Berdasarkan data tersebut di atas, urutan yang benar sesuai dengan perkembangan reaksi redoks adalah…. a. I dan II b. II dan I c. III, II dan I d. I, II dan III e. I, III dan II C2 B C2 E konsep reaksi oksidasi-reduksi dan hubungannya dengan tata nama senyawa serta penerapannya mendeskripsikan perkembangan konsep redoks Peserta didik dapat Mendeskripsikan oksidator dan reduktor Menentukan bilangan oksidasi unsur-unsur dalam senyawa Peserta didik dapat Menentukan bilangan oksidasi unsur-unsur dari senyawa-senyawa Peserta didik dapat Menentukan bilangan oksidasi unsur-unsur dari senyawa-senyawa Pesertadidikdapat Menentukan 27. Perhatikan pernyataan-pernyataan berikut: 1. Oksidator mengalami oksidasi 2. Oksidator mengalami reduksi 3. Reduktor mengalami reduksi 4. Reduktor mengalami oksidasi Pernyataan yang benar adalah pernyataan nomor.... a. 1,2 dan 3 b. 1 dan 3 c. 2 dan 4 d. 3 dan 4 e. 1 dan 2 28. Bilangan oksidasi Mn tertinggi terdapat dalam senyawa.... a. MnCl2 b. K2MnO4 c. KMnO4 d. MnO e. MnO2 C2 C C3 C 29. SBilangan oksidasi oksigen tertinggi terdapat dalam senyawa.... a. CaO b. BaO2 c. O2F3 d. KO2 e. OF2 30. Diantara senyawa berikut ini, yang mengandung belerang (S) dengan bilangan oksidasi terendah adalah.... C3 D C3 A bilangan oksidasi unsur-unsur dari senyawa-senyawa Peserta didik dapat Menentukan bilangan oksidasi unsur-unsur dari senyawa-senyawa Peserta didik dapat Menentukan bilangan oksidasi unsur-unsur dari senyawa-senyawa Peserta didik dapat Menentukan bilangan oksidasi unsur-unsur dari senyawa-senyawa Peserta didik dapat Menentukan a. H2SO4 b. Na2S4O6 c. K2SO3 d. Na2S2O3 e. Al2S3 31. Bilangan oksidasi Cl terendah dan tertinggi terdapat dalam senyawa.... a. KClO dan Cr(ClO3)4 b. AlCl3 dan NH4ClO4 c. Ca(ClO2)2 dan ZnCl2 d. KClO4 dan PCl4 e. AuCl3 dan Mg(ClO)2 C3 D 32. Bilangan oksidasi klor = +7 terdapat pada senyawa.... a. NaClO d. NaClO4 b. NaClO2 e. NaCl c. NaClO3 C3 D 33. Pada reaksi berikut : 3MnO4-2 + 4H+ 2MnO4- + MnO2 + H2O. Bilangan oksidasi Mn berubah dari.... a. -2 menjadi -1 dan 0 b. -2 menjadi -1 dan +4 c. +6 menjadi +7 dan 0 d. +6 menjadi +7 dan +4 e. +8 menjadi +7 dan +4 34. Dalam reaksi: I2 + 6OHI- + IO3- + 3H2O Bilangan oksidasi I berubah dari.... C3 D C3 A perubahan bilangan oksidasi a. b. c. d. e. 0 menjadi -1 dan +5 0 menjadi +4 dan -1 0 menjadi +3 dan -1 +1 menjadi -5 dan -1 -1 menjadi +5 dan +1 Peserta didik dapat Menentukan bilangan oksidasi unsur-unsur dari senyawa-senyawa Peserta didik dapat Menentukan perubahan biloks 35. Bilangan oksidasi atom S yang paling tinggi terdapat pada.... a. SO2 b. S2O3-2 c. SO4-2 d. S4O6-2 e. H2S-2 36. Perubahan berikut menunjukkan penurunan bilangan oksidasi sebanyak 5 tingkat terdapat pada.... a. MnO4-2 MnO2 b. MnO4Mn+2 c. IO3 I d. MnO4MnO2 -2 e. Cr2O7 Cr+3 C3 C C3 B Peserta didik dapat Menentukan ionion dari suatu senyawa 37. Jika senyawa magnesium amonium fosfat (MgNH4PO4) dilarutkan dalam air maka dalam larutan akan ada ion-ion.... a. Mg+2 dan NH4PO4-2 b. MgNH4+3 dan PO4-3 c. NH4+ dan MgPO4d. H4PO4+ dan MgNe. Mg+2, NH4+ dan PO4-3 38. Pada reaksi redoks dibawah ini, Sn + 4HNO3 SnO2 + 4NO2 + 2H2O C3 E C3 C Peserta didik dapat Menentukan zat reduktor Yang berperan sebagai reduktor adalah.... a. SnO2 b. HNO3 c. Sn d. NO2 e. H2O Peserta didik dapat Menentukan zat oksidator dan hasil reaksi dari suatu senyawa. 39. Zat yang merupakan oksidator dan hasil oksidasi pada reaksi berikut adalah.... 3HgS + 2HNO3 + 6HCl HgCl2 + S + NO + H2O a. HgS dan S b. HNO3 dan S c. HNO3 dan NO d. HNO3 dan HgCl2 e. HCl dan S C3 A Peserta didik dapat Menentukan zat yang bukan reduktor 40. Diantara spesi berikut yang paling tidak mungkin digunakan sebagai reduktor adalah.... a. Na b. Fe+2 c. Na+ d. H2 e. Cl41. Besi yang berkarat merupakan hasil oksidasi dari Fe menjadi Fe2O3. Biloks besi dalam senyawa Fe2O3 (karat) tersebut adalah.... a. +1 d. +4 b. +2 e. +5 c. +3 C3 D C3 C Peserta didik dapat Menentukan bilangan oksidasi dari sesuatu unsur Menuliskan nama dari senyawasenyawa yang terlibat dalam reaksi redoks sesuai dengan tata nama IUPAC Peserta didik dapat Menentukan bilangan oksidasi dari sesuatu unsur 42. Salah satu senyawa asam dari unsur karbon adalah H2C2O4, biloks C dalam senyawa tersebut adalah.... a. +1 d. +4 b. +2 e. +5 c. +3 C3 C Menuliskan nama dari suatu senyawa berdasarkan nama IUPAC 43. ENama IUPAC yang benar untuk senyawa Cu2S adalah.... E a. Tembaga(II) sulfida b. Tembaga(II) sulfat c. Tembaga(II) sulfit d. Tembaga(I) sulfida e. Tembaga(I) sulfit 44. Rumus kimia dari timah(IV) sulfat adalah.... a. SnS4 b. SnS2 c. Sn2(SO4)4 d. SnSO4 e. Sn(SO4)2 C1 A C1 C 45. Pemberian nama yang tepat untuk FeCO3 adalah …. a. Besi(II) karbonat b. Besi(III) karbonat c Besi(II) oksida d. Besi(III) oksida e. Besi(II) karbon oksida C1 A Menuliskan rumus kimia dari timah(IV) sulfat Menuliskan nama dari suatu senyawa berdasarkan nama IUPAC Menuliskan rumus kimia dari suatu senyawa Menuliskan nama dari suatu senyawa berdasarkan nama IUPAC Menuliskan nama dari suatu senyawa berdasarkan nama IUPAC Menjelaskan proses Menyebutkan alat pengolahan limbah ukur air bersih dengan metode lumpur aktif 46. Penulisan rumus kimia dari kromium(III) sulfat adalah …. a. CrSO4 b. CrSO3 c. Cr2(SO4)3 d. Cr2(SO3)3 e. Cr2(SO4)2 47. Nama kimia dari senyawa As2O3 adalah .... a. Arsen dioksida b. Diarsen trioksida c. Arsen(II) oksida d. Arsen(III) oksida e. Diarsen oksida Nama yang tepat untuk senyawa FeSO4 adalah .... a. Besi sulfat b. Besi(II) sulfat c. Fero sulfat d. Besi(III) sulfat e. Feri sulfat C1 C C1 D C1 B 48. Parameter berikut yang tidak termasuk parameter air bersih adalah.... a. DO tinggi b. BOD tinggi c. pH sekitar 6,5-8,4 d. Kekeruhan C2 E Menjelaskan proses pengolahan air kotor e. tidak berwarna 49. Diantara proses berikut 1. Karbon organik 2. Fosforus organik 3. Nitrogen organik 4. Belerang organik Perubahan yang terjadi dalam pengolahan air kotor dengan lumpur aktif adalah.... a. Semua b. 1,2 dan 3 c. 2,3 dan 4 d. 1 dan 3 e. 2 dan 4 C2 C Lampiran 09 Soal 1. Dari suatu percobaan diperoleh data sebagai berikut: Bahan Rumus zat Nyala Lampu Hydrogen HCl Terang Gula, air C12H22C11 Tidak menyala Asam cuka, air CH3COOH Nyala kurang klorida, air terang Kekuatan larutan elektrolit yang sesuai dengan data diatas adalah…. f. CH3COOH > C12H22O11 g. C12H22O11> HCl h. CH3COOH <HCl i. HCl < CH3COOH j. C12H22O11 > CH3COOH 2. Data hasil pengujian daya hantar listrik beberapa larutan sebagai berikut: Pengamatan Larutan Nyala Lampu Gelembung Gas 1 Terang Ada 2 Tidak menyala Tidak ada 3 Tidak menyala Ada 4 Tidak menyala Tidak ada 5 Terang Ada Berdasarkan data diatas yang merupakan larutan elektrolit adalah laruta nomor…. d. 1 dan 3 d. 1 dan 5 e. 1 dan 4 e. 2 dan 4 f. 3 dan 5 3. Perhatikanlah data dibawah ini. 6. Mempunyai daya hantar listrik kuat 7. Dalam air terionisasi sebagian ( 0 <α >1 8. Mempunyai daya hantar listrik lemah 9. Ion dalam larutan dalam jumlah banyak 10. Dalam air terionisasi sempurna α = 1 Berdasarkan data tersebut diatas yang tergolong elektrolit kuat adalah nomor.... f. 1 dan 2 g. 2 dan 3 h. 1,4 dan 5 i. 2,4 dan 5 j. 3,4 dan 5 4. Berdasarkan soal nomor 3, yang tergolong larutan elektrolit lemah adalah nomor.... f. 1 dan 2 g. 1 dan 3 h. 2 dan 3 i. 2 dan 4 j. 3 dan 5 5. Data hasil uji elektrolit air dari berbagai sumber sebagai berikut: Nyala lampu Jenis air Adanya gelembung gas Air sumber - Lambat Air laut Terang Cepat Air sungai - Agak cepat Air hujan - Lambat Pernyataan yang tepat untuk data diatas adalah…. f. Air laut tergolong elektrolit kuat g. Air sumber tergolong elektrolit paling kuat h. Daya hantar air sungai lebih kecil dari air hujan i. Daya hantar air hujan lebih besar dari air laut j. Air dari berbagai sumber adalah nonelektrolit 6. Elektron yang dapat terionisasi sempurna disebut…. f. Elektrolit kuat g. Elektrolit lemah h. Nonelektrolit i. Asam j. Basa 7. Larutan senyawa dibawah ini dalam air bersifat elektrolit kuat kecuali.... f. NaOH g. H2SO4 h. CH3COOH i. HCl j. Ba(OH)2 8. Senyawa berikut yang termasuk larutan elektrolit kuat adalah…. f. Fruktosa (aq) g. Air garam dapur (aq) h. Gula (aq) i. Urea (aq) j. Glukosa (aq) 9. Data pengamatan daya hantar listrik beberapa larutan dalam air sebaga berikut: Larutan Nyala lampu Gelembung gas P - Ada gelembung Q Terang Ada gelembun R - Ada gelembung S Terang Ada gelembung T - - U - - V Terang Ada gelembung W - Ada gelembung Yang tergolong larutan nonelektrolit adalah larutan dengan huruf…. d. P dan R d. R dan W e. R dan T e. T dan U f. U dan V 10. Dari hasil pengujian daya hantar listrik terhadap larutan P dan Q diperoleh hasil: Pada larutan P bola lampu menyala dan terjadi gelembung-gelembung gas sedangkan pada larutan Q bola lampu tidak menyala dan tidak terjadi gelembung-gelembung gas. Kesimpulan yang dapat diambil adalah…. f. Laruta P adalah elektrolit karena mudah larut dalam air g. Larutan P adalah elektrolit karena terurai menjadi ion-ion h. Larutan Q adalah elektrolit karena tidak menghasilkan gelembung-gelembung gas i. Larutan P adalah elektrolit karena menghasikan gelembung-gelembung gas j. Larutan Q adalah elektrolit karena elektrolit karena tidak menghasilkan gelembung-gelembung gas. 11. Zat berikut yang tergolong larutan larutan nonelektrolit adalah.... d. Ca(OH)2 d. NaOH e. HCl e. C6H12O6 f. NaCl 12. Larutan gas NH3 dalam air bersifat elektrolit lemah. Salah satu faktor yang menyebabkan larutan ini bersifat demikian adalah.... f. Larutan NH3 dalam air bukan senyawa ion g. Larutan gas NH3 dalam air terurai menjadi ion NH4+ dan OHh. Derajat ionisasi larutan NH3 dalam air sangat kecil i. Pengujian elektrolit pada elektrode tidak terbentuk gelembung gas j. NH3 dan air saling bereaksi membentuk NH4OH 13. Larutan elektrolit berikut yang dalam air menghasilkan ion OH- adalah.... f. Natrium klorida g. Asam cuka h. Garam dapur i. Asam klorida j. Kalium hidroksida 14. Hasil uji daya hantar listrik terhadap larutan A dan B diproleh hasil sebagai berikut. Di larutan A, lampu menyala dan terbentuk gelembung-gelembung gas. Di larutan B, lampu tidak menyala dan tidak terbentuk gelembung- gelembung gas. Kesimpulan yang dapat ditrik dari data tersebut adalah…. a. Larutan A adalah nonelektrolit Karena hanya menghasilkan gelembung b. Larutan B adalah elektrolit karena tidak menghasilkan gelembung c. Larutan A adalah elektrolit karena terurai menjadi ion-ion yang dapat menyalakan lampu d. Larutan B adalah elektrolit karena tidak terurai menjadi ion-ion e. Larutan A adalah elektrolit karena mudah larut dalam air. 15. Diketahui data hasil pengujian daya hantar listrik berbagai zat sebagai berikut. Jenis Padatan Lelehan Larutan P Nonkonduktor Baik Baik Q Nonkonduktor Nonkonduktor Baik R Baik Baik (tidak larut) T Nonkonduktor Nonkonduktor Buruk zat Elektrolit yang merupakan senyawa kovalen adalah.... f. P dan Q g. Q dan R h. R dan i. Q dan S j. Hanya S 16. Pada pengujian elektrolit lampu menyala terang bila elektrode alat uji elektrolit dicelupkan kedalam larutan.... d. CH3COOH d. NaCl e. NH4OH e. C2H5OH f. H2S 17. Pada pengujian elektrolit nyala lampu dalam larutan 0,1M HCl lebih terang dibandingkan dalam larutan 0,1M NH4OH. Hal ini disebabkan.... f. HCl adalah senyawa asam sedangkan NH4OH adalah senyawa basa g. HCl adalah senyawa kovalen polar sedangkan NH4OH adalah senyawa ion h. Jumlah ion dalam larutan HCl lebih banyak dari jumlah ion dalam larutan NH4OH i. Dalam larutan HCl terdapat ion H+ sedangkan dalam larutan larutan NH4OH terdapat OHj. HCl bersifat elektrolit sedangkan NH4OH bersifat nonelektrolit 18. Zat dibawah ini yang cairannya ataupun larutannya dalam air dapat menghantarkan arus listrik adalah.... f. H2SO4 g. C6H5COOH h. H3PO4 i. H2C2O4.2H2O j. NaCl 19. Berikut ini hasil percobaan daya hantar listrik dari beberapa larutan. Zat Lampu Pengamatan lain 1 Nyala terang Banyak gelembung 2 Nyala redup Banyak gelembung 3 Tidak menyala Sedikit gelembung 4 Tidak menyala Tidak ada gelembung Dari data diatas pasangan yang digolongkan elektrolit kuat dan elektrolit lemah berturut-turut adalah.... f. 3 dan 4 g. 2 dan 4 h. 1 dan 4 i. 1 dan 2 j. 1 dan 3 20. Larutan berikut yang menjadi penghantar listrik terbaik adalah.... f. Glukosa 2 M g. Garam dapur 2 M h. Urea 2 M i. Cuka 2 M j. Amonia 2 M 21. Apa nama alat yang digunakan untuk mengetahui apakah suatu zat cair dapat menghantarkan listrik atau tidak adalah.... f. Termometer g. pH meter h. alat uji elektrolit i. alat refluks j. tabung reaksi 22. Garam dapur dalam bentuk lelehan dapat menghantarkan listrik karena.... f. Dalam bentuk lelehan dapat menghasilkan atom-atom g. Dalam bentuk lelehan dapat menghasilkan ion-ion h. Dalam bentuk lelehan dapat menghasilkan molekul-molekul i. Dalam bentuk larutan tidak dapat menghasilkan atom-atom j. Dalam bentuk kristal tidak dapat terurai 23. Peristiwa penguraian zat-zat elektrolit menjadi ion-ion positif dan negatif disebut.... f. Ionisasi g. Oksidasi h. Asimilasi i. Korosi j. reduksi 24. Suatu zat padat dilarutkan dalam air, ternyata larutannya dapat menghantarkan arus listrik. Pernyataan yang tepat untuk menjelaskan peristiwa ini adalah.... f. Air menjadi kondutor listrik bila ada zat terlarut didalamnya g. Dalam air zat padat terurai menjadi atom-atom h. Dalam air zat padat terurai menjadi ion positif dan ion negatif i. Dalam air zat padat terurai menjadi molekul-molekul j. Air menjadi mudah terionisasi bila ada zat terlarut didalamnya 25. Garam dapur jika dilarutkan dalam air akan menghasilkan larutan elektrolit karena.... f. Bereaksi dengan air menghasilkan NaOH dan HCl g. Terurai menjadi Na+ dan Clh. Menguraikan air menjadi ion H+ dan ion OHi. Terurai menjadi logam Na dan gas Cl2 j. Garam dapur adalah senyawa kovalen polar 26. Perhatikanlah pernyataan-pernyataan berikut ini I : Reaksi Penggabungan dan pelepasan oksigen II: Reaksi Perubahan Blangan Oksidasi III : Reaksi Serah terima Elektron Berdasarkan data tersebut di atas, urutan yang benar sesuai dengan perkembangan reaksi redoks adalah…. a. I dan II b. II dan I c. III, II dan I d. I, II dan III g. I, III dan II 27. Perhatikan pernyataan-pernyataan berikut: 5. Oksidator mengalami oksidasi 6. Oksidator mengalami reduksi 7. Reduktor mengalami reduksi 8. Reduktor mengalami oksidasi Pernyataan yang benar adalah pernyataan nomor.... f. 1,2 dan 3 g. 1 dan 3 h. 2 dan 4 i. 3 dan 4 j. 1 dan 2 28. Bilangan oksidasi Mn tertinggi terdapat dalam senyawa.... f. MnCl2 g. K2MnO4 h. KMnO4 i. MnO j. MnO2 29. Bilangan oksidasi oksigen tertinggi terdapat dalam senyawa.... f. CaO g. BaO2 h. O2F3 i. KO2 j. OF2 30. Diantara senyawa berikut ini, yang mengandung belerang (S) dengan bilangan oksidasi terendah adalah.... f. H2SO4 g. Na2S4O6 h. K2SO3 i. Na2S2O3 j. Al2S3 31. Bilangan oksidasi Cl terendah dan tertinggi terdapat dalam senyawa.... f. KClO dan Cr(ClO3)4 g. AlCl3 dan NH4ClO4 h. Ca(ClO2)2 dan ZnCl2 i. KClO4 dan PCl4 j. AuCl3 dan Mg(ClO)2 32. Bilangan oksidasi klor = +7 terdapat pada senyawa.... d. NaClO d. NaClO4 e. NaClO2 e. NaCl f. NaClO3 33. Pada reaksi berikut : 3MnO4-2 + 4H2 MnO4- + MnO2 + H2O. Bilangan oksidasi Mn berubah dari.... f. -2 menjadi -1 dan 0 g. -2 menjadi -1 dan +4 h. +6 menjadi +7 dan 0 i. +6 menjadi +7 dan +4 j. +8 menjadi +7 dan +4 34. Dalam reaksi: I2 + 6OH- I- + IO3- + 3H2O Bilangan oksidasi I berubah dari.... f. 0 menjadi -1 dan +5 g. 0 menjadi +4 dan -1 h. 0 menjadi +3 dan -1 i. +1 menjadi -5 dan -1 j. -1 menjadi +5 dan +1 35. Bilangan oksidasi atom S yang paling tinggi terdapat pada.... f. SO2 g. S2O3-2 h. SO4-2 i. S4O6-2 j. H2S-2 36. Perubahan berikut menunjukkan penurunan bilangan oksidasi sebanyak 5 tingkat terdapat pada.... f. MnO4-2 g. MnO4 MnO2 - h. IO3- Mn+2 I- i. MnO4- MnO2 j. Cr2O7-2 Cr+3 37. Jika senyawa magnesium amonium fosfat (MgNH4PO4) dilarutkan dalam air maka dalam larutan akan ada ion-ion.... f. Mg+2 dan NH4PO4-2 g. MgNH4+3 dan PO4-3 h. NH4+ dan MgPO4i. H4PO4+ dan MgNj. Mg+2, NH4+ dan PO4-3 38. Pada reaksi redoks dibawah ini, Sn + 4HNO3SnO2 + 4NO2 + 2H2O Yang berperan sebagai reduktor adalah.... f. SnO2 g. HNO3 h. Sn i. NO2 j. H2O 39. Zat yang merupakan oksidator dan hasil oksidasi pada reaksi berikut adalah.... 3HgS + 2HNO3 + 6HCl HgCl2 + S + NO + H2O f. HgS dan S g. HNO3 dan S h. HNO3 dan NO i. HNO3 dan HgCl2 j. HCl dan S 40. Diantara spesi berikut yang paling tidak mungkin digunakan sebagai reduktor adalah.... f. Na g. Fe+2 h. Na+ i. H2 j. Cl- 41. Besi yang berkarat merupakan hasil oksidasi dari Fe menjadi Fe2O3. Biloks besi dalam senyawa Fe2O3 (karat) tersebut adalah.... d. +1 d. +4 e. +2 e. +5 f. +3 42. Salah satu senyawa asam dari unsur karbon adalah H2C2O4, biloks C dalam senyawa tersebut adalah.... d. +1 d. +4 e. +2 e. +5 f. +3 43. Nama IUPAC yang benar untuk senyawa Cu2S adalah.... f. Tembaga(II) sulfida g. Tembaga(II) sulfat h. Tembaga(II) sulfit i. Tembaga(I) sulfida j. Tembaga(I) sulfit 44. Rumus kimia dari timah(IV) sulfat adalah.... f. SnS4 g. SnS2 h. Sn2(SO4)4 i. SnSO4 j. Sn(SO4)2 45. Pemberian nama yang tepat untuk FeCO3 adalah …. a. Besi(II) karbonat b. Besi(III) karbonat c. Besi(II) oksida d. Besi(III) oksida e. Besi(II) karbon oksida 46. Penulisan rumus kimia dari kromium(III) sulfat adalah …. a. CrSO4 b. CrSO3 c. Cr2(SO4)3 d. Cr2(SO3)3 e. Cr2(SO4)2 47. Nama kimia dari senyawa As2O3 adalah .... a. Arsen dioksida b. Diarsen trioksida c. Arsen(II) oksida d. Arsen(III) oksida e. Diarsen oksida 48. Nama yang tepat untuk senyawa FeSO4 adalah .... a. Besi sulfat b. Besi(II) sulfat c. Fero sulfat d. Besi(III) sulfat e. Feri sulfat 49. Parameter berikut yang tidak termasuk parameter air bersih adalah.... a. DO tinggi b. BOD tinggi c. pH sekitar 6,5-8,4 d. Kekeruhan e. tidak berwarna 50. Diantara proses berikut 1. Karbon organik 2. Fosforus organik 3. Nitrogen organik 4. Belerang organik Perubahan yang terjadi dalam pengolahan air kotor dengan lumpur aktif adalah.... a. Semua b. 1,2 dan 3 c. 2,3 dan 4 d. 1 dan 3 e. 2 dan 4 Lampiran 10 KISI-KISI INSTRUMEN MOTIVASI Variabel Indikator Memberikan motivasi Motivasi Memperhatikan perkembangan hasil belajar Hubungan materi dengan pendekatan pembelajaran Kesulitan belajar Jumlah Butir soal 1, 3,5,13,14, 19, 24 dan 27 2,4, 16, 23, 20 dan 29 6, 15, 23, 26 dan 29 Jumlah 8 7, 8, 9, 10, 11, 12, 17, 21, 22, 25 dan 30 11 6 5 30 Indikator koesioner pengaruh motivasi terhadap hasil belajar siswa No Aspek Indikator Pertanyaan 1. 2. Memberikan motivasi Memberikan motivasi Saya tertarik mengikuti pelajaran pelajaran kimia materi pokok larutan elektrolit dan konsep redoks Saya tidak tertarik dengan pelajaran kimia materi pokok larutan elektroit dan konsep redoks Pendekatan Kontekstual kurang menarik dan membuat saya bosan Saya benar-benar senang mempelajari materi Larutan Elektrolit dan Konsep Redoks. Pembelajaran ini menarik bagi saya dan membuat saya tidak bosan. Pembelajaran Kontekstual ini membuat saya menjadi aktif dalam kegiatan belajar mengajar. Rasa ingin tahu saya sering kali tergerak olehh pertanyaan yang dikemukakan dan masalah yang diberikan guru pada materi pembelaajaran ini. Pada pembelajaran ini tidak ada hal-hal yang dapat merangsang rasa ingin tahu saya. Memperhatikan Memperhatikan Pendekatan Kontekstual perkembangan perkembangan membantu memudahkan hasil belajar. hasil belajar saya dalam memahami konsep Larutan Elektrolit dan Konsep Redoks. Saya dapat menghubungkan isi pembalajaran ini dengan hal-hal yang telah saya lihat, saya lakukan atau saya pikirkan didalam kehidupan Nomor item Ket 1 2 3 4 5 3. Hubungan materi dengan model pembelajaran Hubungan materi dengan pendekatan pembelajaran 4. Kesulitan belajar Kesulitan belajar sehari-hari. Saya yakin akan berhasil dalam pembelajaran ini. Saya memperhatikan penjelasan guru tentang konsep Larutan Elektrolit dan Konsep Redoks. Dengan diterapkannya pendekatan Kontekstual saya lebih berani bertanya kepada guru pada saat proses belajar mengajar berlangsung. Jelas bagi saya bagaimana hubungan materi dalam pembelajaran ini dengan apa yang telah saya ketahui. Saya senang belajar melalui kegiatan observasi secara langsung/praktikum dalam pembelajaran ini. Saya tidak suka dengan materi Larutan Elektrolit dan Konsep Redoks Isi pembelajaran ini tidak sesuai dengan harapan dan tujuan saya. Menurut pendapat saya materi pembelajaran lebih mudah diingat dengan menggunakan Pendekatan Pembelajaran Kontekstual. Tugas-tugas latihan pada pembelajaran ini terlalu sulit. Pembelajaran ini tidak relevan dengan kebutuhan saya sebab sebagian besar isinya tidak saya ketahu Saya tidak yakin akan berhasil pada pembelajaran ini. Saya tidak melihat adanya hubungan antara isi materi dalam pembelajaran ini dengan sesuatu yang telah saya ketahui. Tugas-tugas latihan pada pembelajaran ini tidak terlalu sulit. Pada saat pembelajaran pendekatan kontekstual saya lebih suka bermain dan bercanda dengan teman. Sedikitpun saya tidak memahami materi pembelajaran ini. Saya tidak suka dengan materi Larutan Elektrolit dan Konsep Redoks. Walaupun sudah diterapkan Pembelajaran Pendekatan Kontekstual saya tetap malu bertanya pada guru jika ada hal-hal yang tidak saya pahami. Saya masih merasa kebingungan dan kesulitan mengerjakan soal-soal Larutan Elektrolit dan Konsep Redoks meskipun sudah diterapkan Pembelajaran pendekatan kontekstual. Saya pasif dalam kegiatan belajar mengajar meskipun sudah diterapkan Pembelajaran Pendekatan Kontekstual. Lampiran 11 ANGKET MOTIVASI SISWA Mata Pelajaran : Kimia Kelas/Semester : X / genap Hari/Tanggal : PETUNJUK: 1. Pada angket ini terdapat 30 pertanyaan. Pertimbangkan baik-baik setiap pertanyaan dalam kaitannya dengan materi pembelajaran yang baru selesai anda pelajari, dan tentukan kebenaranya. Berilah jawaban yang benar-benar cocok dengan pilihan anda. 2. Pertimbangkan setiap pernyataan secara terpisah dan tentukan kebenarannya. Jawaban anda jangan dipengaruhi oleh jawaban terhadap pernyataan lain. Jawaban anda tidak akan mempengaruhi nilai disekolah anda. 3. Berikan penilaian anda secara jujur, objektif, dan penuh tanggungjawab dengan cara memberi tanda checklist (√) pada salah satu dari lima pilihan dibawah ini. Keterangan: Alternatif jawaban Bobot penilaian Sangat Tidak Setuju (STS) Tidak Setuju (ST) Kurang Setuju (KS) Setuju (S) Sangat Setuju (SS) No Pernyataan 1 Saya tertarik mengikuti pelajaran kimia materi pokok Larutan Elektrolit dan Konsep Redoks. 2 Pendekatan Kontekstual membantu memudahkan saya dalam memahami materi Larutan Elektrolit dan Konsep Redoks sehingga mampu mengerjakan soal-soal dengan baik. 3 Saya tidak tertarik dengan pelajaran kimia materi pokok Larutan Elektrolit dan Konsep Redoks. 4 Saya dapat menghubungkan isi pembelajaran inidengan hal-hal yang telah saya lihat, saya lakukan atau saya pikirkan didalam kehidupan sehari-hari. 5 Pendekatan Kontekstual kurang menarik dan membuat saya bosan. 6 Jelas bagi saya bagaimana hubungan materi dalam pembelajaran ini dengan apa yang telah saya ketahui. 7 Tugas-tugas latihan pada pembelajaran ini terlalu sulit. 8 Pembelajaran ini tidak relevan dengan kebutuhan saya sebab sebagian besar isinya tidak saya ketahui. 9 Saya tidak yakin akan berhasil pada pembelajaran ini. 10 Saya tidak melihat adanya hubungan antara isi materi dalam pelajaran ini dengan sesuatu yang telah saya ketahui. 11 Tugas-tugas latihan pada pembelajaran ini tidak terlalu sulit 12 Pada saat Pembelajaram kontekstual saya lebih suka bermain dan bercanda dengan teman. 13 Saya benar-benar senang mempelajari materi Larutan Elektrolit dan Konsep Redoks. 14 Pembelajaran ini menarik bagi saya dan membuat saya tidak bosan. 15 Saya senang belajar melalui kegiatan observasi secara langsung/pratikum dalam pembelajaran ini. 16 Saya yakin akan berhasil dalam pembelajaran ini. 17 Sedikit pun saya tidak memahami materi pembelajaran ini. 18 Saya memperhatikan penjelasan guru tentang Larutan elektrolit dan Konsep Redoks. 19 Pendekatan Kontekstual menjadi aktif dalam membuat saya kegiatan belajar mengajar. 20 Dengan diterapkannya pendekatan kontekstual saya lebih berani bertanya kepada guru pada saat proses belajar mengajar berlangsung. 21 Saya tidaksukadenganmateriLarutan Elektrolit dan Kosep Redoks. 22 Walaupun sudah diterapkan pendekatan Kontekstual saya tetap malu bertanya pada guru jika ada hal-hal yang tidak saya pahami. 23 Isi pembelajaran ini sesuai dengan harapan dan tujuan saya 24 Rasa ingin tahu saya sering kali tergerak oleh pertanyaan yang dikemukakan dan masalah yang diberikan guru pada materi pembelajaran ini. 25 Saya masih merasa kebingungan dan kesulitan mengerjakan soal-soal Larutan Elektrolit dan Konsep Redoks meskipun sudah diterapkan Pendekatan kontekstual. 26 Isi pembelajaran ini tidak sesuai dengan harapan dan tujuan saya. 27 Pada pembelajaran ini tidak ada hal-hal yang dapat merangsang rasa ingin tahu saya. 28 Saya tidak senang belaja rmelalui kegiatan observasi secara langsung/pratikum dalam pembelajaran ini. 29 Menurut pendapat saya materi pembelajaran lebih mudah di ingat dengan menggunakan pendekatan Kontekstual. Saya pasif dalam kegiatan belajar mengajar meskipun sudah diterapkan Pendekatan 30 kontekstual. Keterangan : 1= Sangat Tidak Setuju 2= Tidak Setuju 3= Kurang Setuju 4= Setuju 5 =Sangan Setuju Lampiran 12 Lembar Isian Angket Afektif Nama sekolah : SMA Negeri 1 Amarasi Nama siswa : Kelas : Hari/tanggal : Petunjuk 1. Pernyataan ini berkaitan dengan kebiasaanmu sehari-hari. Hal ini sama sekali tidak akan berpengaruh pada nilaimu disekolah. Atas partisipasinya diucapkan terimakasih. 2. Berilah tanda cek (√ ) pada kolom pilihan sesuai dengan kebiasaanmu sehari-hari (SL, SR, JR dan TP) dengan arti sebagai berikut : SL = Selalu, SR = Sering, JR = Jarang danTP = Tidak pernah. A. Saling membantu No Pernyataan Pilihan SL 1. Saya membantu teman yang kesusahan. 2. Saya membantu menjelaskan kepada teman yang sulit memahami materi kimia. 3. Saya membantu teman mengerjakan tugas atau PR kimia. 4. Saya membantu petugas piket harian di kelas untuk membersihkan kelas. 5. Saya berpura-pura sakit saat teman meminta bantuan saya. SR JR TP B. Bekerja sama No Pernyataan Pilihan SL 1. SR JR TP Saya bekerjasama dengan teman kelompok saat mengerjakan soal-soal yang ada dalam LDS dan atau LKS 2. Saya bekerjasama dengan teman kelompok saat mengerjakan tugas atau PR 3. Saya bekerjasama dengan teman lain saat mengerjakan tugas atau PR 4. Saya bekerjasa dengan teman kelompok saat mempresentasekan hasil diskusi kelompok. 5. Saya bekerjasama dengan petugas piket harian di kelas untuk membersihkan kelas. C. Bertanggung jawab dan teliti No Pernyataan Pilihan SL SR JR TP 1. Saya mnegerjakan tugas atau PR yang diberikan oleh guru. 2. Saya mengumpulkan tugas atau PR tepat waktu. 3. Saya mengerjakan soal didalam LDS dan atau LKS. 4. Saya mengerjakan tugas atau PR dengan teliti. 5. Saya mengerjakan soal didalam LDS dan atau LKS dengan teliti. D. Disiplin No Pernyataan Pilihan SL SR JR TP 1. Saya datang ke sekolah tepat waktu 2. Saya mengumpulkan tugas atau PR tepat waktu. 3. Saya datang sekolah lebih awal saat piket kebersihan kelas. 4. Saya meminta izin sebelum meninggalkan ruangan kelas saat pelajaran berlangsung. 5. Saya mengikuti seluruh peraturan dan tata tertib sekolah. E. Aktif No Pernyataan Pilihan SL SR JR TP 1. Saya memberi saran dan masukan saat diskusi kelompok. 2. Saya melakukan eksperimen 3. Saya menjawab pertanyaan yang diberikan guru kimia kepada saya. 4. Saya mempresentasekan hasil kerja atau diskusi kelompok. 5. Saya memberikan jawaban dari petanyaan yang ada pada LDS dan atau LKS. Lampiran 13 Lembar Penilaian Tes Hasil Belajar (THB) Psikomotor Pendekatan Kontekstual (RPP 01,02 dan 03) Petunjuk! Berikut ini diberikan suatu daftar aspek yang akan diamati terhadap aktivitas siswa selama kegiatan pembelajaran (melakukan eksperimen), dan berilah tanda cek ( ) pada kolom yang sesuai. No Aspek yang di nilai 1 1. 2. 3 4. Keterampilan menyiapkan alat dan bahan Ketrampilan merangkai alat Ketrampilan bereksperimen Ketrampilan bereksperimen 5 Mengamati hasil percobaan 6 Posisi mengamati Rubrik penilaian psikomotor Skor 2 3 4 No Aspek yang di nilai . 1. Keterampilan menyiapkan alat dan bahan 2. Ketrampilan merangkai alat 3. Ketrampilan memasukkan sampel dalam larutan. 4. Ketrampilan mencelupkan elektroda (paku). 5 Posisi mengamati nyala lampu dan gelembung gas Rubrik 1: semuanya dibantu oleh guru. 2: sebagian besar dibantu oleh guru 3:sebagian besar dikerjakan oleh siswa 4: dilakukan semua oleh siswa tanpa bantuan guru Amarasi,......Mei 2014 Pengamat Lampiran 14 LEMBAR PENGAMATAN KEMAMPUAN GURU DALAM MENGELOLA PEMBELAJARAN KONTEKSTUAL Materi Pelajaran Kelas/ Semester Materi Pokok Hari/Tanggal : KIMIA : XI/I : Larutan Elektrolit dan Konsep Redoks : …………….. Nama Guru Pertemuan ke :Maria Hoar………. :I, II, dan III………. Waktu :…2x45 menit……. Petunjuk : Daftar pengelolaan pembelajaran pendekatan kontekstual yang dilakukan guru di kelas. Berikan penilaian sesuai yang diamati dimana penilaiannya dari A - D yang ada pada kolom penilaian di bawah ini: ( catatan: keterangan Huruf A – D ada di bagian bawah tabel ) No I Aspek Yang Diamati Pendahuluan Fase I kegiatan pembelajaran pendahuluan 1.Guru menyapa siswa dan menyampaikan tujuan pembelajaran yang hendak dicapai 2.Guru memotivasi siswa Keterlaksanaan Ya Tidak A √ √ √ √ Penilaian B C D II Kegiatan Inti Fase II Menyampaikan Materi Pembelajaran Secara Singkat √ √ 1. Guru Membagi Siswa Kedalam Kelompok √ Kecil 2. Guru Membagikan LKS Kepada Setiap √ Kelompok Dan Meminta Masing-Masing Kelompok Menyiapkan Alat Dan Bahan 3. Guru Membimbing Siswa Dalam Melakukan Eksperimen Dan Menganalisa Hasil √ Pengamatan √ Fase III Memancing Kerja Siswa √ √ FASE IV Pemberian Umpan Balik 1. Guru Meminta Masing-Masing Kelompok Mendiskusikan Dan Menganalisa Hasil √ Pengamatan 2. Guru Meminta Perwakilan Dari Salah Satu Kelompok Melaporkan Hasil Diskusi √ Keompoknya Dan Kelompok Lain Menanggapi Penutup Fase V Tindak Lanjut 1. Membimbing siswa membuat kesimpulan dan rangkuman hasil pembelajaran yang √ sudah dipelajari 2. Memberikan tugas rumah kepada siswa berupa membuat laporan hasil percobaan √ IV Pengelolaan waktu √ V Suasana kelas 1. Siswa antusias 2. Guru antusias. √ √ Keterangan: Huruf A : Baik ( Nilai 3,50-4,00 ) Huruf B : Cukup Baik ( Nilai 3,00-3,49 ) Huruf C : Kurang Baik ( Nilai 2,00-2,99 ) Huruf D : Tidak Baik ( Nilai 1,00-1,99 ) √ √ √ √ √ √ Kupang, 2014 Pengamat (Yosefince Ismael,S. Pd ) RAN 15 ama eran efbana Taemenas nbay Tallas A. Tefa Boimau Klau Maakh a umone fonia Babis s Keo osary Seuk us Missa Damung ambert Missa Nggepe Haumeni ssi LAH LEMBAR PENILAIAN KOGNITIF SKOR SKOR MAX NILAI KETUNTASAN Nomor Item Pertanyaan 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 C D C C A A C B E D E C E C A D C E D B B C B A B E C C D A D D D A C B E C A D C C A C A C D BE C 1 1 1 1 1 0 1 1 1 1 1 0 1 0 1 1 1 1 0 1 1 0 0 1 1 0 1 0 1 1 1 1 0 1 1 1 0 1 1 1 0 1 1 1 1 1 1 1 1 1 39 50 78 TUNTAS 1 1 1 1 1 1 0 0 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 0 1 1 1 1 1 1 1 0 0 1 1 0 0 1 1 0 1 0 1 0 1 1 40 50 80 TUNTAS 1 1 1 1 1 1 1 1 1 1 1 0 1 1 1 1 1 1 0 1 1 1 0 1 1 0 0 1 1 1 1 1 1 1 1 0 1 1 0 1 1 0 1 1 1 0 0 1 1 0 39 50 79 TUNTAS 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 0 1 1 1 1 1 1 1 1 1 1 1 1 1 1 0 1 0 1 1 1 0 1 46 50 92 TUNTAS 1 1 1 1 1 1 1 0 1 1 0 1 1 0 1 1 0 0 1 1 0 1 1 1 0 1 1 0 1 0 1 0 1 1 1 1 1 1 1 1 1 1 1 0 1 1 1 0 1 1 38 50 77 TUNTAS 1 1 1 1 1 1 1 1 1 1 1 1 1 1 0 1 1 1 1 1 0 1 1 1 1 1 0 1 0 0 0 1 1 1 1 1 1 1 0 1 1 0 1 1 0 1 1 0 0 1 39 50 78 TUNTAS 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 0 1 1 1 1 1 0 0 0 1 1 1 1 1 1 1 0 1 1 1 1 1 1 1 1 1 1 1 45 50 91 TUNTAS 0 1 1 0 1 0 1 1 1 1 1 0 1 0 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 0 1 1 0 1 1 0 42 50 85 TUNTAS 1 0 1 1 0 1 1 1 1 1 0 1 1 1 0 1 1 0 1 0 1 1 0 1 1 1 1 1 1 1 0 1 1 1 1 0 1 1 1 1 1 1 1 1 1 0 1 1 1 0 39 50 78 TUNTAS 1 1 0 1 1 1 1 0 1 1 1 1 1 1 1 0 1 1 0 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 0 1 1 1 1 1 1 1 1 1 0 1 1 1 44 50 89 TUNTAS 1 1 1 1 1 1 0 1 1 0 1 1 1 1 1 0 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 0 1 1 1 1 1 0 1 1 1 1 0 1 1 1 1 1 1 44 50 89 TUNTAS 1 1 0 1 0 1 1 0 1 0 1 0 0 1 0 1 1 1 1 1 1 0 1 1 1 1 1 0 1 1 1 0 1 1 1 1 1 1 1 0 1 1 1 1 1 1 1 1 0 1 38 50 76 TUNTAS 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 0 1 0 1 1 1 1 1 0 0 0 1 1 1 1 0 1 1 1 1 1 1 0 1 1 0 1 0 1 1 0 1 0 39 50 78 TUNTAS 1 1 1 1 1 1 0 1 1 1 1 0 1 1 1 1 0 0 1 1 1 1 1 1 1 1 0 1 1 1 1 1 1 1 0 1 1 1 1 1 1 1 1 1 1 1 1 0 0 0 41 50 82 TUNTAS 1 1 1 1 1 1 0 1 0 0 0 1 1 0 1 1 1 1 1 0 1 1 1 1 1 1 0 1 1 1 1 1 1 0 1 1 0 1 1 1 1 1 1 1 0 1 1 1 1 1 40 50 80 TUNTAS 1 1 1 0 0 1 1 0 1 1 1 1 1 1 1 1 1 1 1 1 1 1 0 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 0 1 1 1 1 1 1 1 45 50 90 TUNTAS 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 0 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 0 1 48 50 97 TUNTAS 1 1 1 1 1 1 1 1 1 0 0 1 1 1 1 1 1 1 0 1 0 1 1 1 0 1 1 1 0 1 1 1 0 1 1 1 1 1 1 1 1 0 1 1 1 1 0 1 1 0 40 50 81 TUNTAS 1 0 1 0 0 1 0 1 0 1 0 1 1 0 0 1 1 1 1 1 0 0 0 1 1 1 0 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 0 1 1 0 1 0 35 50 70 TUNTAS 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 0 1 0 1 1 1 1 1 1 1 1 1 1 1 1 1 0 1 1 1 0 1 1 1 1 46 50 92 TUNTAS 1 1 1 1 1 1 1 1 1 0 1 0 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 0 1 1 1 1 1 0 1 1 0 1 1 1 1 1 1 1 1 1 1 1 0 1 44 50 88 TUNTAS 20 19 19 18 17 19 16 16 19 16 16 15 20 16 17 19 19 17 17 18 17 18 14 21 19 17 15 13 18 18 18 19 17 19 20 18 16 21 17 18 19 17 18 17 16 17 16 17 15 14 MATRIKS HASIL PENGAMATAN KEMAMPUAN PSIKOMOTOR SISWA Aspek Yang Diamati Menyiapkan alat dan Bahan Merangkai alat bereksperimen ereksperimen asil percobaan mati Jumlah Skor Skor Maks Nilai P Keterangan AB 4 3 3 3 4 4 21 24 87,5 AT 4 3 3 2 2 3 17 24 70,83 1 DT 4 2 3 3 2 4 18 24 75 78,33 Tuntas DS 3 4 2 3 4 3 19 24 79,16 DAT 4 3 3 2 3 4 19 24 79,16 FAT 3 4 4 4 3 2 20 24 83,33 2 IB 4 3 3 4 3 4 21 24 87,5 ISK 3 3 4 3 2 3 18 24 75 79,165 Tuntas KODE SISWA / KELOMPOK 3 4 JDM JF ML MTB MK MRS NM 3 3 3 3 3 2 2 3 3 3 3 3 3 3 2 4 3 4 2 4 4 4 4 3 2 3 4 4 3 4 3 4 4 3 3 2 3 4 2 3 2 3 17 21 19 18 18 18 19 24 24 24 24 24 24 24 70,83 87,5 76,16 75 75 75 79,16 78,415 79,1625 Tuntas Tuntas PD 4 2 3 4 3 4 20 24 83,33 RL 2 3 3 4 3 4 19 24 79,16 YM 4 4 2 3 3 4 20 24 83,33 5 YN 4 3 3 4 3 3 20 24 83,33 82,58 Tuntas Jmlh Skor Maks P YEH 4 3 3 2 4 3 19 24 76,16 YTR 3 2 4 4 4 4 21 24 87,5 69 63 66 69 67 68 84 84 84 84 84 84 82,14 75 78,57 82,14 79,76 80,95 95,712 Tuntas Lampiran 20 Analisis Stasistik a. Uji Persyaratan 1) Uji Normalitas data Untuk mengetahui apakah data berdistribusi normal atau tidak maka digunakan data nilai akhir keseluruhan hasil belajar siswa. Tabel. Hasil Belajar Siswa No 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 Nama Siswa Aryo Bureran Anitha Tefbana Damesius Taemenas Desire sonbay Dorince A. Tallas Frengky A. Tefa Imanuel Boimau Irene S. Klau Jefry D. Maakh Jilder Fina Maria Liunome Maria Trivonia Babis Melkianus Keo Melina Rosary Seuk Nikodemus Missa Paulina Damung Rudolf Lambert Yofiana Missa Yohanes Nggepeng Yulen E. Haymeni Yanes T. Rassi Data terbesar = 97 Data terkecil = 70 Hasil Belajar Siswa 78 80 79 92 77 78 91 85 78 89 89 76 78 82 80 90 97 81 70 92 88 n = 21 R = Data terbesar ─ Data terkecil = 97- 70 = 27 Banyaknya Kelas (k) = 1 + 3,3 log n = 1 + 3,3 log 21 = 1 + 3,3 (1,322) = 1+4,3626 = 5,3626 ≈ 5 Interval Kelas (i) = R k = = 5,4 ≈ 5 Tabel Distribusi Frekuensi Kelas 70─ 74 75─ 79 80 ─ 84 85─ 89 90 ─ 94 95─99 ∑ F 1 7 4 4 4 1 21 xi 72 77 82 87 92 97 507 F.xi 72 539 328 348 368 97 1750 Keterangan : Kolom 1 : kelas Kolom 2 : frekuensi Kolom 3 : Xi (nilai tengah) = Rumus untuk menghitung Mean dari data bergolong adalah : Me = Dimana : Me : Mean untuk data bergolong ∑f : Jumlah data atau sampel Fixi : Produk perkalian antara Fi pada tiap interval data rata-rata dari nilai terendah dan tertinggi setiap interval data. Misalnya xi untuk interval pertama Berdasarkan tabel penolong di atas, maka Mean dari data di atas adalah : = 72 Me = x = = = 83,33 Selanjutnya dilakukan pengujian untuk mengetahui standar deviasi atau simpangan baku dari data dengan rumus sebagai berikut : x S= Untuk data interval nilai tes kimia dari sampel sebanyak 21orang siswa, standar deviasi dapat dihitung dengan rumus di atas, setelah terlebih dahulu menyusun tabel penolong. Pada pengujian sebelumnya telah diketahui rata-rata nilai tes sampel adalah 83,33 Tabel penolong untuk menghitung standar deviasi dari sampel Kelas F Xi x 70 ─ 74 75─ 79 1 7 72 77 -11,33 -6,33 80─ 84 85─ 89 90 ─ 94 95 ─ 99 ∑ 4 4 4 1 21 82 87 92 97 ─ x )2 ( 128,3689 40,0689 -1,33 3,67 8,67 13,67 ─ 1,7689 13,4689 75,1689 186,8689 ─ x )2 fi( 128,3689 280,4823 7,0756 53,8756 300,6756 186,8689 957,3469 Berdasarkan rumus untuk menghitung standar deviasi data bergolong, maka standar deviasi atau simpangan baku dari sampel adalah : x S= = = =6,9 Jadi, standar deviasi nilai tes kimia dari sampel sebanyak 21 orang siswa adalah 6,9 Berdasarkan data sebelumnya, diketahui n = 21, k =5, maka pengujian selanjutnya adalah uji dengan chi kuadrat. Tabel kerja pengujian normalitas dengan rumus chi kuadrat 1 N Kelas o . 70 ─ 74 Batas kelas z-score 69,5 -2,0 Batas luas Luas daerah daerah 0,4772 0,0792 Fe 1,6632 F0 2 75 ─ 79 74,5 -1,27 1 0,3980 0,1892 3 80─ 84 79,5 7 3,9732 -0,5 0,1915 0,1279 4 85 ─ 89 84,5 4 2,6859 0,16 0,0636 5 90─ 94 89,5 0,89 0,3133 6 95 ─ 99 94,5 99,5 -5,2437 4 -0,133 -2,793 4 0,0459 0,9639 1 1,61 0,4463 7 -0,2497 2,34 0,4004 Keterangan : Kolom 2 : Kelas interval Kolom 3 : Batas kelas, yaitu angka skor kiri kelas interval pertama dikurangi 0,5 dan kemudian angka skor-skor kanan kelas interval ditambah 0,5 Kolom 4 : Nilai Z – score = Z1 = = -2,0 Z2 = = -1,27 Z3 = = -0,5 Z4 = = 0,16 Z5 = = 0,89 Z6 = = 1,61 Z7 = = 2,34 Kolom 5 : lihat tabel berdasarkan harga Z – score setiap kelas Kolom 6 : luas daerah = batas luas daerah yang lebih besar – batas luas daerah yang lebih kecil Kolom 7 : fe = n x luas daerah Kolom 8 : frekuensi observasi yaitu banyaknya data yang termasuk pada suatu kelas interval Selanjutnya digunakan rumus = untuk menghitung masing-masing kelas interval. = + + = 0,26 + 2,30 + 0,64+0,29+0,52+0,001=4,011 2 2 Dengan membandingkan x hitung dengan nilai x tabel untuk = 0,05 dan derajat kebebasan 2 (dk) = k – 2 = 5 – 2 = 3, maka di cari pada tabel chi-kuadrat didapat x tabel = 7,815 dengan kriteria pengujian sebagai berikut: Jika , artinya data berdistribusi normal, maka akan dilanjutkan dengan analisis korelasi dan regresi sederhana Jika , artinya distribusi data tidak normal Kesimpulan: karena atau 4,011 7,815, maka data berdistribusi normal sehingga analisis korelasi dan regresi dapat dilanjutkan. 2) Uji lineritas Langkah 1: Mencari nilai statistik menggunakan tabel penolong Tabel. Nilai motivasi dan hasil belajar 1 2 3 4 5 6 7 8 9 10 11 12 13 14 Nama Siswa Aryo Bureran Anitha Tefbana Damesius Taemenas Desire sonbay Dorince Apolonia Tallas Frengky A. Tefa Imanuel Boimau Irene S. Klau Jefry D. Maakh Jilder Fina Maria Liunome Maria Trivonia Babis Melkianus Keo Melina Rosary Seuk X 76 80 77 90 75 76 90 80 77 89 85 74 76 80 Y 78 80 79 92 77 78 91 85 78 89 89 76 78 82 X2 5776 6400 5929 8100 5625 5776 8100 6400 5929 7921 7225 5476 5776 6400 Y2 6084 6400 6241 8464 5929 6084 8281 7225 6084 7921 7921 5776 6084 6724 XY 5928 6400 6083 8280 5775 5928 8190 6800 6006 7921 7565 5624 5928 6560 15 16 17 18 19 20 21 Nikodemus Missa Paulina Damung Rudolf Lambert Yofiana Missa Yohanes Nggepeng Yulen E. Haymeni Yanes T. Rassi ∑ 78 90 94 80 68 90 85 1710 80 90 97 81 70 92 88 1750 6084 6400 8100 8100 8836 9409 6400 6561 4624 4900 8100 8464 7225 7744 142004 168796 6240 8100 9118 6480 4760 8280 7480 144346 Langkah 2: Mencari jumlah kuadrat regresi (JKReg[a]) JKReg[a] = = = = 145833,3 Langkah 3: Mencari jumlah kuadrat regresi (JKReg[b│a]) JKReg[b│a] = b JKReg[b│a] = 0,66 JKReg[b│a] = 0,66 JKReg[b│a] = (0,66).(946) JKReg[b│a] = 1218,36 Langkah 4: Mencari jumlah kuadrat residu (JKRes) JKRes = ∑ JKReg[b│a] JKReg[a] JKRes = = 1744,34 Langkah 5: Mencari rata-rata jumlah kuadrat regresi (RJKReg[a]) RJKReg[a] = JKReg[a] = Langkah 6: Mencari rata-rata jumlah kuadrat regresi (RJKReg[b│a]) RJKReg[b│a] = JKReg[b│a] = 1218,36 Langkah 7: Mencari rata-rata jumlah kuadrat residu (RJKRes) RJKRes = = = = 91,8 Langkah 8: Mencari jumlah kuadrat error (JKE) Sebelum mencari JKE data X diurutkan dari data yang terkecil sampai data yang terbesar berikut disertai dengan pasangannya (), seperti pada tabel berikut Tabel penolong pasangan variabel X dan Y untuk mencari JKE No 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 19 20 21 JKE = X Y 76 80 77 90 75 76 90 80 77 89 85 74 76 80 78 90 94 80 68 90 85 78 80 79 92 77 78 91 85 78 89 89 76 78 82 80 90 97 81 70 92 88 Menjadi X 68 74 75 76 76 76 77 77 78 80 80 80 80 85 85 89 90 90 90 90 94 Kelompok K1 K2 K3 K4 Y 78 80 79 92 77 78 K5 K6 K7 91 85 78 89 89 76 78 K8 K9 K10 K11 82 80 90 97 81 70 92 88 =(782- )+(802- )+(792- )+(922+772+782- )+(892+892+762+782)+(882- )+(822+802 )+(912+852)+(902- )+ )+(782- (972+812+702+922 - ) 141+18+0+146+2+434+0 = 741 Langkah 9: Mencari jumlah kuadrat tuna cocok (JKTC) JKTC = JKRes JKE Langkah 10: Mencari rata-rata jumlah kuadrat tuna cocok (RJKTC) RJKTC = = = = 111,48 Langkah 11: Mencari rata-rata jumlah kuadrat error (RJKE) RJKE = = = = 74,1 Langkah 12: Mencari nilai Fhitung = = 1,50 Langkah 13: Mencari Ftabel Dengan membandingkan Fhitung dengan nilai Ftabel untuk = 0,05 berdasarkan dk pembilang =9 dan dk penyebut = 10, maka di cari pada Ftabel didapat nilai Ftabel = 3,02 dengan kriteria pengujian sebagai berikut: Jika artinya data berpola linear, maka akan dilanjutkan dengan analisis korelasi dan regresi sederhana, sedangkan Jika Kesimpulan: karena , artinya data tidak berpola linear atau 1,50 analisis uji korelasi dan regresi dapat dilanjutkan. b. Korelasi Pearson Product Moment (PPM) 3,02, maka data berpola linear sehingga Analisi korelasi pearson product moment ini digunakan untuk mengetahui derajat hubungan antara variabel bebas (motivasi siswa) dengan variabel terikat (Hasil belajar). Tabel. Hubungan Motivasi Terhadap Hasil Belajar No 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 Nama Siswa Aryo Bureran Anitha Tefbana Damesius Taemenas Desire sonbay Dorince Apolonia Tallas Frengky A. Tefa Imanuel Boimau Irene S. Klau Jefry D. Maakh Jilder Fina Maria Liunome Maria Trivonia Babis Melkianus Keo Melina Rosary Seuk Nikodemus Missa Paulina Damung Rudolf Lambert Yofiana Missa Yohanes Nggepeng Yulen E. Haymeni Yanes T. Rassi ∑ rhitung = X 76 80 77 90 75 76 90 80 77 89 85 74 76 80 78 90 94 80 68 90 85 1710 Y 78 80 79 92 77 78 91 85 78 89 89 76 78 82 80 90 97 81 70 92 88 1750 X2 5776 6400 5929 8100 5625 5776 8100 6400 5929 7921 7225 5476 5776 6400 6084 8100 8836 6400 4624 8100 7225 142004 Y2 6084 6400 6241 8464 5929 6084 8281 7225 6084 7921 7921 5776 6084 6724 6400 8100 9409 6561 4900 8464 7744 148796 XY 5928 6400 6083 8280 5775 5928 8190 6800 6006 7921 7565 5624 5928 6560 6240 8100 9118 6480 4760 8280 7480 144346 Sesuai hitungan di atas maka nilai koefisien korelasi pearson product moment atau r = 0,82 yang berarti dejarat hubungan antara variabel terikat dan variabel bebas kuat. Selanjurnya, setelah mendapat koefisien korelasi (PPM) mak dilanjutkan pengujian signifikan dengan rumus: = = 6,25 Dengan membandingkan nilai dengan nilai dengan tingkat kesalahan α = 0,05 atau 5% dengan rumus derajat bebas (dk) = n - 2 = 21 - 2 = 19. Maka di cari pada didapat nilai Jika jika = 1,729 dengan kriteria pengujian sebagai berikut: ≥ berarti signifikan sedangkan Jika Kesimpulan: Karena berarti tidak signifikan ≥ atau 6,25 ≥ 1,729 maka signifikan, sehingga Ha diterima yang berarti terdapat hubungan yang signifikan antara motivasi dalam Pendekatan Kontekstual terhadap hasil belajar siswa SMA Negeri 1 Amarasi c. Koefisien Determinasi KP = x 100 % = 0,822 x 100% = 0,6725 x 100% = 67,25% d. Regresi Sederhana Analisis regresi ini dipakai untuk menganalisis pengaruh variabel bebas (motivasi siswa) dengan variabel terikat (Hasil belajar). Langkah-langkah menjawab regresi sederhana: Langkah 1: Membuat Ha dan Ho dalam bentuk kalimat : Terdapat pengaruh signifikan antara motivasi terhadap hasil belajar siswa dalam Pendekatan Kontekstual. : Tidak terdapat pengaruh signifikan antara motivasi terhadap hasil belajar siswa dalam Pendekatan Kontekstual. Langkah 2: Membuat Ha dan Ho dalam bentuk statistik a: r ≠ H0: r = 0 Langkah 3: Membuat tabel penolong untuk mencari angka statisik Tabel. Nilai motivasi dan hasil belajar 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 Nama Siswa Aryo Bureran Anitha Tefbana Damesius Taemenas Desire sonbay Dorince Apolonia Tallas Frengky A. Tefa Imanuel Boimau Irene S. Klau Jefry D. Maakh Jilder Fina Maria Liunome Maria Trivonia Babis Melkianus Keo Melina Rosary Seuk Nikodemus Missa Paulina Damung Rudolf Lambert Yofiana Missa Yohanes Nggepeng Yulen E. Haymeni Yanes T. Rassi X 76 80 77 90 75 76 90 80 77 89 85 74 76 80 78 90 94 80 68 90 85 Y 78 80 79 92 77 78 91 85 78 89 89 76 78 82 80 90 97 81 70 92 88 X2 5776 6400 5929 8100 5625 5776 8100 6400 5929 7921 7225 5476 5776 6400 6084 8100 8836 6400 4624 8100 7225 Y2 6084 6400 6241 8464 5929 6084 8281 7225 6084 7921 7921 5776 6084 6724 6400 8100 9409 6561 4900 8464 7744 XY 5928 6400 6083 8280 5775 5928 8190 6800 6006 7921 7565 5624 5928 6560 6240 8100 9118 6480 4760 8280 7480 ∑ 1710 1750 142004 148796 Langkah 4: Memasukan angka-angka statistik dari tabel penolong Meghitung rumus b =0,66 Meghitung rumus a a a a 29,59 Langkah 5: Mencari jumlah kuadrat regresi (JKReg[a]) JKReg[a] = = = = 145833,3 Langkah 6: Mencari jumlah kuadrat regresi (JKReg[b│a]) JKReg[b│a] = b JKReg[b│a] = 0,66 JKReg[b│a] = 0,66 JKReg[b│a] = (0,66).(1846) JKReg[b│a] = 1218,36 Langkah 7: Mencari jumlah kuadrat residu (JKRes) 144346 JKRes = ∑ JKReg[b│a] JKReg[a] JKRes = 148796 145833,3= 1744,34 Langkah 8: Mencari rata-rata jumlah kuadrat regresi (RJKReg[a]) RJKReg[a] = JKReg[a] = Langkah 9: Mencari rata-rata jumlah kuadrat regresi (RJKReg[b│a]) RJKReg[b│a] = JKReg[b│a] = 1218,36 Langkah 10: Mencari rata-rata jumlah kuadrat residu (RJKRes) RJKRes = = = = 91,8 Langkah 11: Menguji signifikan = 13,27 Kaidah pengujian Jika Fhitung ≥ Ftabel,, maka tolak Ho, Fhitung ≤ Ftabel,, maka terima Ho Dengan taraf signifikan (α) = 0,05, maka Ftabel = ; , Ftabel= 4,38 Kesimpulan karena Fhitung ≥ Ftabel, atau 13,27 ≥4,38, maka tolak Ho, artinya terdapat pengaruh yang signifikan antara motivasi terhadap Hasil belajar siswa dalam Pendekatan Kontekstual. Persamaan Regresi = a + bX = 29,59+ 0,66X