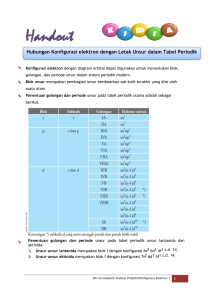
UNSUR LOGAM Lintannisa Rahmatia, M.Si KIMIA ANORGANIK IKATAN LOGAM 1 Memiliki daya hantar listrik/ panas yang baik 2 Keras, dapat ditempah dan ditarik (Meabilitas & Duktilitas) 3 Tersusun dalam kristal logam dalam bentuk padatnya 4 Memiliki titik didih dan titik leleh tinggi 5 Mengkilap Sifat Logam Te o r i y a n g M e n j e l a s k a n Ikatan Logam 01 02 03 Teori Awan Elektron Teori Resonansi Teori Orbital Molekul Te o r i A w a n Elektron 01 • Menurut Drude dan Lorentz pada awal abad ke-20, di dalam kristal logam, setiap atom melepaskan elektron valensinya kation sehingga membentuk yang bermuatan positif awan tersusun elektron dan rapat dalam awan elektron tersebut. • Te o r i ini elektron memprediksi berdasarkan probabilitas pada posisi fungsi dasarnya kemungkinan lokasi probabilitas. Fungsi menggambarkan wilayah seperti awan di mana elektron mungkin ditemukan. TEO RI AWAN ELEKTRON Ikatan logam dapat didefenisikan sebagai gaya tarik antara kation-kation logam dengan awan elektron yang bermuatan negatif yang terbentuk dari elektron valensi yang dilepaskan dari atom-atom logam. 02 T E O R I R E S O N A N S I • Pada tahun logam 1965 dengan Pauling mengemukakan menetapkan konsep ikatan resonansi. Menurut teori ini ikatan logam merupakan ikatan kovalen yang dapat didelokalisasikan ke semua atom yang terdapat dalam kristal logam. • Pauling meninjau kristal logam Li, dari pola d i f ra k s i s in a r- X d a p a t d i k et a h u i b a h w a s e t ia p a t o m Li dikelilingi oleh 8 atom Li yang lain. Bila atom Li menggunakan elektron valensinya, maka resonansi pasangan ikatan Li-Li didalam kisi kristalnya. terjadi secara serempak TEORI RESONANSI • Sehingga ikatan logam menurut teori ini adalah ikatan yang terjadi antara atom logam dengan 8 atau 12 atom logam yang lainnya. Misalnya ikatan antara logam Na dengan 8 logam Na yang lainnya. T E O R I O R B I TA L MOLEKUL 03 • Te o r i i n i d i s e b u t j u g a t e o r i p i t a e n e r g i , o r b i t a l orbital yang sama dari atom-atom logam mengalami kombinasi linear membentuk orbital-orbital bonding dan orbital-orbital tersebut memiliki antibonding. perbedaan Orbital-orbital tingkat energi yang kecil dan membentuk suatu pita yang disebut dengan pita energi. TEORI O R B I TA L MOLEKUL • Ikatan logam adalah ikatan yang disebabkan oleh adanya elektron valensi suatu logam yang tidak terarah (delocalized). Misalnya pada logam Li memiliki struktur 1s2 2s1. Elektron 1s2 terdapat dalam orbital yang terarah (localized) sedangkan elektron dalam 2s1 terdapat pada orbital tidak terarah (delocalized). Elektron 2s inilah yang akan membentuk ikatan. P I TA E N E R G I 3 MACAM PITA ENERGI Pita Valensi, berisi elektron penuh Pita Konduksi, berisi elektron setengah penuh Pita Terlarang, berisi elektron tidak S I FAT L O G A M YA N G D A PAT D I J E L A S K A N LOGAM BERSIFAT MENGKILAP Elektron yang bergerak bebas pada logam dapat menyerap foton cahaya. Bila cahaya tampak jatuh pada permukaan logam, cahaya tersebut akan terserap lalu sebagian elektron valensi yang mudah bergerak tersebut akan tereksitasi. Ketika elektron yang tereksitasi tersebut kembali kepada keadaan dasarnya, maka energi cahaya dengan panjang gelombang tertentu akan dipancarkan kembali. S I FAT L O G A M YA N G D A PAT D I J E L A S K A N LOGAM BERSIFAT MENGHANTARKAN LISTRIK Daya hantar listrik pada logam, disebabkan karena adanya elektron valensi yang mudah bergerak. elektron-elektron valensi tersebut bebas bergerak dalam medan listrik yang ditimbulakan sumber arus sehingga listrik dapat mengalir melalui logam. S I FAT L O G A M YA N G D A PAT D I J E L A S K A N LOGAM BERSIFAT MENGHANTARKAN PANAS Daya hantar panas disebabkan adanya elektron yang dapat bergerak dengan bebas. Bila bagian tertentu dipanaskan, maka elektron-elektron pada bagian logam tersebut akan menerima sejumlah energi sehingga energi kinetisnya bertambah dan gerakannya makin cepat. Elektronelektron yang bergerak dengan cepat tersebut menyerahkan sebagian energi kinetisya kepada elektron lain sehingga seluruh bagian logam menjadi panas dan naik suhunya. S I FAT L O G A M YA N G D A PAT D I J E L A S K A N LOGAM DAPAT DITEMPA, DIBENGKOKAN DAN DITARIK Karena elektron valensi mudah bergerak dalam kristal logam, maka elektron-elektron tersebut mengelilingi ion logam yang bermuatan positif secara simetri. Gaya tarik antara ion logam dan elektron valensi sama kesegala arah. Karena gaya tarik tersebut, maka suatu lapisan ion logam yang bermuatan positif dalam kisi kristal mudah bergeser. Bila sebuah ikatan logam putus, maka segera terbentuk ikatan logam baru. PREPARASI LOGAM 1 Pemekatan Logam 2 Ekstraksi 3 Pemurnian Logam METALURGI PROSEDUR PENGOLAHAN LOGAM DARI BIJIHNYA Pemekatan Logam Cara Fisika • Metode Flotasi • Metode Elektromagnetik, pemekatan logam besi Cara Kimia • Proses Bayer, pemekatan logam alumunium Al2O3 (s) + 2 NaOH (aq) + 3 H2O (l) ---> 2 NaAl(OH)4 (aq) 2 NaAl(OH)4 (aq) + CO2 (g) ---> 2 Al(OH)3 (s) + Na2CO3 (aq) + H2O (l) 2 Al(OH)3 (s) ---> Al2O3 (s) + 3 H2O (g) Ekstraksi Ekstraksi logam dari bijih pekat melibatkan proses reduksi logam dari tingkat oksidasi positif menjadi logam bebas. Sintering Pelengketan, pemanasan bijih lembut tanpa pelelehan untuk membentuk partikel lebih besar Kalsinasi Pemanasan bijih karbonat atau oksida untuk membebaskan gas karbon dioksida atau produk yang mudah menguap 4 FeCO3 (s) + O2 PbCO3 (s) 2 Fe2O3 (s) + 4 CO2 (g) PbO (s) + CO2 (g) Ekstraksi Roasting Proses pemanasan dalam oksigen atau udara di bawah titik leleh bijih yang bersangkutan, biasanya dilakukan pada bijih sulfida untuk memperoleh oksidanya 2 PbS (s) + 3 O2 (g) 2 PbO (s) + 2 SO2 (g) 2 ZnS (s) + 3 O2 (g) 2 ZnO (s) + 2 SO2 (g) Bijih logam yang kurang reaktif dapat dipanggang sampai menjadi logam bebas Hg (s) + O2 (g) PbO (s) + CO (g) Hg (g) + SO2 (g) Pb (l) + CO2 (g) Ekstraksi Proses untuk ekstraksi, reduksi dan pemurnian logam dapat dibagi dalam 3 macam metalurgi Pirometalurgi Proses reduksi menggunakan kalor (temperatur tinggi) untuk mengubah atau mereduksi mineral. Contohnya Smelting, reduksi mineral menghasilkan lelehan logam yang dapat dipisahkan dari batuan yang tak diinginkan. ZnO (s) + C (s) Zn (s) + CO (g) Reduktor SiO2 (s) + CaCO3 (s) Pengotor fluks CaSiO3 (l) + CO2 (g) slag Ekstraksi Natrium Elektrometalurgi Proses reduksi mineral atau yang energi pemurnian logam menggunakan listrik. Contoh elektrometalurgi adalah proses ekstraksi logam Natrium dan Alumunium Ekstraksi Alumunium Ekstraksi Hidrometalurgi Proses yang melibatkan air dalam ekstraksi dan reduksi logam. Proses penting dalam Hidrometalurgi adalah Leaching. Setelah proses leaching logam atau senyawanya terlarut dalam bentuk ion biasa atau ion kompleks. 2 CuFeS2 (s) + H2SO4 bijih tembaga Larutan leach 2 CuSO4 (aq) + Fe2O3 (s) + 3 S (g) + H2O (l) 4 Au (s) + 8 CN- (aq) + O2 (g) + H2O (l) bijih emas larutan leach 4 [Au(CN)2]- (aq) + 4 OH- (aq) Setelah logam dalam bijih diubah menjadi ion dalam larutan, kemudian direduksi CuSO4 (aq) + Fe (s) 2 [Au(CN)2]- (aq) + Zn (s) FeSO4 (aq) + Cu (s) 2 Au (s) + [Zn(CN)4]- (aq) Ekstraksi Keuntungan Hidrometalurgi : 01 Bijih tidak 02 Mengurangi 03 Menghilangkan 04 Efektif untuk perlu penggunaan polusi udara bijih dipekatkan batubara dan dari proses berkadar kokas untuk pirometalurgi rendah pemanggangan Pemurnian Logam Logam kasar perlu dilakukan pemurnian (Refining) ditinjau dari 2 aspek • Zat pengotor dapat menyebabkan logam tidak dapat digunakan dengan baik. Tembaga yang mengandung Arsen dalam jumlah yang sangat sedikitppun mengurangi daya hantar listrik 10% - 20% • Zat pengotor dalam logam mempunyai nilai ekonomis. Perak merupakan hasil samping metalurgi Timbal dan Tembaga. Cara memurnikan logam • Elektrolitik (Tembaga) • Oksidasi zat pengotor (Besi) • Distilasi logam dengan titik leleh rendah seperti Raksa , Nikel dan Seng • Zone Refining (pemurnian zona) Pemurnian Logam Besi dan Baja 01 Preparasi Besi Tanur Tinggi 02 Preparasi Baja P r e p a r a s i B e s i - Ta n u r T i n g g i Bahan mentah untuk preparasi Besi adalah • Bijih besi yang telah dipekatkan • Kokas • Batu kapur (CaCO3), sebagai fluks Besi kasar (besi gubal) diproduksi dalam tanur tinggi dengan ketinggian sampa 100 kaki dan diameter 25 kaki dilapisi dengan batu bata tahan panas. Preparasi Baja Tujuan Utama Preparasi Baja • Membakar habis pengotor-pengotor yang tidak diinginkan dari besi gubal • Menambahkan sejumlah logam atau material lain untuk memperoleh sifat-sifat logam yang diinginkan Jika pengotor utama adalah Mangan maka fluks asam yang harus digunakan adalah oksida non logam (SiO2). Jika pengotor utamanya Silikon atau Fosfor, maka fluks basa yang harus digunakan seperti Magnesium Oksida atau Kalsium Oksida, sehingga terbentuk silikat atau Pospat TUGAS 1 Tugas Kelompok 5-6 orang Paper Tulis Tangan 2 Aplikasi logam di kehidupan, Sifat logam yang dimanfaatkan, Proses pembuatan logam 3 Deadline, sebelum pertemuan ke 13 Paper, PPT dan Lampiran Daftar Pustaka Pertemuan 13 presentasi secara acak THANK YOU Inorganic Chemist L o g a U m n s u r