
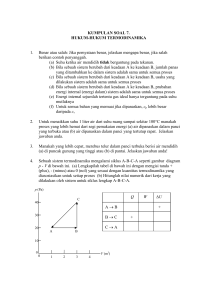
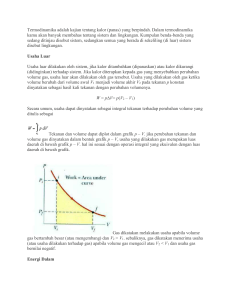
Nama Kelompok : 1.Bayu Indra Wahyudi : 191511011 2.Deden Uus Aprianto : 190511175 3.Dita Aen Nurjannah : 191511014 4..Muhamad Ibnu Ubaedillah :190511174 PENERAPAN KONSEP TERMODINAMIK PADA MESIN PENDINGIN • Termodinamika (bahasa Yunani: thermos = 'panas' and dynamic = 'perubahan') adalah fisika energi , panas, kerja, entropidan kespontanan proses. Termodinamika berhubungan dekat dengan mekanika statistik di mana hubungan termodinamika berasal. • Hukum termodinamika kebenarannya sangat umum, dan hukumhukum ini tidak bergantung kepada rincian dari interaksi atau sistem yang diteliti. Ini berarti mereka dapat diterapkan ke sistem di mana seseorang tidak tahu apa pun kecuali perimbangan transfer energi dan wujud di antara mereka dan lingkungan. PENGERTIAN Termodinamika Termodinamika adalah kajian tentang kalor (panas) yang berpindah. Dalam termodinamika banyak membahas tentang sistem dan lingkungan. Kumpulan benda-benda yang sedang ditinjau disebut sistem, sedangkan semua yang berada di sekeliling (diluar) sistem disebut lingkungan Suhu Kata suhu sering diartikan sebagai suatu besaran yang menyatakan derajatpanas atau dinginnya suatu benda. Kalor Kalor adalah salah satu bentuk energi sama halnya dengan energi kimia, potensial maupun kinetik. Kalor didefinisikan sebagai energi panas yang dimiliki oleh suatu zat. Energi Dalam fisika, energi adalah properti fisika dari suatu objek, dapat berpindah melalui interaksi fundamental, yang dapatdiubah bentuknya namun tak dapat diciptakan maupun dimusnahkan. Joule adalah satuan SI untuk energi, diambil dari jumlah yang diberikan pada suatu objek (melalui kerja mekanik) dengan memindahkannya sejauh 1 meter dengan gaya 1 newton. Hukum Termodinamika Hukum-hukum termodinamika pada prinsipnya menjelaskan peristiwa perpindahan panas dan kerja pada proses termodinamika. Sejak perumusannya, hukum hukum ini telah menjadi salah satu hukum terpenting dalam fisika dan berbagai cabang ilmu lainnya yang berhubungan dengan termodinamika. Hukum-hukum ini sering dikaitkan dengan konsep-konsep yang jauh melampau hal-hal yang dinyatakan dalam kata-kata rumusannya. Hukum kedua Termodinamika Hukum II Termodinamika memberikan batasan-batasan terhadap perubahan energi yang mungkin terjadi dengan beberapa perumusan. idak mungkin membuat mesin yang bekerja dalam satu siklus, menerima kalor dari sebuah reservoir dan mengubah seluruhnya menjadi energi atau usaha luas (Kelvin Planck). idak mungkin membuat mesin yang bekerja dalam suatu siklus mengambil kalor dari sebuah reservoir rendah dan memberikan pada reservoir bersuhu tinggi tanpa memerlukan usaha dari luar (Clausius). Pada proses reversibel, total entropi semesta tidak berubah dan akan bertambah ketika terjadi proses irreversibel (Clausius). Mesin Pendingin (Refrigator) Mesin pendingin merupakan peralatan yang prinsip kerjanya berkebalikan dengan mesin kalor. Pada mesin pendingin terjadi aliran kalor dari reservoir bersuhu rendah ke reservoir bersuhu tinggi dengan melakukan usaha pada sistem. Penguraian Konsep Termodinamika Termodinamika adalah ilmu tentang energi, yang secara spesifik membahas tentang hubungan antara energi panas dengan kerja. Seperti telah diketahui bahwa energi didalam alam dapat terwujud dalam berbagai bentuk, selain energi panas dan kerja, yaitu energi kimia, energi listrik, energi nuklir, energi gelombang elektromagnit, energi akibat gaya magnit, dan lain-lain . Energi dapat berubah dari satu bentuk ke bentuk lain, baik secara alami maupun hasil rekayasa tehnologi. Selain itu energi di alam semesta bersifat kekal, tidak dapat dibangkitkan atau dihilangkan, yang terjadi adalah perubahan energi dari satu bentuk menjadi bentuk lain tanpa ada pengurangan atau penambahan. Prinsip ini disebut sebagai prinsip konservasi atau kekekalan energi. Prinsip thermodinamika tersebut sebenarnya telah terjadi secara alami dalam kehidupan sehari-hari. Bumi setiap hari menerima energi gelombang elektromagnetik dari matahari, dan dibumi energi tersebut berubah menjadi energi panas, energi angin, gelombang laut, proses pertumbuhan berbagai tumbuh-tumbuhan dan banyak proses alam lainnya. Proses didalam diri manusia juga merupakan proses konversi energi yang kompleks, dari input energi kimia dalam maka nan menjadi energi gerak berupa segala kegiatan fisik manusia, dan energi yang sangat bernilai yaitu energi pikiran kita. Dengan berkembangnya ilmu pengetahuan dan teknologi, maka prinsip alamiah dalam berbagai proses thermodinamika direkayasa menjadi berbagai bentuk mekanisme untuk membantu manusia dalam menjalankan kegiatannya. Klasifikasi Sistem Termodinamika Suatu sistem thermodinamika adalah sustu masa atau daerah yang dipilih, untuk dijadikan obyek analisis. Daerah sekitar sistem tersebut disebut sebagai lingkungan. Batas antara sistem dengan lingkungannya disebut batas sistem. istem tertutup Merupakan sistem massa tetap dan identitas batas sistem ditentukan oleh ruang zat yang menempatinya. istem terbuka Pada sistem ini, zat melewati batas sistem. Panas dan kerja bisa juga melewati batas sistem. istem terisolasi Adalah sebuah sistem yang sama sekali tidak dipengaruhi oleh lingkungannya. Sistem ini massanya tetap dan tidak ada panas atau kerja yang melewati batas sistem. Proses-Proses dalam Termodinamika 1.Proses isotermal Proses isotermal adalah suatu proses perubahan keadaan gas pada suhu tetap. Menurut Hukum Boyle, proses isotermal dapatdinyatakan dengan persamaan : pV = konstan ataup1V1=p2V2 . Misalkan, pada sistem terjadi perubahan yang sangat kecil sehingga persamaan usahanya dapat dituliskan sebagai Jika konstanta n R, dan besaran suhu (T) yang nilainya tetap dikeluarkan dari integral, akan diperoleh : 2. Proses isokhorik Proses isokhorik adalah suatu proses perubahan keadaan gas pada volume tetap. Menurut Hukum Gay-Lussac proses isokhorik pada gas dapat dinyatakan dengan persamaan : p/T = konstan atau p1/T1 = p2/T2 Oleh karena perubahan volume dalam proses isokhorik ΔV = 0 maka usahanya W = 0 3.Proses isobarik Proses isobarik adalah suatu proses perubahan keadaan gas pada tekanan tetap. Menurut Hukum Charles, persamaan keadaan gas pada proses isobarik dinyatakan dengan persamaan : V/T = konstan atau V1/T1 = V2/T2 Oleh karena volume sistem berubah, sedangkan tekanannya tetap, usaha yang dilakukan oleh sistem dinyatakan dengan persamaan : W = pΔV = p (V2 – V1) 4.Proses Adiabatik Proses adiabatik adalah suatu proses perubahan keadaan gas di mana tidak ada kalor (Q) yang masuk atau keluar dari sistem (gas). Proses ini dapat dilakukan dengan cara mengisolasi sistem menggunakan bahan yang tidak mudah menghantarkan kalor atau disebut juga bahan adiabatik. Adapun, bahan-bahan yang bersifat mudah menghantarkan kalor disebut bahan diatermik Proses adiabatik ini mengikuti persamaan Poisson sebagai berikut : p Vγ = konstan atau p1 V1γ = p2 V2γ (1–6) Oleh karena persamaan gas ideal dinyatakan sebagai pV = nRT maka Persamaan (9–4) dapat ditulis : T1V1(γ –1) = T2 V2(γ –1) (1–7) Dengan γ = CP/CV = konstanta Laplace, dan CP/CV > 1. CP adalah kapasitas kalor gas pada tekanan tetap dan CV adalah kalor gas pada volume tetap. Perhatikan diagram p – V pada Gambar di atas. Dari kurva hubungan p – V tersebut, kita dapat mengetahui bahwa: urva proses adiabatik lebih curam daripada kurva proses isotermal. uhu, tekanan, maupun volume pada proses adiabatik tidak tetap. Oleh karena sistem tidak melepaskan atau menerima kalor, pada kalor sistem proses adiabatik Q sama dengan nol. Besarnya usaha pada proses adiabatik tersebut dinyatakan dengan persamaan berikut : W= 3/2 nRT−T = 3/2 (p1 V1 − p2 V2) (1–8) Hukum Kedua Termodinamika Ada dua perumusan untuk Hukum kedua Termodinamika, yaitu : umusan Kelvin–Planck Menyatakan bahwa tidak mungkin membuat mesin yang bekerja dalam suatu siklus secara terus menerus, menerima kalor dari suatu reservoir dan mengubah kalor tersebut seluruhnya menjadi usaha luar. umusan Clausius Menyatakan bahwa tidak mungkin membuat mesin yang bekerja menurut satu siklus, mengambil kalor dari reservoir bersuhu rendah dan memberikannya pada tandon bersuhu tinggi tanpa dilakukan kerja dari luar.





![2. Tinjauan Singkat Termodinamika [Compatibility Mode]](http://s1.studylibid.com/store/data/000368661_1-2ccd4e1981a961db647255fa08a2b63f-300x300.png)