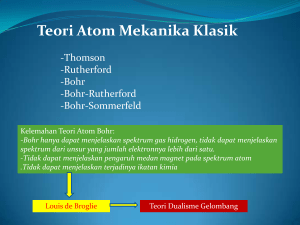
Atom Berelektron Banyak disusun oleh: Rafli Nur Pratama Dinia Rizki Veren Vitrisda Atom Berelektron Banyak Struktur elektrolit suatu atom mengacu pada cara electron tersusun di sekeliling inti, dan terutama pada tingkat energi tertentu yang ditempati atom tersebut. Suatu bilangan yang menunjukkan orbit elektron mengelilingi inti pada kulit atau tingkat energi tertentu disebut bilangan kuantum (quantum number). Setiap elektron dapat digolongkan berdasarkan empat bilangan kuantum yang akan diuraikan berikut ini. Bilangan Kuantum Utama (n) Bilangan kuantum utama menentukan besarnya energi total elektron pada orbit/lintasan elektron pada kulit atom. Besarnya energi total elektron pada atom bersifat kekal danbesarnya energi pada masing-masing kulit atom ditentukanoleh bilangan kuantum utama. Bilangan kuantum utamamempunyai harga positif yaitu 1, 2, 3, … dst. Bilangan kuantum utama menyatakan tempat lintasan /orbit electrondalam atom yang disebut kulit atom yang diberi nama denganhuruf besar, yaitu kulit K untuk n = 1, L untuk n = 2, M untuk n = 3, dan seterusnya. Jumlah maksimum elektron pada kulit ke-n adalah 2n2 Energi total electron pada orbit adalah kekal dan memiliki harga negatif yang berarti untuk melepaskan elektron dari orbitnya diperlukan energi. Besarnya energi elektron pada atom hidrogen pada kulit ke-n dinyatakan : Adapun untuk atom berelektron banyak (terdiri atas lebih dari satu elektron), energi elektron pada kulit ke-n adalah: Dimana : n = bilangan kuantum utama dan Z = nomor atom Bilangan Kuantum Orbital (l) Bilangan kuantum orbital yang diberi simbol l menyatakan besarnya momentum sudut elektron mengelilingi inti atom. Momentum sudut diberi lambang L dan besarnya dinyatakan dalam persamaan : Di mana L = Momentum sudut/anguler electron, l = bilangan kuantum orbital dan Nilai bilangan kuantum orbital dinyatakan l = (n – 1) yaitu 0, 1, 2, 3, …, n–1. Keadaan momentum sudut electronpada orbitnya menyatakan subkulit elektron pada inti atomyang diberi nama sub kulit s, p, d, e, f, g dan seterusnya sesuaidengan urutan abjad. Subkulit l = 0 disebut subkulit s (sharp), subkulit l = 1 adalah p (principle), subkulit l = 2 disebut d (diffuse), dan subkulit l = 3 disebut f (fundamental). Jadi, bila l = 0, kita mempunyai sebuah orbital s, bila l = 1 kita mempunyai orbital p, dan seterusnya. Bilangan Kuantum Magnetik ( ml ) Bilangan kuantum ini menentukan orientasi dari orbit elektron dalam medan magnet. Nilai ml yang mungkin yaitu -l, -(l - 1), ..., -1, 0, 1, ..., (l - 1), + l. Di subkulit s (yaitu bila l = 0) nilai ml = 0. Di sub kulit p (yaitu bila l = 1) nilai ml yang mungkin adalah +1, 0, dan -1, jadi ada tiga orbital p pada sub kulit p, yang biasanya dibedakan dengan px, py, dan pz. Dalam keadaan normal, ketiga orbital ini memiliki tingkat energi yang sama. Dalam setiap nilai bilangan kuantum orbital ( l ) memiliki nilai bilangan kuantum magnetik (ml ) sebanyak (2l +1). Bilangan kuantum magnetik (ml ) merupakan proyeksi vektor pada suatu sumbu z sembarang seperti yang terlihat pada gambar dibawah ini: Elektron dalam suatu atom dengan momentum sudut tertentu dapat berinteraksi dengan medan magnetik luar. Bila arah medan magnetic luar adalah sejajar dengan sumbu z, maka nilai L dalam arah z memenuhi persamaan: Sehingga banyaknya ml untuk setiap nilai l = 0 dalam arah Z terdapat satu nilai ml = 0, sedangkan untuk nilai l = 1 terdapat 3 nilai m yaitu -1, 0, 1 dan besar momentum sudut ke arah sumbu Z (LZ) untuk l = 1 yaitu – , 0 , + dan arah vektor momentum sudut terhadap sumbu Z dapat dicari sebagai berikut : Kemungkinan besar momentum sudut dan arahnya serta bentuk lintasan/ orbit elektron pada bilangan orbital = 1 dapat digambarkan sebagai berikut : Bilangan Kuantum Spin ( ms ) Disamping bergerak mengelilingi inti atom, elektron juga berputar pada sumbunya yang disebut dengan spin. Spin dapat menimbulkan momen magnetik yang memiliki dua kemungkinan putaran yang saling berlawanan arah. Arah putaran ini dinyatakan dengan nilai bertanda +1/2 dengan notasi penulisan anak panah yang arahnya ke atas dan arah yang lain diberi tanda -1/2 dengan notasi penulisan anak panah ke arah bawah. Sub kulit s hanya memiliki sebuah orbital, sehingga sub kulit ini hanya dapat menampung dua buah elektron. Sub kulit p memiliki tiga orbital yaitu px, py, dan pz yang masinng-masing memiliki dua elektron yang arah spinnnya ke atas dan ke bawah sehingga orbital p ini akan mampu menampung enam buah elektron. Model Atom Hidrogen dalam Pandangan Quantum Mekanik Quantum theory adalah sebuah teori yang mampu menyatukan konsep dualisme partikel gelombang sebagai sebuah teori tunggal. Salah satu contoh atom yang paling sederhana adalah atom hidrogen yang terdiri dari hanya satu electron yang bergerak mengelilingi inti (proton). Electron yang bergerak mengelilingi proton memiliki energy potensialyang merupakan interaksi gaya colomb antara elektron dan proton itu sendiri. Potensial energy dari hasil interaksi 2 partikel dari sebuah system dengan muatan masing-masing q1 dan q2 dapat dinyatakan dalam bentuk matematis : Dimana r adalah jarak antara dua partikel tersebut. Energy potensial system 2 partikel ini pada atom hydrogen secara matematis dapat ditulis sebagai berikut : Gambar plot ini menunjukkan tingkat energy dari atom hydrogen. Transisi dikelompokkan kedalam deret yang masing-masing dinamakan sesuai dengan penemunya. Energy dari atom hydrogen ini pada tiap tingkatan akan berbeda, dan untuk menentukan energy pada arah dimensionalnya harus melalui persamaan schrodinger. Berdasarkan dari persamaan scrodinger, persamaan ini dapat dituliskan dalam arah 3 dimensi untuk x, y, dan z sebagai berikut : Dalam analisis 3 dimensi ini, mengindikasikan penggunaan 3 bilangan kuantum yaitu pada sumbu x, y dan z. Teori mekanika kuantum, mampu memprediksi secara tepat tingkatan energy dari atom hydrogen seperti halnya teori yang disampaikan oleh Bohr, dimana untuk energy ke-n selalu berbanding terbalik dengan kuadrat n2 (bilangan kuantum), dan sebagai solusinya secara matematis hubungan ini diperlihatkan oleh persamaan berikut : n= 1,2,3,…. n ini disebut sebagai prinsip bilangan kuantum. Dengan kata lain, tingkatan energy yang dimiliki oleh atom hydrogen bergantung pada n. tanda negatif ini mensyaratkan bahwa untuk melakukan eksitasi energy electron harus melepaskan energy sebesar -13,6 ev. Energy terendah yang dimiliki adalah pada n=1. Dan untuk n yangtak terhingga, En =0.