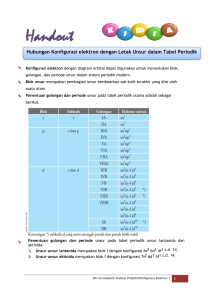
1. . Sifat-sifat Fisika Halogen Semua unsur halogen ada dalam bentuk molekul diatomik, yang berwujud gas, cair, dan padat. F₂ berwujud gas dan berwarna kuning pucat, Cl₂ berwujud gas dan berwarna hijau kekuningan, B r₂ berwujud cair dan berwarna merah coklat dan I₂ berwujud padat dan berwarna ungu hitam. Tapi I₂ dapat berubah wujud pada suhu kamar menjadi gas berwarna ungu-biru. 1. 2. Sifat-sifat Kimia Halogen 2. Semua unsur halogen dapat membentuk senyawa dengan penarikan satu elektron dari luar, maupun secara kovalen. 3. Umumnya unsur-unsur halogen memiliki tingkat oksidasi -1, namun demikian halogen dapat pula memiliki tingkat oksidasi +1, +3, +5 dan +7, kecuali flourin. 4. Semua unsur halogen merupakan oksidator yang sangat kuat. Kekuatan oksidator ini berkurang dari fluorin ke iodin. 5. Semua unsur halogen dapat bereaksi dengan semua unsur logam dan beberapa unsur non logam. Fluorin merupakan unsur yang paling reaktif dan kereaktifannya berkurang untuk unsur-unsur halogen yang lain sesuai dengan kenaikan nomor atom. 6. Semua unsur halogen dapat bereaksi dengan hidrogen membentuk asam halida (HX). 7. Kecuali fluorin, semua unsur halogen dapat membentuk asam oksi dengan rumus HXO, HXO₂, HXO₃ dan HXO4 yang disebut sebagai asam hipohalit, asam halit, asam halat, dan asam perhalat. 8. Unsur-unsur halogen dapat pula bergabung dengan sesama unsur halogen membenuk senyawa antar halogen. Senyawa-senyawa ini dapat dibedakan ke dalam empat kelompok senyawa yaitu : 1. Kelompok AX, contoh : ClF, BrCl, ICl 2. Kelompok AX3, contoh : ClF3, BrF3, IF3 3. Kelompok AX5, contoh : BrF5, IF5 4. Kelompok AX7, contoh : IF7 1. Sifat-sifat yang dipengaruhi jari-jari atom Semakin ke bawah kulit elektron semakin banyak sehingga dalam sistem periodik semakin ke bawah maka jari-jari atom tambah besar. • Dengan bertambahnya jari-jari atom berarti jarak orbital elektron terluar makin jauh letaknya dari inti atomnya. Elektron pada orbital terluar akan semakin mudah melepaskan diri. Oleh karena itu, sifat keelektronegatifan halogen senantiasa berkurang seiring dengan penambahan jari-jari atomnya. • Halogen dapat menarik elektron sesamanya atau menarik elektron satu golongan yang keelektronegatifannya lebih rendah (berada di bawahnya dalam sistem periodik). • Kenaikan titik didih dn titik lebur halogen sebanding dengan naiknya nomor atom. Hal ini berhubungan dengan banyaknya energy yang harus dipakai untuk mengatasi gaya tarik-menarik antara molekul-molekul zat, contohnya gaya van der waals yang menarik molekul-molekul berdekatan satu sama lain. Gaya ini makin tinggi untuk molekul-molekul kompleks yang memiliki banyak elektron. 2. Tingkat oksidasi asam-oksi halogen Kecuali flour (F), halogen dapat membentuk asam-asam yang mengandung oksigen atau lumrahnya asam-oksi halogen. Dalam kasus ini halogen memiliki biloks-biloks positif dan biloks positif ini adalah hal yang tidak biasa untuk halogen yang sangat reaktif menangkap elektron. Setiap harga biloks ini memiliki nama khusus. a. Biloks (+1) namanya diawali dengan hipo, diikuti dengan nama halogen lalu diakhiri dengan it. Singkatnya nama asamnya menjadi : asam hipo(nama halogen)it. Contohnya asam hipoklorit b. Biloks (+3) hanya diakhiri dengan –it, contohnya asam bromit c. Biloks (+5) diberi akhiran –at, contohnya asam iodat d. Biloks (+7) diberi awalan per- atau super- dan diakhiri –at, contohnya asam perklorat Sebenarnya kekuatan asam-basa halogen meliputi 2 tipe. Tipe yang pertama adalah asam halogenida. Asam ini hanya terdiri dari unsur Hidrogen dengan halogen, contohnya HF, HCL, HBr, dan selanjutnya pasti sudah tahu kan… Untuk kekuatan keasamannya, nilainya sebanding dengan jari-jari Asam yang kedua adalah asam yang barusan kita bahas, yaitu asam oksihalogen. Asam ini terdiri atas unsur O,H, dan Halogen. Kekuatan asam oksihalogen sebanding dengan harga biloksnya. Bila harga biloksnya sama, maka kekuatan keasamannya berbanding terbalik dengan jari-jari. 3. Keistimewaan Flour Untuk halogen yang satu ini kita bisa menemukan penyimpangan, ups, maksudnya keistimewaan ketimbang halogen yang lainnya. Beberapa keistimewaan itu antara lain a. HF (Hidrogen Flour) termasuk dalam asam lemah (tidak terionisasi sempurna) padahal hidrogen halida yang lain adalah asam kuat. b. Flour memiliki ukuran atom yang kecil sehingga sangat reaktif menangkap elektron atau merupakan oksidator yang kuat. Selain itu florur mempunyai energy hidrasi yang besar. Flour dalam hidrogen flourida mempunyai sifat suka menarik proton sehingga menimbulkan ikatan hidrogen. Ikatan hidrogen ini hanya dimiliki Nitrogen, Oksigen, dan Flour saja. Jadi halogen lain tidak memiliki itu. Hal ini juga yang menyebabkan titik didih hidrogen flourida lebih tinggi ketimbang hidrogen halida yang lain. PENGERTIAN SENYAWA POLAR DAN NON POLAR Senyawa polar adalah Senyawa yang terbentuk akibat adanya suatu ikatan antar elektron pada unsur-unsurnya. Hal ini terjadi karena unsur yang berikatan tersebut mempunyai nilai keelektronegatifitas yang berbeda. Senyawa non polar : Senyawa yang terbentuk akibat adanya suatu ikatan antar elektron pada unsur-unsur yang membentuknya. Hal ini terjadi karena unsur yang berikatan mempunyai nilai elektronegatifitas yang sama/hampir sama. CIRI -CIRI SENYAWA POLAR : Dapat larut dalam air dan pelarut lain Memiliki kutub + dan kutub -, akibattidak meratanya distribusi elektron – memiliki pasangan elektron bebas ( bila bentuk molekul diketahui ) atau memiliki perbedaan keelektronegatifan. CONTOH : alkohol, HCl, PCl3, H2O, N2O5. GAMBAR SENYAWA POLAR CIRI – CIRI SENYAWA NON POLAR : tidak larut dalam air dan pelarut polar lain tidak memiliki kutub + dan kutub – , akibat meratanya distribusi elektron – tidak memiliki pasangan elektron bebas ( bila bentuk molekul diketahui ) atau keelektronegatifannya sama. CONTOH : Cl2, PCl5, H2, N2. GAMBAR SENYAWA NON POLAR : UKURAN KUANTITATIF TITIK DIDIH SENYAWA KONVALEN ( POLAR DAN NON POLAR ) * Senyawa polar lebih tinggi titik didihnya dari pada senyawa non polar urutan titik didih, ikatan hidrogen > dipol-pol > non polar-non polal atau ikatan hidrogen > Van der Waals > gaya london bila sama-sama polar/non polar, yang Mr besar titik didihnya lebih besar . untuk senyawakarbon Mr sama, rantai C memanjang titik didih > rantai bercabang ( bulat ) PERBEDAAN SENYAWA POLAR DAN NON POLAR SENYAWA POLAR dapat larut dalam air memiliki pasangan elekton bebas ( bentuk tidak simetris) berakhir ganjil , kecuali BX3 dan PX5 CTH : NH3, PCl3, H2O, HCl, HBr, SENYAWA NON POLAR tidak dapat larut dalam air tidak memiliki pasangan elektron bebas (bentuk simetris ) berakhir genap CTH : F2, BR2, O2, H2