17.Atom unsur Sc, Cu, Zn, Ga, dan Ag berturut
advertisement
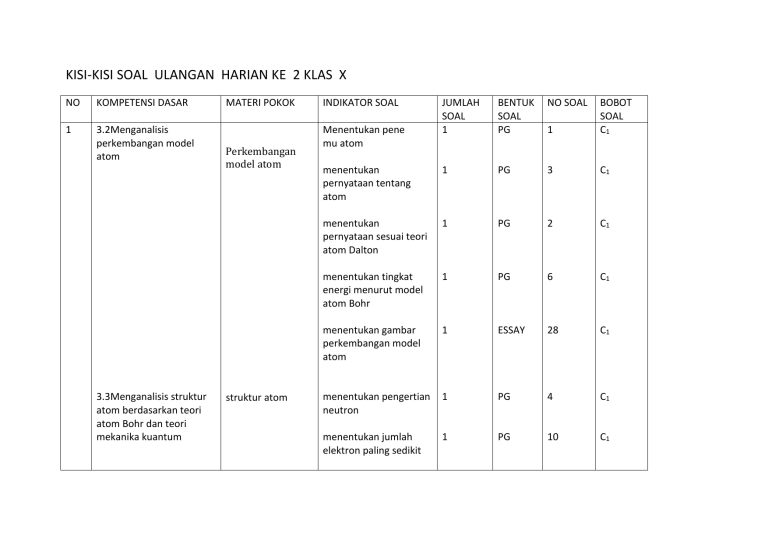
KISI-KISI SOAL ULANGAN HARIAN KE 2 KLAS X NO KOMPETENSI DASAR 1 3.2Menganalisis perkembangan model atom 3.3Menganalisis struktur atom berdasarkan teori atom Bohr dan teori mekanika kuantum MATERI POKOK Perkembangan model atom struktur atom INDIKATOR SOAL JUMLAH SOAL 1 BENTUK SOAL PG NO SOAL 1 BOBOT SOAL C1 menentukan pernyataan tentang atom 1 PG 3 C1 menentukan pernyataan sesuai teori atom Dalton 1 PG 2 C1 menentukan tingkat energi menurut model atom Bohr 1 PG 6 C1 menentukan gambar perkembangan model atom 1 ESSAY 28 C1 menentukan pengertian neutron 1 PG 4 C1 menentukan jumlah elektron paling sedikit 1 PG 10 C1 Menentukan pene mu atom menentukan 2 proton,neutron,elektron PG ESSAY 8 30 C2 C2 menentukan elektron maksimum dalam kulit 1 PG 11 C2 menentukan elektron valensi Mg 1 PG 12 C2 menentukan elektron valensi terbanyak 1 PG 13 C2 menentukan nomor massa ion 1 PG 14 C2 menentukan jumlah proton ion 1 PG 15 C2 menentukan pasangan isoton 1 PG 7 C2 menentukan isotop,iso bar,isoton 1 ESSAY 27 C2 menentukan bilangan kuantum yang diperbolehkan 1 PG 19 C2 menentukan bilangan kuantum sub kulit d 1 PG 21 C1 3.4Menganalisis hubungan konfigurasi elektron dan diagram orbital untuk menentukan letak unsur dalam tabel periodik dan sifat-sifat periodik unsur menentukan 4 bilangan kuantum pada orbital 4d 1 PG 22 C1 menentukan 4 bilangan kuantum pada 4P5 1 ESSAY 26 C2 menentukan hubungan massa dan energi 1 PG 5 C1 menentukan perpindahan elektron dari kulit ke kulit 1 PG 9 C1 menentukan konfigurasi elektron ion 1 PG 23 C2 menentukan diagram konfigurasi elektron menurut prinsip Pauli 1 PG 16 C1 menentukan konfigurasi elektron sama dengan ion 1 PG 24 C2 menentukan konfigurasi elektron,jumlah orbital 1 ESSAY 29 C2 menentukan konfigurasi elektron atom X 1 PG 25 C2 menentukan sub kulit d belum penuh pada ion 1 PG 17 C2 menentukan orbital pada sukulit sebelum 4f 1 PG 18 C1 menentukan orbital yang belum berpasangan pada ion 1 PG 20 C1 SOAL ULANGAN HARIAN KE 2 Pilihlah jawaban yang paling tepat di antara huruf A,B,C,D,E. 1. Seorang ahli kimia yang pertama kali mengusulkan ide materi tersusun dari bagian-bagian kecil yang tidak bisa dibagi lagi adalah... A. Aristoteles B. Plato C. Dalton D. Demokritos E. Bohr 2. Manakah dari pernyataan berikut yang tidak termasuk bagian dari teori atom Dalton? A. Atom - atom tidak dapat dibelah, dibuat, dihancurkan B. Jumlah proton dalam atom sama dengan nomor atomnya C. Dalam reaksi kimia atom-atom bergabung, berpisah, tersusun kembali D. Semua materi tersusun dari partikel-partikel yang sangat kecil yang disebut atom E. Semua atom dalam unsur yang sama memiliki ukuran dan massa yang sama 3. Dari pernyataan berikut yang benar mengenai atom adalah ... A. Semua unsur hanya memiliki satu nomor massa B. Nomor massa atom dapat lebih rendah dari jumlah proton C. Nomor massa dapat sama dengan jumlah proton D. Jumlah netron tidak pernah sama dengan jumlah elektron E. Terdiri dari inti atom yang bermuatan negatif dan elektron bermuatan Positif 4. Pernyataan yang benar mengenai netron adalah ... A. Memiliki muatan +1 satuan dan massa 1 satuan B. Tidak bermutan dan massa 1 satuan C. Tidak bermuatan dan tidak bermassa D. Bermuatan -1 dan tidak bermassa E. Bermuatan sama dengan muatan elektron 5. Hubungan antara perubahan massa dengan energi dinyatakan oleh ... A. E. Rutherford B. O. Hann C. P. Curie D. A. Einstein E. J. Chadwick 6. Tingkat energi atom hidrogen menurut model atom Bohr disebut ... A. Orbit B. Orbital C. Tingkat eksitasi D. Diagram orbital E. Lingkaran 7.Ion 17Cl - iso elektronik dengan ... A. Atom argon, 18Ar B. Atom bromin, 35Br C. Ion fluorida, 9FD. Ion natrium, 11Na+ E. Ion oksida, 8O-2 8. 126 52Te memiliki neutron, proton, elektron sebesar ... A. B. C. D. E. 126 neutron, 52 proton, 52 elektron 74 neutron, 52 proton, 52 elektron 52 neutron, 74 proton, 74 elektron 52 neutron, 126 proton, 126 elektron 52 neutron, 126 proton, 52 elektron 9.Perpindahan elektron dari satu kulit ke kulit yang lebih tinggi tingkat energinya disebut ... A. Eksitasi B. Transisi C. Difusi D. Oksidasi E. Transmisi 10.Dari spesi-spesi berikut yang memiliki jumlah elektron paling sedikit adalah ... A. 11Na B. 11Na+ C. 9FD. 9F E. 12Mg2+ 11.Jumlah elektron maksimum yang menempati kulit ke-2 dan ke -4 adalah ... A. 2 dan 8 B. 4 dan 8 C. 8 dan 18 D. 8 dan 32 E. 18 dan 32 12.Atom magnesium memiliki nomor massa 24 dan nomor atom 12 jumlah elektron valensi atom Magnesium adalah ... A. 1 B. 2 C. 3 D. 4 E. 6 13.Diantara atom-atom berikut yang memiliki elektron valensi terbanyak adalah ... A. 11Na B. 13 Al C. 15P D. 18Ar E. 19K 14.Ion M2+ memiliki jumlah elektron 36 jika atom M memiliki 49 neutron maka nomor massa adalah ... A. B. C. D. 36 49 83 85 E. 87 15.Ion A2- memiliki 20 elektron maka jumlah proton dalam atom A adalah ... A. 14 B. 16 C. 18 D. 20 E. 22 16.Berikut konigurasi elektron manakah yang tidak melanggar prinsip larangan Pauli ... A. ↑↓ ↑↓ ↑↓ B. ↑↓ ↑↓ ↑ ↑↓ ↑↑ ↑↓ ↑↓ ↑↓ ↑ C. D. ↑ ↓ ↓ ↑ E. 17.Atom unsur Sc, Cu, Zn, Ga, dan Ag berturut-turut memiliki nomor atom 21, 29, 30, 31, dan 47. Semua ion berikut memiliki subkulit d penuh, kecuali ... A. Ag+ B. Cu2+ C. Ga3+ D. Zn2+ E. Sc3+ 18.Orbital apakah yang harus terisi penuh sebelum 4f? A. 6s B. 5p C. 5d D. 5s E. 4d 19.Kelompok bilangan kuantum (n, l, ml, ms) yang diperbolehkan bagi sebuah elektron dalam atom adalah ... 1 A. 1, 0, 0, - 2 1 B. 1, 1, 0, + 2 1 C. 2, 1, 2, + 2 D. 3, 2, - 2, 0 1 E. 2, 2, 0, - 2 20.Banyaknya orbital yang berisi elektron tak berpasangan pada ion Ni2+ (nomor atom = 28) adalah ... A. 0 B. 2 C. 4 D. 6 E. 7 21.Semua elektron dalam subkulit d harus mempunyai bilangan kuantum ... A. n = 3 B. m = 2 C. l = 2 D. n = 4 1 E. ms = + 2 22.Harga keempat bilangan kuantum suatu elektron yang terdapat dalam orbital 4d adalah ... 1 A. n = 4 l=0 ml = 0 ms = + 2 B. n = 4 l=1 ml = -1 ms = - 2 C. n = 4 l=2 ml = +1 ms = + 2 D. n = 4 l=2 ml = +3 ms = - 2 E. m = 4 l=3 ml = +2 ms = + 2 1 1 1 23.Konfigurasi elektron X2- dari suatu ion unsur 32 16X adalah ... A. 1s2 2s2 2p6 3s2 3p1 B. 1s2 2s2 2p6 3s2 3p6 C. 1s2 2s2 2p6 3s2 3p6 3d1 2s2 D. 1s2 2s2 2p6 3s2 3p6 3d2 4s2 1 E. 1s2 2s2 2p6 3s2 3p3 3d7 4s2 24.Unsur Cl ada di periode 3 maka ion klorida akan mempunyai konfigurasi elektron yang sama dengan atom atau ion ... A. FB. Ne C. Na+ D. Ca2+ E. Al3+ 25.Konfigurasi elektron atom X bernomor massa 80 dan memiliki 45 neotron dalam intinya adalah ... A. [Ne] 3s2 4p6 B. [Ar] 4s2 3d10 5s2 5p3 C. [Ar] 4s2 3d10 4p5 D. [Kr] 5s2 4d7 E. [Xe] 6s2 4f14 5d10 II.SOAL ESSAY 26.Suatu elektron terakhir menempati sub kulit 4p5 tentukan bilangan kuantum n,l,ml,ms 27.Tentukan isotop,isobar,isoton, pada: 16 8 O 24 11Na 23 + 11Na 24 12Mg 12 6C 15 7N 27 3+ 13Al 28.Gambarkan model atom menurut perkembangannya dari model atom Dalton hinggamekanika kuantum 29.Unsur Y memiliki no atom 26 tentukan konfigurasi elektron,jumlah kulit,jumlah orbital 30.Lengkapi tabel berikut No Nama unsur 1 karbon 2 belerang 3 kalium 4 besi 5 Perak No atom 6 16 No massa 12 Jumlah neutron Jumlah elektron Notasi unsur 16 39 47 Jumlah proton 19 56 26 Fe ..... 47Ag KUNCI JAWABAN 1.C 11.D 22.C 2.B 12.B 22.D 3.C 13.D 23.B 4.B 14.C 24.B 5.D 15.C 25.C 6.A 16.E 7.E 17.B 8.B 18.A 9.B 19.A 10.A 20.A 26.n = 5 ℓ = 1 ml = 0 m s= ½ 27.isotop = 2311Na dengan 24 + 11Na Isoton = 168O dengan 157N skor = 5 isobar = 24 11Na dengan 2412Mg skor = 5 28.Gambar model atom skor = 5 Model atom bohr Model atom mekanika kuantum 29.X = 1S2 2S2 2P6 3S2 3P6 4S23d6 n = 4 4 orbital s 6 orbital p 5 orbital d No Nama unsur 1 Karbon 2 Belerang 3 Kalium 4 Besi 5 Perak Skor = 5 No atom Jumlah skor PG = 25 X 3 = 75 skor = 5 30. 6 16 19 26 47 No massa 12 32 39 56 131 Skor essay= 5 x 5 = 25 Skor total = 100 Jumlah proton 12 16 19 26 47 Jumlah neutron 6 16 20 30 84 Jumlah elektron 6 16 19 26 47 Notasi unsur 12 6C 32 16S 39 19K 56 26Fe 131 47Ag











