Teori Pita Energi
advertisement

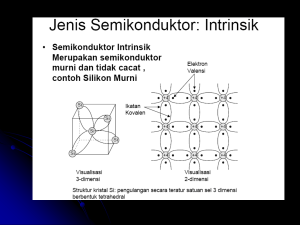
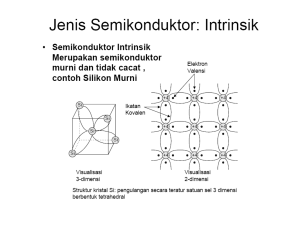
Mengenal Sifat Material Teori Pita Energi Teori Pita Energi Ulas Ulang Kuantisasi Energi Planck : E nhf energi photon (partikel) bilangan bulat frekuensi gelombang cahaya h = 6,63 10-34 joule-sec De Broglie : Elektron sbg gelombang h mv bilangan gelombang: k momentum: energi kinetik elektron sbg gelombang : p2 2k 2 Ek 2m 2m p 2 k 2 h k k 2 mv h Teori Pita Energi Energi elektron sebagai fungsi k (bilangan gelombang) p2 2k 2 Ek 2m 2m E k Teori Pita Energi Makin tinggi nomer atom, atom akan makin kompleks, tingkat energi yang terisi makin banyak. Teori Pita Energi Sodium s p 0 1 7 6 5 6 5 E [ eV ] 4 2 Hidrogen d 7 6 5 4 3 f 7 6 5 4 7 7 5 4 6 3 4 3 3 2 4 5 3 5,14 6 Kemungkinan terjadinya transisi elektron dari satu tingkat ke tingkat yang lain semakin banyak [6] Teori Pita Energi Molekul Molekul lebih kompleks dari atom; tingkat-tingkat energi lebih banyak karena energi potensial elektron yang bergerak dalam medan yang diberikan oleh banyak inti atom tidaklah sederhana. Lebih dari itu, energi vibrasi dan rotasi atom secara relatif satu terhadap lainnya juga terkuantisasi seperti halnya terkuantisasinya energi elektron pada atom. Transisi dari satu tingkat ketingkat yang lain semakin banyak kemungkinannya, sehingga garis-garis spektrum dari molekul semakin rapat dan membentuk pita. Timbullah pengertian pita energi yang merupakan kumpulan tingkat energi yang sangat rapat. Teori Pita Energi Penggabungan 2 atom H membentuk molekul H2 10 8 E [ eV ] 6 Ikatan tak stabil 4 2 0 1 Ikatan stabil 2 4 2 R0 3 jarak antar atom Å Teori Pita Energi Pada penggabungan dua atom, tingkat energi dengan bilangan kuantum tertinggi akan terpecah lebih dulu Elektron yang berada di tingkat energi terluar disebut elektron valensi Elektron valensi ini berpartisipasi dalam pembentukan ikatan atom. Elektron yang berada pada tingkat energi yang lebih dalam (lebih rendah) disebut elektron inti; Teori Pita Energi Padatan Gambaran tentang terbentuknya molekul dapat diperluas untuk sejumlah atom yang besar yang tersusun secara teratur, yaitu kristal padatan. Dalam penggabungan N atom identik, setiap tingkat energi terpecah menjadi N tingkat dan setiap tingkat akan mengakomodasi sepasang elekron dengan spin yang berlawanan ( ms = ± ½ ). Energi n=3 n=2 n=1 Jarak antar atom Teori Pita Energi [6] 0 3d sodium 3p 4s 3s E [ eV ] 10 R0 = 3,67 Å 20 30 2p 0 5 10 Å 15 Teori Pita Energi Cara penempatan elektron pada tingkat-tingkat energi mengikuti urutan sederhana: tingkat energi yang paling rendah akan terisi lebih dulu, menyusul tingkat di atasnya, dan seterusnya. Pada 0o K semua tingkat energi sampai ke tingkat EF terisi penuh, dan semua tingkat energi di atas EF kosong . EF , tingkat energi tertinggi yang terisi disebut tingkat Fermi, atau energi Fermi. Pada temperatur yang lebih tinggi, beberapa tingkat energi di bawah EF kosong karena elektron mendapat tambahan energi untuk naik ke tingkat di atas EF . Teori Pita Energi Elektron valensi yang berada pada tingkat energi Fermi ataupun di atas energi Fermi, berada pada salah satu tingkat energi yang dimiliki oleh kristal. Jumlah tingkat energi yang dimiliki oleh kristal sangat banyak dan sangat rapat sehingga hampir merupakan perubahan yang kontinyu. Oleh karena itu, elektron pada tingkat energi Fermi yang bergerak dalam kristal dapat dipandang sebagai elektron bebas. Elektron yang bergerak dengan kecepatan tertentu memiliki energi kinetik dan bilangan gelombang, k, tertentu. p2 2k 2 Ek 2m 2m Gerakan elektron tersebut mengalami hambatan karena ada celah energi. Konduktor Isolator Semikonduktor Konduktor , Isolator, Semikonduktor Jika banyak atom bergabung menjadi padatan, tingkat valensi terluar dari setiap atom cenderung akan terpecah membentuk pita energi. Tingkat-tingkat energi yang lebih dalam, yang disebut tingkat inti, tidak terpecah. Setiap tingkat valensi dari dari suatu padatan yang terdiri dari N atom berbentuk pita valensi yang terdiri dari N tingkat energi. Dengan demikian maka tingkat valensi s yang di tiap atom memuat 2 elektron, akan menjadi pita s yang dapat menampung 2N elektron. Tingkat valensi p yang di tiap atom memuat 6 elektron, akan menjadi pita p yang dapat menampung 6N elektron. Konduktor , Isolator, Semikonduktor Gambaran pita-pita energi pada suatu padatan Pita-pita energi yang terjadi dalam padatan dapat digambarkan sebagai berikut: pita p celah energi pita s Konduktor , Isolator, Semikonduktor Pita energi paling luar, jika ia hanya sebagian terisi dan padanya terdapat tingkat Fermi, disebut sebagai pita konduksi. Pada metal, pita valensi biasanya hanya sebagian terisi Sodium kosong celah energi EF kosong terisi pita valensi pita konduksi Konduktor , Isolator, Semikonduktor Pada beberapa metal, pita valensi terisi penuh. Akan tetapi pita ini overlap dengan pita di atanya yang kosong. Pita yang kosong ini memfasilitasi tingkat energi yang dengan mudah dicapai oleh elektron yang semula berada di pita valensi. Magnesium kosong EF terisi penuh pita valensi Konduktor , Isolator, Semikonduktor Pada beberapa material, pita valensi terisi penuh dan pita valensi ini tidak overlap dengan pita di atasnya yang kosong. Jadi antara pita valensi dan pita di atasnya terdapat celah energi. Intan Silikon kosong kosong celah energi celah energi terisi penuh isolator pita valensi terisi penuh semikonduktor Course Ware Mengenal Sifat Material Teori Pita Energi Sudaryatno Sudirham