Materi Konfigurasi Elektron dan elektron Valensi
advertisement

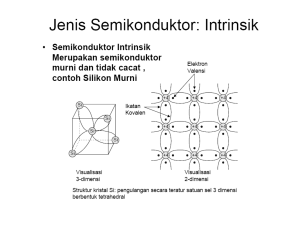
Materi Konfigurasi Elektron dan elektron Valensi Kelas X Semester 2 Hadiyanto Sahputra Guru Kimia SMK PIRI 1 Yogyakarta Aturan-aturan dalam pengisian konfigurasi elektron: 1.Pengisian dimulai dari tingkat energi paling rendah ketingkat energi paling tinggi dari kulit K, L,M dan seterusnya 2.Jika jumlah elektron yang tersisa ≤ 8 di tempatkan pada kulit berikutnya 3.Jumlah maksimum elektron pada kulit terluar adalah 8 Aturan pengisian jumlah elektron maksimum per kulit diperkenalkan oleh Pauli, dengan memakai rumum 2n2, dimana n = kulit atom. Setiap kulit atom dapat terisi elektron maksimum 2n2, dimana n adalah kulit ke berapa. Jika n = 1 maka berisi 2 elektron Jika n = 2 maka berisi 8 elektron Jika n = 3 maka berisi 18 elektron dan seterusnya. Konfigurasi Elektron (Ke): susunan Elektron Tiap kulit atom Contoh: Tentukan Konfigurasi elektron dari nomor atom 11 nama unsur Natrium ( Na) Jawab: 11Na = 2, 8, 1 Elektron Valensi (ev): jumlah elektron pada kulit terluar suatu atom netral. Cara menentukan elektron valensi adalah dengan menuliskan konfigurasi elektron Contoh: Tentukan Konfigurasi elektron dari nomor atom 11 nama unsur Natrium ( Na) Jawab: 11Na = 2, 8, 1 Maka ev =1 Tuliskan Konfigurasi Elektron dibawah ini: Jawab. Jawaban: 1. Jumlah elektron = 8 Konfigurasi elektron K= 2 L= 6 2.Jumlah elektron = 18 Konfigurasi elektron K= 2 L= 8 M= 8 3.Jumlah elektron = 38 Konfigurasi elektron K= 2 L=8 M= 18 N=8 O=2 Tuliskan Elektron valensi dari soal dibawah ini Jawab: 1. Nomor atom = 20, jumlah elektron=20 Konfigurasi elektron K=2 L=8 M=8 N=2 Elektron valensi =2 2. Nomor atom = 35 Konfigurasi elektron K=2 L=8 M=18 N=7 Elektron valensi =7 Tugas: 1. Tuliskan Pengertian aturan dalam Konfigurasi elektron? 2. Apakah yang dimaksud dengan: a.Konfigurasi Elektron: b.Elektron Valensi: 3 Tentukan Ke dan ev dari : a. 16S = B. 17Cl =