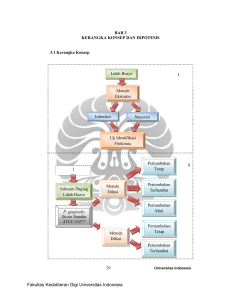
PENGARUH EKSTRAK LIDAH BUAYA (Aloe vera)
advertisement

PENGARUH EKSTRAK LIDAH BUAYA (Aloe vera) TERHADAP PERTUMBUHAN Pseudomonas aeruginosa PADA PASIEN OSTEOMIELITIS BANGSAL CEMPAKA RUMAH SAKIT ORTOPEDI PROF. DR. R. SOEHARSO SURAKARTA INVITRO SKRIPSI Untuk Memenuhi Persyaratan Memperoleh Gelar Sarjana Kedokteran LILIS SITI ASIYANI G 0005127 Isabela Ariane G.0005117 FAKULTAS KEDOKTERAN UNIVERSITAS SEBELAS MARET SURAKARTA 2009 i PENGESAHAN SKRIPSI Skripsi dengan judul : Pengaruh Ekstrak Lidah Buaya (Aloe vera ) Terhadap Pertumbuhan Pseudomonas aeroginosa pada Pasien Osteomyelitis Bangsal Cempaka Rumah Sakit Ortopedi Prof. Dr. R. Soeharso Surakarta Invitro Isabela Ariane, NIM : G0005117, Tahun : 2009 Telah diuji dan sudah disahkan dihadapan Dewan Penguji Skripsi Fakultas Kedokteran Universitas Sebelas Maret Surakarta Pada Hari kamis, Tanggal 19 februari 2009 Pembimbing Utama Nama : Agus Priyono, dr., SpOT. NIP : 130 543 975 Pembimbing Pendamping Nama : Maryani, dr., Msi.. NIP : 132 162 021 Penguji Utama Nama : M. Titiek Marminah, Dra., Apt., SU. NIP : 130 786 877 Anggota Penguji Nama : J. Priyambodo, Prof.,Dr.,dr., MS., SpMK. NIP : 130 543 992 Pembumbung Pakar Nama : Anung B. Satriadi, dr., SpOT. NIP : 130 543 992 (…………………………..) (…………………………..) (…………………………..) (…………………………..) (………………………......) Surakarta,…………………….. Ketua Tim Skripsi Dekan FK UNS Sri Wahyono, dr., M. Kes. NIP. 030 134 646 Prof. Dr. A. A. Subiyanto, dr., MS. NIP. 030 134 565 ii PERNYATAAN Dengan ini menyatakan bahwa dalam skripsi ini tidak terdapat karya yang pernah diajukan untuk memperoleh gelar kesarjanaan di suatu Perguruan Tinggi, dan sepanjang pengetahuan saya juga tidak terdapat karya atau pendapat yang pernah ditulis atau diterbitkan oleh orang lain, kecuali yang secara tertulis diacu dalam naskah dan disebutkan dalam daftar pustaka. Surakarta, 19 Februari 2009 Isabela Ariane NIM. G0005117 iii ABSTRAK ISABELA ARIANE, G0005117, 2009. Pengaruh Ekstrak Lidah Buaya (Aloe vera) Terhadap Pertumbuhan Pseudomonas aeruginosa Pada Pasien Osteomielitis Bangsal Cempaka Rumah Sakit Ortopedi Prof. Dr. R. Soeharso Surakarta Invitro. Fakultas Kedokteran Universitas Sebelas Maret Surakarta. Lidah buaya (Aloe vera) mengandung antrakuinon terutama aloin (5-9%) dan saponin yang diduga mempunyai efek antibakteri sehingga mampu menghambat pertumbuhan bakteri. Tujuan penelitian ini adalah untuk mengetahui pengaruh ekstrak lidah buaya (Aloe vera) terhadap pertumbuhan Pseudomonas aeruginosa penyebab osteomielitis rumah sakit ortopedi Prof. Dr. R. Soeharso Surakarta invitro. Penelitian ini bersifat analitik eksperimental dengan teknik kuota sampling yang terdiri dari sepuluh sampel yang berasal dari isolat pus pasien osteomielitis bangsal Cempaka rumah sakit ortopedi Prof. Dr. R. Soeharso Surakarta. Subyek penelitian Pseudomonas aeruginosa berumur 24 jam pada media PSA dan distandarisasi dengan Mc Farland 0,5, kemudian dioleskan pada agar Muller Hinton menggunakan kapas lidi steril. Penelitian ini menggunakan metode difusi. Aquades sebagai kontrol negatif, disk antibiotik imipenem 10 mg sebagai kontrol positif, beserta ekstrak lidah buaya (Aloe vera) konsentrasi 50%, 75%, dan 100% diteteskan diatas sumuran yang dibuat pada agar Muller Hinton. Di inkubasi selama 18-24 jam, kemudian zona hambatan pertumbuhan yang terbentuk diukur. Data yang diperoleh dianalisis menggunakan uji oneway Anova. Hasil penelitian menunjukkan adanya perbedaan rata hitung zona hambatan yang bermakna ( p < 0,05 ) antara; (1) ekstrak lidah buaya 50% dengan imipenem, ekstrak lidah buaya 100%, dan aquades, (2) ekstrak lidah buaya 75% dengan imipenem dan aquades, (3) ekstrak lidah buaya 100% dengan imipenem dan aquades, (4) imipenem dengan aquades. Tetapi tidak terdapat perbedaan yang bermakna (p > 0,05 ) antara ekstrak lidah buaya 75% dengan ekstrak lidah buaya 50% dan 100%. Kesimpulan yang didapat adalah ekstrak lidah buaya (Aloe vera) terbukti mampu menghambat pertumbuhan Pseudomonas aeruginosa secara invitro (p< 0,05 ). Terjadi peningkatan efek antibakteri pada peningkatan konsentrasi ekstrak lidah buaya 50% menjadi 100%, namun efek antibakteri.ekstrak lidah buaya konsentrasi 50%, 75%, dan 100% lebih lemah dibanding imipenem. Kata kunci : Ekstrak lidah buaya (Aloe vera) – Antibakteri – Pseudomonas aeruginosa iv ABSTRACT ISABELA ARIANE, G0005117, 2009. The Influence Of Aloe Extract (Aloe vera) To Pseudomonas aeruginosa Growth In Osteomyelitis Patient At Cempaka Barn Of The Prof. Dr. R. Soeharso Orthopaedic Hospital Surakarta Invitro. Faculty Of Medicine, Sebelas March University, Surakarta. Aloe Extract contains many anthraquinones especially aloin (5-9%) and saponin which are considered have an antibacterial effect so that can inhibit bacterial growth. The aim of the research is to know the influence of aloe extract (Aloe vera) to Pseudomonas aeruginosa growth in osteomyelitis patient at Cempaka barn of the Prof. Dr. R. Soeharso orthopaedic hospital Surakarta invitro. This experimental analytic research uses a quota sampling technique which is consist of 10 samples from pus isolates of osteomyelitis patient at Cempaka barn of the Prof. Dr. R. Soeharso orthopaedic hospital Surakarta. The research subject is Pseudomonas aeruginosa which has been grown on Pseudomonas Selective Agar for 24 hours and standardized by 0,5 Mc Farland standard then spreaded by a sterile cotton bud on Muller Hinton medium. This experimental uses diffusion methode. The aquadest (the negative control), the 10 mg imipenem antibiotic disk (the positive control), the 50%, 75%, and 100% concentrations of aloe extract are droped into the hole in the Muller Hinton medium. It is incubated for 24 hours, then the inhibiting zone is measured. The collected datas are analized by oneway Anova test. The result of the research shows the significant difference of mean inhibitory zone diameter (p < 0,05) between; (1) aloe extract of 50% concentration to imipenem, aloe extract of 100% concentration, and aquadest, (2) aloe extract of 75% concentration to imipenem and aquadest, (3) aloe extract of 100% concentration to imipenem and aquadest, (4) imipenem to aquadest. There is no significancy (p > 0,05 ) between aloe extract of 50% concentration to 75% and 100% of concentration. The conclusion is aloe extract has been proven can inhibit Pseudomonas aeruginosa growth invitro (p < 0,05). The increasing of aloe extract concentration 50 % to 100% can increase the antibacterial effect, but the antibacterial effect of all aloe extract concentrations are weaker than imipenem. Keyword : Aloe extract (Aloe vera) – antibacterial - Pseudomonas aeruginosa v PRAKATA Penulis mengucapkan puji syukur kepada Allah SWT yang telah melimpahkan rahmat, hidayah dan kasih sayangNya sehingga penulis mampu menyelesaikan skripsi berjudul “Pengaruh Ekstrak Lidah Buaya (Aloe vera ) Terhadap Pertumbuhan Pseudomonas aeruginosa pada Pasien Osteomielitis Bangsal Cempaka Rumah Sakit Ortopedi Prof. Dr. R. Soeharso Surakarta Invitro”. Penyusunan skripsi ini dimaksudkan untuk memenuhi salah satu syarat memperoleh gelar sarjana kedokteran di Fakultas Kedokteran Univesitas Sebelas Maret Surakarta. Penulisan skripsi ini tidak dapat terselesaikan tanpa bantuan, dukungan dan do’a berbagai pihak. Untuk itu penulis ingin mengucapkan terima kasih yang sebesar-besarnya kepada : 1. A.A. Subiyanto, Prof., Dr., dr., MS. selaku Dekan Fakultas Kedokteran Universitas Sebelas Maret 2. Sri wahyono, dr., M.Kes. selaku Ketua Tim Skripsi Fakultas Kedokteran Universitas Sebelas Maret. 3. Kepala Laboratorium Mikrobiologi Fakultas Kedokteran Universitas Sebelas Maret.yang telah membantu pelaksanaan skripsi ini 4. Agus Priyono, dr., SpOT. selaku Pembimbing Utama yang telah memberikan bimbingan, nasehat dan motivasi kepada penulis. 5. Maryani, dr., MSi. Pembimbing Pendamping yang telah memberikan bimbingan, nasehat dan motivasi kepada penulis. 6. M. Titiek Marminah, Dra., Apt., SU. selaku Penguji Utama yang telah memberikan petunjuk, bantuan dan sarannya. 7. Prof. J. Priyambodo, Dr., dr., MS., SpMK. selaku selaku Penguji Pendamping yang telah memberikan petunjuk, bantuan dan sarannya. 8. Anung B. Satriadi, dr., SpOT. Selaku Co-Author dari Rumah Sakit Ortopedi Prof. Dr. R. Soeharso Surakarta 9. Tim Etik Penelitian Kesehatan Rumah Sakit Ortopedi Prof. Dr. R. Soeharso Surakarta 10. Staff dan laboran Laboratorium Mikrobiologi Fakultas Kedokteran Universitas Sebelas Maret. 11. Bapak, Ibu, mas Bimo & mba Pipin, dan Geta tercinta yang senantiasa memberikan doa, cinta, kasih sayang, serta Motivasi. 12. Laurent, Kiki, Nia, kelompok PBL C3 05 FK UNS, teman-teman angkatan 05 FK UNS, dan teman kos MP47 terima kasih atas bantuannya. Peneliti menyadari akan kekurangan dalam penyusunan skripsi ini, oleh karena itu kritik dan saran yang bersifat konstruktif sangat peneliti harapkan. Akhirnya peneliti berharap semoga skripsi ini dapat bermanfaat bagi masyarakat. Surakarta, 20 Januari 2009 Isabela Ariane vi DAFTAR ISI PRAKATA ………………………………………………………………………….. vi DAFTAR ISI………………………………………………………………………… vii DAFTAR TABEL…………………………………………………………………… x DAFTAR LAMPIRAN……………………………………………………………... xii DAFTAR GAMBAR………………………………………………………………... xiii BAB I . BAB II . PENDAHULUAN……………………………………………………... 1 A. Latar Belakang Masalah……………………………………………. 1 B. Perumusan Masalah……………………………………………........ 3 C. Tujuan Penelitian…………………………………………………… 3 D. Manfaat Penelitian………………………………………………….. 3 LANDASAN TEORI…………………………………………………... 5 A. Tinjauan Pustaka……………………………………………………. 5 1. Lidah Buaya (Aloe vera)…………………………………………. 5 2. Ekstraksi..................................................................................... 10 3. Osteomielitis........................................................................... 11 4. Pseudomonas aeruginosa.......................................................... 13 5. Obat Anti Mikroba.................................................................... 17 vii B. Kerangka Pemikiran………………………………………………... 21 C. Hipotesis……………………………………………………………. 22 METODE PENELITIAN……………………………………………... 23 A. Jenis Penelitian……………………………………………………... 23 B. Subyek Penelitian…………………………………………………... 23 C. Lokasi Penelitian…………………………………………………… 23 D. Teknik Pengambilan Sampel……………………………………….. 24 E. Identifikasi Variabel………………………………………………... 24 F. Definisi Operasional Variabel……………………………………… 24 G. Prosedur Penelitian…………………………………………………. 26 H. Instrumentasi dan Bahan Penelitian………………………………… 27 I. Cara Kerja…………………………………………………………... 28 J. Teknik Analisis Data……………………………………………….. 30 BAB IV. HASIL PENELITIAN………………………………………………… 32 BAB V. PEMBAHASAN……………………………………………………….. 43 BAB VI. SIMPULAN DAN SARAN……………………………………………. 53 A. Simpulan……………………………………………………………. 53 BAB III. viii B. Saran………………………………………………………………... 54 1. Rumah Sakit……………………………………………………. 54 2. Peneliti…………………………………………………………. 54 3. Departemen Kesehatan………………………………………… 55 DAFTAR PUSTAKA……………………………………………………………….. 56 LAMPIRAN…………………………………………………………………………. 60 ix DAFTAR TABEL Tabel 1. Sebaran responden menurut umur responden………………………… 32 Tabel 2. Sebaran responden menurut jenis kelamin…………………… 33 Tabel 3. Sebaran menurut riwayat osteomielitis yang diderita responden 33 Tabel 4. Data sekunder diagnosa awal ( pasien datang ke RSO Prof. Dr. 34 Soeharso Surakarta)…………………………………………….. Tabel 5. Data sebaran responden berdasarkan lokasi infeksi 34 (osteomielitis) (data sekunder)………………………………….. Tabel 6. Hasil identifikasi Pseudomonas aeruginosa pada seluruh 35 spesimen pus responden................................................................ Tabel 7. Sebaran Pseudomonas aeruginosa menurut riwayat 35 osteomielitis yang di derita responden.......................................... Tabel 8. Hasil pengukuran diameter zona hambatan beberapa antibiotik 36 terhadap pertumbuhan bakteri pseudomonas aeruginosa pada osteomielitis pada masimg-masing kelompok.............................. Tabel 9. Hasil pengukuran diameter zona hambatan ekstrak lidah buaya (Aloe 37 vera) terhadap pertumbuhan bakteri Pseudomonas aeruginosa pada osteomielitis pada masing-amsing kelompok………………………… Tabel 10. Hasil uji statistik dengan uji oneway Anova……………………………… x 40 Tabel 11. Hasil uji post hoc test berupa perbandingan multipel diameter zona hambatan berbagai macam perlakuan terhadap pertumbuhan Pseudomonas aeruginosa…………………………………………………... xi 41 DAFTAR LAMPIRAN Lampiran 1. Surat Keterangan Telah Melaksanakan Penelitian di Rumah Sakit Ortopedi Prof. Dr. Soeharso Surakarta Lampiran 2. Surat Keterangan Telah Menyelesaikan Penelitian di Laboratorium Mikrobiologi Lampiran 3. Surat Keterangan Telah Melaksanakan Pembuatan Ekstrak Lidah Buaya (Aloe Vera) di Laboratorium Galenika B2P2TO2T Tawangmangu Lampiran 4. Informed Consern Lampiran 5. Data identitas responden Lampiran 6. Uji Normalitas Lampiran 7. Uji Homogenitas Lampiran 8 Uji Anova Dan Post Hoc Test Lampiran 9. Tabel F Untuk Uji Anova Lampiran 10. Tabel sensitivitas disk antibiotik (mm) Lampiran 11. Bahan dan Cara Kerja Ekstraksi Perkolasi Lampiran 12. Perincian Bahan Pembuatan Ekstrak Lidah Buaya (Aloe vera) Lampiran 13. Dokumentasi Penelitian xii DAFTAR GAMBAR Gambar 1. Grafik Batang Rata-Rata Diameter Zona Hambatan (mm) Pada Masing-Masing Kelompok Perlakuan...........................................39 xiii BAB I PENDAHULUAN A. Latar Belakang Masalah Osteomielitis atau inflamasi pada tulang, umumnya disebabkan oleh infeksi bakteri (Kalyoussef, 2006). Organisme atau mikroba yang sering ditemukan pada osteomielitis (biasanya campuran berbagai jenis bakteri) antara lain Staphylococcus aureus, Escherichia coli, Streptococcus pyogens, Proteus sp., dan Pseudomonas sp. (Apley, 1993). Saat ini penanganan osteomielitis masih merupakan masalah dalam bidang ortopedi, karena seringkali antibiotika yang diberikan secara oral maupun parenteral tidak dapat mencapai lokasi infeksi dengan baik (Lubis, 2005). Berdasarkan hasil pemeriksaan pus / jaringan nekrotik dari pasien osteomielitis di laboratorium Mikrobiologi Fakultas Kedokteran Universitas Sebelas Maret Surakarta pada periode April-Juli 2008 didapatkan sedikitnya sepuluh dari enam belas spesimen pus / jaringan nekrotik dari pasien osteomielitis yang diperiksa positif mengandung Pseudomonas aeruginosa. Pseudomonas aeruginosa merupakan penyebab infeksi nosokomial, (Qarah, 2005). Pseudomonas aeruginosa merupakan salah satu organisme penyebab osteomielitis (Apley, 1993). Pseudomonas aeruginosa meningkat secara klinik karena resisten terhadap berbagai antimikroba dan memiliki kemampuan untuk mengembangkan tingkat Multi Drug Resistance (MDR) yang tinggi, termasuk pada penisilin dan sefalosporin generasi pertama dan 1 2 kedua, tetrasiklin, kloramfenikol, dan makrolid (Rosana, 2007). Infeksi yang disebabkan oleh bakteri resisten dikaitkan dengan angka perawatan rumah sakit yang lebih tinggi, masa perawatan rumah sakit yang lebih lama, serta tingkat kesakitan dan kematian yang lebih tinggi (Sastroasmoro, 2005). Sehingga akhir-akhir ini, penggunaan dan pencarian obat dari sumber tanaman sebagai sumber obat alternatif meningkat tajam (Cowan, 1999). Lidah buaya telah lama dijuluki sebagai medical plant (tanaman obat) atau master healing plant (tanaman penyembuh utama) (Astawan, 2006). Penelitian dr. Bill Wolfe pada tahun 1969 membuktikan bahwa lidah buaya sangat efektif membunuh bakteri penyebab infeksi. Ekstrak lidah buaya (Aloe vera) mempunyai berbagai aktifitas antibakteri antara lain terhadap Staphylococcus aureus, Klebsilla pneumonia, Pseudomonas aeruginosa, Mycobacterium tuberculosis (Furnawanthi, 2007). Lidah buaya mengandung komplek antrakuinon antara lain aloe emodin, aloin, barbaloin yang berfungsi sebagai senyawa antibakteri. Selain itu terkandung juga zat saponin yang bersifat antiseptik (Furnawanthi, 2007). Senyawa kuinon dapat menyebabkan protein bakteri menjadi inaktif dan kehilangan fungsinya. (Cowan, 1999). Sedang saponin dapat melarutkan lipid pada membran sel bakteri (lipoprotein), akibatnya dapat menurunkan tegangan permukaan lipid, permeabilitas sel berubah, fungsi sel bakteri menjadi tidak normal, dan sel bakteri lisis dan mati (Voight, 1994, Brooks, 2007). Sehubungan dengan adanya indikasi ekstrak lidah buaya mempunyai daya antibakteri, maka perlu dilakukan penelitian tentang pengaruh antibakteri 3 lidah buaya tersebut terhadap pertumbuhan kuman Pseudomonas aeruginosa penyebab osteomielitis secara invitro. B. Rumusan Masalah Adakah pengaruh ekstrak lidah buaya (Aloe vera) terhadap pertumbuhan bakteri Pseudomonas aeruginosa bangsal Cempaka rumah sakit ortopedi Prof. Dr. R. Soeharso Surakarta secara invitro? C. Tujuan Penelitian 1. Untuk mengetahui apakah ekstrak lidah buaya mampu menghambat pertumbuhan kuman Pseudomonas aeruginosa pada pasien osteomielitis bangsal Cempaka rumah sakit ortopedi Prof. Dr. R. Soeharso Surakarta secara invitro. 2. Untuk mengetahui kekuatan hambatan dari ekstrak lidah buaya terhadap Pseudomonas aeruginosa pada pasien osteomielitis bangsal Cempaka rumah sakit ortopedi Prof. Dr. R. Soeharso Surakarta secara invitro yang dilihat dari zona hambatan pertumbuhan kuman yang terbentuk pada media yang digunakan. D. Manfaat Penelitian 1. Manfaat Teoritik a. Menambah pengetahuan dalam bidang fitofarmasi 4 b. Dapat memberikan informasi ilmiah mengenai daya hambat lidah buaya (Aloe vera) terhadap Pseudomonas aeruginosa pada pasien osteomielitis bangsal Cempaka rumah sakit ortopedi Prof. Dr. R. Soeharso Surakarta secara invitro 2. Manfaat Aplikatif a. Diharapkan dapat dipakai sebagai acuan terhadap pengembangan penelitian obat alami sebagai alternatif dalam pengobatan penyakit infeksi khususnya osteomielitis. b. Memberikan informasi ilmiah kepada masyarakat tentang khasiat lidah buaya khususnya terhadap pertumbuhan Pseudomonas aeruginosa pada osteomielitis. BAB II LANDASAN TEORI A. Tinjauan Pustaka 1. Lidah Buaya (Aloe vera) a. Klasifikasi Devisi : Spermatophyta (Tumbuhan Biji) Kelas : Angiospermae (Tumbuhan Berbiji Tertutup) Sub kelas : Monocotyledoneae Ordo : Liliflorae (Liliales) Famili : Liliaceae Genus : Aloe Spesies : Aloe vera (Sudarto, 1997) b. Nama lokal Prancis, Portugis, Jerman : Aloe Inggris : Crocodiles tongues Malaysia : Jadam Spanyol : Salvilla Indonesia : Lidah buaya Tibet : Jelly Leek India : mussabbar (Sudarto, 1997) 5 6 c. Deskripsi tanamam 1) Daun Seperti halnya tanaman berkeping satu lainnya, daun lidah buaya berbentuk tombak dengan helaian memanjang. Daunnya berdaging tebal, tidak bertulang, berwarna hijau keabu-abuan dan mempunyai lapisan lilin dipermukaan, serta bersifat sekulen, yakni mengandung air, getah, atau lendir yang mendominasi daun. Bagian atas daun rata dan bagian bawahnya membulat (cembung). Didaun lidah buaya muda dan sucker (anak) terdapat bercak atau totol berwarna hijau pucat sampai putih. Bercak ini akan hilang saat lidah buaya dewasa. Namun, tidak demikian halnya dengan tanaman lidah buaya jenis kecil dan lokal. Hali ini kemungkinan disebabkan faktor genetiknya. Sepanjang tepi daun berjajar gerigi atau duri yang tumpul dan tidak berwarna (Furnawanthi, 2007). 2) Batang Tanaman lidah buaya berbatang pendek. Batangnya tidak kelihatan karena tertutup oleh daun-daun yang rapat dan sebagian terbenam dalam tanah. Melalui batang ini akan muncul tunas-tunas yang selanjutnya menjadi anakan. Lidah buaya yang bertangkai panjang juga muncul dari batang melalui celah-celah atau ketiak daun (Sudarto, 1997). 3) Akar 7 Akar tanaman lidah buaya berupa akar serabut yang pendek dan berada disekitar permukaan tanah. Panjang akar berkisar antara 50-100 cm. Dengan demikian, untuk pertumbuhannya tanaman menghendaki tanah yang subur dan gembur di bagian atasnya. Hal ini dicapai dengan lapisan olah sedalam 30 cm (Sudarto, 1997). 4) Bunga Bunga lidah buaya berwarana kuning atau kemerahan berupa pipa yang mengumpul, keluar dari ketiak daun. Bunga berukuran kecil, tersususun dalam rangkaian berbentuk tandan, dan panjangnya dapat mencapai 1 meter. Bunga biasanya muncul bila ditanam di pegunungan (Sudarto, 1997). 5) Syarat tumbuh dan ekologi a) Ketinggian tempat Lidah buaya ( Aloe vera ) dapat tumbuh mulai dari daerah dataran rendah sampai daerah pegunungan. Daya adaptasi tinggi sehingga tempat tunbuhnya menyebar di seluruh dunia, mulai dari daerah tropika sampai daerah subtropika. Di dataran tinggi tanaman ini dapat menghasilkan bunga (Sudarto, 1997). b) Iklim Tanaman lidah buaya (Aloe vera) tahan terhadap segala unsur iklim, yaitu suhu, curah hujan, dan sinar matahari. Tanaman ini juga tahan kekeringan, dapat menyimpan air pada 8 daunnya yang tebal, mulut daunnya tertutup rapat sehingga dapat mengurangi penguapan pada musim kering. Meskipun tanaman menghendaki ditanam di tempat terbuka, tetapi dalam ruangan yang sinar mataharinya kurangpun dapat tumbuh dengan baik. Oleh karena itu, tanaman terdapat dimana-mana, mulai dari Eropa, Amerika, Afrika, dan Asia. Di daerah yang bersuhu antara 28º-32º C tanaman dapat tumbuh dengan baik. Kelemahan lidah buaya hanya apabila ditanam di daerah basah dengan curah hujan tinggi adalah banyaknya serangan cendawan, terutama Fusarium Sp. Yang menyerang pangkal daun (Sudarto, 1997). c) Tanah Tanah yang dikehendaki lidah buaya ( Aloe vera ) adalah tanah subur, kaya bahan organik, dan gembur. Di Kalimantan Barat, tanaman tumbuh baik di daerah bertanah gambut dengan pH yang rendah. PH ideal untuk tanaman lidah buaya adalah 5,5-6 (Sudarto, 1997). d. Kandungan kimia dan kegunaan Komponen yang terkandung dalam lidah buaya sebagian besar adalah air yang mencapai 99,5% dengan total padatan terlarut hanya 0,49%, lemak 0,067%, karbohidrat 0,043%, protein 0,038%, vitamin A 4,594 IU, dan vitamin C 3,476 mg (Furnawanthi, 2007). Lidah buaya mempunyai kandungan zat gizi yang diperlukan 9 tubuh dengan cukup lengkap, yaitu vitamin A, B1, B2, B3, B12, C, E, kolin, inositol dan asam folat (Astawan, 2006). Zat-zat ini sangat berguna untuk pertumbuhan tulang, pembentukan dan pergantian jaringan, pengaturan metabolisme dalam tubuh manusia, dan pengaturan gerak urat syaraf (Sudarto,1997). Kandungan mineralnya antara lain terdiri dari: kalsium (Ca), magnesium (Mg), potasium (K), sodium (Na), besi (Fe), zinc (Zn), dan kromium (Cr). Beberapa unsur vitamin dan mineral tersebut dapat berfungsi sebagai pembentuk antioksidan alami, seperti vitamin C, vitamin E, vitamin A, magnesium, dan zinc. Antioksidan ini berguna untuk mencegah penuaan dini, serangan jantung, dan berbagai penyakit degeneratif (Astawan, 2006) Lidah buaya (Aloe vera) dilaporkan mengandung mono dan poli sakarida, tannin, sterol-sterol, asam-asam organik, enzim, saponin, vitamin dan mineral (Newall,et all, 1998). Lidah buaya juga mengandung komplek antrakuinon antara lain aloe emodin, aloin, barbaloin. Zat lain terkandung di dalam lidah buaya yaitu zat saponin yang mempunyai kemampuan membersihkan dan bersifat antiseptik (Furnawanthi, 2007). Sebuah penilitian invitro dalam bidang bioterapi molekuler di Amerika Serikat yang dilakukan tahun 1991, menemukan manosa yang terkandung dalam jel lidah buaya, manosa mampu menghambat pertumbuhan virus HIV 1–30% dan meningkatkan viabilitas sel terinfeksi. Menurut journal of the Amerika Pediatric Medical Association, lidah buaya dapat membantu mencegah encok (rematik) dan mengurangi 10 peradangan persendian. Penelitian dr. Bill Wolfe pada tahun 1969 membuktikan bahwa lidah buaya sangat efektif membunuh bakteri penyebab infeksi. Journal of Alternatif Medicine mempublikasikan efektifitas lidah buaya untuk mengatasi gangguan percernaan. Kegunaan lainnya antara lain menurunkan kadar gula darah penderita diabetes, menghambat sel kanker, serta membantu penyembuhan luka, ambeien dan radang tenggorokan (Furnawanthi, 2007). Ekstrak lidah buaya (Aloe vera) mempunyai berbagai aktifitas anti bakteri antara lain terhadap Staphylococcus aureus, Klebsilla pneumonia, Pseudomonas aeruginosa, Mycobacterium tuberculosis (Furnawanthi, 2007). 2. Ekstraksi Ekstraksi adalah penyarian senyawa-senyawa yang terdapat didalam simplisia tanaman yang menggunakan cairan penyari yang sesuai dengan kandungan zat dengan cara yang tepat. Prinsip ekstraksi adalah melarutkan komponen yang berada dalam campuran secara selektif dengan pelarut yang sesuai. Prinsip kelarutan yaitu polar melarutkan yang polar, pelarut semipolar melarutkan senyawa semipolar, pelarut nonpolar melarutkan senyawa nonpolar. Sediaan yang diperoleh dari hasil ekstraksi dinamakan ekstrak, sedangkan pelarutnya disebut penyari, sedangkan sisasisa yang tidak ikut tersari disebut ampas (Harborne, 1998). Penggolongan ekstrak berdasarkan sifatnya yaitu : a. Ekstrak encer 11 Sediaan ini mempunysi konsistensi seperti madu b. Ekstrak kental Sediaan ini liat pada kondisi dingin dan tidak dapat dituang, kemudian kandungan air sekitar 30 % c. Ekstrak kering Sedian ini mempunyai konsistensi kering dan mudah digosokkan, kandungan air tidak lebih dari 5 % (Voight, 1994) Teknik menggunakan perkolasi cairan yang digunakan pengekstraksi yaitu dalam etanol pengekstrasian, 70%. Senyawa antrakuinon termasuk kompleks senyawa fenol yang umumnya seringkali berikatan dengan glukosa sebagai glikosida sehingga mudah larut dalam etanol dan air karena glikosida mudah larut dalam keduanya. Sedang saponin mudah terdisosiasi dalam larutan air (Voight, 1994). 3. Osteomielitis osteomielitis atau inflamasi pada tulang, umumnya disebabkan oleh infeksi bakteri (Kalyoussef, 2006). Organisme atau mikroba yang sering ditemukan pada osteomielitis (biasanya campuran berbagai jenis bakteri) antara lain Staphylococcus aureus, Escherichia coli, Streptococcus pyogens, Proteus sp., dan Pseudomonas sp.(Apley, 1993). Secara umum osteomielitis dibagi menjadi dua macam, yaitu osteomielitis hematogen dan osteomielitis sekunder. Osteomielitis hematogen adalah suatu infeksi yang disebabkan oleh bakteri yang 12 disebarkan melalui aliran darah. Osteomielitis hematogen ada 3 macam yaitu akut, subakut, dan kronis. Jenis kedua adalah osteomielitis sekunder karena fokus infeksi yang berdekatan. Osteomielitis ini disebabkan oleh trauma langsung, tindakan pembedahan serta perluasan lansung infeksi dari jaringan lunak yang berdekatan. Organisme penyebab penyebab osteomielitis mencapai tulang melalui satu dari tiga rute, yaitu penyebaran secara hematogen, perluasan lansung dari fokus infeksi di sendi dan jaringan lunak sekitar, tindakan bedah ortopedi (King, 2006, Sjamsuhidajat, 2005, Ladd, 2003). Diagnosis dibuat berdasarkan atas pemeriksaan fisik dan pemeriksaan penunjang. Osteomielitis hematogen biasanya bermanifestasi sebagai suatu penyakit deman sistemik akut, yang disertai dengan gejala nyeri setempat, perasaan tidak enak, kemerahan, dan pembengkakan. Pada saat ini kultur darah biasanya memberikan hasil positif (ditemukan pertumbuhan bakteri). Nekrosis tulang pada pemeriksaan radiologis untuk tujuh sampai sepuluh hari pertama biasanya tidak cukup memuaskan. Walaupun penyembuhan spontan dapat terjadi, akan tetapi bila pengobatannya tidak adekuat, dapat menjadi kronis dengan disertai destruksi tulang dan penyebaran infeksi (Robbins, 2007). Gejala dan tanda ostemielitis sekunder berupa demam, nyeri, pembengkakan dan pengeluaran cairan infeksi. Rasa sakit, demam dan reaksi peradangan bisa karena trauma asli atau karena memang infeksi jaringan lunak. Infeksi yang samar menjadi jelas hanya beberapa minggu 13 atau beberapa bulan kemudian ketika traktus sinus berkembang, luka operasi terbuka, dan fraktur gagal menyembuh. Pada pemeriksaan darah ditemukan leukositosis dan peningkatan LED. Pada kultur darah biasanya memberikan hasil positif (ditemukan pertumbuhan bakteri), pemeriksaan bakteriologi dari cairan infeksi mungkin membantu mengidentifikasi organisme penyebab dan menentukkan sensitivitasnya terhadap antibiotik (Apley, 1993, Sjamsuhidajat, 2005). 4. Pseudomonas aeruginosa a. Klasifikasi Filum : Proteobacteria Kelas : Gamma Proteobacteria Ordo : Pseudomonadales Famili : Pseudomonadaceae Genus : Pseudomonas Species : Pseudomonas aeruginosa (Levinson, 2006) b. Morfologi dan Identifikasi Pseudomonas aeruginosa menjadi penyebab terpenting infeksi, khususnya pada pasien dengan mekanisme sistem imun yang menurun. Patogen tersering dari isolasi yang berasal dari pasien rumah sakit yang telah dirawat lebih dari 1 minggu. Merupakan patogen nosokomial utama, 14 seperti pada pneumonia, infeksi saluran kemih, dan bakterimia (Qarah, 2005). P. aeruginosa dapat menyebabkan osteomielitis pada tulang temporal, juga merupakan penyebab tersering osteomielitis pada tulang calcaneus pada anak-anak (Murray, 1995). Pseudomonas merupakan bakteri gram negatif, motil, aerobik (Harvey, 2007). Beberapa galur memproduksi pigmen larut air. P. aeruginosa sering dalam jumlah sedikit pada flora normal usus dan kulit manusia dan merupakan patogen utama dari kelompoknya (Brooks et al, 2007). P. aeruginosa merupakan bakteri batang gram negatif dengan ukuran 0,5-1,0 x 3,0-4,0 um (staf pengajar FK UI, 1994). P. aeruginosa terlihat sebagai bentuk tunggal, ganda, dan kadang-kadang dalam rantai pendek (Brooks et al, 2007). Umumnya memiliki flagel polar, tetapi kadang-kadang 2-3 flagel (staf pengajar FK UI, 1994). P. aeruginosa bersifat aerobik obligat yang tumbuh dengan cepat pada berbagai tipe media, kadang memproduksi bau manis, seperti anggur atau jagung (corn taco like odor). Beberapa galur menghemolisis darah. P. aeruginosa membentuk koloni bulat halus dengan warna floresen kehijauan (Brooks et al, 2007). Pseudomonas menghasilkan, 1.) piosianin (pyosianin) yakni pigmen berwarna hijau-biru dan tidak flouresen yang larut dalam agar dan kloroform, yang dapat memberi warna hijau-biru nanah pada luka. 2.) flouresen, suatu pigmen yang larut air, beberapa strain menghasilkan pigmen merah.3.) pioverdin (pyoverdin) yang memberi warna kehijauan pada agar, flouresen dibawah sinar ultraviolet, 15 dapat digunakan sebagai diagnosa awal pada infeksi kulit pada pasien luka bakar. 4.) beberapa galur menghasilkan pigmen merah gelap piorubin atau pigmen hitam piomelanin. P. aeruginosa satu-satunya spesies yang menghasilkan pyocianin (Staf Pengajar FK UI, 1994, Levinson, 2006, Brooks et al, 2007 ). P. aeruginosa tumbuh baik pada suhu 37º-42ºC, pertumbuhan pada 42ºC membantu membedakannya dari pasien Pseudomonas pada kelompok floresen (Brooks et al, 2007). Bersifat oksidase positif (proses oksidasi yang melibatkan transpor elektron oleh sitokrom). Nonfermenters atau tidak meragi glukosa karena energi kuman tersebut berasal dari proses oksidasi glukosa bukan fermentasi glukosa, sehingga bisa dibedakan dari enterobacteri yang memfermentasi gula (Levinson, 2006) Patogenesis dari P. aeruginosa didasarkan atas multipel virulences factor ; endotoksin, eksotoksin, dan enzim. Endotoksin P. aeruginosa sama seperti bakteri gram negative lainnya yang menyebabkan sepsis dan syok septik. P. aeruginosa memproduksi eksotoksin A yang menyebabkan nekrosis jaringan, toksin memnghambat sintesis protein eukariotik dengan sebuah mekanisme ymg identik dengan eksotoksin difteria. Selain itu P. aeruginosa juga menghasilkan enzim yaitu elastase dan protease, yang bersifat histotoksik dan memfasilitasi masuknya bakteri ke dalam aliran darah (Levinson, 2006). P aeruginosa juga menghasilhan 2 hemolisin : sebuah fosfolipase C yang tidak tahan panas dan glikolipid yang tahan panas (Brooks et al, 2007 ). 16 P. aeruginosa tumbuh sebagai koloni yang tidak memfermentasi laktosa (tidak berwarna) pada MacConkey dan EMB agar, juga oksidasi positif. Pada agar TSI (Triple Sugar Iron) akan tampak seperti kilauan logam, juga membentuk pigmen hijau biru pada nutrient agar pada umunya, serta beraroma buah (Levinson, 2006). Pada tes indol didapatkan hasil negatif untuk P. aeruginosa (Koneman, 2006). Sebagian besar strain kuman ini menunjukkan hemolisis ß pada agar darah disertai pembentukkan pigmen (Johnson, 1993). Pembiakan merupakan tes spesifik dari diagnosis infeksi P. aeruginosa (Brooks et al, 2007 ). P. aeruginosa secara alami resisten terhadap berbagai antimikroba. Kebanyakan antibiotika tidak efektif terhadap kuman ini (Weinstein, 1992). P. aeruginosa meningkat secara klinik karena resisten terhadap berbagai antimikroba dan memiliki kemampuan untuk mengembangkan tingkat Multi Drug Resistance (MDR) yang tinggi, termasuk pada penislin dan sefalosporin generasi pertama dan kedua, tetrasiklin, kloramfenikol, dan makrolid. Patogen dengan MDR dapat menyebabkan morbidity, mortality, dan meningkatnya biaya (Rosana, 2007). Infeksi klinis oleh P. aeruginosa sebaiknya tidak diterapi dengan obat tunggal, karena biasanya sulit sembuh dengan cara ini, dan karena bakteri dapat dengan cepat menjadi resisten jika menggunakan obat tunggal. Salah satu obat pilihan P. aeruginosa adalah imipenem. Struktur obat ini berkaitan dengan antibiotik ß laktam. Imipenem mempunyai 17 aktivitas yang baik terhadap banyak batang gram negatif, organisme gram positif dan kuman anaerob. Obat ini resisten terhadap ß laktamase. Semua obat ß laktam merupakan penghambat selektif dari sintesis dinding sel bakteri, yaitu dengan cara: (1) mengikat PBP (Protein Pengikat Penisilin) tertentu yang bekerja sebagai reseptor obat pada bakteri, (2) menghambat sistesis dinding sel dengan menghambat transpeptidase peptidoglikan, (3) mengaktifkan enzim autolitik pada dinding sel yang dapat menimbulkan lesi penyebab matinya bakteri (Brooks et al, 2007 ). 5. Obat Anti Mikroba Anti mikroba adalah obat pembasmi mikroba, khususnya mikroba yang merugikan manusia (Ganiswarna,, 1995). Obat yang digunakan untuk membasmi mikroba penyebab infeksi pada manusia ditentukan harus memiliki sifat toksisitas selektif setinggi mungkin, artinya obat tersebut haruslah bersifat toksik bagi mikroba, tetapi relatif tidak toksik untuk hospes (Brooks et al, 2007 ). Pada beberapa situasi klinik sangat penting untuk lebih memilih menggunakan obat bakterisidal daripada bakteriostatik. Obat bakterisidal membunuh kuman, sedangkan obat bakteriostatik hanya menghambat pertumbuhan bakteri tapi tidak membunuhnya (Levinson, 2006). Penentuan daya antibakteri dapat dilakukan dengan menentukan adanya daya hambat pertumbuhan bakteri atau dilanjutkan dengan menentukan potensi daya hambat dengan membandingkan dengan antibiotika (Dzulkarnain, 1996) 18 Daya kerja obat antimikroba : (Levinson, 2006) (a) Penghambatan sintesis dinding sel (b) Mengganggu fungsi membran sel (c) Penghambatan sintesis dan penyusunan protein (d) Penghambatan sintesis asam nukleat Uji aktivitas antimikroba secara umum dikelompokkan menjadi 2, yaitu : metode difusi dan metode dilusi. 1) Metode Difusi Cakram kertas saring yang mengandung obat dalam jumlah tertentu ditempatkan pada permukaan pembenihan padat yang telah ditanami dengan biakan tebal organisme yang diperiksa. Setelah pengeraman, garis tengah daerah hambatan jernih yang mengelilingi obat dianggap sebagai ukuran kekuatan hambatan obat terhadap terhadap organisme yang diperiksa. Metode cawan piringan kertas merupakan teknik yang paling simple untuk menggambarkan faktor fisik dan kimia yang berpengaruh terhandap interaksi obat anti mikroba dan organisme (Brooks et al, 2007 ). Untuk mengevaluasi hasil uji kepekaan tersebut (apakah isolat mikroba sensitif atau resisten terhadap obat), dapat dilakukan dua cara seperti berikut. a) Cara Kirby Baeuer, yaitu dengan cara membandingkan diameter dari area jernih (zona hambatan) disekitar cakram dengan yang dibuat oleh NCCLS (National Comitte for 19 Clinical Laboratory Standard). Dengan tabel NCCLS ini dapat diketahui kriteria sensitif, sensitif intermediet, dan resisten. b) Cara Joan-Strokes, yaitu dengan cara membandingkan radius Zona hambatan yang terjadi antara bakteri kontrol yang sudah diketahui kepekaannya terhadap obat tersebut dengan isolat bakteri yang diuji. Prosedur uji kepekaan untuk bakteri kontrol dan bakteri uji dilakukan bersamasama dalam satu piring agar (Sjoekoer, 2003). 2) Metode Dilusi Sejumlah obat antimikroba tertentu dicampurkan pada pembenihan bakteri yang cair atau padat. Kemudian pembenihan tersebut ditanami dengan bakteri yang diperiksa dan dieram. Titer obat ialah jumlah obat antimikroba yang dibutuhkan untuk menghambat pertumbuhan atau mematikan bakteri yang diperiksa. Teknik pengenceran tabung menetapkan jumlah terkecil zat kemoterapeutik yang dibutuhkan untuk menghambat organisme invitro. Jumlah tersebut sebagai konsentrasi hambatan minimum atau Minimal Inhibitory Consentration (MIC) (Brooks et al, 2007 ). Diantara banyak faktor yang mempengaruhi aktivitas invitro, yang berikut harus diperhatikan secara nyata mempengaruhi hasil-hasil tersebut, yaitu : (a) pH lingkungan, (b) komponen-komponen pembenihan, (c) 20 stabilisasi obat, (d) besarnya inokulum, (e) masa pengeraman (f) aktivitas metabolik organisme (Brooks et al, 2007 ). Senyawa antibakteri yang terkandung dalam ekstrak lidah adalah antrakuinon dan Saponin (Newall et al, 1998). Kuinon merupakan penyedia radikal bebas yang stabil. Kuinon juga diketahui dapat membentuk kompleks yang irreversibel dengan gugus nukleofilik asam amino dari protein, sehingga sering menyebabkan protein bakteri menjadi inaktif dan kehilangan fungsinya. (Cowan, 1999). Sedang saponin merupakan emulgator anion aktif, dapat melarutkan lipid pada membran sel bakteri (lipoprotein), menurunkan tegangan permukaan lipid, permeabilitas sel berubah, fungsi sel bakteri menjadi tidak normal, dan sel bakteri lisis dan mati (Voight, 1994, Brooks, 2007). Kadar aloin dalam lidah buaya berkisar antara 5-9 %, aloin termasuk kompleks antrakuinon (Furnawanthi, 2007). 21 B. Kerangka Pemikiran Osteomielitis Pseudomonas aeruginosa Ekstrak lidah buaya (Aloe vera) 1. Antrakuinon (aloin) Merupakan radikal bebas yang dapat membentuk kompleks yang irreversibel dengan gugus nukleofilik asam amino dari protein, sehingga protein bakteri menjadi inaktif dan kehilangan fungsinya. 2. Saponin Dapat melarutkan lipid pada membran sel bakteri (lipoprotein), menurunkan tegangan permukaan lipid, permeabilitas sel berubah, fungsi sel bakteri menjadi tidak normal, dan sel bakteri lisis dan mati. Hambatan pertumbuhan Pseudomonas aeruginosa 22 C. Hipotesis Ekstrak lidah buaya (Aloe vera) dapat menghambat pertumbuhan Pseudomonas aeruginosa pada osteomielitis secara invitro. BAB III METODOLOGI PENELITIAN A. Jenis Penelitian Penelitian ini bersifat eksperimental laboratorik menggunakan rancangan post test only with control group design. B. Subyek Penelitian Subyek penelitian adalah Pseudomonas aeruginosa dari isolat yang berasal dari pus pada pasien osteomielitis rumah sakit ortopedi Prof. Dr. R. Soeharso Surakarta. 1. Pseudomonas aeruginosa diidentifikasi dengan kultur 2. Osteomielitis, criteria sebagai berikut : a. Pasien atau responden telah bersedia menjadi subyek penelitian dengan menandatangani informed concern b. Diagnosis ditegakkan berdasarkan rekam medis responden. C. Lokasi Penelitian Penelitian dilakukan di bangsal Cempaka rumah sakit ortopedi Prof. Dr. R. Soeharso Surakarta dan laboratorium Mikrobiologi Fakultas Kedokteran Universitas Negeri Sebelas Maret Surakarta. 23 24 D. Teknik Sampling Dalam penelitian ini digunakan teknik non random sampling, (kuota sampling), dimana Besar sampel yang digunakan adalah sepuluh biakan Pseudomonas aeruginosa dari dua puluh tujuh isolat yang berasal dari pus pasien osteomyelitis bangsal Cempaka rumah sakit ortopedi Prof. Dr. R. Soeharso Surakarta pada tanggal 5 Agustus – 10 September 2008. E. Identifikasi Variabel 1. Variabel bebas : Ekstrak lidah buaya (Aloe vera) dengan konsentrasi 50 %, 75 %, 100 %. 2. Variabel terikat : Pertumbuhan Pseudomonas aeruginosa. 3. Variabel luar : a. Variabel terkendali : pengekstraksian, konsentrasi ekstrak, dan umur biakan kuman b. Variabel tak terkendali : musim, umur tanaman, dan asal tanaman F. Definisi Operasional Variabel 1. Ekstrak lidah buaya (aloe vera) Ekstrak lidah buaya (Aloe vera) yang berasal dari tumbuhan lidah buaya lokal Tawangmangu yang diperoleh dari Balai Besar Pusat Penelitian Obat Tradisional (B2P2OT) Tawangmangu. Ekstrak lidah buaya (Aloe vera) dengan konsentrasi 50 %, 75 %, 100 % didapatkan 25 dengan cara mengencerkan ekstrak menggunakan aquades steril. Skala pengukuran variabel ini menggunakan skala rasio. 2. Pseudomonas aeruginosa Pseudomonas aeruginosa pada penelitian ini berasal dari specimen pus osteomielitis bangsal Cempaka rumah sakit ortopedi Prof. Dr. R. Soeharso Surakarta yang diidentifikasi di laboratorium Mikrobiologi Universitas Negeri Sebelas Maret Surakarta. Efek antibakteri terhadap pertumbuhan Pseudomonas aeruginosa dilihat dari zona hambatan yang terbentuk pada pertumbuhan koloni Pseudomonas aeruginosa pada media muller hinton yang diberi sumuran ekstrak lidah buaya dengan konsentrasi 50 %, 75 %, 100 % dan telah diinkubasikan selama 18-24 jam dengan suhu 370C. Sebagai kontrol positif adalah antibiotik imipenem10 mg sedangkan kontrol negatif adalah aquades steril. Skala pengukuran variabel ini menggunakan skala rasio. 3. Variabel luar a. Pengekstraksian, konsentrasi ekstrak, dan umur biakan kuman, merupakan variable-variabel yang dapat dikendalikan. b. Musim, umur tanaman, asal tanaman merupakan variabel yang tidak dapat dikendalikan. Ketiga faktor tersebut bisa mempengaruhi kandungan yang ada dalam ekstrak lidah buaya. 26 G. Prosedur Penelitian Pus penderita osteomielitis Kaldu pepton 370C 18-24 jam Pseudomonas Selective Agar 370C 18-24 jam koloni bulat halus dengan warna kehijauan Pseudomonas aeruginosa Standarisasi Mc Farland 0,5 imipenem 10 mg Ekstrak lidah buaya 50% Cakram 75% Aquades steril 100 sumuran sumuran Inokulasi Pseudomonas aeruginosa yang telah distandarisasi Mc Farland 0,5 pada medium Muller-Hinton agar 370C 18-24 jam Ukur zona hambatan pertumbuhan kuman (mm) Analisis Data 27 H. Instrumentasi dan Bahan Penelitian 1. Alat untuk pemeriksaan uji aktivitas antibakteri a. Tabung reaksi steril b. Kapas lidi steril c. Oshe kolong d. Erlenmeyer e. Pipet f. Lampu spiritus g. “Hole” (pembuat lubang dalam agar Mueller Hinton) 2. Bahan untuk pemeriksaan uji aktivitas antibakteri a. Biakan bakteri Pseudomonas aeruginosa b. PSA (Pseudomonas Selective Agar) c. Aquades steril d. Muller Hinton agar e. Kaldu pepton f. Ekstrak lidah buaya konsentrasi tertentu g. Cakram antibiotik imipenem 10 mg h. NaCl fisiologis steril i. Standard Mc Farland 0,5 28 I. Cara Kerja 1. Persiapan awal Alat-alat yang diperlukan dicuci bersih kemudian dikeringkan dan disterilkan dalam autoklaf pada suhu 1210C selama 15 menit. 2. Pengambilan Sampel Pus Pasien osteomielitis yang telah memenuhi 2 kriteria diatas kemudian dibersihkan lokasi infeksinya dengan menggunakan NaCl Fisiologis. Setelah itu dilakukan usap pus secara steril pada lokasi infeksi menggunakan kapas lidi steril dan kemudian hasil usapan tadi dimasukkan ke dalam kaldu pepton untuk selanjutnya akan dilakukan identifikasi dengan sebelumnya di eramkan dalam inkubator 37° C selama 24 jam. Identifikasi Pseudomonas aeruginosa dengan cara kultur. Pada saat pengamilan sampel pasien, peneliti melakukan dengan mandiri dengan didampingi laboran yang berasal dari laboratorium Mikrobiologi Fakultas Kedokteran Universitas Sebelas Maret. 3. Pengkulturan Spesimen Spesimen yang berasal dari kaldu pepton tadi kemudian dikulturkan ke dalam media PSA dengan cara digoreskan menggunakan oshe kolong yang telah dicelupkan dalam kaldu pepton tersebut, kemudian inkubasi 37° C selama 24 jam. Setelah diinkubasi, koloni Pseudomonas aeruginosa akan berupa koloni bulat halus dengan warna kehijauan. 4. Persiapan ekstrak lidah buaya 29 Konsentrasi ekstrak lidah buaya yang dipakai adalah 50%, 75%, 100%, yang didapatkan dari B2P2TO Tawangmangu. Ekstrak lidah buaya tersebut diencerkan dengan cara disuspensikan dengan aquades steril. 5. Pembuatan suspensi bakteri Beberapa oshe bakteri diambil dari biakan Pseudomonas aeruginosa media PSA kemudian dimasukkan ke dalam tabung reaksi yang berisi kaldu pepton steril, lalu dikocok sampai homogen. Kemudian dibandingkan dengan suspensi Mc Farland 0,5. 6. Persiapan disk antibiotik Menggunakan disk antibiotik standar yaitu imipenem 10 mg sebagai kontrol positif CT 0024B. 7. Pelaksanaan uji bakteri Disiapkan media agar Muller Hinton, lalu dibuat sumuran berdiameter 6 mm, sebanyak 4 sumuran tiap plate. Setelah itu bakteri Pseudomonas aeruginosa yang telah disuspensikan dangan standart Mc Farland 0,5 dioleskan pada agar Muller Hinton dengan kapas lidi steril. Tunggu selama 5 menit, kemudian teteskan 0,05 ml aquades steril, Ekstrak lidah buaya dengan konsentrasi 50%, 75%, 100%, pada masing-masing sumuran dalam satu agar muller hinton. Kemudian letakan cakram imipenem 10 mg pada permukaan media perbenihan. Dalam media tersebut diberi cakram imipenem 10 mg pada biakan Pseudomonas aeruginosa sebagai pembanding atau blanko kontrol positif dan aquades sebagai kontrol negatif. Pengujian senyawa antibakteri dilakukan dengan 30 pengamatan yang dilakukan setelah 24 jam. Zona hambatan yang terbentuk diukur dengan penggaris dalam satuan milimeter (mm). J. Teknik Analisis Data Data yang berupa diameter zona hambatan dianalisis dengan menggunakan uji oneway ANOVA yang kemudian dilanjutkan dengan post hoc test berupa uji Dunnett T3. Data Diolah dengan program Statistical Product and Service Solution (SPSS) 17,00 for windows. 1. Uji oneway ANOVA (Analysis of Variance) Uji ini digunakan untuk membandingkan rata-rata lebih dari dua kelompok dan untuk menguji apakah kelima kelompok perlakuan memiliki rata-rata diameter zona hambatan yang berbeda signifikan atau tidak. Hipotesis: H0 : Kelima rata-rata kelompok adalah sama H1 : Kelima rata-rata kelompok adalah tidak sama Pengambilan keputusan : a. Berdasarkan perbandingan Fhitung dan F tabel Jika F hitung (angka F output) > F tabel (tabel F), maka H0 ditolak. 31 Jika F hitung (angka F output) < F tabel (tabel F), maka H0 diterima. b. Berdasarkan nilai probabilitas Jika nilai probabilitas > 0,05, maka H0 diterima Jika nilai probabilitas < 0,05, maka H0 ditolak 2. Uji Dunnett T3 Uji Dunnett T3 digunakan untuk membandingkan rata-rata diameter zona hambatan antar kelompok perlakuan. Hipotesis : H0 : Perbedaan rata-rata diameter zona hambatan antara kelompok yang dibandingkan tidak signifikan H1 : Perbedaan rata-rata diameter zona hambatan antara kelompok yang dibandingkan signifikan. Pengambilan keputusan : Jika nilai probabilitas < 0,05, maka H0 ditolak Jika nilai probabilitas > 0,05, maka H0 diterima BAB IV HASIL PENELITIAN A. Data Hasil Penelitian Sampel Pseudomonas aeruginosa dalam penelitian ini berjumlah sepuluh dari dua puluh tujuh spesimen pus pasien osteomielitis bangsal Cempaka rumah sakit ortopedi Prof. Dr. R. Soeharso Surakarta pada tanggal 5 Agustus – 10 September 2008 yang diperiksa di Laboratorium Mikrobiologi Fakultas kedokteran Universitas Sebelas Maret. Berikut ini adalah data responden yang menjadi sampel penelitian ini. Tabel 1. Sebaran responden menurut umur responden Umur (tahun) Frekuensi (orang) Persentase (%) 0-20 3 11,1 20-40 13 48,2 40-60 7 25,9 > 60 4 14,8 Menurut data umur responden berdasarkan (tabel 1), didapatkan sebaran umur responden 11,1 % berumur 0-20 tahun, 48,2 % 20-40 tahun, 40-60 tahun 25,9 %, dan > 60 tahun sebanyak 14,8%. 32 33 Tabel 2. Sebaran responden menurut jenis kelamin Jenis Kelamin Frekuensi (orang) Persentase (%) Pria 20 74,1 Wanita 7 25,9 Berdasarkan data pada tabel 2, persentase responden pria lebih banyak daripada jumlah responden wanita yaitu 74,1 %, sedang responden wanita hanya 25,9 %. Tabel 3. Sebaran menurut riwayat osteomielitis sekunder yang diderita responden. Osteomielitis sekunder Jumlah (orang) Persentase (%) Akut 14 51,6 Kronis 13 48,4 Peneliti menggolongkan osteomielitis sekunder akut dan kronis berdasarkan data sekunder dari rekam medis pasien di RSO Prof. Dr. R. Soeharso Surakarta. Sebaran menurut riwayat osteomielitis sekunder yang diderita responden yaitu 51,6 % akut dan 48,4 % kronis. 34 Tabel 4. Data sekunder diagnosa awal ( pasien datang ke RSO Prof. Dr. Soeharso Surakarta ) Diagnosa Awal (Pasien Datang Frekuensi (orang) Persentase (%) Fraktur Terbuka 11 40,7 Infeksi Post Operasi 9 33.3 Inf. Perkontinuitatum dari luka 4 14,8 Fraktur Tertutup 2 7.4 Multipel Fraktur 1 3,7 Ke RSOP) Tabel 4 menunjukkan bahwa responden datang ke RSO Prof. Dr. Soeharso Surakarta karena trauma. Fraktur terbuka (40,7%) merupakan diagnosa awal terbanyak pada saat pasien dibawa ke RSO Prof. Dr. R. Soeharso surakarta. Tabel 5. Data sebaran responden berdasarkan lokasi infeksi (osteomielitis) (data sekunder). Lokasi Infeksi Jumlah (orang) Persentase (%) Femur 13 48,4 Tibia, Fibula 6 22,2 Tibia 3 11,1 Pedis 2 7.4 Ekstermitas Lainnya 3 11,1 (Osteomielitis) Sebaran responden berdasarkan lokasi infeksi (osteomielitis) didapatkan lokasi terbanyak terjadinya infeksi adalah femur (48,4%). 35 Dilanjutkan tibia dan fibula (22,2%), tibia (11,1%), pedis (7,4 %). Dan juga dutemukan pada lokasi eksterimtas lainnya (humerus, ulna, dan calcaneus) sebesar 11,1%. Tabel 6. Hasil identifikasi Pseudomonas aeruginosa pada seluruh spesimen pus responden. Jumlah sampel (+) Pseudomonas (-) Pseudomonas aeruginosa aeruginosa 27 10 17 Persentase (%) 37 63 Dari seluruh spesimen pus yang diidentifikasi sejumlah 27, 10 diantaranya positif Pseudomonas aeruginosa atau 37 % dari jumlah keseluruhan. Tabel 7. Sebaran Pseudomonas aeruginosa menurut riwayat osteomielitis sekunder yang diderita responden. Osteomielitis Jumlah sekunder Pseudomonas aeruginosa Positif Negatif Akut 14 6 (42,9 %) 8 (57,1 %) Kronis 13 4 (30,8 %) 9 (69,2 %) Sebaran Pseudomonas aeroginosa menurut riwayat osteomielitis sekunder yang di derita responden didapatkan 6 ( 42,9 % ) positif Pseudomonas aeruginosa pada 14 responden dengan osteomielitis akut, 36 sedang pada dari 13 responden dengan osteomielitis kronis hanya di temukan 4 (30,8 %) responden positif Pseudomonas aeruginosa. Tabel 8. Hasil pengukuran diameter zona hambatan beberapa antibiotik terhadap pertumbuhan bakteri pseudomonas aeruginosa pada osteomielitis pada masimg-masing kelompok. Sampel 1 2 3 4 5 6 7 8 9 10 MEAN Diameter zona hambatan (mm) Antibiotik Tobramicin 10 µg Meropenem 10 µg Amikasin 30 µg 15 S 08 R 16 I 00 R 34 S 18 S 20 S 26 S 21 S 00 R 12 R 00 R 00 R 00 R 19 S 10 R 20 S 18 S 00 R 00 R 18 S 08 R 13 I 13 R 00 R 00 R 19 S 00 R 11 R 08 R 5,3 R 12,4 R 15 I Keterangan : S : Sensitif, I : Intermediet, R : Resisten Pada ketiga kelompok perlakuan diatas, pemberian disk antibiotik memberikan pengaruh hambatan dengan rata hitung diameter daya hambat untuk disk antibiotik tobramicin 10 µg 5,30 mm, meropenem 10 µg 12,40 mm, dan amikasin 30 µg 15,00 mm. 37 Setelah dilakukan penelitian mengenai pengaruh ekstrak lidah buaya (Aloe vera) terhadap pertumbuhan bakteri Pseudomonas aeruginosa pada osteomielitis secara invitro, maka didapatkan hasil sebagai berikut: Tabel 9. Hasil pengukuran diameter zona hambatan ekstrak lidah buaya (aloe vera) terhadap pertumbuhan bakteri pseudomonas aeruginosa pada osteomielitis pada masimg-masing kelompok. Sampel 1 2 3 4 5 6 7 8 9 10 MEAN Diameter zona hambatan (mm) Antibiotik Ekstrak Lidah Buaya Aquades Kontrol (-) Imipenem 10 50 % 75% 100% µg kontrol (+) 19 S 9 10 11 0 33 S 9 11 13 0 30 S 10 11 12 0 25 S 8 9 10 0 27 S 12 9 12 0 18 S 10 9 13 0 11 R 8 11 10 0 22 S 7 9 10 0 10 R 9 11 12 0 25 S 8 9 10 0 22 S 9,0 9,9 11,3 0 Keterangan : S : Sensitif, I : Intermediet, R : Resisten Pada tabel di atas dapat dilihat adanya perbedaan rata-rata diameter zona hambatan yang menunjukkan perbedaan pengaruh berupa efek antibakteri pada masing-masing kelompok perlakuan. Pada kelompok perlakuan dengan menggunakan aquades (kontrol negatif) tidak terdapat zona hambatan (0 mm), hal ini menunjukkan bahwa aquades tidak 38 mempunyai efek antibakteri. Sedangkan kelompok perlakuan yang menggunakan antibiotik (kontrol positif) imipenem 10 µg terdapat ratarata diameter zona hambatan yaitu 22 mm yang menunjukkan efek antibakteri. Pada kelompok ekstrak lidah buaya (Aloe vera) konsentrasi 50% diperoleh rata-rata diameter zona hambatan 9 mm, pada ekstrak lidah buaya (Aloe vera) konsentrasi 75% diperoleh rata-rata diameter ziona hambatan 9,9 mm, dan pada ekstrak lidah buaya (Aloe vera) konsentrasi 100% diperoleh rata-rata diameter zona hambatan 11,3 mm. Hal ini menunjukkan adanya pengaruh (antibakteri) ekstrak lidah buaya (Aloe vera) terhadap pertumbuhan bakteri Pseudomonas aeruginosa pada osteomielitis secara invitro yang meningkat seiring dengan meningkatnya konsentrasi ekstrak lidah buaya yang digunakan. Antibiotik imipenem 10 µg sebagai kontrol positif berdasarkan pada tabel 9 di atas juga menunjukkan pola kepekaan bakteri yang lebih sensitif dibandingkan dengan pemberian ketiga antibiotik pada tabel 8 yaitu tobramicin, amikasin, dan meropenem. 39 Dari tabel 9 kemudian dibuat grafik yang menggambarkan rata-rata diameter zona hambatan pada masing-masing kelompok perlakuan. 25 20 15 10 5 0 aquades ekstrak 50% ekstrak 75% ekstrak 100% imipenem Gambar 1. Grafik Batang Rata-Rata Diameter Zona Hambatan (mm) Pada Masing- Masing Kelompok Perlakuan. B. Analisis Data Data hasil penelitian yang berupa diameter zona hambatan dianalisis dengan uji oneway ANOVA yang kemudian dilanjutkan dengan post hoc test berupa uji Dunnett T3. Data diolah dengan program Stastistical Product and Service Solution (SPSS) 17,00 for windows. 40 1. Uji ANOVA Dari hasil penelitian pada tabel 8 setelah diuji dengan uji Analysis of variance (ANOVA) dengan menggunakan program SPSS 17,00 didapatkan hasil sebagai berikut : Tabel 10. Hasil uji statistik dengan uji oneway ANOVA Between Groups Within Groups Total Sum of Squares 2457.320 559.000 3016.320 df 4 45 49 Mean Square 614.330 12.422 F 49.454 Sig. .000 Dari hasil uji ANOVA diketahui bahwa F hitung = 49,454 sedangkan F tabel untuk tingkat signifikansi 0,05 adalah 2,579. Karena F hitung > F tabel maka dapat dikatakan bahwa rata-rata diameter zona hambatan kelima kelompok perlakuan tersebut memang berbeda signifikan dengan p < 0,05. Dari hasil uji ANOVA menunjukkan adanya perbedaan yang signifikan antara kelima kelompok perlakuan yaitu antara aquades, antibiotik yaitu imipenem 10 µg, dan ekstrak lidah buaya (Aloe vera) konsentrasi 50%, 75%, dan 100% dalam menghambat pertumbuhan Pseudomonas aeruginosa pada osteomielitis secara invitro dengan p < 0,05. 41 2. Uji Dunnett T3 Setelah dilakukan uji Dunnett T3 didapatkan hasil sebagai berikut : Tabel 11. Hasil uji post hoc test Dunnett T3 berupa perbandingan multipel diameter zona hambatan berbagai macam perlakuan terhadap pertumbuhan Pseudomonas aeruginosa (I) Perlakuan (J) Perlakuan Mean Difference (I-J) Std. Error Sig. 95% Confidence Interval Lower Bound Upper Bound * ekstrak 50 % imipenem -13.000 2.440 .003 -21.53 -4.47 ekstrak 75% ekstrak 75% ekstrak 100% aquades imipenem -.900 -2.300* 9.000* -12.100* .547 .597 .447 2.420 .656 .011 .000 .006 -2.65 -4.19 7.41 -20.63 .85 -.41 10.59 -3.57 ekstrak 100% ekstrak 100% aquades imipenem -1.400 9.900* -10.700* .506 .112 .314 .000 2.432 .013 -3.00 8.78 -19.23 .20 11.02 -2.17 11.300* imipenem aquades aquades .396 .000 2.399 .000 9.89 13.48 12.71 30.52 22.000* Pada tingkat signifikansi 0,05 hasil pada tabel 10 dapat diuraikan sebagai berikut: a. Nilai p < 0,05 didapatkan pada perbandingan antara ekstrak lidah buaya 50% dengan antibiotik imipenem 10 µg, ekstrak lidah buaya 100%, dan aquades. Nilai p < 0,05 juga didapatkan pada perbandingan antara ekstrak lidah buaya 75% dengan antibiotik imipenem 10 µg dan aquades Perbandingan antara ekstrak lidah buaya 100% dengan antibiotik imipenem 10 µg, dan aquades didapatkan nilai p < 0,05. Selain itu, Nilai p < 0,05 juga didapatkan 42 pada perbandingan antara antibiotik imipenem 10 µg dengan aquades. Hal ini menunjukkan bahwa ada perbedaan diameter daya hambat yang bermakna diantaranya. b. Nilai p > 0,05 antara ekstrak lidah buaya 75% dengan ekstrak lidah buaya 50%, dan ekstrak lidah buaya 100%. Hal ini menunjukkan bahwa tidak ada perbedaan diameter daya hambat yang bermakna diantaranya. Perbedaan hasil antara uji Anova dengan post hoc test dikarenakan bila ada sepasang saja yang bermakna pada uji Anova maka Anova mengatakan bahwa hal tersebut bermakna secara keseluruhan. Oleh sebab itu, perlu uji lanjutan yaitu post hoc test. BAB V PEMBAHASAN Pada penelitian ini, sampel berasal dari dua puluh tujuh spesimen pus pasien osteomielitis bangsal Cempaka rumah sakit ortopedi Prof. Dr. R. Soeharso Surakarta pada tanggal 5 Agustus – 10 September 2008 yang diperiksa di laboratorium Mikrobiologi Fakultas kedokteran Universitas Sebelas Maret. Dari dua puluh tujuh responden yang diteliti jumlah terbanyak berusia antara 20-40 tahun yaitu 13 responden (48,2 %). Persentase responden pria lebih banyak daripada jumlah responden wanita yaitu 74,1. Sehingga responden terbanyak adalah pria dan responden pada usia produktif. Menurut data yang berasal dari rumah sakit ortopedi Prof. Dr. R. Soeharso Surakarta pada periode Agustus-September 2008, jumlah pasien dengan kasus kecelakaan lalu lintas pada pria lebih banyak dari pada wanita dengan persentasi 69,6 %. Jumlah responden pria yang lebih banyak dari wanita mungkin berhubungan dengan meningkatnya insiden trauma pada pria yang disebabkan oleh kegiatan yang beresiko dan aktivitas fisik sebagai predesposisi terjadinya cedera (King. 2006). Dengan tingginya jumlah responden pada usia produktif memungkinkan menurunnya produktifitas responden karena terhambatnya kemampuan mereka dalam bekerja dan mencari nafkah. Pria khususnya pada usia produktif seringkali menjadi tulang punggung keluarga dan menjadi sumber pendapatan keluarga, sehingga dengan menurunnya produktifitas akan mempersulit perekonomian 43 44 keluarga. Menurunnya prodiktifitas ini selain dapat merugikan keluarga juga dapat merugikan masyarakat sekitar serta negara karena pembangunan membutuhkan sumber daya manusia usia produktif. Tabel 3 menunjukkan riwayat osteomielitis sekunder yang diderita responden didapatkan empat belas responden (51,6 %) dengan osteomielitis akut sedangkan responden dengan osteomielitis kronis sejumlah tiga belas responden (48,4 %). Jumlah responden dengan osteomielitis kronis yang hampir sama dengan jumlah osteomielitis akut dapat mengasumsikan bahwa responden dengan osteomielitis akut mempunyai kemungkinan untuk berkembang menjadi kronis. Permasalahan di atas mungkin disebabkan penanganan osteomielitis yang masih merupakan masalah dalam bidang ortopedi, karena seringkali antibiotika yang diberikan secara oral maupun parenteral tidak dapat mencapai lokasi infeksi dengan baik (Lubis, 2005). Selain itu mungkin bakteri penyebabnya merupakan bakteri yang resistan terhadap berbagai antibiotik. Faktor menurunnya sistem kekebalan tubuh responden mungkin juga berpengaruh. Pemakaian antibiotik yang tidak tepat waktu penggunaan sehingga menyebabkan peak plasma level yang meningkat serta adanya enzim perusak antibiotik pada pasien yang mungkin dapat pula menyebabkan sulit dan lamanya pengobatan osteomielitis. Tabel 4 juga dapat dilihat bahwa pada semua responden didapatkan osteomielitis sekunder yang disebabkan oleh trauma, dengan fraktur terbuka merupakan jumlah terbanyak, serta tidak didapatkan responden dengan osteomielitis primer atau hematogen. Temuan ini menunjukan bahwa kemungkinan sumber infeksi bukan berasal dari endogen (infeksi sebelumnya di 45 organ lain pasien yang menyebar melalui aliran darah) melainkan dari eksogen (melului pasien lain, lingkungan atau atmosfer, serta tindakan bedah). Sehingga hendaknya perlu diadakan peningkatan penanganan dan pencegahan osteomielitis oleh rumah sakit seperti penanganan trauma dan tindakan pembedahan serta perawatan luka yang optimal dan steril, serta perlu dilakukan upaya pengendalian sumber-sumber infeksi yang ada di rumah sakit dalam rangka mencegah transmisi sumber infeksi kepada pasien. Selain itu penting pula memperhatikan golden periode dari cedera atau trauma jangan sampai terlalui, sehingga dapat dilakukan penanganan yang baik dan optimal sehingga memungkinkan terhadap pencegahan infeksi. Pada tabel 5 menunjukkan ekstermitas merupakan lokasi osteomielitis yang diderita oleh semua responden. selain itu ditemukan bahwa tulang yang paling sering terkena infeksi adalah femur, tibia, dan fibula yang merupakan tulang panjang. Hal ini mungkin disebabkan tulang panjang rentan terhadap trauma dan infeksi, karena vaskulari pada tulang panjang yang sedikit sehingga menghambat distribusi antibiotik pada target yang dituju (Kalyoussef, 2006, Sjamsuhidajat, 2003). Dari seluruh spesimen pus yang diidentifikasi sejumlah dua puluh tujuh, sepuluh diantaranya positif P. aeruginosa atau 37 % dari jumlah keseluruhan. Jumlah tersebut cukup tinggi, hal ini perlu diwaspadai karena mugkin disebabkan oleh infeksi nosokomial (infeksi yang didapat dirumah sakit), karena salah satu bakteri yang dapat menyebabkan infeksi nosokomial yaitu P. aeruginosa (Harvey, 46 2007). Karena bukan merupakan true patogen maka ada sumber infeksi dan cara pemindahsebaran dari P. aeruginosa penyebab osteomielitis di atas. P. aeruginosa tersebar luas di alam, terdapat di tanah, air, tumbuhan, bahkan hewan (termasuk manusia) (Qarah, 2005). P. aeruginosa dapat dijumpai di banyak tempat dirumah sakit, disinfektan, alat bantu pernafasan, makanan, saluran pembuangan air, dan kain pel mmerupakan beberapa contoh reservoir. Pemindahsebarannya P. aeruginosa mungkin dapat melalui aliran udara, air, tangan tercemar, penanganan dan alat-alat yang tidak steril di rumah sakit (Prakash, 2000). Akhirnya pengendalian infeksi rumah sakit merupakan suatu keharusan untuk melindungi pasien dari kejangkitan infeksi dalam bentuk upaya pencegahan, survailan, dan pengobatan rasional (Zulkarnain, 2006). Pada tabel 7 dapat dilihat Empat Sampel positif P. aeruginosa barasal dari spesmen pus responden dengan osteomielitis kronis atau 30,8 % dari tiga belas sampel, dan enam Sampel positif P. aeruginosa lainnya barasal dari spesmen pus responden dengan osteomielitis akut atau 42,9 % dari empat belas sampel. Jumlah responden osteomielitis sekunder kronis dan akut yang positif P. aeruginosa yang hampir sama mengasumsikan bahwa osteomielitis akut yang positif P. aeruginosa mempunyai kemungkinan untuk berkembang menjadi osteomielitis kronis. Hal tersebut mungkin disebabkan infeksi yang terbentuk sulit untuk diobati karena P. aeruginosa sering resisten terhadap banyak antimikroba (Mayasari, 2005). Sehingga perlu dilakukan beberapa upaya yang dapat dilakukan untuk meminimalkan risiko resistensi, antara lain melakukan optimalisasi terapi, 47 seleksi antibiotika secara seksama, penetapan dosis, cara dan lama terapi yang lebih rasional, serta dalam situasi tertentu melakukan rotasi atau penjadwalan penggunaan antibiotika. Penggunaaan pedoman terapi infeksi juga harus didorong, khususnya dengan memanfaatkan bukti-bukti ilmiah terbaru (current best evidance) yang lebih dapat dipercaya validitasnya (Dwiprahasto, 2005). Selain itu faktor menurunnya sistem kekebalan tubuh responden mungkin berpengaruh sehingga dapat mempersulit dan memperlama pengobatan osteomielitis yang disebakan oleh P. aeruginosa, sehingga dapat memungkinkan untuk berkembang menjadi osteomielitis kronis. P. aeruginosa merupakan patogen oportunistik, yang memanfaatkan kerusakan pada mekanisme pertahanan inang untuk memulai suatu infeksi (Mayasari, 2005). Demikian pula halnya pada responden osteomielitis seknder akut non Pseudomonas, apabila disebakan oleh bakteri Multi Drug Resistant lainnya seperti methisilin-resistant Enterococcus Staphylococcus (VRE), aureus Enterobacteriaceae (MRSA), dengan vancomisin-resistant ESBL, Streptococcus pneumoniae, juga mempunyai kemungkinan untuk berkembang menjadi kronis. Pemberian perlakuan antibiotik tobramycin, meropenem, dan amikasin terhadap semua sampel P. aeruginosa bertujuan untuk mengetahui pola resistensi bakteri P. aeruginosa terhadap beberapa jenis antibiotik. Rerata hitung diameter zona hambatan yang terbentuk dari jenis antibiotik tobramicin 10 µg ( 5,30 mm ), dan meropenem 10 µg ( 12,4 mm ) berada dalam kategori resisten, sedangkan zona hambatan dari antibiotik amikasin 30 µg (15,0 mm) termasuk dalam kategori intermediet. Antibiotik imipenem 10 µg sebagai kontrol positif 48 berdasarkan pada tabel 9 menunjukkan pola kepekaan bakteri yang lebih sensitif terhadap pertumbuhan P. aeruginosa dibandingkan dengan pemberian ketiga antibiotik pada tabel 8 yaitu tobramicin, amikasin, dan meropenem. Hasil pengukuran pengaruh ekstrak lidah buaya terhadap P. aeruginosa pada osteomielitis disajikan dalam tabel 9. Pada tabel 9 dapat dilihat gambaran dari diameter zona hambatan pertumbuhan dari berbagai konsentrasi, berupa rerata diameter zona hambatan pertumbuhan pada tiap konsentrasi. Zona hambatan pertumbuhan yang terbentuk pada konsentrasi 50% ( 9,0 mm ), 75% ( 9,9 mm ), 100% ( 11,3 mm ). Diameter zona hambatan kontrol positif yaitu antibiotik imipenem 10 µg ( 22,0 mm ), ternyata lebih besar dari konsentrasi 50%, 75%, dan 100%. Sedangkan pada aquades sebagai kontrol negatif tidak terbentuk zona hambatan sama sekali ( 0,0 mm ). Data pada tabel 8 dan 9 menunjukkan bahwa rata-rata hitung diameter zona hambat ekstrak lidah buaya konsentrasi 50% (9,0mm), 75% (9,9mm), 100% (11,3mm) melebihi nilai rata hitung zona hambat disk antibiotik tobramicyn 10 µg (5,30mm). Begitu pula rata diameter daya hambat ekstrak lidah buaya konsentrasi 100% (11,3 mm) hampir menyamai rata diameter daya hambat disk antibiotik meropenem 10 µg (12,4mm). Tabel 9 juga menunjukkan bahwa semakin besar konsentrasi ekstrak lidah buaya yang digunakan semakin besar pula diameter zona hambatan yang terbentuk. Diameter zona hambatan yang meningkat, dengan meningkatnya konsentrasi ekstrak menunjukkan adanya hubungan dosis dan respon. Temuan 49 tersebut memperkuat kesimpulan bahwa ada hubungan kausal antara pemberian ekstrak lidah buaya dengan hambatan pertumbuhan pada P. aeruginosa. Setelah dilakukan uji statistik (tabel 10) untuk membandingkan kelima rata hitung diameter zona hambatan kelompok perlakuan utama, yaitu aquades ( 0,0 mm ), ekstrak lidah buaya 50% ( 9,0 mm ), 75% ( 9,9 mm ), 100% ( 11,3 mm ) dan antibiotik imipenem 10 µg ( 22,0 mm ), didapatkan bahwa ada perbedaan rata hitung diameter zona hambatan yang bermakna ( p < 0,05 ) antara kelompok perlakuan tersebut. Analisis kemudian dilanjutkan dengan melakukan perbandingan multiple rata hitung diameter zona hambatan kelima kelompok perlakuan utama (tabel 11), tampak adanya perbedaan rata hitung zona hambatan yang bermakna ( p < 0,05 ) antara antara ekstrak lidah buaya 50% dengan antibiotik imipenem 10 µg, ekstrak lidah buaya 100%, dan aquades. Nilai p< 0,05 juga didapatkan pada perbandingan antara ekstrak lidah buaya 75% dengan antibiotik imipenem 10 µg dan aquades. Perbandingan antara ekstrak lidah buaya 100% dengan antibiotik imipenem 10 µg, dan aquades didapatkan nilai p < 0,05. Selain itu, Perbedaan bermakna ( p < 0,05 ) juga ditemukan pada perbandingan antara antibiotik imipenem 10 µg dengan aquades. Tetapi terdapat perbedaan yang tidak bermakna (p > 0,05 ) antara ekstrak lidah buaya 75% dengan ekstrak lidah buaya 50%, dan ekstrak lidah buaya 100%. Berdasarkan pada analisis tersebut, ekstrak lidah buaya memiliki kemampuan untuk menghambat pertumbuhan P. aeruginosa. 50 Senyawa anrtibakteri yang terkandung dalam ekstrak lidah adalah antraquinon dan saponin (Newall et al, 1998). Adapun mekanisme dalam menghambat P. aeruginosa mungkin karena kuinon sering menyebabkan protein bakteri menjadi inaktif dan kehilangan fungsinya. (Cowan, 1999). Sedang saponin dapat melarutkan lipid pada membran sel bakteri (lipoprotein), akibatnya dapat menurunkan tegangan permukaan lipid, permeabilitas sel berubah, fungsi sel bakteri menjadi tidak normal, dan sel bakteri lisis dan mati (Voight, 1994, Brooks, 2007). Penelitian ini sesuai dengan penelitian yang telah dilakukan oleh Roro Wahyudianingsih (2001) dari Fakultas Kedokteran Universitas Kristen Maranatha, bahwa ekstrak lidah buaya (Aloe vera) mampu menghambat pertumbuhan beberapa bakteri gram positif dan negatif. Dengan adanya penelitian ini, daya antibakteri ekstrak lidah buaya (Aloe vera) terhadap P. aeruginosa invitro, akan menambah satu lagi potensi daya antibakteri ekstrak lidah buaya yaitu P. aeruginosa. Penelitian yang dilakukan Dian Handayani, Noviandi Sayuti, dan Dachriyanus Dari Fakultas Farmasi Universitas Andalas dengan judul Isolasi Dan Karakterisasi Senyawa Antibakteri Epidioksi Sterol Dari Spon Laut Petrosia Nigrans, Asal Sumatera Barat. Didapatkan Hasil Pemeriksaan Aktivitas Antibakteri dari Ekstrak Metanol Spon laut Petrosia nigrans dengan Metoda Difusi Agar yaitu Diameter Hambat Ekstrak Metanol Spon laut Petrosia nigrans (1%) untuk P. aeruginosa sebesar 6 mm. Serta penelitian megenai Isolasi Dan Identifikasi Senyawaaktif Anti Mikroba Dari Daun Tumbuhan Piper 51 Sarmentosum Roxb. Ex Hunter oleh Shinta Jurusan Kimia Universitas Gunadarma dengan hasil yang menunjukkan bahwa pada konsentrai 1000 µg/ml atau 1 mg/ml didapatkan diameter zona hambat untuk kuman P. aeruginosa.sebesar 22 mm. Menilik dari kedua penelitian yang dilakukan oleh Dian handayani dkk. dan Shinta jika dibandingkan dengan penelitian mengenai aktivitas antibakteri lidah buaya yang peneliti lakukan, didapat bahwa Ekstrak Metanol Spon laut Petrosia nigrans (1%) dan Ekstrak Daun Tumbuhan Piper Sarmentosum Roxb. Ex Hunter 1000 µg/ml mempunyai aktivitas antibakteri yang lebih kuat dari pada ekstrak lidah buaya (Aloe vera) terhadap P. aeruginosa. Sri Herlina dan Taslim Ersam Jurusan Kimia FMIPA ITS, telah melakukan penelitian mengenai Tiga Senyawa Santon Dari Kulit Akar Mundu Garcinia Dulcis (Roxb.) Kurz. Dari hasil penelitian tersebut, ternyata ketiga senyawa Santon Dari Kulit Akar Mundu Garcinia Dulcis (Roxb.) Kurz tidak menunjukkan aktivitas sebagai antibakterial terhadap P. aeruginosa. Sehingga berdasarkan penelitian di atas diketehui bahwa ekstrak lidah buaya (Aloe vera) lebih efektif menghambat pertumbuhan P. aeruginosa dibanding Tiga Senyawa Santon Dari Kulit Akar Mundu Garcinia Dulcis (Roxb.) Kurz. Perbedaan kekuatan hambatan masing-masing ekstrak di atas terhadap P. aeruginosa mungkin disebabkan oleh perbedaan khasiat masing-masing simplisia. Khasiat suatu simplisia tergantung dari kandungan, jenis, dan jumlahnya (Dzulkarnain et al, 1996). Berdasarlan temuan diatas didukung oleh adanya daya hambat ekstrak lidah buaya khususnya pada konsentrasi 100% (11,3mm) yang cukup besar, dan 52 toksisitas lidah buaya yang diharapkan rendah karena pemanfaatan lidah buaya sejak lama sebagai penyubur rambut, antiperadangan, serta berbagai produk makanan dan minuman oleh masyarakat secara aman, maka ada harapan bagi lidah buaya sebagai salah satu alternatif antibakteri yang alami dan aman terhadap P. aeruginosa. Namun demikian harus diadakan penelitian lebih lanjut secara invivo megenai dosis keamanan dan toksisitasnya. Bila dibandingkan secara perbandingan multiple (tabel 9) antara antibiotik imipenem 10 µg dengan ketiga konsentrasi ekstrak lidah buaya, rata-rata hitung diameter ketiga konsentrasi ekstrak lidah buaya dalam penelitian ini masih belum mampu mendekati atau melebihi rata-rata hitung zona hambatan antibiotik imipenem 10 µg. Permasalahan di atas mungkin disebabkan proses ekstraksi yang tidak optimal untuk memunculkan bahan-bahan antibakteri pada esktrak lidah buaya secara adekuat. Selain itu, mungkin karena human error pada saat pengenceran ekstrak lidah buaya dengan menggunakan pelarut aquades steril, kemungkinan tidak dapat melarutkan suluruh kandungan yang terdapat dalam ekstrak lidah buaya dengan sempurna. BAB VI SIMPULAN DAN SARAN A. SIMPULAN Dari hasil penelitian tentang pengaruh ekstrak lidah buaya (Aloe vera) terhadap pertumbuhan bakteri Pseudomonas aeruginosa pada pus pasien osteomielitis rumah sakit ortopedi Prof. Dr. R. Soeharso Surakarta secara invitro, maka dapat disimpulkan bahwa: 1. Ekstrak lidah buaya (Aloe vera) terbukti mampu menghambat pertumbuhan Pseudomonas aeruginosa pada osteomielitis secara invitro dimana rata hitung diameter zona hambatan kelompok perlakuan, yaitu aquades ( 0,0 mm ), ekstrak lidah buaya 50% ( 9,0 mm ), 75% ( 9,9 mm ), 100% ( 11,3 mm) dan antibiotik imipenem 10 µg ( 22,0 mm ), didapatkan bahwa ada perbedaan rata hitung diameter zona hambatan yang bermakna ( p < 0,05 ) antara kelompok perlakuan tersebut. 2. Terjadi peningkatan efek antibakteri pada peningkatan konsentrasi ekstrak lidah buaya 50% menjadi 100%, namun efek antibakteri ekstrak lidah buaya konsentrasi 50%, 75%, dan 100% lebih lemah dibanding imipenem. Hipotesis penelitian yaitu ekstrak lidah buaya (Aloe vera) dapat menghambat pertumbuhan Pseudomonas aeruginosa pada osteomielitis secara invitro terbukti. 53 54 B. SARAN Setelah dilakukan penelitian tentang pengaruh ekstrak lidah buaya (Aloe vera) terhadap pertumbuhan bakteri Pseudomonas aeruginosa pada pus pasien osteomielitis rumah sakit ortopedi Prof. Dr. R. Soeharso Surakarta secara invitro, maka peneliti menyarankan : 1. Rumah Sakit 1. Untuk tidak menggunakan ekstrak lidah dalam pengobatan osteomilitis yang disebabkan Pseudomonas aeruginosa sebelum didapatkan hasil penelitian lebih lanjut mengenai ekstrak lidah sebagai alternatif pengobatan infeksi. 2. Untuk mamantau kembali dan meningkatkan pelaksanaan penaggulangan trauma. Misalnya dengan meningkatkan sterilitas dan higienisasi instrumen serta tenaga kesehatan yang ada di rumah sakit, dan meningkatkan kompetensi tenaga kesehatan. 3. Untuk meningkatkan upaya pengendalian infeksi rumah sakit untuk melindungi pasien dari kejangkitan infeksi misalnya dalam bentuk upaya pencegahan, dan survailan. 2. Peneliti 1. Perlu dilakukan upaya pengembangan ekstrak lidah buaya (Aloe vera) sebagai terapi alternatif infeksi bakteri khususnya yang disebabkan oleh Pseudomonas aeruginosa. 55 2. Perlu dilakukan penelitian lebih lanjut tentang daya antibakteri ekstrak lidah buaya (Aloe vera) invivo (pada hewan coba) agar dapat diketahui dosis keamanan dan toksisitasnya. 3. Departemen Kesehatan 1. untuk mengembangkan ekstrak lidah buaya sebagai salah satu herbal untuk pengobatan penyakit infeksi khususnya osteomyelitis. 2. Hendaknya memasukkan program pencegahan dan penaggulangan trauma ke dalam daftar program Puskesmas sebagai pusat pelayanan kesehatan masyarakat peling dasar. Misalnya dengan memberikan edukasi yang benar dan baik kepada masyarakat mengenai pencegahan penaggulangan trauma yang optimal sedini mungkin penyuluhan. dan antara lain DAFTAR PUSTAKA Apley graham A., 1993. Apley’s System of Orthopaedic And Farctures. Seventh Edition. Butterworth-Heinemann Ltd, Oxford. Hal 40-42. Astawan, 2006. Departemen Kesehatan Republik Indonesia. In: Mari Kita Santap Lidah Buaya. http://www.depkes.go.id/index.php?option=articles&task =viewarticle&artid=324&Itemid=3. (7 Maret 2008) Babcock M.H., 2006. Osteomyelitis. http://www.nlm.nih.ov/medlineplus/ncy/article /000437.htm. (18 Maret 2008). Brooks G.F., Butel J.S., Morse S.A., 2007. Jawetz, Melnick, Adelberg. Medical Microbiology. In: Antimicrobial Chemoterapy; Pseudomonads, Acinetobacters, & Uncommon Gram-Negative Bacteria. Lange Medical Books/ McGraw –Hill, United Stated of America. Hal 161-95, 263-265 Cowan M.M., 1999. Plant Products as Antimicrobial Agents. Departement of Microbiology, Miami University, Oxford, Ohio, 45056. Dwiprahasto, 2005. Kebijakan Untuk Meminimalkan Risiko Terjadinya Resistensi Bakteri Di Unit Perawatan Intensif Rumah Sakit. www.jmpkonline.net/files/ mkiwan.pdf. (25 Januari 2009) Dzulkarnain B, Sundari Dian, Chosin Ali, 1996. Tanaman Obat Bersifat Antibakteri di Indonesia. Cermin Dunia Kedokteran. Hal 35-48 Furnawanthi S.P., 2007. Khasiat dan Manfaat Lidah Buaya Si Tanaman Ajaib. Tangerang: Argomedia Pustaka. Ganiswarna S.G., Rianto S., Frans D.S., Purwantyastuti, Nafrialdi., 1995. Farmakologi dan Terapi. Bagian Farmakologi Fakultas Kedokteran Universitas Indonesia, Jakarta. Hal: 572-3. Handayani D., Sayuti N., Dachriyanus, 2008. Isolasi Dan Karakterisasi Senyawa Antibakteri Epidioksi Sterol Dari Spon Laut Petrosia Nigrans, Asal Sumatera Barat. http://www.google.co.id/search?hl=id&q=ekstrak+antimikroba+Pseudo monas&start=50&sa=N. (20 Januari 2009). 56 57 Harborne JB, 1987. Metode Fitokimia: Penuntun Cara Modern Menganalisis Tumbuhan. Terbitan kedua. Diterjemahkan oleh Kosasih Padmawinata dan Iwang Sudiro. Bandung: ITB. Hal 3-15, 102-8 Harvey R.A., Pamela C.C., Bruce D.F., 2007. Microbiology Second Edition, Lippincott’s Illustrated Reviews. Lippincott Williams & Walkins. Philadelphia. Hal 69-75 Herlina S., Ersam T., 2006. Tiga Senyawa Santon Dari Kulit Akar Mundu Garcinia Dulcis (Roxb.) Kurz. http://www.google.co.id/search?hl=id&q=ekstrak+ antimikroba+Pseudomonas&start=50&sa=N. (20 Januari 2009) Jawetz E., Melnick J., Adelberg E., 1996. Mikrobiologi Kedokteran Edisi 20. Jakarta; EGC. Hal: 153-87 Johnson A.G., et al., 1993. Mikrobiologi dan Imunologi. Seri Ringkasan. Alih Bahasa oleh Yulius E.S. Department of Medical Microbiology and Imunnology University of Minnesota. Binarupa Aksara. Hal 29-32. Khan A. N., 2007. Osteomyelitis Kronis. .com/pedTOPIC502 .HTM. (23 Mei 2008). http://www.emedicine- Kalyoussef S., 2006. Osteomyelitis. http://www.emedicine-.com/pedTOPIC1677 .HTM (7 Maret 2008). Koneman E.W., 2006. Koneman’s Color Atlas and Textbook of Diagnostic Microbiology. Sixth Edition. Lippincott Williams & Walkins. Philadelphia. Hal 624-25 Ladd A., Jones H.H., Otanes O., 2003. http://osteomyelitis.stanford.edu/. (2 Februari 2009) Osteomyelitis. Levinson W., 2006. Review of Medical Microbiology And Immunology. Ninth edition. Lange Medical Books/ McGraw –Hill, United Stated of America. Hal 69-93, 149-50. Lubis M.T., et al, 2005. The Use of Ceftriaxone Impregnated Beads in The Management of Chronic Osteomyelitis. http://www.digilibui.edu/opac/th emes/libri2/detail.jsp?id=105714&lokasi=lokal. (27 April 2008) 58 Mayasari E., 2006. Pseudomonas aeruginosa; Karakteristik, Infeksi, dan Penanganan. http :// library.usu.ac.id. (2 februari 2009) Murray P. R., 1995. Manual of Clinical Microbiology. Sixth Edition. American Society Of Microbiology Press, Washington, DC. Hal 509-517. Newall A. et al, 1996. Herbal Medicine, A Guide For Health Care and Professionals . London: The Pharmaceutical Press. Hal 25-6 Qarah S., 2005. Pseudomonas aeruginosa infections. http://www.emedicine.Com /med/topic1943.htm. (7 Maret 2008) Robbins S.L., Kumar V., 2007. Buku Ajar Patologi. Edisi 7. Volume 2. Diterjemahkan oleh Staf Pengajar Laboratorium Patologi Anatomik FK UNAIR. In: sistem Muskuloskeletal. Jakarta ; Penerbit Buku Kedokteran EGC. Hal 453-73 Rosana Y., Riyanto B., Setiawan B., 2007. Pseudomonas Infections : What Antibiotics is the Best?. http://www.kalbe.co.id/files/cdk/files/10Peran MediauntukIdentifikasiMikroba124.pdf/10PeranMediauntukIdentifikasiMik roba124.htm. (17 Maret 2008) Salter R.B., 1999. textbook Of Disorders And Injuries Of The Musculoskeletal System. Third Edition. Lippincott Williams & Walkins. Maryland. Hal 21618. Sastroasmoro (ed), 2005. Penggunaan Siprofloksasin Di Indonesia. www.yanmedikdepkes.net/hta/Hasil%20Kajian%20HTA/2005/Penggunaan%20Siprofloksa sin%20di%20Indonesia.doc. (17 Maret 2008) Shinta, 2002. Isolasi Dan Identifikasi Senyawaaktif Anti Mikroba Dari Daun Tumbuhan Piper Sarmentosum Roxb. Ex Hunter. http://digilib.gunadarma.ac. d/go.php?id=jbptitbpp-gdl-s2-2002shintanim218 44. (20 Januari 2009) Sjamsuhidjat R, De Jong Wim, 2005. Buku Ajar Ilmu Bedah. Edisi Revisi. Jakarta; ECG. Hal 1221-4. Sjoekoer M. Dzen et al (eds), 2003. Bakteriologi Medik. Malang: Bayu Medika Publisin. Hal 122-23 59 Staf Pengajar Fakultas Kedokteran Universitas Indonesia, 1994. Buku Ajar Mikrobiologi Kedokteran. Binarupa Aksara. Hal 177-79. Sudarto S.P., 1997. LIdah Buaya. Yogyakarta: Kanisius Taufiqurahman M.A., 2003. Metodologi Penelitian Kedokteran dan Kesehatan. Klaten: CSGF. Voigt R., 1994. Buku Pelajaran Teknologi Farmasi. Terjemahan Nurono. Yogyakarta, Gajah Mada University Press. Hal 579-80. Weinstein R.A., 1992. Multiply Drug-Resistant Pathogens: Epidemiology And Control. Little. In : Bennett J.V. and Brachman P.S. (eds). Hospital Infections. Third Edition. Brown An Company. Toronto. Hal 265-282. Wahyudianingsih R., 2001. Aktivitas Antibakteri Lidah Buaya (Aloe vera)terhadap Beberapa Bakteri. http://digilib.litbang.depkes.go.id/go.php?id=jkpkbppk-gdl-res-2003-roro1695-antibakteri. (17 Maret 2008). Zulkarnain I., 2006. Infeksi Nosokomial. Dalam : Sudoyo A.W. et all (eds), Buku Ajar Ilmu Penyakit Dalam. Jakarta; Pusat Penerbitan Departemen Ilmu Penyakit Dalam FK UI. Hal 1749-51. 60 Lampiran 1. Surat Keterangan Telah Melaksanakan Penelitian di Rumah Sakit Ortopedi Prof. Dr. R. Soeharso Surakarta 61 Lampiran 2. Surat Keterangan Telah Menyelesaikan Penelitian Di Laboratorium Mikrobiologi Fakultas kedokteran UNS 62 Lampiran 3. Surat Keterangan Telah Melaksanakan Pembuatan Ekstrak Lidah Buaya (Aloe vera) Di Laboratorium Galenika B2P2TO2T Tawangmangu 63 Lampiran 4. Informed Consern SURAT PERNYATAAN PERSETUJUAN (INFORMED CONSERN) PENELITIAN Pengaruh Ekstrak Lidah Buaya (Aloe Vera) terhadap Pertumbuhan Pseudomonas aeroginosa pada Pasien Osteomyelitis Bangsal Cempaka Rumah Sakit Ortopedi Prof. Dr. R. Soeharso Surakarta Secara Invitro Oleh Isabela Ariane Saya yang bertandatangan di bawah ini, Jenis Kelamin : Umur : Tahun Alamat : Dengan ini menyatakan persetujuan saya untuk ikut serta dalam penelitian dengan judul diatas setelah memahami prosedur dibawah ini. Penelitian ini bertujuan untuk mengetahui efektivitas ekstrak lidah buaya dalam menghambat pertumbuhan Pseudomonas aeroginosa pada pasien osteomyelitis Rumah Sakit Ortopedi Prof. Dr. R. Soeharso Surakarta.secara invitro.untuk itu saya bersedia untuk menjalani posedur berikut: 1. Saya bersedia untuk dimintai keterangan mengenai identitas diri saya meliputi umur, jenis kelamin, serta alamat oleh peneliti 2. Saya bersedia untuk diambil pus (nanah) yang berasal dari lokasi infeksi osteomyelitis yang saya derita untuk selanjutnya dapat digunakan untuk kepentingan penelitian 3. Untuk keperluan sampling penelitian, responden tidak dipungut biaya 4. Saya telah membaca dan mendapat semua informasi yang berkaitan dengan penatalaksanaan penelitian ini, dan saya setuju untuk berpartisipasi dalam penelitian ini 5. Dengan demikian saya setuju untuk turut serta dalam penelitian ini Surakarta, PENELITI RESPONDEN 64 Lampiran 5. Data Identitas Responden NO. UMUR (TAHUN) JENIS KELAMI N P 1. 51 2. 61 3. 38 4. 46 5. W √ DIAGNOSIS AWAL DIAGNOSIS (PASIEN DATANG KE RSOP) LOKASI INFEKSI BAKTERI Fraktur terbuka Osteomyelitis kronis Tibia, Fibula - √ Infeksi Post Operasi Osteomyelitis Femur - √ Fraktur terbuka Osteomyelitis Humerus - √ Infeksi Post Operasi Osteomyelitis Femur - 46 √ Luka terinfeksi Osteomyelitis kronis Calcaneus - 6. 26 √ Fraktur terbuka Osteomyelitis kronis Femur - 7. 71 Luka terinfeksi Osteomyelitis kronis Pedis P. aeruginosa 8. 25 √ Infeksi Post Operasi Osteomyelitis Femur P. aeruginosa 9. 26 √ Infeksi Post Operasi Osteomyelitis kronis Tibia, Fibula - 10. 23 √ Infeksi Post Operasi Osteomyelitis kronis Tibia, Fibula - √ 65 11. 37 √ Infeksi Post Operasi Osteomyelitis Tibia, Fibula - 12. 45 √ Infeksi Post Operasi Osteomyelitis Femur - 13. 47 √ Infeksi Post Operasi Osteomyelitis kronis Tibia - 14. 17 √ Fraktur terbuka Osteomyelitis Femur P. aeruginosa 15. 55 √ Fraktur terbuka Osteomyelitis Tibia, Fibula - 16. 13 Fraktur terbuka Osteomyelitis Femur P. aeruginosa 17. 63 Luka terinfeksi Osteomyelitis kronis Femur - 18. 40 Fraktur terbuka Osteomyelitis Femur P. aeruginosa 19. 21 √ Infeksi Post Operasi Osteomyelitis kronis Tibia P. aeruginosa 20. 28 √ Fraktur terbuka Osteomyelitis kronis Tibia P. aeruginosa 21. 28 Multiple fraktur Osteomyelitis Femur - 22. 51 √ Fraktur terbuka Osteomyelitis kronis Femur - 23. 41 √ Fraktur tertutup Osteomyelitis kronis Femur - √ √ √ √ 66 24. 60 √ Fraktur terbuka Osteomyelitis Tibia, Fibula P. aeruginosa 25. 55 √ Luka terinfeksi Osteomyelitis kronis Pedis P. aeruginosa 26. 8 Fraktur tertutup Osteomyelitis Ulna - 27. 26 Fraktur terbuka Osteomyelitis Femur P. aeruginosa √ √ 67 Lampiran 6. Uji Normalitas Tests of Normality(b) Kolmogorov-Smirnov(a) Perlakuan Hasil Statistic df Shapiro-Wilk Sig. Statistic df Sig. imipenem .154 10 .200(*) .954 10 .718 ekstrak 50 % .200 10 .200(*) .924 10 .391 ekstrak 75% .317 10 .005 .713 10 .001 ekstrak 100% .251 10 .075 .831 10 .034 Uji Kolmogorov-Smirnov digunakan untuk mengetahui apakah populasi data berdistribusi normal atau tidak. Distribusi data yang normal merupakan distribusi data yang tersebar merata sistematis dan membentuk kurva seperti lonceng. Hipotesis : H0 = Data berdistribusi normal H1 = Data tidak berdistribusi normal Keputusan : Jika nilai probabilitas < 0,05, maka H0 ditolak Jika nilai probabilitas > 0,05, maka H0 diterima Dari tabel di atas diketahui bahwa nilai probabilitas untuk keempat kelompok perlakuan tersebut kecuali pada perlakuan ekstrak 75% (p) > 0,05. Dengan demikian H0 diterima yang berarti data diasumsikan berdistribusi normal sehingga berlaku asumsi untuk penggunaan uji ANOVA. 68 Lampiran 7. Uji Homogenitas Test of Homogeneity of Variances Hasil Levene Statistic df1 15.209 df2 4 Sig. 45 .000 Analisis ini bertujuan untuk menguji berlaku atau tidaknya asumsi untuk ANOVA, yaitu apakah semua kelompok perlakuan mempunyai varians data yang sama. Varians data harus stabil secara sistematis pada keseluruhan data. Hipotesis : H0 = kelima varians kelompok adalah identik H 1= kelima varians kelompok adalah tidak identik Keputusan : Jika nilai probabilitas < 0,05, maka H0 ditolak Jika nilai probabilitas > 0,05, maka H0 diterima Dari uji homogenitas varians data diketahui bahwa nilai probabilitas adalah 0,120 sehingga p < 0,05. Dengan demikian H0 ditolak yang berarti bahwa kelima varians kelompok adalah tidak identik, sehingga asumsi kesamaan varians untuk ANOVA terpenuhi tetapi memakai uji dunnetT3 sebagai Post Hoc Test 69 Lampiran 8. Uji Anova Dan Post Hoc Test ANOVA Hasil Between Groups Within Groups Total Sum of Squares 2457.320 559.000 3016.320 df Mean Square 614.330 12.422 4 45 49 F 49.454 Sig. .000 Post Hoc Tests Dunnett T3 (I) Perlakuan imipenem (J) Perlakuan Upper Bound 2.440 .003 4.47 21.53 12.100 2.420 .006 3.57 20.63 10.700 * 2.432 .013 2.17 19.23 * 22.000 -13.000* 2.399 2.440 .000 .003 13.48 -21.53 30.52 -4.47 -.900 .547 .656 -2.65 .85 * .597 .011 -4.19 -.41 9.000* -12.100* .447 2.420 .000 .006 7.41 -20.63 10.59 -3.57 ekstrak 50 % .900 .547 .656 -.85 2.65 ekstrak 100% -1.400 .506 .112 -3.00 .20 * 9.900 -10.700* .314 2.432 .000 .013 8.78 -19.23 11.02 -2.17 2.300* .597 .011 .41 4.19 aquades imipenem ekstrak 100% aquades imipenem aquades imipenem ekstrak 50 % ekstrak 75% aquades Lower Bound * ekstrak 75% ekstrak 100% Sig. 13.000 ekstrak 50 % ekstrak 100% ekstrak 75% 95% Confidence Interval Std. Error * ekstrak 75% ekstrak 50 % Mean Difference (I-J) aquades imipenem ekstrak 50 % ekstrak 75% ekstrak 100% -2.300 1.400 .506 .112 -.20 3.00 11.300* -22.000* .396 2.399 .000 .000 9.89 -30.52 12.71 -13.48 -9.000* .447 .000 -10.59 -7.41 -9.900 * .314 .000 -11.02 -8.78 -11.300 * .396 .000 -12.71 -9.89 70 Lampiran 9. Tabel F Untuk Uji Anova 71 72 Lampiran 10. Tabel Sensitivitas Disk Antibiotik (mm) Jenis Antibiotik Resisten Intermediet sensitif Imipenem ≤ 13 14 - 15 ≥ 16 Meropenem ≤ 12 13 - 16 ≥ 17 Tobramycin ≤ 12 13 - 14 ≥ 15 Amikasin ≤ 14 15 - 16 ≥ 17 73 Lampiran 11. Bahan dan Cara Kerja Ekstraksi Perkolasi Bahan : 1. Lidah buaya (Aloe vera) yang telah dijadikan serbuk 100 gr 2. Pelarut (etanol 70%) 1000 mg Perbandingan serbuk lidah buaya dengan etanol 70% adalah 1:10 Cara kerja : 1. 100 gr serbuk lidah buaya dibahasi dengan etanol 70% 20 ml 2. Aduk rata lalu tutup dan diamkan 1 jam 3. Setelah itu masukkan kedalam alat perkolator 4. Tetesi etanol 70% sampai terendam 1 lapis (1 cm) diatas serbuk lidah buaya 5. Diamkan 24 jam 6. Dialiri etanol 70% dalam corong sambil teteskan 1 tetes (1 ml)/ detik 7. Teteskan samapi pelarut 1000 ml semua terpakai 8. Perkolat yang didapat dievaporasi untuk menguapkan semua cairan penyari (etanol 70%) menjadi ekstrak kental ( DEPKES RI, 1986) 9. Selanjutnya ekstrak kental dikeringkan dengan cara diuapkan diatas waterbath sambil diangin-anginkan untuk membantu penguapan. 74 Lampiran 12. Perincian Bahan Pembuatan Ekstrak Lidah Buaya (Aloe vera) No. Berat sampel Berat ekstrak 1 100 gr 36,76 Kesetaraan = berat ekstrak rata-rata = 36,76 Berat sampel rata-rata 100 = 0, 37 = 1 gram bahan lidah buaya setara dengan 0,37 gr ekstrak rimpang kunyit 75 Lampiran 13. Dokumentasi Penelitian Foto 1. Tanaman dan Ekstrak Lidah Buaya (Aloe vera) 76 Foto 2. Pseudomonas aroginosa pada media PSA (Pseudomonas selective Agar), Pseudomonas aeruginosa membentuk koloni bulat halus dengan warna floresen kehijauan 77 Foto 3. Hasil Pengamatan Zona Hambatan Pertumbuhan Terhadap Pseudomonas aeroginosa Pada Media Muller Hinton 18-24 Jam Setelah Perlakuan (disk Antibiotik). AK IPM TOB MEM Keterangan : TOB = Tobramycin AK = Amikasin MEM = Meropenem IPM = Imipenem 78 Foto 3. Hasil Pengamatan Zona Hambatan Pertumbuhan Terhadap Pseudomonas aeroginosa Pada Media Muller Hinton 18-24 Jam Setelah Perlakuan (ekstrak dan aquades) D B A Keterangan : A. ekstrak lidah buaya 50% B. ekstrak lidah buaya 75% C. ekstrak lidah buaya 100% D. Aquades C