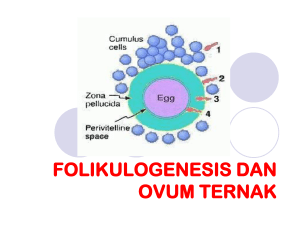
Penambahan Growth Differentiation Factor-9 (GDF
advertisement

VETERINARIA Medika Vol. 3, No. 1, Pebruari 2010 Penambahan Growth Differentiation Factor-9 (GDF 9) pada Medium Kultur In Vitro Terhadap Profil Kromosom Oosit Sapi Addition of Growth Differentiation Factor-9 (GDF-9) At Culture Medium In Vitro on Chromosome Profile of Bovine's Oocyte 1Widjiati, 2Nunung Aji Wibowo, 1Indah Norma Triana 1 Fakultas Kedokteran Hewan Unair 2 PPDH Fakultas Kedokteran Hewan Unair Kampus C Unair, Jl. Mulyorejo, Surabaya-60115. Telp. 031.5992785, Fax. 031.5993015 Email : [email protected] Abstract Growth Differentiation Factor - 9 (GDF-9) was a member of the TGF-â superfamily known to regulated ovarian functions in mammals. The aim this research was to find out the influenced suplementation GDF-9 toward maturation degree of bovine's oocyte in vitro. The objective of the current study was to test the hypothesis influence suplementation GDF-9 protein at the oocyte's maturation medium in vitro toward degree's maturation bovine's oocytes. Oocytes were collected with aspiration technique for the folicles wich have 3 – 5 mm diameters. Furthermore oocytes were matured within TCM 199 medium in wich additional amount 3% BSA, 50 µg / ml gentamycin sulfat, 1µg/ml FSH, 1µg/ml LH, 5 ng GDF-9, then oocytes cultured during 22 hours at 38,5º C temperature in the incubator with 5% CO2. After 22 hours incubated later doing investigation oocyte maturation with 1 % aceto orcein dye for observing figure M II. The result showed that Suplementation GDF-9 at a maturation medium gave influenced toward maturation oocyte which is indicated incrase of number M II and showed significant different. Keywords : Metafase II (M II), protein GDF-9, bovine's oocyte Pendahuluan Metode Embrio Transfer (ET) merupakan teknik pemindahan embrio dari satu induk ke beberapa induk resipien. Tahapan ET meliputi pengambilan sel telur, maturasi, fertilisasi, dan transfer ke induk resipien. Pada tahap penanaman embrio ke resipien perlu dilakukan keseragaman siklus birahi yaitu dengan sinkronisasi birahi. Hasil dari ET tersebut yaitu memungkinkan diperoleh sejumlah pedet dengan umur yang sama bahkan dapat diupayakan dengan keseragaman genetik. Akan tetapi ET belum bisa digunakan secara masal karena memerlukan biaya yang tinggi dan keahlian khusus serta masih dalam proses penelitian lebih lanjut (Mc Donald's, 2001). Teknik Embrio Transfer (ET) memiliki tingkat keberhasilan yang masih rendah, terlihat dari jumlah kebuntingan yang terjadi dari embrio yang dihasilkan secara in vitro kemudian ditransfer ke induk resipien menunjukkan jumlah yang rendah. Rendahnya angka kebuntingan dari teknik Embrio Transfer (ET) antara lain disebabkan kualitas embrio yang dihasilkan secara in vitro masih rendah yaitu dapat dilihat dari nilai blastula IVF. Pelaksanaan Embrio Transfer (ET) memerlukan embrio in vitro dengan kualitas bagus yaitu dengan tingkat kematangan maksimal. Upaya untuk meningkatkan kualitas embrio yaitu dengan memperhatikan faktor spermatozoa dan faktor oosit. Salah satu proses yang sangat berpengaruh pada kualitas oosit adalah maturasi oosit. Proses maturasi yang tidak sempurna akan mempengaruhi fertilitas oosit sehingga berpengaruh pada produksi embrio in vitro (Hunter, 2005). Oosit dimaturasi secara IVM (In Vitro Maturation) akan berkembang pada metafase II, sehingga terjadi pematangan inti dan sitoplasma yang ditandai dengan munculnya pronukleus . Media buatan dalam maturasi in vitro harus disesuaikan dengan kebutuhan oosit secara alami terutama harus kaya akan zat-zat nutrisi. Dalam media buatan tersebut juga menjadi tempat yang baik untuk pertumbuhan kuman dan virus. Penambahan antobiotik ke dalam media dapat mencegah berkembangnya kuman dan virus sehingga proses maturasi oosit dapat berjalan lebih sempurna ( Squires, 2003). Gonadotropin Hormone yaitu FSH dan LH memiliki pengaruh yang sangat besar untuk merangsang maturasi oosit. FSH mempunyai reseptor pada sel granulosa di dalam folikel yang berfungsi untuk merangsang pertumbuhan folikel. LH disekresi oleh kelenjar adenohipofisis dan memiliki reseptor pada sel teka interna yang dapat mempengaruhi steroidogenesis, luteolisis, ovulasi, dan pengaturan siklus birahi. Kedua hormon tersebut memiliki peranan yang sangat penting dalam mengatur aktivitas ovarium . Dalam penelitian yang dilakukan oleh Squires (2003) menyebutkan bahwa penambahan sintetik hormon FSH ke dalam media buatan dapat memberikan pengaruh pada proses maturasi oosit. Setelah proses maturasi maka oosit segera difertilisasi secara in vitro 53 Widjiati dkk. Suplementasi Growth Differentiation ... kemudian berkembang menjadi blastosis sebelum proses pembekuan dan transfer kepada induk resipien. Secara alami oosit menghasilkan suatu molekul protein yaitu GDF-9 (Growth Differentiation Factor-9) yang digunakan untuk pendewasaan dan pematangan oosit. GDF-9 merupakan molekul polipeptida famili dari TGF-â Growth Factor. Pada proses perkembangan oosit yang normal maka GDF-9 sangat diperlukan sampai terjadi ovulasi. Massangger atau mRNA GDF-9 tetap disekresikan oleh oosit setelah ovulasi tetapi akan berhenti pada 1,5 hari setelah fertilisasi (Mc Grath et al, 1995 ; Leitinen et al, 1999). Oleh karena itu maka perlu dilakukan penelitian u n t u k m e n g i d e n t i f i k a s i p e n g a r u h G ro w t h Differentiation Factor-9 (GDF-9) pada maturasi oosit secara in vitro. GDF-9 dapat menginduksi enzim Hyaluron Sintetase (HAS2), Cyclooxygenase (COX2), dan Steroidogenic Acute Regulator Protein (StAR) yang memicu perkembangan sel cumulus tetapi menekan pembentukan Urokinase Plasminogen Aktivator (uPA) dan sintesis LH receptor (LRH) mRNA. Kejadian tersebut membuat peningkatan GDF-9 bersifat antagonis dengan LH secara alami di dalam sel kumulus (Spicer et al, 2008). (Elvin et al, 1999) menyatakan bahwa dengan penambahan GDF-9 ke dalam media maturasi in vitro dapat memperbesar ukuran sel kumulus. GDF-9 dapat berikatan dengan receptor sel kumulus untuk meningkatkan sintesis progesteron meskipun tanpa pemberian FSH. Sehingga GDF-9 dapat bekerja sinergis seperti FSH yang sangat penting untuk perkembangan oosit dan reproduksi betina secara nomal. Gonadotropin Hormone memiliki peranan yang sangat penting untuk mengatur proses reproduksi. FSH dan LH adalah hormon yang mendorong pertumbuhan folikel dan pematangan oosit. Penambahan FSH ke dalam media pematangan secara in vitro menghasilkan oosit-oosit mature yang lebih baik daripada media TCM 199 tanpa perlakuan khusus (Squires, 2003). GDF-9 mempercepat proliferasi sel granulosa yang digambarkan dengan peningkatan gabungan thymidin. Sekresi GDF-9 dari oosit mendorong sintesis androgen dan progesteron di dalam sel teka. GDF-9 digunakan untuk mengatur fungsi sel kumulus oosit kompleks sejak masa preovulasi sampai terjadi persiapan fertilisasi (Sophie et al, 2004). Materi dan Metode Penelitian Peralatan yang digunakan untuk penelitian ini antara lain adalah : gunting (Tajimaco S.S), pinset (Tajimaco S. S), disposable syringe 5 cc (One Med), jarum ukuran G18, cawan petri disposable (Merk Falcon), Erlenmeyer, pipet Pasteur, pipet Eppendorff, tabung Eppendorff, Alat centrifuge (Medifuge), Freezer, Incubator CO2, gelas ukur, mikroskop Inverted (Meiji). 54 Media kimia yang diperlukan antara lain :Tissue Culture Media (TCM-199) merk MEM Eagle's, NaCl fisiologis dan Diionized Water (DW), Gentamycin Sulfat, Bovine Serum Albumin (BSA), Phosphat Buffer Salin (PBS), aceto orcein, mineral oil, NaHCO3, FSH merk Fullagon, LH merk Chorullon. Sampel yang digunakan pada penelitian ini adalah ovarium sapi yang diperoleh dari limbah Rumah Potong Hewan kemudian diambil oositnya selanjutnya dimaturasi dalam media maturasi yang dibagi menjadi dua kelompok yaitu : P0 : Media maturasi yang diberi tambahan FSH 1 µg/ml, BSA 3%, LH 1 µg/ml, P1 : Media maturasi yang diberi tambahan FSH 1 µg/ml, BSA 3%, LH 1 µg/ml, dan GDF-9 5 ng/ml Ovarium dibawa ke Laboratorium Fakultas Kedokteran Hewan Universitas Airlangga untuk mendapatkan oositnya. Ovarium dicuci dengan NaCl fisiologis ditambah gentamicyn untuk menghindari kontaminasi kuman. Melakukan koleksi oosit pada ovarium dengan diameter permukaan 3-5 mm. Oosit hasil koleksi kemudian dicuci di dalam medium maturasi TCM 199, FSH 1 µg/ml, LH 1 µg/ml sebanyak dua kali sampai bersih sebagai kontrol sedangkan sebagai perlakuan oosit dicuci menggunakan medium maturasi TCM 199, FSH 1 µg/ml, LH 1 µg/ml, GDF-9 5 ng/ml. Setelah bersih oosit kemudian dimaturasi di dalam inkubator CO2, dengan suhu 38,5º Celcius. Untuk proses pematangan oosit digunakan medium maturasi yang dibagi menjadi dua kelompok yaitu : P0 : Media maturasi yang diberi tambahan FSH 1 µg/ml, BSA 3%, LH 1 µg/ml, P1 : Media maturasi yang diberi tambahan FSH 1 µg/ml, BSA 3%, LH 1 µg/ml, dan GDF-9 sebanyak 5 ng/ml Oosit dikultur dalam 100 ul medium tetes dan ditutup dengan mineral oil. Pematangan oosit dilakukan pada suhu 38oC di dalam inkubator 5% CO2 selama 22 jam. Oosit hasil maturasi diperiksa tingkat kematangannya dengan metode pewarnaan aceto orcein (Wu, et al 2006). Hasil dan Pembahasan Penelitian ini dilakukan untuk mengetahui apakah teknik maturasi yang dijalankan mampu meningkatkan kemampuan maturasi oosit yang diisolasi dari folikel kecil secara in vitro. Pada penelitian yang telah dilakukan bertujuan untuk mengamati tingkat kematangan oosit berdasarkan perubahan inti yang terdapat di dalam oosit. Setelah mengalami maturasi selama 22 jam maka oosit diwarnai dengan pewarnaan aceto orcein 1% untuk mengetahui pola perkembangan pembelahan inti. Hasil pengamatan tentang pengaruh suplementasi GDF-9 pada media maturasi oosit sapi dapat dilihat sebagai VETERINARIA Medika Vol. 3, No. 1, Pebruari 2010 Tabel 1 Rata-Rata Hasil Pengamatan Metafase II Perlakuan Rata-rata ± SD P0 P1 16,11 ± 0,96b 38,89 ± 13,54a Keterangan : Superskrip yang berbeda pada kolom yang sama menunjukkan perbedaan yang nyata (p<0,05). P0: Kontrol, P1: Perlakuan dengan suplementasi GDF-9 pada medium. berikut : Data yang diperoleh dilakukan analisis statistik dengan menggunakan uji T (T-test). Perbedaan yang nyata setelah dilakukan Uji T (T-test) ditunjukkan pada perlakuan (P1) dengan media yang disuplementasi GDF-9 dibandingkan dengan kontrol (P0) yaitu pada pembentukan Metafase II (M II) dengan asumsi (p<0,05). Bahan – bahan yang digunakan untuk maturasi oosit merupakan molekul – molekul yang secara alami terdapat di dalam tubuh (in vivo). Faktor yang paling penting untuk proses maturasi terutama adalah FSH, LH dan beberapa Growth Factor. Inkubator CO2 digunakan untuk menjaga suhu, kelembaban, osmolaritas, dan pH seperti di dalam tubuh supaya kegiatan sel tetap berjalan (Squaires, 2003). Teknik pewarnaan oosit yang digunakan pada penelitian ini adalah aceto orcein. Pewarnaan tersebut bertujuan untuk mengetahui tahapan proses pembelahan yang terjadi di dalam oosit. Setelah mengalami maturasi selama 22 jam oosit dipindahkan ke dalam glass object kemudian direndam di dalam larutan fiksatif selama 24 jam. Larutan fiksatif tersebut dibuat dari 6 bagian alkohol absolut dan 1 bagian dari larutan acetic acid. Tujuan dari proses fiksasi adalah untuk dehidrasi supaya zat warna mudah diserap oleh sel. Oosit diwarnai dengan zat pewarna orcein dengan cara meneteskan pewarna tersebut ke dalam preparat glass object. Zat pewarna akan memberikan warna yang kontras terhadap nukleolus dan kromosom sehingga dapat diamati tahapan dari proses pembelahan oosit (Barry and Perkins, 2001). Sebagai sel somatik, siklus sel oosit diatur oleh aktivitas protein yang dikenal dengan Cyclin Dependent Kinase (cdk) dan GDF-9. Banyak penelitian membuktikan bahwa pentingnya peranan GDF-9 sebagai stimulator saat perkembangan folikel primer serta fungsinya terhadap perkembangan sel granulosa pada folikel antral dan preantral. Dengan penambahan GDF-9 terlihat adanya laju pertumbuhan folikel primer dan folikel preantral pada saat in vivo. Sel kumulus mengalami perkembangan karena peningkatan produksi androgen pada sel teka serta didukung dengan sel granulosa yang menekan produksi inhibin. GDF-9 juga mempengarui berbagai fungsi sel ovarium termasuk sintesis DNA sel granulosa dan proses steroidogenesis (Jayawardana et al, 2004). GDF-9 memiliki peranan dalam perkembangan folikel primer serta deferensiasinya. GDF-9 mampu menstimulasi produksi TIC androstenedione karena kemampuannya berhubungan dengan deferensiasi sel teka pada preovulatory folikel. Perkembangan folikel dihubungkan dengan adanya peningkatan androgen yang memproduksi enzim cytocrom P450, kemudian mengalami penurunan setelah adanya stimulasi LH dan hCG. Maka exspresi GDF-9 tertinggi pada oosit menunjukkan bahwa GDF9 lebih banyak dan aktif selama stadium awal perkembangan folikel (Jinwen, 2005). Penelitian dari (Shimizu et al, 2004) menyebutkan bahwa injeksi GDF-9 pada mencit dapat meningkatkan jumlah folikel primer dan folikel sekunder serta menurunkan jumlah folikel primordial. Aplikasi injeksi GDF-9 pada in vivo dapat meningkatkan jumlah folikel primer dan preantral. Penemuan tersebut menunjukkan bahwa folikel dapat tumbuh pada stadium primer dengan pemberian GDF9. Penemuan tersebut dapat membuktikan bahwa GDF9 dapat mempercepat masa transisi dari folikel primordial menjadi primer. Didukung dengan penelitian dari (Vitt et al, 2002) yang menyatakan bahwa folikel primordial mulai melakukan pertumbuhan dengan injeksi GDF-9. Injeksi GDF-9 merupakan metode yang efektif dalam merangsang folikel primordial untuk tumbuh. Penemuan tersebut dapat dijadikan aplikasi untuk mengatasi infertilitas pada hewan betina. GDF-9 telah meningkatkan pertumbuhan folikel primer secara in vivo dan kelangsungan hidup oosit pada media kultur in vitro. Pemberian GDF-9 pada jaringan ovarium mencit dapat mengubah susunan ovarium dan merangsang pertumbuhan folikel primer. Hal tersebut menunjukkan bahwa GDF-9 merupakan faktor yang sangat penting dalam perkembangan oosit. Folikel primordial dapat berubah selama in vivo, tetapi peningkatan signifikan dalam presentase dari folikel primordial tidak dapat diamati karena GDF-9 juga mempercepat peralihan folikel primordial menjadi primer, primer menjadi sekunder (Kaivo-oja, 2007). Penjelasan tersebut di atas menerangkan bahwa protein GDF-9 dapat menginduksi pematangan oosit ditunjukkan dengan adanya peningkatan pembentukan M II. Kesimpulan Berdasarkan pengamatan dari hasil penelitian suplementasi protein GDF-9 (Growth Differentiation Factor – 9) pada media kultur in vitro oosit sapi dapat memberikan pengaruh terhadap tingkat kematangan oosit yang ditunjukkan dengan peningkatan jumlah M II. Daftar Pustaka Barry E.G. and Perkins D.D. 2001. How to prepare aceto-orcein squashes, especially for pachytene chromosomes. Academic Press. San Diego. 55 Widjiati dkk. Suplementasi Growth Differentiation ... Elvin J.A., Clark A.T., Wang P., Wolfman N.M., and Matzuk M.M. 1999. Paracrine actions of Growth Differentiation Factor-9 in the mammalian ovary. Mol Endocrinol 13: 10351048. Hunter,R.H.F. 2005. Fisiologi dan Teknologi Reproduksi Hewan Betina Domestik. Penerbit ITB dan Penerbit Universitas Udayana. Hyttel P.I., Callsen F.H., And Greve I. 2000. Oocytes growth, capacitation and final maturation in cattle. J. Theriogenologi. Biol Reprod 47: 2332. Jayawardhana B.C., Shimizu T., Hiromi N., and Etsushi K. 2004. Hormon regulator of expression Growth Differentiation Factor-9 receptor tipe I and tipe II genes in vitro the bovine ovarium folicle. Reproduction 131: 543. Jinwen D. 2005. Growth Differentiation Factor-9 is required during early ovarian folliculogenesis. Biol Reprod 75: 531-535. Kaivo-oja N. 2007. Growth Differentiation Factor-9 Signalling in the Ovary. Thesis. Hartman Institute University of Helsinki. Finland. Laitinen M., Vuojolainen K., Jaatinen R., Ketola I., Aaltonen J., Lehtonen E., Heikinheimo M., and Ritvos O. 1999. A Novel Growth Differentiation Factor-9 (GDF-9) related factor is Co-Expressed with GDF-9 in mouse oocytes during folliculogenesis. Sciencedirect 73: 144149. Mc Donald's. 2001. Veterinary Endocrinology and Reproduction. 7th.ed. M.H. Pinda Iowa States Press. United States of America. 285-295. Mc Grath S.A., Esquela A.F., and Lee S.J. 1995. Oocytesspecific expression of Growth D i ff e r e n t i a t i o n F a c t o r- 9 . M o l e c u l a r Endocrinology 9: 131-136. 56 Shimizu T., Miyahayashi S., Yokoo M., Hoshino Y., Sasada H., and Sato E. 2004. Molecular cloning of porcine Growth Differentiation Factor-9 (GDF-9) cDNA and its role in early folliculogenesis: direct ovarian injecton of GDF-9 gene fragments promotes early follicolugenesis. Reproduction. 128: 537-543. Sophie P., Uzbekova S., Perreau C., Papillier P., Mermillod P., and Dalbie”s R. 2004. Spatiotemporal expression of the germ cell marker genes MATER, ZAR 1, GDF-9, BMP 15, and VASA in adult bovine tissues, oocytes, and preimplantation embryos 1. Science Direct 71: 1359-1366. Spicer, Allen D.T., Muzerbourg S., Payne A.H.,and Hsuech A.J. 2008. Stimulated proliferation and inhibit steroidogenis by bovine theca cells influence of folicle size on respones to GDF-9. Biol Reprod 78: 329-335. Sulaiman. 2005. Statistik Non-Parametrik. Edisi II. Penerbit Andi Offset Yogyakarta. Squaries E.J. 2003. Appllied Animal Endocrinology. Cromwell Press. Trowbridge.UK. Tamer S.H. and David A. 2005. Oocytes prevent cumulus cell apoptosis maintaining a morphogenic paracrine gradient of bone morphogenetic proteins. Journal of Science 10: 5257-5267. Vitt U.A., Mazerbourg S., Klein C.,and Hsueh A.J.W. 2002. Bone morphogenetic protein receptor for Growth Differentiatio Factor-9. Biol Reprod. 67: 473-480. Widjiati. 2006. Induksi Maturasi Oosit Secara In Vitro Oleh Transforming Growth Factor Basal Oosit Cumulus Komplek. Disertasi. Universitas Brawijaya . Malang. Winda. 2006. Siklus Hidup Ovarium. Review Article.