Vaksin Virus Influenza
advertisement

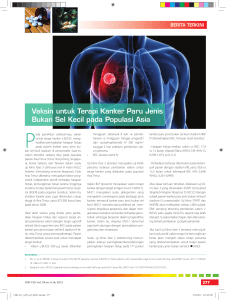
Tinjauan Pustaka Vaksin Virus Influenza I Made Setiawan Rumah Sakit Penyakit Infeksi Prof. Dr. Sulianti Saroso, Jakarta Abstark: Walaupun tingkat kematian penyakit influenza sangat rendah namun imunisasi terhadap penyakit ini masih dianggap penting karena dapat mencegah penyakit, sehingga tingkat kesakitan dan kematian dapat ditekan. Imunisasi terutama sangat penting untuk kelompok anak-anak, orang tua lebih dari 65 tahun, orang yang menderita penyakit kronis, dan orang yang mempunyai risiko menderita penyakit influenza. Vaksin influenza cukup efektif untuk mencegah penyakit influenza, selain mempunyai efek samping yang ringan. Ada berbagai jenis vaksin influenza, yaitu vaksin hidup, vaksin mati, dan vaksin subunit. Dengan berkembangnya teknologi untuk membuat vaksin, maka kita mengenal berbagai jenis vaksin, misalnya vaksin dengan adjuvan, vaksin DNA, vaksin rekombinan. Semua vaksin dengan teknologi baru diharapkan dapat meningkatkan efektivitas vaksin dengan efek samping yang minimal. Kata kunci: imunisasi, vaksin, virus influenza Vaccine for Influenza Virus I Made Setiawan Prof. Dr. Sulianti Saroso Infectious Diseases Hospital, Jakarta Abstract: The mortality rate of influenza infection is low. However, immunization to prevent spreading of disease is considered important. This immunization is aimed to reduce the morbidity and mortality rate, especially for children, elderly (more than 65 years old), people with chronic infections, and those who are prone to suffer influenza infection. This vaccine, having few adverse effects, is effective to prevent influenza. There are several types of influenza vaccine: live attenuated vaccine, inactivated vaccine, subunit vaccine. Boosted by the new technological advancement in vaccine production, there are several types of vaccine available now, such as vaccine with adjuvant, DNA vaccine, recombinant vaccine. Each of these vaccines is hoped to improve the effectivity of the vaccine with low adverse effects. Keywords: immunization, vaccine, influenza virus Maj Kedokt Indon, Volum: 58, Nomor: 12, Desember 2008 517 Vaksin Virus Influenza Pendahuluan Virus influenza beredar sangat luas di seluruh dunia dan mengakibatkan terjadinya epidemi penyakit saluran napas pada manusia setiap tahun. Angka konsultasi ke dokter menjadi meningkat di Inggris sebagai akibat adanya wabah influenza. Saat terjadi epidemi antara tahun 1975-1976 dan antara tahun 1989-1990 diperkirakan sebanyak 6.200–29.600 orang meninggal dunia akibat penyakit influenza. Selama periode tahun 1976-1999 tingkat kematian tahunan akibat pneumonia dan influenza di Amerika Serikat sebanyak 8.097 orang. Sekitar 90% kematian yang disebabkan influenza terjadi pada orang yang berumur 65 tahun atau lebih. Selain itu, tingkat kematian yang tinggi juga ditemukan pada anak yang berumur kurang dari 1 tahun.1 Sampai saat ini imunisasi masih merupakan cara yang cukup efektif untuk mencegah serta mengurangi komplikasi akibat penyakit influenza. Komplikasi juga dapat dicegah dengan pemberian profilaksis obat antivirus, misalnya inhibitor M2 (amantadine dan rimantadine) atau inhibitor neuraminidase (oseltamivir dan zanavir).2,3 Dalam tulisan ini akan dibahas tentang vaksin virus influenza. Virologi Virus Influenza Struktur dan Fungsi Virus influenza adalah virus RNA tunggal negatif bersegmen dan berselubung, termasuk famili Orthomyxoviridae. Bentuk partikel virus adalah pleomorfik dengan ukuran 80-120 nm. Selubung (envelope) virus terdiri dari lipid bilayer, pada permukaannya terdapat tonjolan dua glikoprotein antigen yang sangat penting, yaitu hemaglutinin (HA) untuk menempelnya virus dan terjadinya fusi anatara dinding virus dan dinding sel yang diinfeksi, dan neuraminidase (NA) untuk mencegah terjadinya agregasi virus serta melepaskan virion yang baru dirakit dari sel yang diinfeksi. Kedua protein ini sangat penting untuk masuk dan keluar virus dari sel yang diinfeksi sesudah mengalami replikasi di dalam sel. Selain itu, kedua protein ini juga merupakan antigen yang sangat penting terhadap respons imun humoral (antibodi). Perubahan antigenik yang lebih luas terjadi pada HA dibandingkan dengan NA.4,5 Pada selubung juga terdapat protein M2 yang mengadakan interaksi dengan genom sel dan faktor ekspor nuklear untuk membantu merakit virus. Bentuk tetramerik protein M2 merupakan saluran ion antara bagian dalam virus dan lingkungan luarnya. Protein M2 memegang peranan yang sangat penting untuk menjaga agar pH tetap rendah selama terjadi sintesis HA dan virion yang masih telanjang. Masingmasing gen segmen RNA di-encapsidasi oleh nukleoprotein (NP).4,5 Gen PB2, PB1, dan PA mengkode protein yang membentuk kompleks polimerase yang berguna untuk transkripsi, terletak pada setiap ujung masing-masing segmen gen. Protein non-strutural nuklear eksport (Nuclear Export Protein, 518 NEP) dan protein non-struktural NS1 yang dikenal sebagai penekan interferon antagonis banyak ditemukan pada sel yang terinfeksi dan tidak tergabung dalam struktur virion.4,5 Sudah sejak lama diketahui bahwa virus influenza selalu dipelihara dan beredar pada burung air (waterfowl), yang merupakan sumber virus influenza. Sampai saat ini terdapat 16 subtipe HA dan 9 subtipe NA virus yang sudah dapat diidentifikasi pada spesies unggas. Berdasarkan bukti serologis, hanya subtipe H1, H2, H3, N1, dan N2 telah diketahui dapat menginfeksi manusia sejak 100 tahun yang lalu. Saat ini terdapat dua subtipe virus influenza A yang beredar pada manusia di seluruh dunia, yaitu H2N2 dan H3N2. HA virus influenza A H2N2 dan H3N2 yang menyebabkan terjadinya pandemi pada manusia mungkin berasal dari virus unggas sebagai akibat terjadinya reassortment genetik antara virus manusia dan virus unggas.6 Imunitas terhadap Virus Influenza Penanda utama bahwa seseorang memiliki daya tahan terhadap virus influenza setelah mendapat imunisasi atau menderita penyakit adalah antibodi humoral yang berkomplementer secara spesifik dengan antigen HA dan NA virus.ref Antibodi HA dapat menahan virus dengan menetralisasi infektivitasnya, sedangkan antibodi terhadap NA membatasi penyebaran virus dengan jalan menghambat lepasnya virion yang baru dirakit dari sel yang terinfeksi.5,16 Jika dibandingkan dengan imunitas humoral, imunitas seluler terhadap virus influenza belum banyak diketahui. Respons sel T CD8+ sitotoksik biasanya muncul dalam 3-4 hari sesudah infeksi. Sel T sitotoksik CD8+ mendeteksi dan melisis sel pejamu yang terinfeksi virus dan spesifisitasnya ditujukan terhadap epitop HA, NP, M, dan PB2 yang sangat dilindungi dibandingkan dengan epitop imunitas humoral. Sel T helper CD4+ merupakan sinyal yang sangat penting dalam memfasilitasi respons imun seluler maupun humoral. Selain itu, sel T helper CD4+ juga mempunyai efek sitotoksik, walaupun efek ini kurang kuat dibandingkan dengan sel T CD8+.5,16 Gambar Struktur virus influenza (Lamb and Krug, 2001).4 Maj Kedokt Indon, Volum: 58, Nomor: 12, Desember 2008 Vaksin Virus Influenza Sangat jelas bahwa, imunitas humoral maupun seluler mempunyai peranan yang sangat penting dalam menahan infeksi virus influenza. Antibodi dapat mengurangi jumlah virus yang menginfeksi sel dan menahan terjadinya infeksi ulang. Sel T sitotoksik menghancurkan sel yang terinfeksi virus dan menekan sitokin. Respons imun seluler terhadap influenza kurang spesifik, terutama karena memberi respons imun yang luas terhadap antigen inti.5,16 Vaksin Influenza Jenis vaksin virus influenza yang digunakan untuk mengimunisasi manusia di seluruh dunia adalah vaksin virus mati, karena vaksin virus hidup dapat bereplikasi dan dianggap berbahaya. Vaksin yang ada saat ini diproduksi dari virus yang ditumbuhkan dalam telor ayam yang subur dan dibunuh menggunakan formalin atau α-propiolakton. Vaksin dapat berupa virus utuh yang merupakan hasil pemisahan protein dengan detergen atau formulasi antigen permukaaan yaitu, hemaglutinin dan neuraminidase dari ketiga galur virus yang disarankan oleh WHO. Sekitar 50 negara sudah menyiapkan dana untuk melakukan program imunisasi dan vaksin influenza juga sudah tersedia di beberapa negara. Sekitar 234 juta orang dari 6 miliar penduduk dunia sudah mendapat imunisasi influenza pada tahun 2000. Rekomendasi untuk melakukan vaksinasi spesifik sangat bervariasi, tetapi sebagian besar menyarankan untuk mengadakan imunisasi tahunan pada orang tua dan penderita penyakit kronis tertentu. Saran ini muncul karena adanya tingkat kesakitan dan kematian yang tinggi pada kelompok yang berisiko, yang sesuai dengan efikasi vaksin.1 Vaksin Virus Mati Utuh Perkembangan vaksin virus utuh bergantung kepada kemampuan untuk memperbanyak dan mempurifikasi virus. Biasanya virus ditumbuhkan pada sakus alantoik telor ayam yang berembrio. Sebelumnya virus dipurifikasi dan dikonsentrasi menggunakan teknik dengan mengabsorpsi dan elusi pada sel darah merah, kemudian dimatikan dengan formalin. Selanjutnya Stanley menemukan cara baru untuk mempurifikasi vaksin dengan menggunakan alat sentrifugasi, dan sampai sekarang cara ini menjadi standar untuk memproduksi vaksin secara rutin setiap tahun. Puncak perkembangan teknologi pemurnian virus adalah menggunakan ultra sentrifugasi dengan beberapa modifikasi, sehingga lahirlah teknologi sentrifugasi perbedaan densitas. Gabungan purifikasi filtrasi membran dan purifikasi dengan sentrifugasi dapat menghasilkan vaksin yang mendapat lisensi.5 Vaksin virus mati sangat berhasil dipakai untuk mencegah penyakit influenza. Setiap dosis vaksin mati saat ini mengandung 15 µg virus influenza A H1N1, H3N2, dan virus influenza B. Vaksin mati diperkirakan mempunyai efikasi protektivitas 60-90% pada anak-anak dan orang dewasa, dan lebih rendah pada orang tua. Vaksin ini sudah diakui sangat Maj Kedokt Indon, Volum: 58, Nomor: 12, Desember 2008 aman dan ditoleransi dengan sangat baik.7 Karena terjadinya mutasi shift atau drift pada protein HA dan NA virus influenza tidak dapat diramal, maka WHO mengorganisasi sistem surveilans influenza secara global untuk memilih virus influenza A H1N1 dan H3N2 dan virus influenza B yang mangalami mutasi drift yang terakhir untuk dipakai membuat vaksin trivalen. Pemilihan virus dilakukan antara bulan Februari dan April setiap tahun, kemudian vaksin diproduksi, dan didistribusikan bulan September atau Oktober pada tahun yang sama.5 Hal ini untuk mencegah agar pembuatan vaksin jangan sampai terlambat seperti pada pandemi-pandemi yang lalu. Efikasi dan Efektivitas Vaksin Mati Utuh Berdasarkan studi tentang efikasi dan efektivitas vaksin influenza mati utuh, ternyata vaksin ini memberi keuntungan yang cukup berarti. Berdasarkan hasil penelitian, efikasi vaksin untuk mencegah influenza simptomatik --yang dipastikan dengan pemeriksaan laboratorium--diperkirakan 80%.8,9 Keuntungan lain yang diperoleh termasuk berkurangnya absen anak sekolah, menurunnya kasus penyakit otitis media, berkurangnya angka kekambuhan penyakit asma, menurunnya angka kejadian penyakit saluran napas yang lain, bila berkontak dengan anggota serumah yang tidak mendapat imunisasi.10 Keamanan Vaksin Virus Mati Utuh Vaksin virus utuh lebih sering menimbulkan reaksi samping pada anak-anak kecil dibandingkan dengan formula vaksin terpisah/subunit yang hanya mengandung antigen protein permukaan murni. Walaupun demikian, hasil penelitian terakhir membuktikan bahwa vaksin influenza mati yang utuh juga cukup aman diberikan pada penderita asma dan penyakit kronis yang lain.16 Reaksi ikutan yang sering terjadi pada imunisasi vaksin influenza mati yang utuh adalah eritema, nyeri, dan pembengkakan pada tempat suntikan yang terjadi 12-24 jam sesudah imunisasi. Kadang-kadang terjadi indurasi. Gejala lokal sering terjadi pada orang dewasa. Gejala sistemik yang terjadi adalah suhu tubuh sedikit meningkat dalam 48 jam sesudah imunisasi. Gejala yang lain adalah nyeri otot, nyeri sendi, sakit kapala, dan badan lemas. Gejala ini muncul pada sekitar 6-50% orang yang mendapat imunisasi.16 Reaksi hipersensitif terutama reaksi alergi terhadap protein telor dikarenakan proses pembuatan vaksin dilakukan pada telor ayam yang berembriyo. Walaupun demikian, anak yang alergi masih dapat diberikan imunisasi influenza secara hati-hati dengan membagi dosis.16 Komplikasi lain yang pernah dilaporkan adalah munculnya sindrom Guillain-Bare dalam 6 minggu sesudah pemberian vaksinasi. Komplikasi ini terjadi sangat jarang, kira-kira satu dalam satu juta orang yang mendapat imunisasi.17 Berdasarkan studi kepustakaan, ternyata gejala 519 Vaksin Virus Influenza ikutan yang terjadi pada imunisasi influenza adalah sangat kecil. Akhir-akhir ini ditemukan adanya sindrom oculorespiratory yang merupakan reaksi berupa kemerahan pada mata dengan atau tanpa gejala saluran napas, misalnya batuk, pilek, sesak napas, susah menelan, nyeri tenggorokan, dan muka udem, yang terjadi 2-24 jam sesudah imunisasi. Reaksi ini ditemukan di Canada dengan frekuensi yang sangat rendah (13,9-19,3 per 100.000 penduduk yang mendapat imunisasi).18,19 Di tempat lain kasus tersebut dilaporkan sangat sedikit, dan mekanisme terjadinya masih belum jelas.1 Vaksin Subunit/Terpisah/Split Vaccine Sebelum berkembangnya teknologi purifikasi vaksin untuk memperoleh vaksin yang sangat murni, maka pabrik pembuat vaksin mengembangkan teknik pemisah protein virus dengan menggunakan eter atau deterjen, sehingga toksigenitas vaksin yang terjadi pada manusia dapat dikurangi. Vaksin tersebut sudah banyak digunakan di dunia, dan terutama disarankan untuk anak yang berumur kurang dari 12 tahun.5 Vaksin subunit yang diberikan 1 kali dosis cukup untuk mengimunisasi orang yang sudah mendapat imunisasi atau yang sudah mempunyai memori imunologi terhadap antigen atau epitop virus yang dapat melindungi (epitop protektif). Sebaliknya vaksin terpisah/subunit ini kurang imunogenik untuk orang yang tidak memiliki memori terhadap antigen karena belum pernah mendapat imunisasi atau belum pernah terinfeksi virus influenza. Oleh karena itu, disarankan untuk memberikan dua kali dosis.20 Efikasi dan Efektivitas Vaksin Virus Subunit Berdasarkan hasil penelitian pada orang dewasa umur aktif kerja yang diberi vaksin influenza terpisah/subunit, diperkirakan mempunyai efikasi untuk mencegah influenza yang dibuktikan secara laboratorium adalah 77%. Keuntungan lain yang diperoleh adalah berkurangnya absensi kerja, konsultasi dokter, dan penggunaan antibiotik.11,12 Frekuensi influenza yang dideteksi berdasarkan pemeriksaan laboratorium berkurang 52% pada orang yang mendapat imunisasi13 dan berkurang 94% pada orang yang lebih tua yang tinggal dalam masyarakat.14 Banyak studi lain membuktikan bahwa angka perawatan pneumonia dan influenza di rumah sakit menurun.1 Imunisasi pada penderita penyakit paru kronis dapat mengurangi angka perawatan rumah sakit sebagai akibat pneumonia dan influenza sebanyak 52%.15 Keamanan Vaksin Mati Subunit Vaksin terpisah/subunit dapat ditoleransi dengan sangat baik dan sangat aman. Selain itu, tidak ada laporan yang dipublikasi tentang adanya reaksi hipersensitivitas pada vaksin influenza subunit.1 520 Indikasi Vaksin Influenza Walaupun penyakit influenza merupakan penyebab kematian yang sangat rendah (kurang dari 0,1%), tetapi ia dapat menyerang penduduk dengan angka kesakitan yang tinggi. Selain itu, penyakit influenza pada anak-anak dan orang tua yang berumur lebih dari 65 tahun, serta orang yang menderita penyakit kronis dapat mengakibatkan komplikasi yang sangat berat. Pemberian imunisasi pada kelompokkelompok ini dapat mengurangi terjadinya komplikasi. Kelompok masyarakat yang menjadi sasaran imunisasi adalah:16 - Orang tua yang berumur lebih dari 65 tahun. - Petugas rumah sakit yang merawat penderita penyakit kronis. - Orang dewasa dan anak-anak yang menderita penyakit paru atau sistem kardiovaskuler kronis, termasuk anak yang menderita penyakit asma. - Orang dewasa dan anak-anak yang menderita penyakit yang perlu dikontrol secara teratur setiap tahun, misalnya penyakit diabetes melitus, gangguan fungsi ginjal, hemoglobinopati, dan penyakit penekanan sistem imun. - Anak dan dewasa muda (umur 6 bulan sampai 18 tahun) yang mendapat pengobatan aspirin jangka panjang, yang mungkin mempunyai risiko sindrom Reye bila menderita penyakit influenza. - Wanita dengan kehamilan trimester kedua atau ketiga pada saat terjadi musim influenza. Kontraindikasi Vaksin Influenza Vaksin ini tidak boleh diberikan pada anak berumur kurang dari 6 bulan, karena pada kelompok umur ini vaksin sering menimbulkan gejala panas. Pada anak yang berumur kurang dari 12 tahun sebaiknya diberikan vaksin influenza yang terpisah/subunit. Orang yang menderita penyakit saluran napas yang ringan dapat diberikan imunisasi vaksin influenza. Orang yang alergi terhadap protein telor dapat diimunisasi tetapi harus diberikan secara hati-hati.16 Pendekatan Baru Vaksinasi Pada dekade yang lalu telah banyak dikembangkan teknologi baru yang dapat digunakan untuk memproduksi vaksin atau untuk meningkatkan imunogenisitas vaksin serta mengurangi efek samping yang terjadi. Berikut ini akan diuraikan beberapa teknik baru yang sudah dan sedang dikembangkan oleh para ahli imunisasi. Vaksin Virus Influenza Hidup yang Dilemahkan Vaksin influenza hidup yang diberikan secara intranasal memberikan keuntungan karena menyerupai infeksi alami, dapat memberikan respons imunologis yang lebih luas, dan dengan masa perlindungan yang lebih dibandingkan dengan vaksin mati. Strategi penggunaan vaksin hidup berdasarkan Maj Kedokt Indon, Volum: 58, Nomor: 12, Desember 2008 Vaksin Virus Influenza pemindahan gen pengkode cold adaptation (ca) dan temperature sensitivity (ts) dari donor virus induk yang dilemahkan telah digunakan di Rusia selama bertahuntahun.25 Kemudian di Amerika Serikat dilakukan penelitian secara intensif selama bertahun-tahun untuk membuat vaksin hidup yang dilemahkan tersebut. Kemajuan yang paling penting diperoleh oleh Maassab et al.26 di Universitas Michigan. Dia mengembangkan vaksin influenza hidup, yaitu reasortant yang dilemahkan diadaptasi dingin, yang di dalamnya diselipkan gen HA atau NA yang diinginkan. Vaksin ini diperjuangkan agar mendapat lisensi. Vaksin trivalen virus influenza A dan B hidup dari Maassab terdiri dari galur biang influenza lemah yang diadaptasi dingin yang di dalamnya mengandung gen HA dan NA yang beredar saat ini menggantikan gen yang sesuai dari galur biang dengan cara reassortment. Galur biang virus influenza A dan B dilemahkan sehingga replikasinya terbatas hanya pada saluran napas bagian atas manusia. Caranya adalah replikasinya diadaptasi pada telor dengan temperatur rendah (25oC) sehingga terjadi mutasi stabil pada ketiga gen polimerase viz. PA, PB1, dan PB2. Studi klinis memperlihatkan bahwa vaksin ini memberikan hasil yang cukup memuaskan pada anak, orang dewasa, dan orang tua. Pemberian secara nasal memperoleh hasil efikasi yang tinggi pada anak yang masih muda.11,15,27 Setelah dievaluasi secara klinis selama tiga dekade, maka vaksin ini disetujui oleh Food and Drug Administration pada bulan Juni 2003 untuk digunakan pada anak-anak yang sehat, anak remaja umur 5-17 tahun, dan orang dewasa sehat yang berumur 18-49 tahun. Vaksin dengan dasar ca dapat bereplikasi dengan sangat baik pada suhu nasofaring, tetapi tidak pada suhu saluran napas bagian bawah.1 Dari hasil penelitian, vaksin ca pada anak-anak yang masih muda di Amerika Serikat memberikan daya lindung yang sangat tinggi, sehingga memberikan keuntungan dapat menurunkan insidens penyakit influenza dan komplikasi otitis media.27 Selama tahun kedua studi, vaksin ca dapat memberikan tingkat perlindungan yang tinggi terhadap varian yang tidak mempunyai hubungan dekat dengan antigen vaksin.28 Studi pada penduduk yang diobservasi secara ketat memberi kesan bahwa pemberian kombinasi vaksin hidup dan mati dapat meningkatkan daya proteksi terhadap infeksi influenza. Dalam pelaksanaannya, pemberian vaksin hidup yang dilemahkan banyak mendapat tantangan terutama dari Pfleiderer et al,29 mereka meragukan keamanan vaksin ini. Bila vaksin ini mendapat lisensi, maka keamanan vaksin ini harus dipastikan dengan penelitian tentang akibat imunosupresif yang terjadi; respons imun humoral dan seluler yang terjadi harus diukur secara benar; stabilitas penyimpanan terhadap infektivitasnya harus diamati dengan ketat. Selain itu perlu dipastikan kemungkinan: adanya percampuran di antara galur vaksin yang dapat memberi efek terhadap respons imun seseorang; terjadinya integritas genetik virus yang tertahan sesudah mengalami replikasi di Maj Kedokt Indon, Volum: 58, Nomor: 12, Desember 2008 dalam tubuh orang yang divaksinasi; respons imun yang ditimbulkan oleh pemberian galur biang yang sama secara berulang dari tahun ke tahun hanya terbatas untuk berkembangnya imunitas terhadap enam komponen vaksin selain HA atau NA. Keamanan vaksin ini juga diragukan karena diproduksi dengan menggunakan telor ayam sehingga dapat menimbulkan reaksi alergi terhadap protein telor ayam. Selain itu barier mukosa juga mungkin dapat tembus, sehingga terjadi infeksi sekunder oleh mikroba patogen yang lain yang terdapat dalam tubuh. Yang paling berbahaya dari penggunaan vaksin virus hidup adalah bila imunisasi terjadi bersamaan dengan infeksi virus influenza liar yang virulen. Hal ini mungkin mengakibatkan terjadinya reassortment, sehingga terbentuk virus virulen baru sebagai akibat adanya mutasi drift ataupun shift. Oleh karena itu, penggunaan vaksin influenza hidup perlu dipertimbangkan secara matang.28 Vaksin yang Ditambah Adjuvan Vaksin influenza subunit dengan adjuvan MF59 (suatu emulsi squalene dalam air) dapat diberikan secara parenteral. Vaksin ini sudah mendapat lisensi di beberapa negara Eropa, tetapi tidak di Inggris. MF59 dapat meningkatkan respons antibodi hemaglutinasi inhibisi secara bermakna terhadap antigen influenza A (H3N2) dan influenza B interpandemik dan ditoleransi dengan baik terutama pada orang tua dengan penyakit kronis, walaupun ditemukan adanya sedikit reaksi lokal yang bersifat sementara dan sedikit lebih banyak dibandingkan dengan vaksin yang lain. 30 Juga dengan menambah adjuvan MF59 pada vaksin virus H5N3 A/Duck/ Singapore/97 dapat mencegah infeksi influenza unggas H5N1.31 Virosom terdiri dari bilayer phospholipids (liposom) yang mengandung protein permukaan virus yang menempel pada lapisan bilayer. Virosom sudah secara luas dievaluasi dalam berbagai populasi manusia.32 Imunisasi dengan virosom dapat menginduksi konsentrasi antibodi yang lebih tinggi, dengan rata-rata serokonversi yang lebih tinggi, serta jumlah individu dengan titer antibodi protektif yang lebih tinggi dibandingkan dengan vaksin mati yang konvensional. Vaksin ini sudah mendapat lisensi di Inggris.1,32 Kompleks perangsang imun yang mempunyai struktur menyerupai sangkar, yang aslinya membentuk kompleks antara kolesterol dan saponin, yang berasal dari pohon Quillaia saponaria. Vaksin yang mengandung saponin tertentu disebut Iscoprep 703 dapat merangsang respons antibodi serum dengan sangat cepat pada manusia dibandingkan dengan vaksin mati yang konvensional. Iscoprep 703 dapat meningkatkan proliferasi respons sel T helper dan respons sel T sitotoksik.1 Walaupun vaksin influenza yang diberikan secara intranasal dapat meningkatkan cakupan vaksin dan dapat memberikan imunitas mukosa, vaksin influenza mati yang 521 Vaksin Virus Influenza konvensional yang diberikan secara intranasal ternyata kurang berhasil dengan baik. Percobaan pada binatang membuktikan bahwa penambahan adjuvan mukosa yang berasal dari bakteri berhasil meningkatkan imunogenisitas. Beberapa vaksin tersebut yang diberikan secara intranasal telah dievaluasi secara klinis dan ternyata hasil yang diperoleh sangat menjanjikan. Satu formula semprot intranasal yang mengandung vaksin influenza subunit trivalen yang dipersiapkan dari virosom dan enterotoksin E coli tipe liar telah mendapat lisensi di Prancis. Walaupun vaksin intranasal ini memenuhi kriteria imunogenisitas yang tepat untuk lisensi ulang setiap tahun seperti vaksin influenza konvensional, tetapi lisensinya sudah dicabut karena dicurigai mempunyai reaksi ikutan, yaitu Bell‘s palsy.1 Berbagai partikel mikro saat ini sedang diteliti untuk dipakai sebagai adjuvan dan sistem pengantar yang dapat membawa antigen virus influenza secara parenteral, atau mengantarkan ke situs mukosa termasuk saluran cerna.1 Vaksin Virus dari Biakan Sel Vaksin ini mempunyai potensi untuk dapat memberikan respons dengan cepat terhadap epidemi maupun pandemi yang dapat terjadi setiap saat, dan dapat menghindari terjadinya risiko kontaminasi protein telor dan endotoksin pada vaksin yang dapat mengganggu secara biologis. Selain itu, virus influenza yang ditumbuhkan pada sel mamalia lebih menyerupai proses infeksi yang terjadi pada manusia dibandingkan dengan virus yang ditumbuhkan pada telor. Oleh karena itu, vaksin ini diperkirakan akan lebih efektif. Vaksin influenza yang dibuat dalam sel Madin Darby Canine Kidney (MDCK) dan sel monyet hijau Afrika (sel Vero) sudah mendapat lisensi di Belanda.1 Vaksin Rekombinan Vaksin subnit influenza telah dipersiapkan dari protein hemaglutinin dan neuraminidase rekombinan yang diekspresikan oleh baculovirus dalam sel serangga. Hemaglutinin rekombinan ditoleransi dengan sangat baik oleh orang dewasa muda dan tua. Terdapat efek dose response yang sangat bermakna terhadap vaksin hemaglutinin H1 dan H3. Studi fase I dan studi virus neuraminidase rekombinan yang diekspresikan baculovirus pada relawan sehat yang dinfeksi virus letal hasilnya sangat menjanjikan.1,5,34 Diperlukan pengembangan vaksin influenza yang dapat menghindari hilangnya efektivitas sebagai akibat adanya mutasi drift atau shift pada antigen virus. Protein M2 secara antigenik sangat dilindungi dan antibodi homologous terhadapnya dapat mencegah terjadinya infeksi baik in vitro maupun in vivo pada mencit.21 Genetik Terbalik/Reverse Genetic Dengan berkembangnya teknik genetik terbalik untuk virus RNA sens-negatif, maka saat ini hasil gen virus influenza sudah dapat dimanipulasi secara langsung dan virus 522 rekombinan yang baru sudah dapat dibuat. Pendekatan ini berpotensi dipakai untuk membuat vaksin interpandemi.1,5 Vaksin Asam Nukleat Vaksin DNA merupakan pendekatan baru yang sangat menjanjikan untuk vaksinasi. Penerapan temuan ini pada berbagai penyebab penyakit telah menghasilkan publikasi yang banyak dan sangat menjanjikan dipakai untuk mengembangkan vaksin DNA yang sangat berguna untuk kehidupan manusia. Vaksin ini dapat merangsang respons imun dengan batas yang sangat luas termasuk respons antibodi, respons sel T sitotoksik dan sel T helper. Vaksin DNA dengan susunan pengkode nukleoprotein, hemaglutinin, neuraminidase, protein matriks 1 (M1), dan protein nonstruktural 1 virus influenza telah dipelajari secara luas, dalam bentuk tunggal maupun kombinasi, atau dikombinasi dengan DNA yang mengkode berbagai sitokin.1,5 Beberapa tahun yang lalu Wolft et al,22 menemukan DNA plasmid rekombinan yang membawa selipan sekuens gen reporter yang dapat mengekspresikan protein asing pada tempat suntikan dalam otot hewan coba. Yang paling menarik adalah vaksin DNA dapat mengekspresikan antigen di dalam sitosol sel yang dapat mempresentasikan antigen (Antigen presenting cell, APC). Dengan demikian, fragmen antigen tersebut dapat dipresentasikan ke sistem imun oleh jalur imunologi kelas I maupun kelas II. Pentingnya vektor DNA untuk vaksin influenza A diperlihatkan oleh Liu et al dan Ulmer et al.23 Penelitian mereka memperlihatkan bahwa dalam tubuh mencit timbul respons imun seluler maupun humoral setelah mencit disuntik dengan plasmid rekombinan yang mengandung sekuens gen HA dari virus PR8 H1N1 1934 dan NP. Bila mencit ini diberi virus PR8 homologous yang virulen secara intranasal, maka mencit tersebut terlindungi/tidak sakit. Yang lebih penting lagi adalah mencit yang disuntik dengan DNA rekombinan yang mengandung protein NP, yang sangat dilindungi dari virus PR8 H1N1, hampir sepenuhnya mendapat daya lindung bila diinfeksi dengan virus pandemi H3N2 tahun 1968. Dengan keberhasilan ini, sangat mungkin untuk mengembangkan satu vaksin yang mengandung kodon NP yang sangat dilindungi sehingga dapat terhindar terhadap seluruh virus influenza A pada manusia yang ada saat ini, waktu yang lalu, dan yang akan datang.5 Penggunaan Vaksin untuk Menghadapi Pandemi Vaksin influenza konvensional tampaknya kurang imunogenik jika dipakai untuk menghadapi situasi pandemi. Untuk meningkatkan imunogenisitas vaksin, maka perlu diberikan dua dosis dan perlu ditambahkan adjuvan. Dalam menghadapi pandemi, pemberian imunisasi perlu dikombinasi dengan obat profilaksis antivirus seperti penghambat neuraminidase misalnya oseltamivir. Seandainya penyebab pandemi adalah virus influenza A subtipe H5N1, maka teknologi pembuatan vaksin secara Maj Kedokt Indon, Volum: 58, Nomor: 12, Desember 2008 Vaksin Virus Influenza konvensional tidak mampu membuat galur vaksin yang produktif dan aman. Hal ini disebabkan virus H5N1 sangat berbahaya karena sangat virulen.1 Untuk mengatasi masalah ini Li et al,33 memodifikasi gen hemaglutinin virus A/Hong Kong/97. Ya membuat serentetan delesi residu asam amino basa pada situs potong (cleavage site) penyebab virus menjadi virulens. Kemudian, dengan menggunakan teknologi genetik terbalik (reverse genetic), gen hemaglutinin yang dimodifikasi dan gen neuraminidase dari virus A/Hong Kong/ 97 tipe liar dimasukkan ke dalam virus ca A/Ann Arbor/6/60. Virus ca yang diperoleh tidak patogenik pada hewan coba, tumbuh sangat baik pada telor, dan dapat melindungi ayam dari infeksi virus yang mematikan. Virus ca ini merupakan calon galur virus vaksin yang sangat baik. Teknologi lain yang mungkin dapat memberikan hasil baik adalah teknologi DNA rekombinan untuk membuat hemaglutinin rekombinan. Tetapi, uji klinis baculovirus yang mengekspresikan hemaglutinin dari virus A/Hong Kong/97 H5N1 belum memberikan hasil baik, walaupun diberikan dua dosis 90 µg.34 Kesimpulan Virus influenza menyebar dengan sangat luas di seluruh dunia dan dapat menyebabkan penyakit pada masyarakat. Walaupun angka kematian yang ditimbulkan sangat rendah, namun imunisasi sangat penting untuk mencegah terjadinya penyakit yang dapat mengganggu kehidupan. Virus influenza sangat cepat mengalami mutasi, sehingga vaksin yang digunakan untuk mencegah harus selalu diganti. Ada berbagai jenis vaksin virus influenza yang sudah dibuat dan sudah digunakan dalam masyarakat, di antaranya vaksin hidup, vaksin mati, vaksin subunit, dan lain-lain. Saat ini pendekatan dengan teknologi baru untuk membuat vaksin sedang diteliti untuk memperoleh hasil yang lebih baik dan optimal, misalnya vaksin DNA, vaksin dengan penambahan ajuvan, dan sebagainya. Daftar Pustaka 1. 2. 3. 4. 5. 6. Nicholson KG, Wood JM, Zambon M. Influenza. Lancet. 2003; 362:1733-45. Peters PH, Gravenstein S, Norwood P, Bock VD, Couter AV, Gibbens M, et al. Long-term use of oseltamivir for the prophilaxis of influenza in vaccinated frail older population. J Am Geriatr Soc. 2001;49:1025-31. Hayden FG, Belshe R, Villanueva C, Lanno R, Hughes C, Small I, et al. Management of influenza in household: A prospective, randomised comparison of oseltamivir treatment with or without postexposure prophylaxis. J Infect Dis. 2004;189:440-9. Lamb RA, Krug RM. Orthomyxoviridae: the viruses and their replication. Dalam: Knip DM, Howley PM, penyunting. Field virology. Edisi ke-4. Philadelphia: Lippincott, Williams, and Wilkins; 2001.h.1487-531,. Hilleman M. Realities and enigmas of human viral influenza: Pathogenesis, epidemiology and control. Vaccine. 2002; 20:306887. Takada A, Kuboki N, Okasaki K, Aninomiya A, Tanaka H, Ozaki H, et al. Avirulent avian influenza as a vaccine strain against a Maj Kedokt Indon, Volum: 58, Nomor: 12, Desember 2008 7. 8. 9. 10. 11. 12. 13. 14. 15. 16. 17. 18. 19. 20. 21. 22. 23. 24. 25. potential human pandemic. J Virol. 1999;73:8303-7. Cox NJ, Subbarao K. Influenza. Lancet. 1999; 354:1277-82. Clover RD, Crawford S, Glezen WP, Taber LH. Matson CC, Couch RB. Comparison of heterotypic protection against influenza A/Taiwan/86 (H1N1) by attenuated and inactivated vaccines to A/Chile/83 like viruses. J Infect Dis. 1991;163:300-4. Hurwitz E.S, Haber M, Chang A, Shope T, Teo ST, Giesick JS, et al. Studies of the 1996-1997 inactivited influenza vaccine among children attending day care: Immunologic response, protection against infection, and clinical effectiveness. J Infect Dis. 2000; 182:1812-21. Rudenko LG, Slepuskin AN, Monto AS, Kendal AP, Grigorieva P, Burtseva EP, et al. Effecacy of attenuated and inactivated influenza vaccine in school children and their unvaccinated contacts in Novgorod, Risia. J Infect Dis. 1993;168:881-7. Edwards KM, Dupont WD, Westrich MK, Plummer WD, Palmer PS, Wright PF. A randomized control trial of cold-adapted and inactivated vaccine for the prevention of influenza A diseases. J Infect Dis. 1994;169:68-76. Wilde JA, McMillan JA, Serwint J, Butta J, O‘Ricardan MA, Steinhoff MC. Effectiveness influenza vaccine in health care professionals. JAMA. 1999;281:908-13. Govaert TME, Thijs CTMCN, Sprenger MJW, Dinant GJ, Knottmerus JA. The efficacy of influenza vaccination in elderly individual: A randomized double-blind placebo-controlled trial. JAMA. 1994;272:1661-5. Deguchi Y, TakasugiY, Tatara K. Efficacy of influenza vaccine in the elderly in welfare nursing home: Reduction in risks of mortality and morbidity during an influenza A (H3N2) epidemic. J Med Microbiol. 2000;49:553-6. Nichol KL, Baken L, Nelson A. Relation between influenza vaccination and outpatient visit, hospitalization, and mortality in elderly person with chronic lung disease. Ann. Intern Med. 1999; 130:397-403. Kilbourne ED, Arden NH. Inactivated influenza vaccine. Dalam: Plotkin SA, Orenstein WA, penyunting. Vaccines. Edisi ke-3. Philadelphia, London, Toronto, Montreal, Sydney, Tokyo: W.B. Saunders Company; 1999.h.531-51. Lasky T, Terrcciano GJ, Magder L, Koski CL, Ballesteros M, Nash D, et al. The Guilain-Bare syndrome and the 1993 and 1993-1994 influenza vaccine. N Eng J Med. 1998;339:1797802. Boulianne N, De Serres G, Duval B, Shadmani R, Rochette L. Clinical manifestation and incidence of oculorespiratory syndrome following influenza vaccination-Quebec 2000. Can Commun Dis Resp. 2001;27:85-90. Choudhri Y, Walop W, Squires S, Tam T, King A, Skowronski D, et al. ORS during the 2000-2001 influenza vaccination season. Can Commun Dis Resp. 2002;28:2-8. Barry DW, Mayner RE, Staton E, Dunlap RC, Rastogi SC, Hannah JE, et al. Comparative trial of influenza vaccines in man. Am J Epidem. 1976;104:34-46. Zebedee FL, Lamb RA. Influenza A virus M2 protein: Monoclonal antibody restriction of virus growth and detection of M2 in virus. J. Virol. 1988;62:2762-72. Wolff JA, Malone RW, Williams P, Chong W, Acsadi G, Jani A, et al. Direct gene transfer into mouse muscle, in vivo. Science. 1990;247:1465-8. Donnelly JJ, Ulmer JB, Shiver JW, Liu MA. DNA vaccine. Annu Rev Immunol. 1997;15:617-48. Ulmer JB, Donnelly JJ, Parker SE, Rhode GH, Felgner PL, Dwarki Vj, et al. Heterologous protection against influenza by injection of DNA encoding viral protein. Science 1993;259:1745-9. Kendal AP. Cold-adapted live attenuated influenza vaccines develope in Russia: can they contribute to meeting the needs for influenza control in other countries. Eur J Epidemiol. 1997;13: 591-609. 523 Vaksin Virus Influenza 26. Maassab HR, Herlocher ML, Briyant ML. Live influenza vaccine. Dalam: Plotkin SA, Orenstein WA, editor. Vaccine. Edisi ke-3. Philadelphia: Saunders; 1999.h.909-27. 27. Belshe RB, Mendelman PM, Treanor J, King J, Gruber WC, Piedra P, et al. The efficacy of live attenuated, cold-adapted, trivalent, intranasal influenza vaccine in children. N Eng J Med. 1998;338:1405-12. 28. Belshe RB, Gruber WC, Mendelmen PM, Cho I, Reisinger K, Block SL, et al. Efficacy of vaccination with lived attenuated, cold-adapted, trivalent, intranasal influenza virus vaccine against a variants (A/Sydney) not contain in the vaccine. J Pediatr. 2000;136:168-75. 29. Pfleiderer M, LÏwer J, Kurth R. Cold-atenuated live influenza vaccine, a risk-benefit assessment. Vaccine. 2002; 20:886-894. 30. Banzhoff A, Nacci P, Podda A. A new MF-59-adjuvanted influenza vaccine enhance the immune response in the elderly with chronic diseases: Results from an immunogenicity meta-analysis. Gerontology. 2003;49:177-84. 524 31. Nicholson KG, Colegatre AE, Polda A, Stephenson I, Wood J, Ypma E, et al. Safety and antigenicity of non-adjuvant and MF59 adjuvant influenza A/Duck/Singapore/97 (H5N3) vaccine: A randomized trial of two potensial vaccine against H5N1 influenza. Lancet. 2001;357:1937-43. 32. Holm KJ, Goa KL. Liposomal influenza vaccine. Biodrugs. 1999;11:137-46. 33. Li SQ, Liu CG, Klimov A. Subbarao K, Perdue ML, Mo D, et al. Recombinant influenza A virus vaccines for the pathogenic human A Hong Kong 97 (H5N1) viruses. J Infect Dis. 1999;179: 1132-8. 34. Treanor JL, Wilkinson BE, Masseoud F, Hu-Primmer J, Battaglia R, O‘Brien D, et al. Safety and immunogenicity of a recombinant haemaglutinin vaccine for H5 influenza in human. Vaccine. 2001; 19:1732-7. EV Maj Kedokt Indon, Volum: 58, Nomor: 12, Desember 2008