peluruhan radioaktif - iful06*[dot]*wordpress*[dot]
advertisement
![peluruhan radioaktif - iful06*[dot]*wordpress*[dot]](http://s1.studylibid.com/store/data/000535417_1-2830d0d135f136db47fabf24b90f0dee-768x994.png)
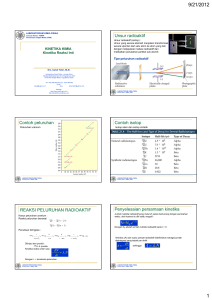
BAB V KERADIOAKTIFAN 1) Peluruhan Radioaktif Jika suatu inti terdiri atas sejumlah neutron yang tidak seimbang, inti tersebut menjadi tegang dan mempunyai kelebihan energi. Beginilah keadaan inti dan suatu atom karbon jika di dalamnya terdapat kurang dari enam atau lebih dan tujuh neutron. Inti ini tidak dapat bertahan. Suatu saat inti akan melepaskan kelebihan energi dan mungkin melepaskan satu atau dua partikel radiasi sekaligus. Satu inti karbon dengan enam proton dan enam neutron disebut sebagai karbon - 12 atau ditulis dengan simbol C-12. Angka 12 menunjukkan jumlah dari nukleon. Satu inti karbon dengan 7 neutron dapat diindentifikasi sebagai C-13. Inti karbon C12 dan C-13 mempunyai sifat stabil. Selain bentuk ini, bentuk yang lain tidak stabil. Semakin janggal jumlah neutronnya, semakin bertambah ketegangannya dan semakin cepat pula inti melepaskan kelebihan energinya dalam bentuk sinar radiasi. Satu inti karbon dengan hanya 5 neutron, atau yang disebut C-11, dapat mempertahankan kondisi/keadaan tersebut selama 20 menit. C-10 membelah dalam waktu 19 detik dan C-9 hanya dalam 1/8 detik. Lebih mudah bagi inti untuk bertahan dengan kelebihan 1 neutron. Karbon-14, inti dengan 8 neutron, dapat tetap bertahan selama beribu-ribu tahun tanpa ada masalah. Kelebihan 2 neutron menjadikan inti tidak dapat bertahan dalam waktu 2 atau 3 detik. Inti yang memiliki kelebihan 3 neutron akan meletup dalam waktu 1 detik. Gambar-gambar berikut ini memperlihatkan seluruh struktur inti suatu atom karbon, yaitu semua isotop dan karbon. Apa yang kita pelajari mengenai karbon di sini tidak hanya berlaku untuk karbon saja. Keadaan itu juga sama bagi hampir setiap elemen, baik besi atau emas, nitrogen atau oksigen, radon atau uranium. Jika jumlah neutron dalam suatu inti sesuai, inti itu stabil atau non-radioaktif. Tetapi bila jumlah neutron tidak sesuai, inti menjadi tidak stabil dan suatu saat akan melepaskan ketegangannya dengan mengeluarkan sinar radiasi. Inti yang tidak stabil mengakibatkan zat menjadi radioaktif. Setiap inti melepaskan ketegangannya dengan cara yang berbeda dan mengeluarkan energi atau partikel radiasi yang berbeda. Pada sebagian besar kasus, inti melepaskan energi elektromagnetik yang disebut radiasi gamma, yang dalam banyak hal mirip dengan sinar-X. Ia bergerak secara lurus, melemah bila membentur suatu benda. tetapi sering sebagian dari radiasi gamma menembus benda tersebut. Dalam banyak hal, inti juga melepaskan radiasi beta. Radiasi beta lebih mudah untuk dihentikan. Pelat seng biasa atau kaca dapat menghentikan semua radiasi beta. Bahkan pakaian yang kita pakai dapat melindungi dengan baik dan radiasi beta. Suatu kejadian dimana atom yang tidak stabil melepaskan kelebihan energinya disebut proses peluruhan radioaktif. Inti yang ringan dengan sedikit nukleon menjadi stabil setelah hanya mengalami I (satu) kali proses peluruhan. Tetapi inti yang berat mengandung ratusan nukleon. Apabila inti berat mengalami peluruhan. ada kemungkinan inti tersebut tetap tidak stabil. Oleh karena itu, kondisi stabil dapat dicapai setelah beberapa kali peluruhan. Jika jumlah proton berubah selama proses peluruhan, elemen tersebut akan berubah menjadi elemen lain. Contohnya, uranium U-238 (terdiri atas 92 proton dan 146 neutron) selalu melepaskan 2 proton dan 2 neutron ketika sedang meluruh. Setelah mengalami satu kali proses peluruhan jumlah protonnya menjadi 90. Tetapi elemen dengan 90 proton disebut torium. Inti torium ini juga tidak stabil dan akan berubah menjadi protaktinium setelah proses peluruhan berikutnya. Kemudian, inti ini juga akan berubah menjadi inti lain. Pada akhirnya menjadi inti stabil, yaitu inti timah hitarn yang akan dihasilkan setelah peluruhan ke 14. KERADIOAKTIFAN ALAM Terjadi secara spontan Misalnya: 92238 U ® 224 90 Th + 24 He 1. Jenis peluruhan a. Radiasi Alfa - terdiri dari inti 24 He - merupakan partikel yang massif - kecepatan 0.1 C - di udara hanya berjalan beberapa cm sebelum menumbuk molekul udara b. Radiasi Beta - terdiri dari elektron -10 e atau -10 beta - terjadi karena perubahan neutron 01 n ® - di udara kering bergerak sejauh 300 cm 1 1 p + -10 e c. Radiasi Gamma - merupakan radiasi elektromagnetik yang berenergi tinggi - berasal dari inti - merupakan gejala spontan dari isotop radioaktif d. Emisi Positron - terdiri dari partikel yang bermuatan positif dan hampir sama dengan elektron - terjadi dari proton yang berubah menjadi neutron 1 1 p ® 1 0 n + +10 e e. Emisi Neutron - tidak menghasilkan isotop unsur lain 2. Kestabilan inti 1. Pada umumnya unsur dengan nomor atom lebih besar dari 83 adalah radioaktif. 2. Kestabilan inti dipengaruhi oleh perbandingan antara neutron danproton di dalam inti. isotop dengan n/p di atas pita kestabilan menjadi stabil dengan memancarkan partikel beta. isotop dengan n/p di bawah pita kestabilan menjadi stabil dengan menangkap elektron. emisi positron terjadi pada inti ringan. penangkapan elektron terjadi pada inti berat. 3. Deret keradioaktifan Deret radioaktif ialah suatu kumpulan unsur-unsur hasil peluruhan suatu radioaktif yang berakhir dengan terbentuknya unsur yang stabil. a. Deret Uranium-Radium Dimulai dengan 92 238 U dan berakhir dengan 82 206 Pb b. Deret Thorium Dimulai oleh peluruhan 90 232 Th dan berakhir dengan 82 208 Pb c. Deret Aktinium Dimulai dengan peluruhan 92 235 U dan berakhir dengan 82 207 Pb d. Deret Neptunium Dimulai dengan peluruhan Bi 93 237 Np dan berakhir dengan 83 209 Di alam, kita dapat menemukan beberapa contoh inti berat yang dapat mencapai kondisi stabil setelah melalui masa peluruhan yang panjang. Inilah salah satu alasan mengapa lingkungan mengandung banyak sekali bahanbahan radioaktif alam. Pada suatu mata rantai peluruhan tertentu, unsur yang dihasilkan adalah radium. Radium adalah logam. seperti unsur-unsur pada awal mulainya peluruhan. Tetapi, yang mengherankan sewaktu radium meluruh, unsur ini berubah menjadi bahan yang bersifat gas yang disebut radon. Bahanbahan lain dari proses peluruhan tetap berada di dalam bumi, tetapi gas radon bergerak menuju ke permukaan bumi. Pada saat mencapai permukaan bumi ia menyebar ke segala arah dan membaur. Dalam hal ini gas radon tidak membahayakan sama sekali. Tetapi, jika ada sebuah rumah tepat berada di suatu tempat dirnana gas radon mencapai permukaan bumi, gas radon akan masuk ke dalam rumah itu dan tidak akan bercampur dengan udara luar. Konsentrasi radon dalam udara yang kita hirup di dalam rumah mungkin ratusan, bahkan ribuan kali lebih tinggi daripada yang ada di luar rumah. Apabila kita menghirup udara, atom-atom radon masuk ke dalam paru-paru. Hal yang sama terjadi pada setiap bahan yang dihasilkan selama peluruhan radon, yang juga bersifat radioaktif. Akibatnya, paru-paru terkena radiasi. Ada beberapa faktor lain yang mempengaruhi adanya paparan oleh radon, seperti kandungan partikel udara dalam rumah, bahan-bahan bangunan yang digunakan (yang juga mengeluarkan radon) dan juga gedung di tempat kita tinggal. Akibat dari gas radon, banyak orang yang pekerjaannya berhubungan dengan radiasi menerima dosis radiasi lebih tinggi di rumah daripada di tempat kerja. Dalam berpuluh-puluh ribu rumah, para penghuninya menerima dosis radiasi beberapa kali lipat dari batas dosis yang direkomendasikan bagi para pekerja di industri, pembangkit tenaga nuklir dan fasilitas perawatan dengan sinar-X. Radioaktivitas Alam Inti Kestabilan inti • Inti stabil • Inti tidak stabil menjadi stabil ( berubah secara spontan). Unsur RA U 238 yang langsung dari lam digunakan sebagai bahan bakar 100 gr U238 = 99,3 % U238 + 0,7% U235 Unsur – Unsur RA di alam : 40 K T1/2 = 1,28 x 109 th 87 Rb T1/2 = 4,8 x 1010 th 113 Cd T1/2 = 9 x 1015th Unsur radioaktif yang dihasilkan secara kontinu dalam atmosfer bumi sebagai hasil reaksi molekul udara dengan partikel berenergi tinggi yang dikaenal dengan sinar kosmik (14C ). Penentuan Umur Radiometrik Sinar kosmik inti atomik berenergi tinggi ( proton) masuk ke atmosfer sehingga terjadi tumbukan dengan partikel sekunder menghasilkan netron. Netron tersebut kemudian bereaksi dengan Nitrogen di udara ( 147 N ) Reaksi : 14 7 N 1 + 0 n 6 C 1 H 14 1 Setelah dihasilkan di atmosfer, karbon membentuk CO2 radioaktif yang kemudian diserap oleh tumbuhan dan dimakan oleh konsumen-konsumen di atasnya (manusia dan hewan). Radiokarbon Mengukur kandungan 14 C dalam tanaman diambil sampel diuapkan dan diambil uapnya (gas) CO2 yang kemudian dimasukkan ke dalam indikator ”pekabeta”. R = Ro e t T= Dimana : 1 ln Ro R Ro = aktivitas sample masih hidup. R = aktivitas sample yang sudah mati. Gambar 1. Detektor Peka-Beta Detektor peka-beta adalah sebuah alat yang dipergunakan untuk mengamati hasil dari aktivitas peluruhan beta yang terjadi pada sample radioaktif. Secara bahasa detektor adalah : Alat yang peka terhadap radiasi, menghasilkan sinyal respons yang dapat diukur atau dianalisis. Radioisotop Membandingkan penjumlahan inti mula-mula yang ada pada sampel karang, tunggu sampai inti meluruh sampai stabil membentuk (Pb206). Pb206 yang terbentuk dikonversikan dengan 238 U (inti mula-mula). Dalam 25 tahun, 1206Pb yang diperkirakan terbentuk. Keradioaktif Buatan Merupakan perubahan inti yang terjadi karena ditembak oleh partikel. Prinsip penembakan: Jumlah nomor atom sebelum penembakan = jumlah nomor atom setelah penembakan. Jumlah nomor massa sebelum penembakan = jumlah nomor massa setelah penembakan. Misalnya: 7 14 N+ 4 2 He ® 8 17 O + 11 p RUMUS k = (2.3/t) log (No/Nt) k = tetapan laju peluruhan k = 0.693/t1/2 t = waktu peluruhan t = 3.32 . t1/2 . log No/Nt No = jumlah bahan radioaktif mula-mula Nt = jumlah bahan radioaktif pada saat t t1/2 = waktu paruh RINGKASAN 1. Kestabilan inti: umumnya suatu isotop dikatakan tidak stabil bila: a. n/p > (1-1.6) b. e > 83 e = elektron n = neutron p = proton 2. Peluruhan radioaktif: a. Nt = No . e-1 b. 2.303 log No/Nt = k . t c. k . t1/2 = 0.693 d. (1/2)n = Nt/No t1/2 x n = t No = jumiah zat radioaktif mula-mula (sebelum meluruh) Nt = jumiah zat radioaktif sisa (setelah meluruh) k = tetapan peluruhan t = waktu peluruhan t1/2 = waktu paruh n = faktor peluruhan Contoh: 1. Suatu unsur radioaktif mempunyai waktu paruh 4 jam. Dari sejumlah No unsur tersebut setelah 1 hari berapa yang masih tersisa ? Jawab: t1/2 = 4 jam ; t= 1 hari = 24 jam t1/2 x n = t ® n = t/t1/2 = 24/4 = 6 (1/2)n = Nt/No ® (1/2)6 = Nt/No ® Nt = 1/64 No 2. 400 gram suatu zat radioaktif setelah disimpan selama 72 tahun ternyata masih tersisa sebanyak 6.25 gram. Berapakah waktu paruh unsur radioaktif tersebut ? Jawab: No = 400 gram Nt = 6.25 gram t = 72 tahun (1/2)n = Nt/No = 6.25/400 = 1/64 = (1/2)6 n = 6 (n adalah faktor peluruhan) t = t1/2 x n ® t1/2 = t/n = 72/6 = 12 tahun