pendahuluan - WordPress.com
advertisement

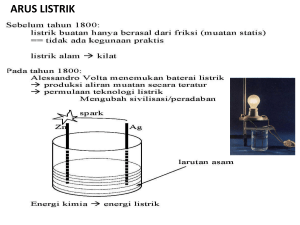
PENDAHULUAN 1. LATAR BELAKANG Di dalam kehidupan kita bahwa terdapat beberapa hal yang berkaitan langsung dengan kita yang ada hubungannya dengan kimia. Seperti batu batrai, disk player, stavol, dll. Beberapa benda yang telah disebutkan di atas merupakan hasil olah dari suatu reaksi kimia. Oleh karena itu, perlu adanya suatu pengamatan dan pencarian informasi baik secara langsung melihat benda itu maupun mempelajari teori-teorinya untuk memperdalam hazanah ilmu pengetahuan kita. Sehingga diharapkan kita tidak mudah heran dengan suatu reaksi yang tidak pernah kita bayangkan akan seperti yang kita lihat. 2. RUMUSAN MASALAH 1. Apakah konsep dasar reaksi kimia? 2. Apakah yang dimaksud dengan reaksi asam basa? 3. Apakah yang dimaksud dengan reaksi oksidasi reduksi? 4. Jelaskan konsep bilangan oksidasi? 5. Apakah yang dimaksud dengan reaksi redoks? 6. Berikan contoh reaksi redoks di sekitar kita! 1 PEMBAHASAN 1. KONSEP DASAR REAKSI KIMIA Reaksi kimia adalah suatu proses dimana zat-zat baru yaitu hasil reaksi, terbentuk dari beberapa zat aslinya, yang disebut pereaksi. Biasanya suatu reaksi kimia disertai oleh kejadian-kejadian fisis, seperti perubahan warna, pembentukan endapan, atau timbulnya gas. Lambang-lambang yang menyatakan suatu reaksi kimia disebut persamaan kimia. Dalam penulisan persamaan reaksi diperlukan tiga langkah : a. Nama-nama pereaksi dan hasil reaksi ditulis, hasilnya disebut sebuah persamaan sebutan. Contoh : nitrogen oksida + oksigen→ b. Nitrogen dioksida Sebagai penggantin nama zat dipergunakan rumus-rumus kimia. Hasilnya disebut persamaan kerangka. Contoh : No + O2→No2 c. Persamaan kerangka kemudian di kesetimbangan, yang menghasilkan persamaan kimia. Contoh : 2No + O2→2 No2 Hubungan kuantitatif antara pereaksi dan hasil reaksi dalam suatu persamaan kimia berimbang menmberikan dasar staikiometri. Perhitungan staikiomentri mengharuskan penggunaan bobot atom unsur dan bobot molekul senyawa. Banyaknya suatu hasil reaksi tertentu yang menurut perhitungan akan diperoleh dalam suatu reaksi kimia rendemen teoritis untuk suatu reaksi kimia. Penting untuka mengetahui mana yang merupakan pereaksi pembatas yakni pereaksi yang secara teoritis dapat bereaksi sampaihabis, sedangkan pereaksi-pereaksi lain berlebih. (Keenan, 1984) 2. REAKSI ASAM BASA Di tahun 1923 ketika Bronsted dan Lowry mengusulkan teori asam-basanya, Lewis juga mengusulkan teori asam basa baru juga. Lewis, yang juga mengusulkan teori 2 oktet, memikirkan bahwa teori asam basa sebagai masalah dasar yang harus diselesaikan berlandaskan teori struktur atom, bukan berdasarkan hasil percobaan. Semua zat yang didefinisikan sebagai asam dalam teori Arrhenius juga merupakan asam dalam kerangka teori Lewis karena proton adalah akseptor pasangan elektron . Dalam reaksi netralisasi proton membentuk ikatan koordinat dengan ion hidroksida. H+ + OH- H2O (9.30) Situasi ini sama dengan reaksi fasa gas yang pertama diterima sebagai reaksi asam basa dalam kerangka teori Bronsted dan Lowry. HCl(g) + NH3(g) NH4Cl(s) (9.31) Dalam reaksi ini, proton dari HCl membentuk ikatan koordinat dengan pasangan elektron bebas atom nitrogen. Keuntungan utama teori asam basa Lewis terletak pada fakta bahwa beberapa reaksi yang tidak dianggap sebagai reaksi asam basa dalam kerangka teori Arrhenius dan Bronsted Lowry terbukti sebagai reaksi asam basa dalam teori Lewis. Sebagai contoh reakasi antara boron trifluorida BF3 dan ion fluorida F-. BF3 + F-–> BF4- … (9.32) Reaksi ini melibatkan koordinasi boron trifluorida pada pasangan elektron bebas ion fluorida. Menurut teori asam basa Lewis, BF3 adalah asam. Untuk membedakan asam semacam BF3 dari asam protik (yang melepas proton, dengan kata lain, asam dalam kerangka teori Arrhenius dan Bronsted Lowry), asam ini disebut dengan asam Lewis. Boron membentuk senyawa yang tidak memenuhi aturan oktet, dan dengan demikian adalah contoh khas unsur yang membentuk asam Lewis. Karena semua basa Bonsted Lowry mendonasikan pasangan elektronnya pada proton, basa ini juga merupakan basa Lewis. Namun, tidak semua asam Lewis adalah asam Bronsted Lowry sebagaimana dinyatakan dalam contoh di atas. 3 Dari ketiga definisi asam basa di atas, definisi Arrhenius yang paling terbatas. Teori Lewis meliputi asam basa yang paling luas. Sepanjang yang dibahas adalah reaksi di larutan dalam air, teori Bronsted Lowry paling mudah digunakan, tetapi teori Lewis lah yang paling tepat bila reaksi asam basa melibatkan senyawa tanpa proton. 3. REAKSI OKSIDASI REDUKSI Redoks (singkatan dari reaksi reduksi/oksidasi) adalah istilah yang menjelaskan berubahnya bilangan oksidasi (keadaan oksidasi) atom-atom dalam sebuah reaksi kimia. Hal ini dapat berupa proses redoks yang sederhana seperti oksidasi karbon yang menghasilkan karbon dioksida, atau reduksi karbon oleh hidrogen menghasilkan metana(CH4), ataupun ia dapat berupa proses yang kompleks seperti oksidasi gula pada tubuh manusia melalui rentetan transfer elektron yang rumit. Istilah redoks berasal dari dua konsep, yaitu reduksi dan oksidasi. Ia dapat dijelaskan dengan mudah sebagai berikut: Oksidasi menjelaskan pelepasan elektron oleh sebuah molekul, atom, atau ion Reduksi menjelaskan penambahan elektron oleh sebuah molekul, atom, atau ion. Walaupun cukup tepat untuk digunakan dalam berbagai tujuan, penjelasan di atas tidaklah persis benar. Oksidasi dan reduksi tepatnya merujuk pada perubahan bilangan oksidasi karena transfer elektron yang sebenarnya tidak akan selalu terjadi. Sehingga oksidasi lebih baik didefinisikan sebagai peningkatan bilangan oksidasi, dan reduksi sebagai penurunan bilangan oksidasi. Dalam prakteknya, transfer elektron akan selalu mengubah bilangan oksidasi, namun terdapat banyak reaksi yang diklasifikasikan sebagai "redoks" walaupun tidak ada transfer elektron dalam reaksi tersebut (misalnya yang melibatkan ikatan kovalen). Reaksi non-redoks yang tidak melibatkan perubahan muatan formal (formal charge) dikenal sebagai reaksi metatesis. 4 4. KONSEP BILANGAN OKSIDASI Dengan bilangan oksidasi akan mempermudah dalam pengerjaan reduksi atau oksidasi dalam suatu reaksi redoks. Kita akan membuat contoh dari Vanadium. Vanadium membentuk beberapa ion, V2+ dan V3+. Bagaimana ini bisa terjadi? Ion V2+ akan terbentuk dengan mengoksidasi logam, dengan memindahkan 2 elektron: Vanadium kini disebut mempunyai biloks +2. Pemindahan satu elektron lagi membentuk ion V3+: Vanadium kini mempunyai biloks +3. Pemindahan elektron sekali lagi membentuk bentuk ion tidak biasa, VO2+. Biloks vanadium kini adalah +4. Perhatikan bahwa biloks tidak didapat hanya dengan menghitung muatan ion (tapi pada kasus pertama dan kedua tadi memang benar). Bilangan oksidasi positif dihitung dari total elektron yang harus dipindahkan-mulai dari bentuk unsur bebasnya. Vanadium biloks +5 juga bisa saja dibentuk dengan memindahkan elektron kelima dan membentuk ion baru. Setiap kali vanadium dioksidasi dengan memindahkan satu elektronnya, biloks vanadium bertambah 1. Sebaliknya, jika elektron ditambahkan pada ion, biloksnya akan turun. Bahkan dapat didapat lagi bentuk awal atau bentuk bebas vanadium yang memiliki biloks nol. 5 Bagaimana jika pada suatu unsur ditambahkan elektron? Ini tidak dapat dilakukan pada vanadium, tapi dapat pada unsur seperti sulfur. 5. REAKSI REDOKS Senyawa-senyawa yang memiliki kemampuan untuk mengoksidasi senyawa lain dikatakan sebagai oksidatif dan dikenal sebagai oksidator atau agen oksidasi. Oksidator melepaskan elektron dari senyawa lain, sehingga dirinya sendiri tereduksi. Oleh karena ia "menerima" elektron, ia juga disebut sebagai penerima elektron. Oksidator bisanya adalah senyawa-senyawa yang memiliki unsur-unsur dengan bilangan oksidasi yang tinggi (seperti H2O2, MnO4−, CrO3, Cr2O72−, OsO4) atau senyawa-senyawa yang sangat elektronegatif, sehingga dapat mendapatkan satu atau dua elektron yang lebih dengan mengoksidasi sebuah senyawa (misalnya oksigen, fluorin, klorin, dan bromin). Senyawa-senyawa yang memiliki kemampuan untuk mereduksi senyawa lain dikatakan sebagai reduktif dan dikenal sebagai reduktor atau agen reduksi. Reduktor melepaskan elektronnya ke senyawa lain, sehingga ia sendiri teroksidasi. Oleh karena ia "mendonorkan" elektronnya, ia juga disebut sebagai penderma elektron. Senyawa-senyawa yang berupa reduktor sangat bervariasi. Unsur-unsur logam seperti Li, Na, Mg, Fe, Zn, dan Al dapat digunakan sebagai reduktor. Logamlogam ini akan memberikan elektronnya dengan mudah. Reduktor jenus lainnya adalah reagen transfer hidrida, misalnya NaBH4 dan LiAlH4), reagen-reagen ini digunakan dengan luas dalam kimia organik[1][2], terutama dalam reduksi senyawasenyawa karbonil menjadi alkohol. Metode reduksi lainnya yang juga berguna melibatkan gas hidrogen (H2) dengan katalis paladium, platinum, atau nikel, Reduksi katalitik ini utamanya digunakan pada reduksi ikatan rangkap dua ata tiga karbonkarbon. 6. REAKSI REDOKS DI SEKITAR KITA Sel Volta ( Sel Galvani ) Sel elektrokimia di mana reaksi oksidasi-reduksi spontan terjadi dan menghasilkan beda potensial disebut sel galvani. Dalam sel galvani energy kimia 6 diubah menjadi energi listrik. Sel galvani juga sering disebut Sel Volta. Contoh sel galvani adalah baterai. Terkadang perubahan kimia yang terjadi dalam sel galvani dapat dilihat dengan mudah, seperti sel galvani magnesium-tembaga yang ditunjukkan Gambar 1. Karena magnesium lebih mudah teroksidasi daripada tembaga, magnesium melepaskan elektron dan teroksidasi, membentuk ion Mg2+. Potensial anoda magnesium menjadi lebih negatif karena meningkatnya tekanan listrik dari elektron yang lepas. Pada saat yang sama, ion Cu2+ menangkap elektron dari elektroda tembaga dan direduksi ke logam tembaga. Potensial elektroda tembaga menjadi lebih positif karena tekanan listrik turun pada saat elektron dipindahkan dari katoda. Jika kabel dihubungkan pada kedua elektroda, arus mengalir dari elektroda magnesium ke elektroda tembaga, dan voltmeter pada rangkaian luar akan menunjukkan voltase 2,696 V. Energi yang dilepaskan sel dapat digunakan untuk menyalakan radio dengan menghubungkan kabel dari elektroda ke radio. Reaksi keseluruhan sel tembagamagnesium ini adalah reaksi redoks. Mg(s) + Cu2+(aq) Mg2+(aq) + Cu(s) 7 Apakah fungsi jembatan garam? Ketika setengah reaksi berlanjut, ion- ion magnesium dilepaskan ke larutan pada anoda, dan ion-ion tembaga pindah ke katoda. Ion-ion harus bisa bergerak bebas antara kedua elektroda untuk menetralkan muatan positif (kation Mg2+) yang dihasilkan pada anoda dan muatan negatif (anion) yang tertinggal pada katoda. Larutan ion-ion dalam jembatan garam dapat menetralkan muatan positif dan negatif dalam larutan dan mencegah timbulnya kelebihan muatan pada elektroda. Reaksi redoks yang sama terjadi jika logam magnesium diletakkan langsung dalam larutan tembaga sulfat, dengan reaksi yaitu: Mg + Cu2+ Mg2+ + Cu. Akan tetapi, ini bukan sel galvani karena elektron tidak mengalir melalui rangkaian luar. Elektron bergerak langsung dari logam magnesium ke ion-ion tembaga, membentuk logam tembaga. Ini adalah cara membuatlogam tembaga dari ion-ion tembaga, tapi tidak untuk membangkitkan tenaga listrik. 8 PENUTUP 1. KESIMPULAN Beberapa perubahan yang merupakan suatu bentuk reaksi kimia dalam kehidupan sehari-hari pada dasarnya ada yang menguntungkan bagi manusia. Namun apa bila salah meletakkan takaran pada suatu perubahan, maka akan menyebabkan terjadinya kerusakan bahkan membahayakan kehidupan manusia. Seperti halnya yang terjadi di Jepang akhir-akhir ini, terjadi dampak tsunami menyebabkan bocornya gudang kimia terbesar di Negara tersebut, mengakibatkan kekhawatiran bagi seluruh wilayah/Negara-negara di sekitarnya. 2. SARAN Sebagai pelajar yang sedang menuntut ilmu tentunya kita sangat banyak belum menemukan hal-hal yang berkaitan dengan pembahasan di makalah ini. Oleh karena itu, penulis sangat mengharap kita semua tidak hanya puas dengan materi ini saja, marilah kita mencoba mencari lagi dan menguak ilmu ini agar kita tidak termasuk dalam orang-orang yang mudah heran dengan sesuatu perubahan kimia. 9 DAFTAR PUSTAKA http://www.chem-is ry.org/materi_kimia/kimia_dasar/asam_dan_basa/teori-asambasa/ Hudlický, Miloš (20 Maret 1996). Reductions in Organic Chemistry. Washington, D.C.: American Chemical Society. hlm. 429. ISBN 0-8412-3344-6. Hudlický, Miloš (20 Maret 1990). Oxidations in Organic Chemistry. Washington, D.C.: American Chemical Society. hlm. 456. ISBN 0-8412-1780-7. "gutier.doc". http://www.bioscience.org/2000/v5/d/gutier/gutier.pdf. Diakses pada 30 Juni 2008. 10