Uploaded by
kim1998
Aktivitas Antioksidan Citrullus colocynthis dan Artemisia absinthium
advertisement

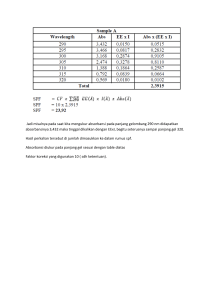
Nama : Friskila Agnesia Dora Nim : 1606015037 ANTIOKSDAN IN VITRO DAN KAPASITAS PENGAMBILAN RADICAL DARI CITRULLUS COLOCYNTHES (L) DAN ARTEMISIA ABSINTHIUM MENGGUNAKAN EKSTRAKSI KATION RADIKAL PROMETHAZINE HIDROKLORIDA DAN PENGUJIAN KONTEMPORER M. Nadeem Asghar, I. Ullah Khan and N. Bano Metodologi Penelitian Protokol pengujian: pengujian dekolorisasi kation radikal promethazine hidroklorida. Satu mL larutan stok PMZH (0,75 mM) dicampur secara menyeluruh dengan 0,5 mL (1 mM) K2S2O8 dan 3 mL asam fosfat (H3PO4). Setelah 1 jam inkubasi pada 25 C, pembacaan absorbansi larutan disesuaikan menjadi 0,7 ±0,02 pada 515 nm dengan bantuan asam ortofosfat. Tidak ada perubahan yang berarti dalam absorbansi larutan ini yang dicatat untuk periode 2 bulan pada suhu 4 C dan dapat digunakan untuk penentuan aktivitas antioksidan total. Untuk aktivitas antioksidan dari ekstrak tumbuhan dan antioksidan standar, sampel diencerkan dalam pelarut yang tepat sedemikian rupa sehingga setelah penambahan 10 mL sampel menjadi 2,99 mL larutan kation radikal PMZH, 20-60% penghambatan (% Iat 515 nm) dari yang kosong diproduksi. Penghambatan persentase ditentukan sebagai% Iat 515 nm ¼ (1 - Af / Ao)x100, di mana Ao adalah absorbansi pada 515 nm dari solusi kation radikal bebas, sedangkan Af adalah absorbansi setelah penambahan sampel antioksidan. Absorbansi dimonitor selama 8 menit setelah penambahan larutan antioksidan. Semua pengukuran dilakukan dalam rangkap tiga pada setiap konsentrasi sampel standar dan pelarut, dengan blanko pelarut yang tepat digunakan untuk setiap pengujian. Kapasitas antioksidan setara Trolox (TEAC) dari sampel ditentukan dengan perbandingan dengan kurva standar trolox. Uji dekolorisasi kation radikal ABTSþ. Protokol pengujian kation radikal ABTS (ABTSþ), sebagaimana dikembangkan oleh Re et al. (1999), dengan perubahan kecil diikuti untuk penentuan TEAC sampel. Secara singkat, ABTS dilarutkan dalam air suling ganda hingga konsentrasi 7-mM. ABTSþ diproduksi dengan mereaksikan larutan stok ABTS dengan 2,45 mM K2S2O8 (konsentrasi akhir) dan memungkinkan campuran tersebut tetap gelap pada suhu kamar selama 12-16 jam sebelum digunakan. Untuk mempelajari aktivitas antioksidan dari antioksidan standar dan sampel tanaman, larutan ABTS diencerkan dengan buffer phosphate saline saline (PBS) (pH 7,4) hingga absorbansi 0,70 ± 0,02 pada 734 nm dan diseimbangkan pada 25 C. Untuk ekstrak herbal, pengenceran dibuat dalam pelarut organik masing-masing yang telah diekstraksi dari suspensi berair. Setelah penambahan 10 mL sampel rapi atau diencerkan (sebagaimana diperlukan) menjadi 2,99 mL larutan ABTSþ encer (A ¼ 0,700± 0,020), absorbansi dicatat pada 25C, dengan interval 1 menit selama 8 menit. Kosong pelarut dijalankan di setiap pengujian untuk pembacaan yang akurat. Semua penentuan dilakukan setidaknya tiga kali berturut-turut, dan rangkap tiga pada setiap tingkat konsentrasi standar yang terpisah. Persentase penghambatan absorbansi dihitung dengan rumus berikut. % Inhibition (at 734 nm) = (1-Af/Ao) x 100 dimana Ao adalah absorbansi larutan kation radikal sebelum penambahan sampel / antioksidan standar dan Af adalah absorbansi setelah penambahan sampel / antioksidan standar. Data yang dihasilkan diplot antara konsentrasi antioksidan dan trolox untuk kurva referensi standar. Uji kadar fenolik total. Total konten fenolik ekstrak ditentukan menggunakan metode yang dikembangkan oleh Slinkard dan Singleton (1977). Larutan stok asam galat dibuat dengan melarutkan 0,5 g asam galat dalam 10 mL etanol dalam labu ukur 100 mL dan diencerkan dengan volume dengan air suling ganda. Larutan natrium karbonat dibuat dengan melarutkan 200 g natrium karbonat anhidrat dalam 800 mL air suling ganda. Setelah mendidih dan selanjutnya mendinginkan larutan, beberapa kristal natrium karbonat ditambahkan. Solusinya dibiarkan selama 24 jam, disaring dan volume dinaikkan menjadi 1 L dengan air suling ganda. Untuk menyiapkan kurva kalibrasi, 0, 1, 2, 3, 5 dan 10 mL larutan stok fenol ditambahkan ke dalam 100 mL labu volumetrik secara terpisah dan kemudian diencerkan ke volume dengan air suling ganda. Solusi yang dihasilkan mengandung konsentrasi 0, 50, 100, 150, 250 dan 500 mg / L asam galat. Dari setiap solusi kalibrasi dan sampel atau kosong, 40 mL dipipet ke dalam kuvet terpisah dan masing-masing 3,16 mL air suling ganda ditambahkan. Reagen Folin - Ciocalteu (200 mL) ditambahkan dan dicampur dengan baik. Setelah 8 menit, 600 mL larutan natrium karbonat dicampur secara menyeluruh dalam larutan. Larutan didiamkan pada suhu 40 C selama 30 menit dan absorbansi setiap larutan dicatat pada 765 nm terhadap blanko (tanpa larutan fenolik). Oleh karena itu diperoleh plot linear konsentrasi dan absorbansi. Konsentrasi total senyawa fenolik dari setiap fraksi AS, AL, CP, CPP dalam miligram setara asam galat (GAE) ditentukan dengan menggunakan persamaan standar berikut. Absorbance = 0,118x + 0:0824 Gallic acid mg/l) Total konten flavonoid. Total kandungan flavonoid ditentukan menggunakan metode kolorimetri yang dijelaskan oleh Dewanto et al. (2002). Secara singkat, 0,25 mL ekstrak tumbuhan atau larutan standar quercetin dicampur dengan 1,25 mL air suling dalam tabung reaksi diikuti dengan penambahan 75 mL larutan natrium nitrit 5% (NaNO2) 5%. Setelah 5 menit, 150 mL larutan aluminium triklorida heksahidrat (AlCl3 6H2O) 10% ditambahkan dan didiamkan selama 6 menit. Sebanyak 0,5 mL larutan 1 M natrium hidroksida (NaOH) ditambahkan dan volume campuran dinaikkan menjadi 2,5 mL dengan air suling dan dicampur dengan baik. Absorbansi diukur segera terhadap blanko pada 510 nm dan dibandingkan dengan kurva standar quercetin. Isi flavonoid dinyatakan sebagai miligram setara quercetin per gram residu. Daya antioksidan pereduksi besi. Pengurangan kapasitas ekstrak tanaman diukur menurut metode Benzie dan Strain (1999). Larutan ferricreducedantantantantantantantantantantantionantion (FRAP) mengandung 25 mL buffer 300 mM asetat (pH 3,6), 2,5 mL larutan 10 mM TPTZ dalam larutan 40 mM asam klorida (HCl) dan 2,5 mL larutan ferric chloride 20 mM. Campuran diinkubasi pada suhu 37C selama periode pemantauan. Sebanyak 3 mL reagen FRAP dicampur dengan 100 mL sampel dan 300 mL air suling. Pembacaan absorbansi diambil pada 593 nm setelah setiap menit selama 6 menit. Hasil dibandingkan dengan kurva standar ferrous sulfate. 2, 20 -diphenyl-1-picrylhydrazyl uji kapasitas radikal-scavenging. Aktivitas pembasmi radikal bebas DPPH ditemukan menggunakan metode yang dilaporkan sebelumnya (Shimada et al., 1992). Secara singkat, larutan DPPH (3 mL, 25 mg / L) dalam metanol dicampur dengan volume yang sesuai dari larutan sampel yang rapi atau diencerkan. Kemajuan reaksi campuran dipantau pada 517 nm selama periode 40 menit. Setelah reduksi yang tepat, warna ungu larutan berubah menjadi diphenylpicrylhydrazine kuning. Persentase sisa DPPH (% DPPHrem) dihitung sebagai: di mana [DPPH] t ¼ 0 adalah konsentrasi radikal DPPH sebelum bereaksi dengan sampel antioksidan dan [DPPH] t ¼ t adalah konsentrasi radikal DPPH setelah reaksi dengan sampel antioksidan pada waktu t. Kurva kinetik yang menunjukkan pembersihan radikal DPPH dalam hal penurunan absorbansi pada 517 nm sebagai fungsi waktu (min) diplot untuk setiap fraksi sampel. Nilai EC50, yang merupakan konsentrasi zat yang akan mengurangi jumlah radikal DPPH hingga setengah dari konsentrasi asli dalam kondisi eksperimental, juga ditentukan untuk setiap fraksi. Total aktivitas antioksidan dalam sistem emulsi asam linoleat dengan metode tiosianat besi. Aktivitas antioksidan total dari ekstrak air dan organik dari kedua tanaman ditentukan sesuai dengan metode yang digunakan oleh Mitsuda et al. (1996). Larutan, yang mengandung 100 mL masing-masing ekstrak tanaman yang rapi atau diencerkan dari kedua tanaman dalam 2,5 mL buffer kalium fosfat (0,04 M, pH 7,0) ditambahkan ke 2,5 mL emulsi asam linoleat dalam buffer kalium fosfat (0,04 M, pH 7.0). Setiap larutan kemudian diinkubasi pada suhu 37 C dalam botol tertutup, dalam gelap. Larutan tanpa ekstrak tambahan digunakan sebagai blanko, sedangkan larutan yang mengandung 100 mL (50 mg / 20 mL) trolox dan BHA digunakan sebagai kontrol positif. Pada interval 24 jam selama inkubasi, 0,1 mL masing-masing larutan dipindahkan ke gelas yang mengandung 3,7 mL etanol. Setelah penambahan masingmasing 0,1 mL besi (II) klorida (FeCl2; 20 mM dalam 3,5% HCl) dan larutan tiosianat (30%) ke sampel etanol, larutan diaduk selama 1 menit. Setelah inkubasi selama 5 menit pada 37 C, nilai absorpsi (nilai peroksidasi lipid) diambil pada 500 nm. Kegiatan chelating logam. Ion ferro (Feþþ) oleh ekstrak tanaman / herbal diperkirakan sesuai dengan metode yang digunakan oleh Dinis et al. (1994). 100 mL ditambahkan ke larutan 2 mM FeCl2 (0,05 mL). Reaksi dimulai dengan penambahan 5 mM ferrozine (0,2 mL) dan volume total disesuaikan menjadi 4 mL etanol. Kemudian, campuran dikocok dengan kuat dan dibiarkan berdiri pada suhu kamar selama 10 menit. Setelah campuran mencapai kesetimbangan, absorbansi larutan kemudian diukur secara spektrofotometri pada 562 nm. Hasilnya dinyatakan sebagai persentase penghambatan pembentukan kompleks ferrozine-Fe2lex. Persentase penghambatan pembentukan kompleks ferrozine-Fe2þ dihitung menggunakan rumus yang diberikan di bawah ini: di mana AControl adalah absorbansi kontrol, dan ASample adalah absorbansi dengan adanya sampel herbal / sampel. 10 µl MeOH 10 µl Sampel 2.99 ml PMZH 0,75 mM 2,99 ml PMZH 0,75 mM 10 µ Sampel 2,99 ml MeOH ingkubasi selama 8 menit Mengukur asorbansi 3.,0 ml MeOH