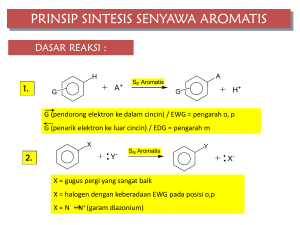
BROMOBENZENA KELOMPOK 6 Nama anggota: 1. Rani Ruhajjah 2. Anwar Fuady 3. Shofa Shofiatunnisa 4. Reni Lestari 5. Zeinhara Enggar AF (066118161) (066118162) (066118170) (066118181) (066118186) BAB 1 PENDAHULUAN 1.1 Tujuan Melakukan reaksi subtitusi elektrofilik aromatik seperti nitrasi, halogenasi, sulfanasi serta alkilasi dan asilasi Friedel-Craft. 1.2 Dasar Teori Subtitusi aromatik elektrofilik digunakan sebagai reaksi sintetik lebih meluas daripada subtitusi aromatik nukleofilik, karena bahan asalnya tidak dibatasi oleh persyaratan. (Ralp J.S Fessenden. 1986). Reaksi subtitusi merupakan suatu reaksi dimana terjadi pergantian satu atom atau gugus atom dalam suatu senyawa oleh atom atau gugus lain. (Suja & Nurlita. 2004). Awan elektron pada cincin benzen merupakan sumber elektron, namun terdapat kestabilan pada struktur cincinnya sehingga benzen hanya dapat mengalami reaksi subtitusi oleh elektrofilik. (Petrucci, Ralph H. 1985). BAB II METODE KERJA 2.1 Alat dan Bahan -Alat : 1. Batang Pengaduk 2. Corong Buchner 3. Erlenmeyer 4. Gelas piala 250ml 5. Penangas air dan es - Bahan : 1. 17 ml Air dingin 2. 0,8 ml Bromobenzen 3. 1,5 ml Asam Nitrat 4. 1,5 ml Asam Sulfat 2.2 Cara kerja Bagan Kerja 1. + 1,5 ml Asam Nitrat pekat, dinginkan di es 2. + 1,5 ml Asam Sulfat pekat, diamkan + tetes demi tetes 0,8 ml Bromobenzen 3. 4. 5. selama 10 menit + dinginkan , + 17 ml air dingin Saring endapan bromobenzen, cuci dengan air dingin Rekristalisasi dengan 8 ml etanol 6. Oven kristal BAB III HASIL DAN PEMBAHASAN 3. 1 Data Pengamatan Bagan kerja Hasil percobaan M = 1,49 x 0,8 ml = 1,192 1,192 Mol = 157 = 0,00759 b. Teoritis = 0,00759 x 157 = 1,192 g b. Percobaan = 0,6596 – 0,6170 = 0,0426 g % rendemen = 0,0426 1,192 % kesalahan = 1,192 −0,0426 1,192 96,43% x 100% = 3,75% x 100% = 3.2 Reaksi Br Br Br Br NO2 + NO2+ NO2 bromobenzena bromonitrobenzena orto 37% meta 1% NO2 para 62% 3.3 Perhitungan V bromobenzene = 0,8 ml ρ bromobenzene = 1,49 m =ρ.V = 1,49 . 0,8 ml = 1,192 Mol = 𝑚 𝑏𝑟𝑜𝑚𝑜𝑏𝑒𝑛𝑧𝑒𝑛𝑒 𝑚𝑟 𝑏𝑟𝑜𝑚𝑜𝑏𝑒𝑛𝑧𝑒𝑛𝑒 Berat teoritis = 1,192 157 = 0,00759 mol = mol x mr bromobenzene = 0,00759 x 157 = 1,192 g Berat percobaan = berat kertas saring isi – berat kertas saring kosong = 0,6596 – 0,6170 = 0,0426 g %rendemen = = % kesalahan relative = = berat percobaan 𝑏𝑒𝑟𝑎𝑡 𝑡𝑒𝑜𝑟𝑖𝑡𝑖𝑠 0,0426 x 100% 1,192 x 100% = 3,75% berat teoritis − berat percobaan 𝑏𝑒𝑟𝑎𝑡 𝑡𝑒𝑜𝑟𝑖𝑡𝑖𝑠 1,192 −0,0426 1,192 x 100% = 96,43% x 100% 3.4 Pembahasan Dalam percobaan reaksi substitusi elektrofilik ini, zat yang digunakan adalah bromobenzena dan asam nitrat pekat. Sebelum direaksikan dengan bromobenzena, asam nitrat pekat ini dicampurkan terlebih dahulu dengan H2SO4 pekat. Tujuannya adalah membentuk NO2+ sebagai hasil dari oksidasi asam nitrat pekat oleh H2SO4 pekat (oksidator) . Reaksi inilah yang dikenal dengan reaksi substitusi elektrofilik, dimana elektrofilnya adalah NO2+. Dalam lingkungan asam sulfat, asam nitrat akan terprotonkan sehingga menjadi reaktif. Mekanisme yang terjadi dalam proses pembentukan gugus elektrofil NO2+ (ion nitronium) adalah sebagai berikut. Gambar Pembentukan Gugus Elektrofil Nitro (Ion Nitronium) O H2SO4 + H O N O H O O O H O H O N NO2+ + H2O O H + HSO4- N Pada HNO3, atom oksigen yang mengandung pasangan elektron bebas menyerang H+ yang berasal dari asam sulfat atau dengan kata lain asam nitrat terprotonkan. Selanjutnya terjadi dehidrasi atau pelepasan molekul H2O sehingga dihasilkan ion nitronium (NO2+). Selanjutnya gugus elektrofil ini akan diserang oleh bromobenzena sehingga menghasilkan 3 jenis produk yang berbeda yaitu o-bromonitrobenzena, m-bromonitrobenzena, dan p-nitrobenzena yang memiliki persentase berbeda-beda yaitu sebagai berikut. Br Br Br Br NO2 + NO2+ NO2 bromobenzena bromonitrobenzena orto 37% meta 1% NO2 para 62% Gugus halogen merupakan gugus penarik elektron, dimana secara umum gugus penarik elektron adalah pengarah meta. Namun untuk gugus halogen mengalami penyimpangan karena gugus halogen memiliki pasangan elektron bebas sehingga kecenderungan berubah menjadi pengarah orto dan para. Penambahan bromobenzena dilakukan sedikit demi sedikit agar tumbukan partikel antara bromobenzena dengan gugus NO2+ lebih sempurna, Adapun tujuan dilakukannya pengocokan adalah untuk mempercepat proses reaksi dan kesempurnaan reaksi yang terjadi. . Pencucian dengan air dingin ini bertujuan untuk menghilangkan kontaminan dari kristal yang diperoleh serta mempercepat terbentuknya kristal. Penambahan etanol pada endapan yang dilanjutkan dengan pemanasan menyebabkan endapan menjadi melarut namun membentuk cairan seperti minyak yang mengapung berwarna putih kekuningan. Penambahan etanol ini bertujuan untuk mengubah produk sampingan seperti m-bromonitrobenzena, dan o-bromonitrobenzena menjadi p-bromonitrobenzena sehingga didapat kristal yang lebih murni. Filtrat yang diperoleh kemudian diuapkan dalam penangas air dengan tujuan untuk mendapatkan kristal pbromonitrobenzena yang terlarut, namun dalam percobaan tidak ditemukan kristal pbromonitrobenzena dalam filtrat. Berdasarkan percobaan didapatkan rendemen sebanyak 3,75%. Dalam hal ini dikarenakan kurang optimalnya pengadukan yang dilakukan sehingga tidak semua bromobenzene bereaksi membentuk bromonitrobenzene, kurang teliti nya dalam menjaga rentang suhu saat penambahan bromobenzene sehingga terjadi tumpukan antara elektrofilik dengan bromobenzene kurang optimal. Kemungkinan tidak semua produk minor (posisi orto dan meta) dapat berubah menjadi produk mayor (posisi para) melalui penambahan etanol sehingga rendemen menjadi kurang dari 100% BAB IV KESIMPULAN Berdasarkan percobaan yang dilakukan dapat disimpulkan yakni sebagai berikut 1. Rendemen yang dihasilkan adalah 3,75% 2. Faktor kesalahan bias terjadi saat proses pengadukan, pemanasan, serta penambahan etanol 3. Hasil produk dari reaksi ini adalah p – bromonitrobenzene dan o bromonitrobenzene DAFTAR PUSTAKA Fessenden, Ralph J & Fessenden Joan S. 1982. Kimia Organik Edisi Ketiga Jilid 1. Jakarta: Erlangga Frieda Nurlita dan I Wayan Suja. 2004. Buku Ajar Praktikum Kimia Organik. Singaraja: STKIP Singaraja Petrucci, Ralph H. 1985. Kimia Dasar Prinsip dan Terapan Modern Edisi Keempat Jilid 3. Jakarta: Erlangga