Analisis Kualtiatif dan Kuantitafi (Karbohidrat, Protein, Lipid)
advertisement

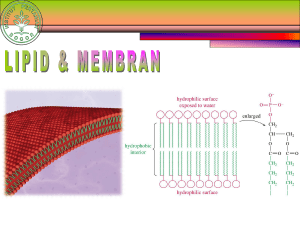
ANALISIS KUALITATIF DAN ANALISIS KUANTITATIF PADA KARBOHIDRAT, PROTEIN, DAN LIPID KARBOHIDRAT Analisis Kualitatif Karbohidrat 1. Molisch (monosakarida, disakarida dan polisakarida) Sampel + α-naftol+ H2SO4 → warna violet (ungu) (+) 2. Benedict (gula pereduksi : aldehid atau keton) Sample + camp. CuSO4, Na-Sitrat, Na2CO3 → Cu2O endapan merah bata (+) 3. Barfoed a. Sampel + camp. CuSO4 dan CH3COOH → Cu2O endapan merah bata (+) (uji monosakarida/gula pereduksi) b. Sampel + camp. CuSO4 dan CH3COOH → dipanaskan dalam air mendidih 3 menit → dinginkan + fosfomolibdat → biru (+) (membedakan reaktifitas mono, di dan poli sakarida) Analisis Kuantitatif Karbohidrat 1. Metode fisika a. Berdasarkan indeks bias, cara ini menggunakan alat refraktometer yaitu dengan rumus: X= [ ( A+B )C – BD) ] b. Berdasarkan rotasi optis, cara ini menggunakan alat polarimeter digital ( dapat diketahui hasilnya langsung) dinamakan sakarimeter. Rumusnya : [ a ] D20 = 100A L x C 2. Metode kimia a. Titrasi BSN : SNI cara uji makanan dan minuman (nomor SNI 01-2892-1992) b. Spektrofotometri Gula pereduksi + Cu2SO4 + Na-sitrat+ Na-tatrat+asam fosfomolibdat → komplek biru (diukur dg spektrofotometer pada panjang gelombang 630 nm) c. Metode Enzimatik Tepat untuk menentukan kadar gula individual (spesifik) Glukosa oksidase D-glukosa + O2 oleh glukosa oksidase → asam glukonat dan H2O2 H2O2 + O-disianidin oleh enzim peroksidase → 2H2O + O-disianidin teroksidasi yg berwarna coklat (dpt diukur pd panjang glb. 540) Heksokinase D-glukosa + ATP oleh heksokinase → glukosa-6-phosphat + ADP Glukosa-6-phosphat + NADP positip oleh glukosa-6-phosphat dehidrogenase → glukosa-6-phosphat + NADPH + H positip. Adanya NADPH yang dapat berpendar (memiliki gugus kromofor dpt diukur pada pj.glb. 334 nm, jumlah NADPH yang terbentuk setara dengan jumlah glukosa). PROTEIN Analisis Kualitatif Protein 1. Reaksi Xantoprotein Reaksi untuk melihat adanya gugus fenil pada molekul protein, gugus fenil dengan asam nitrat membentuk senyawa nitro yang berwarna kuning setelah dipanaskan. 2. Reaksii Sakaguchi Reaksi ini berdasarkan adanya gugus guanidin dengan reagensia Sakaguchi, memberikan warna merah. 3. Reaksi Millon Reaksi ini berdasarkan inti fenol bereaksi dengan reagensia Millon, memberikan warna merah. 4. Metode Biuret Reaksi ini berdasarkan adanya dua atau lebih ikatan peptida dengan reagensia Biuret memberikan warna lembayung. 5. Reaksi Natriumnitroprusida Natriumnitroprusida dalam larutan amoniak akan menghasilkan warna merah dengan protein yang mempunyai gugus –SH bebas. Jadi protein yang mengandung sistein dapat memberikan hasil positif. 6. Reaksi Hopkins – Cole Triptofan dapat berkondensasi dengan beberapa aldehida dengan bantuan asam kuat dan membentuk senyawa yang berwarna. Larutan protein yang mengandung triptofan dapat direaksikan dengan pereaksi Hopkins – Cole hingga membentuk lapisan di bawah larutan protein. Beberapa saat kemudian akan terjadi cincin ungu pada batas antara kedua lapisan tersebut. Analisis Kuantitatif Protein 1. Metode Biuret. Larutan protein dibuat alkalis dengan NaOH kemudian ditambahkan larutan CuSO4 encer. Uji ini untuk menunjukkan adanya senyawa – senyawa yang mengandung gugus amida asam. 2. Metode Lowry Protein dengan asam fosfotungstat-fosfomolibdat pada suasana alkalis akan memberikan warna biru yang intensitasnya bergantung pada konsentrasi yang ditera. Kosentrasi protein diukur berdasarkan optik density pada panjang gelombang 600 nm. 3. Metode Spektrofotometer UV Kebanyakan protein mengabsorpsi sinar ultraviolet maximum pada 280 nm. Hal ini terutama oleh adanya asam amino tirosin triptofan dan fenilalanin yang ada pada protein tersebut. 4. Metode Turbidimeter Kekeruhan akan terbentuk dalam larutan yang mengandung protein apabila ditambahkan bahan pengendap protein misalnya TCA, K4Fe(CN)6 atau asam sulfosalisilat. Tingkat kekeruhan diukur dengan alat turbidimeter. 5. Penentuan Protein dengan Titrasi Formol Larutan protein dinetralkan dengan basa NaOH, kemudian ditambahkan formalin akan membentuk dimethilol. Indikator yang digunakan adalah PP, akhir titrasi bila tepat terjadi perubahan warna menjadi merah muda yang tidak hilang dalam 30 detik. LIPID Analisis Kualitatif Lipid 1.Uji Kelarutan Lipid Tujuan : Pengujian kepolaran lipid Parameter : Lipid bersifat polar ( larut dalam air dan alkohol ) Lipid bersifat nonpolar ( larut dalam kloroform dan eter ) 2. Uji Akrolein Tujuan : Menentukan keberadaan gliserin/lemak Parametern : Bau akrolein ( seperti abu alkohol ) 3. Uji Ketidakjenuhan Lipid Parameter : Adanya reaksi positif ( berupa timbulnya warna merah saat ditetesi ion Hubs ) Asam lemak tidak jenuh adanya timbul warna merah yang semakin lama pudar. Asam lemak jenuh timbul warna merah tetapi tidak pudar 4. Uji Ketengikan Lipid Tujuan : Mengetahui oksidasi lipid Parameter : Larutan putih = tidak tengik Larutan merah muda = tengik Analisis Kuantitatif Lipid 1.Kromatografi Lapisan Tipis (TLC) Digunakan untuk memisahkan komponen-komponen atas dasar perbedaan perbedaan adsorpsi atau partisi oleh fase diam di bawah gerakan pelarut pengembang. 2. Kromatografi Cairan (HPLC) Digunakan untuk memisahkan lipida non-volatil yang memiliki berat molekul tinggi.