DAFTAR ISI BAB I........................................................
advertisement

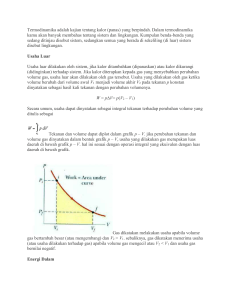
DAFTAR ISI BAB I.............................................................................................................................2 PENDAHULUAN.........................................................................................................2 A. Latar Belakang....................................................................................................2 B. Rumusan Masalah...............................................................................................3 C. Tujuan.................................................................................................................3 D. Manfaat Penulisan..............................................................................................3 BAB II...........................................................................................................................4 PEMBAHASAN............................................................................................................4 A. Hukum-Hukum Termodinaka...................................................................................4 B. Penerapan Hukum-Hukum Termodinamika.............................................................6 C. Siklus Termodinamika............................................................................................10 BAB III........................................................................................................................12 PENUTUP...................................................................................................................12 DAFTAR PUSTAKA..................................................................................................13 1 BAB I PENDAHULUAN A. Latar Belakang Semua mahluk hidup melakukan kerja.Tumbuh-tumbuhan melakukankerja ketika mengangkat air dan zat hara dari akar ke cabang-cabang dan daunnya,hewan melakukanmelakukan kerja ketika berenang,merayap, dan terbang.Kerja juga terjadi ketikapemompaan darah melalui pembuluh darah dalam tubuh dan pada pemompaan ion-ionmelewati dinding sel.Semua kerja ini diperoleh dari pengeluaran energi kimia yangdisimpan dalam makanan yang dikonsumsi oleh mahluk hidup. Termodinamika berasal dari dua kata yaitu thermal (yang berkenaan dengan panas) dan dinamika (yang berkenaan dengan pergerakan).Termodinamika adalah kajian mengenai hubungan,panas, kerja, dan energi dan secara khusus perubahan panas menjadi kerja.Hukum termodinamika pertama dan kedua dirumuskan pada abad ke-19oleh para ilmuan mengenai peningkatan efisiensi mesin uap. Bagaimanapun hukum ini merupakan dasar seperti hukum fisika lainnya.Mereka membatasi efisiensi amuba atauikan paus seperti mereka membatasi efisiensi mobil atau tenaga nuklir tumbuhan. Termodinamika memainkan peran penting dalam analisis sistem dan piranti yang ada didalamnya terjadi perpindahan formasi energi. Implikasi thermodinamika bercakupan jauh, dan penerapannya membentang ke seluruh kegiatan manusia. Bersamaan dengan sejarah teknologi kita, perkembangan sains telah memperkaya kemampuan kita untuk memanfaatkan energi dan menggunakan energi tersebut untuk kebutuhan masyarakat. Kebanyakan kegiatan kita melibatkan perpindahan energi dan perubahan energi. Termodinamika merupakan ilmu tentang energi, yang secara spesifik membahas tentang hubungan antara energi panas dengan kerja. Seperti telah diketahui bahwa energi didalam alam dapat terwujud dalam berbagai bentuk energi, 2 selain energi panas dan kerja, yaitu energi kimia, energi listrik, energi nuklir, energi gelombang elektromagnetik, energi akibat gaya magnit, dan lain-lain. Energi dapat berubah dari satu bentuk ke bentuk lain, baik secara alami maupun hasil rekayasa teknologi. Selain itu energi di alam semesta bersifat kekal, tidak dapat dibangkitkan atau dihilangkan, yang terjadi adalah perubahan energi dari satu bentuk menjadi bentuk lain tanpa ada pengurangan atau penambahan. Prinsip ini disebut sebagai prinsip konservasi atau kekekalan energi. B. Rumusan Masalah Berdasarkan latar belakang tersebut di atas, adapun rumusan masalah dari makalah ini yaitu sebagai berikut. 1. Apa pengertian dari hukum-hukum termodinamika? 2. Bagaimana penerapan hukum-hukum termodinamika? 3. Bagaimana siklus Termodinamika? C. Tujuan Berdasarkan rumusan masalah tersebut di atas, adapun tujuan dari penulisan makalah ini yaitu sebagai berikut: 1. Untuk mengetahui hukum-hukum termodinamika. 2. Untuk mengetahui penerapan termodinamika. 3.Untuk mengetahuisiklus Termodinamika D. Manfaat Penulisan Berdasarkan tujuan tersebut di atas, adapun manfaat dari penulisan makalah ini yaitu sebagai berikut: 1. Sebagai tambahan pengetahuan hukum-hukum termodinamika berserta siklussiklusnya. 2. Sebagai wadah pengembangan diri bagi penulis dalam menyusun karya ilmiah. 3 BAB II PEMBAHASAN A. Hukum-Hukum Termodinaka 1. Hukum I Termodinamika Hukum I Termodinamika menyatakan bahwa besarnya kalor yang masuk sistem akan digunakan untuk meningkatkan energi dalam sistem dan sisanya lagi digunakan untuk melakukan usaha. Secara matematis, persamaan Hukum I Termodinamika dinyatakan sebagai berikut: Q= ∆ U+W Dalam kehidupan sehari-hari, banyak peristiwa yang berhubungan dengan Hukum I Termodinamika, sebagai contoh adalah peristiwa di dalam mesin. Sebelum dapat melakukan usaha, sistem tersebut harus dipanaskan terlebih dahulu. Hal inilah yang menjadi salah satu alasan orang-orang memanaskan motornya terlebih dahulu sebelum digunakan. Dengan adanya pemanasan terlebih dahulu, maka energi dalam gas akan meningkat dan stabil, sehingga usaha yang dihasilkan lebih besar dan lancar. 2. Hukum II Termodinamika Hukum II Termodinamika batasan-batasan terhadap perubahan energi yang mungkin terjadi dengan beberapa perumusan sebagai berikut: 1) Tidak mungkin membuat mesin yang bekerja dalam satu siklus, menerima kalor dari sebuah reservoir dan mengubah seluruhnya menjadi energi atau usaha luas (Kelvin Planck). 2) Tidak mungkin membuat mesin yang bekerja dalam suatu siklus mengambil kalor dari sebuah reservoir rendah dan memberikan pada reservoir bersuhu tinggi tanpa memerlukan usaha dari luar (Clausius). 3) Pada proses reversibel, total entropi semesta tidak berubah dan akan bertambah ketika terjadi proses irreversibel (Clausius). 4 Untuk menjelaskan tidak adanya reversibilitas para ilmuwan merumuskan prinsip baru, yaitu Hukum II Termodinamika, dengan pernyataan: “kalor mengalir secara alami dari benda yang panas ke benda yang dingin, kalor tidak akan mengalir secara spontan dari benda dingin ke benda panas”. 3. Hukum III Termodinamika Hukum ketiga termodinamika terkait dengan temperatur nol absolut. Hukum ini menyatakan bahwa pada saat suatu sistem mencapai temperatur nol absolut, semua proses akan berhenti dan entropi sistem akan mendekati nilai minimum. Hukum ini juga menyatakan bahwa entropi benda berstruktur kristal sempurna pada temperatur nol absolut bernilai nol. Hukum ketiga termodinamika memberikan dasar untuk menetapkan entropi absolut suatu zat, yaituentropi setiap kristal sempurna adalah nol pada suhu nol absolut atau nol derajat Kelvin (K). Padakeadaan ini setiap atom pada posisi yang pasti dan memiliki energi dalam terendah. Sehingga sistem dalam keadaan diam atau statis. Kristal adalah zat padat yang terdiri dari atom-atom diam dalam suatu barisan statik barbaniar, suatu keadaan dinamik yang paling teratur. Jadi, begitu sulit mendapatkan zat dalam keadaan dinamik teratur atau kristal sempurna seperti yang dibayangkan oleh hukum III termodinamika karena pada tingkat atomik setiap zat dalam kedudukannya selalu bergerak acak yang menyebabkan molekulmolekul menjadi kacau atau tidak teratur (entropi). Oleh karena itu, menurut Whitehead logika hukum III termodinamika ini adalah keliru dalam hal mengkongkretkan suatu hal yang abstrak. B. Penerapan Hukum-Hukum Termodinamika 1. Penerapan Hukum I Termodinamika Pada suatu sistem yang mengalami perubahan temperatur, besarnya perubahan energi dalam sistem dinyatakan dengan persamaan. 5 a) Proses Isotermal b) Proses Isobarik Pada persamaan tersebut x merupakan konstanta yang bergantung pada jenis gas, apakah gas tersebut monoatomik atau diatomik. Untuk gas monoatomik, nilai x adalah 3/2, untuk gas diatomik temperatur rendah x=5/2, dan untuk gas diatomik temperatur tinggi x = 7/2. c) Proses Isokhorik Proses isokhorik merupakan proses yang terjadi pada volume konstan. Oleh karena usaha pada suatu proses mengisyaratkan adanya perubahan volume, jadi dapat disimpulkan bahwa pada proses isokhorik, suatu sistem tidak melakukan usaha. d) Proses Adiabatik Proses adiabatik merupakan suatu proses, dimana tidak ada kalor yang masuk maupun kalor yang keluar sistem. Jadi syarat terjadinya proses adiabatik adalah sistem harus terisolasi secara sempurna, sehingga tidak ada kebocoran kalor sedikitpun. Q = ΔU + W 0 = ΔU + W ΔU = -W 6 2. Penerapan Hukum II Termodinamika Salah satu penerapan Hukum II Termodinamika adalah munculnya konsep mesin pendingin. Mesin pendingin merupakan mesin yang dapat mengambil sejumlah kalor dari suatu benda, selanjutnya memindahkan kalor tersebut ke lingkungan sehingga benda yang telah diambil kalornya akan mengalami penurunan temperatur. Besarnya kalor yang dipindahkan sama dengan energi yang dikonsumsi oleh mesin pendingin tersebut. Energi yang dikonsumsi dapat berupa energi listrik. Proses Perpindahan Kalor pada Mesin Pendingin Suatu mesin pendingin bekerja dengan memindahkan sejumlah kalor dari reservoir bertemperatur rendah (benda yang didinginkan) ke reservoir bertemperatur tinggi (tinggi). Kalor tidak mengalir secara spontan dari temperatur rendah ke temperatur tinggi. Untuk mewujudkan hal tersebut, maka diperlukan sejumlah usaha untuk memindahkankalor tersebut. Usaha inilah berasal dari energi listrik yang dikonsumsi oleh mesin pendingin. 7 Proses Pendinginan Ruangan Menggunakan Mesin Pendingin Energi yang bermanfaat ŋ = Energi yang dimasukkan W Q 2−Q 1 ŋ = = Q2 Q2 ŋ = (1 - Q1 Q 2 )X 100% menurut Carnot, efisiensi mesin carnot berlaku pula: 8 ŋ = (1 - T1 T 2 )X 100% 3. Penerapan Hukum III Termodinamika Berdasarkan persamaan Planck-Boltzmann, S = k.InW, dimana Entropi (S) merupakan “kekacauan” atau ketidakaturan” sistem. Keadaan sistem yang tidak teratur adalah keadaan dimana pertikel-partikel (molekul-molekul, atom tau ion) tersusun secara tidak teratur. Semakin tidak teratur susunan keadaan sistem, makin besar kebolehjadian keadaan sistem dan makin besar entropinya. Oleh karena itu, zat padat kristal pada umunya mempunyai entropi yang relatif rendah dibandingkan dengan cairan atau gas. Gas mempunyai entropi yang paling tinggi karena keadaan sistem paling tidak teratur. Sehingga makin tidak teratur susunan molekul, makin tinggi harga W dan entropinya. Sebaliknya semakin teratur susunan molekul sistem, makin rendah harga W dan entropi. Jika suatu zat murni didiinginkan hingga dekat 0 K, semua gerakan translasi dan rotasi terhenti dan molekul-molekul hanya mengambil kedudukan tertentu dalam kristal. Molekul hanya memiliki energi vibrasi yang sama besar sehingga berada pada keadaan kuantum tunggal. Dalam hal ini W=1 dan In W=0, sehingga menurut persamaan Boltmann S= 0. Jadi entropi suatu kristal murni yang sempurna adalah 0 (nol) pada suhu 0 K. Penyataan ini dalam persamaan matematikanya adalah ST = 0. Kebanyakan logam bisa menjadi superkonduktor pada suhu sangat rendah, karena tidak banyak keacakan gerakan kinetik dalam skala molekular yang menggangu aliran elektron. C. Siklus Termodinamika Siklus termodinamika secara umum bisa diklasifikasikan kedalam dua tipe: 1. Siklus reversibel, 9 2. Siklus irreversibel. 1. Siklus Reversibel Sebuah proses, dimana perubahan dalam arah sebaliknya, akan membalik prosesseutuhnya, dikenal dengan proses reversibel. Sebagai contoh, jika selama prosestermodinamika dari keadaan 1 ke 2, kerja yang dilakukan oleh gas adalah W12, dankalor yang diserap adalah Q1-2. Sekarang jika kerla dilakukan pada gas sebesar W1-2dan mengeluarkan kalor sebesar Q1-2, kita akan membawa sistem kembali dari keadaan2 ke 1, proses disebut reversibel. Pada proses reversibel, seharusnya tidak ada kerugian panas karena gesekan, radiasiatau konduksi, dsb. Siklus akan reversibel jika semua proses yang membentuk siklusadalah reversibel. Maka pada siklus reversibel, kondisi awal dicapai kembali pada akhir siklus. 2. Siklus Ireversibel Sebagaimana telah disebut di atas bahwa jika perubahan dalam arah sebaliknya, akan membalik proses seutuhnya disebut sebagai proses reversibel. Tetapi jikaperubahan tidak membalik proses, maka disebut proses ireversibel. Pada proses ireversibel, terjadi kerugian panas karena gesekan, radiasi atau konduksi.Dalam keadaan di lapangan, sebgai besar proses adalah ireversibel. Penyebab utmaireversibel adalah : (1) gesekan mekanik dan fluida, (2) ekspansi tak tertahan, (3)perpindahan panas dengan perbedaan temperatur tertentu. Lebih jauh, gesekan akan merubah kerja mekanik menjadi panas. Panas ini tidak bisa dirubah kembali dalam jumlah yang sama ke dalam kerja mekanik. Sehingga jika ada gesekan di dalam proses maka proses adalah ireversibel. Sebuah siklus adalah ireversibel jika ada prosesireversibel pada proses-proses pada siklus tersebut. Maka pada siklus ireversibel,kondisi awal tidak didapati pada akhir siklus. 3. Reversibilitas Proses Termodinamika 10 a. Isothermal dan Adiabatik Perlu dicatat bahwa proses atau siklus penuh adalah hal yang ideal. Dalam keadaan sebenarnya, operasi isotermal atau adiabatik lengkap tidak dicapai. Namun demikian keadaan ini bisa diperkirakan. Alasan dari hal tersebut adalah tidak mungkinmentransfer kalor pada temperatur konstan pada operasi isotermal. Lebih jauh, adalahtidak mungkin membuiat silinder non-konduksi pada proses adiabatik. Pada keadaansebenarnya, proses isotermal bisa dicapai jika proses begitu lambat sehingga kalor yangdiserap atau dilepaskan pada laju dimana temperatur tetap konstan. Dengan cara yangsama, proses adiabatik bisa dicapai jika proses terjadi dengan sangat cepat sehinggatidak ada waktu bagi kalor untuk masuk atau meninggalkan gas. Dengan pandangan tersebut, proses isotermal dan adiabatik dianggap sebagai prosesreversibel. b. Volume konstan, tekanan konstan dan pvn konstan Kita tahu bahwa temperatur benda panas, yang memberikan panas, tetap konstanselama proses, temperatur zat kerja akan bervariasi ketika proses berlangsung. Dalampandangan ini, ketiga operasi di atas adalah ireversibel. Tetapi hal ini bisa dibuat mendekati reversibilitas dengan memanipulasi temperatur benda panas bervariasisehingga pada setiap tingkatan temperatur zat kerja tetap konstan.Dalam hal ini, proses volume konstan, tekanan konstan dan pvn konstan dianggapsebagai proses reversibel. BAB III PENUTUP A. KESIMPULAN 11 Berdasarkan penjelasan tersebut di atas, adapun kesimpulan dari makalah ini yaitu sebagai berikut: 1. Hukum-hukum termodinamika, yaitu: a. Hukum I Termodinamika menyatakan bahwa besarnya kalor yang masuk sistem akan digunakan untuk meningkatkan energi dalam sistem dan sisanya lagi digunakan untuk melakukan usaha. b. Hukum II Termodinamika, mernyatakan: “kalor mengalir secara alami dari benda yang panas ke benda yang dingin, kalor tidak akan mengalir secara spontan dari benda dingin ke benda panas” c. Hukum III Termodinamika, menyatakan bahwa pada suhu 0 K (-273 oC) sistem berada pada kondisi diam atau statis. 2. Penerapan Hukum-hukum Termodinamika a. Penerapan Hukum I Termodinamika berdasarkan fungsi keadaan yaitu isotermal, isobarik, isokhorik dan proses adiabatik. b. Penerapan Hukum II Termodinamika pada mesin pendingin dengan efisiensi menurut Carnot c. Penerapan Hukum II Termodinamika yaitu logam bisa menjadi superkonduktor pada suhu sangat rendah, karena tidak banyak keacakan gerakan kinetik dalam skala molekular yang menggangu aliran elektron. 3. Siklus Termodinamika secara umum dibedakan menjadi reversible dan irreversible. B. Saran Diharapkan para pembaca kiranya mencari dan mengkaji lebih dalam terkait Termodinamika agar dapat menambah informasi lebih banyak. DAFTAR PUSTAKA Alhabibah, Chaed. 2013. Hukum Ketiga Termodinamika. http://www.slideshare.net/ chaedalhabibah/hukum-3-termodinamika 12 Aprilia, Handry. 2014. Hukum Termodinamika 1, 2, 3. http://www.slideshare.net/ hendriapriliyan/hukum-termodinamika-123. Azkamiru.2010. Hukum Termodinamika. https://azkamiru.files.wordpress.com/2010/ 01/25-hukum-termodinamika.pdf Michael B. Thermal imaging in teaching elements of [email protected], [email protected]. Diakses pada tanggal 10 Oktober 2015. Frank M. Teaching chemical thermodynamics: with or without mathematics?. University of Zagreb, Croatia. [email protected], vs�[email protected], [email protected]. Diakses pada tanggal 10 Oktober 2015. Nasution, Mia. 2013. Hukum-hukum Termodinamika 3. http://id.scribd.com/doc/ 141873409/Hukum-Termodinamika-3#scribd. Diakses pada tanggal 10 Oktober 2015. Wikipedia. 2015. Wikipedia. https://id.wikipedia.org/wiki/Termodinamika. Diakses pada tanggal 10 Oktober 2015 13


![2. Tinjauan Singkat Termodinamika [Compatibility Mode]](http://s1.studylibid.com/store/data/000368661_1-2ccd4e1981a961db647255fa08a2b63f-300x300.png)